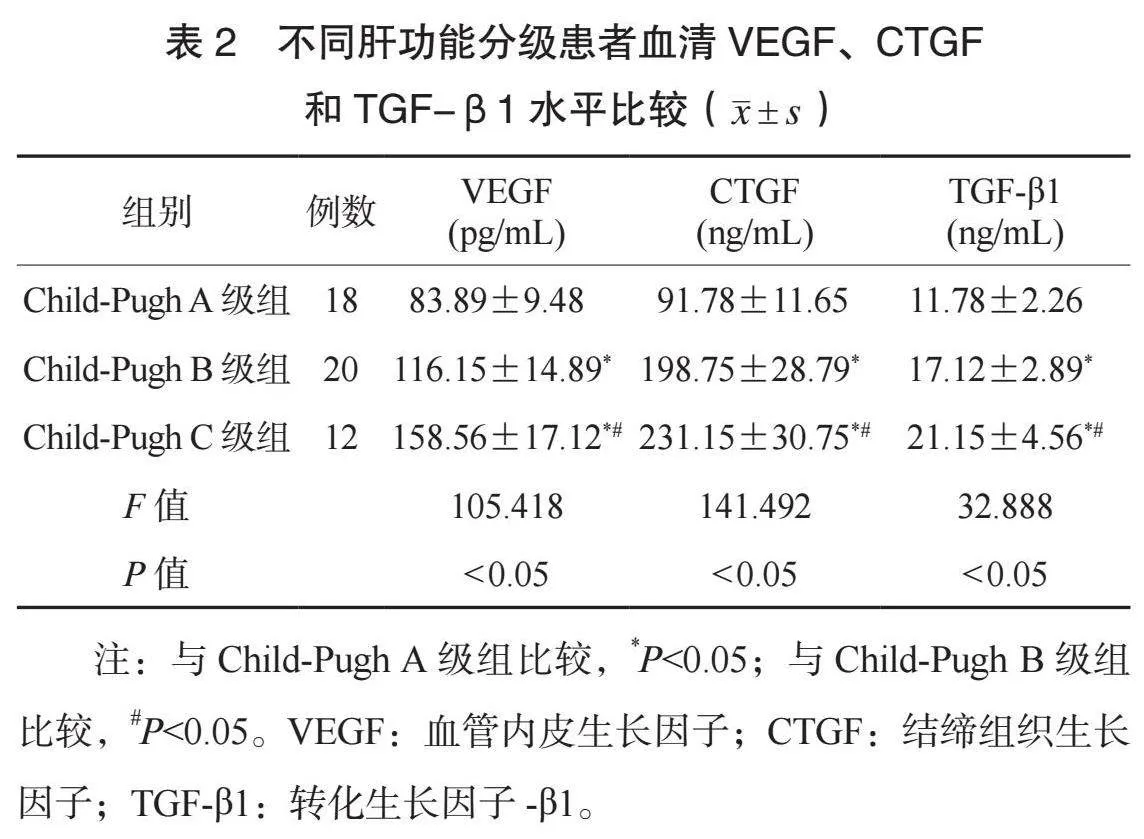
血清血管内皮生长因子、结缔组织生长因子和转化生长因子-β1水平与乙型病毒性肝炎肝硬化分级的关系分析

【摘要】目的 对血清血管内皮生长因子(VEGF)、结缔组织生长因子(CTGF)和转化生长因子-β1(TGF-β1)水平与乙型病毒性肝炎肝硬化分级的关系进行探讨,为临床提供参考。方法 回顾性分析2020年1月至2023年8月庆阳市人民医院收治的50例乙型病毒性肝炎肝硬化患者的临床资料纳为观察组,另回顾性分析同期于庆阳市人民医院进行体检的30例健康体检者的临床资料纳为对照组。比较两组研究对象血清VEGF、CTGF和TGF-β1水平。按照肝功能分级的不同把观察组患者分为Child-Pugh A级组(18例)、Child-Pugh B级组(20例)和Child-Pugh C级组(12例)。比较3组患者血清VEGF、CTGF和TGF-β1水平,并分析血清VEGF、CTGF和TGF-β1水平与乙型病毒性肝炎肝硬化患者肝功能分级的相关性。结果 与对照组比较,观察组患者的血清VEGF、CTGF和TGF-β1水平均更高(均P<0.05)。与Child-Pugh A级组和Child-Pugh B级组比较,Child-Pugh C级组患者血清VEGF、CTGF和TGF-β1水平均更高,与Child-Pugh A级组比较,Child-Pugh B级组患者血清VEGF、CTGF和TGF-β1水平均更高(均P<0.05)。Spearman相关性分析显示,血清VEGF、CTGF和TGF-β1水平与乙型病毒性肝炎肝硬化患者肝功能分级均呈正相关(均P<0.05)。结论 血清VEGF、CTGF和TGF-β1水平与乙型病毒性肝炎肝硬化分级呈正相关,可反映疾病严重程度,临床应密切监测上述指标。
【关键词】血管内皮生长因子;结缔组织生长因子;转化生长因子-β1;乙型病毒性肝炎肝硬化;肝功能分级
乙型病毒性肝炎肝硬化的症状表现为腹水、肝掌等,威胁患者生命安全[1]。有研究指出,肝纤维化是慢性肝病进展至肝硬化的重要标志之一[2]。而肝脏病理穿刺活检是诊断肝纤维化的重要标准,可直接获取肝脏组织样本并进一步确定肝脏病理情况。但由于该检查方式属于侵入性检查,存在一定创伤,部分患者和家属接受度不高。血管内皮生长因子(VEGF)是调控血管新生的关键因子,乙型病毒性肝炎肝硬化患者因感染乙型病毒性肝炎病毒导致肝细胞损伤,刺激肝脏细胞分泌VEGF,促进血管新生,从而加剧病变发展[3]。结缔组织生长因子(CTGF)作为临床新发现的与细胞外基质(ECM)分泌密切相关的多肽类因子,与VEGF均可导致肝脏纤维基质出现沉积情况,并逐步演化至肝硬化[4]。血清转化生长因子-β1(TGF-β1)可诱导肝细胞凋亡,抑制肝细胞增殖,促进ECM生成、抑制ECM降解等作用[5]。基于此,本研究讨论乙型病毒性肝炎患者的血清VEGF、CTGF和TGF-β1水平与肝硬化分级关系。
1 资料与方法
1.1 一般资料 回顾性分析2020年1月至2023年8月庆阳市人民医院收治的50例乙型病毒性肝炎肝硬化患者的临床资料纳为观察组,另回顾性分析同期于庆阳市人民医院进行体检的30例健康体检者的临床资料纳为对照组。对照组研究对象中男性16例,女性14例;年龄32~60岁,平均年龄(46.05±6.09)岁;BMI 20~25 kg/m2,平均BMI(22.89±1.28)kg/m2。观察组患者中男性27例,女性23例;年龄30~60岁,平均年龄(45.11±6.23)岁;BMI 20~24 kg/m2,平均BMI(22.65±1.19)kg/m2。两组研究对象一般资料比较,差异均无统计学意义(均P>0.05),有可比性。 按照肝功能分级的不同[6]将观察组患者分为Child-Pugh A级组(18例)、Child-Pugh B级组(20例)和Child-Pugh C级组(12例)。Child-Pugh A组中男性10例,女性8例;年龄30~60岁,平均年龄(44.15±6.44)岁;BMI 21~24 kg/m2,平均BMI(22.45±0.49)kg/m2。Child-Pugh B组中男性11例,女性9例;年龄31~58岁,平均年龄(45.08±6.16)岁;BMI 20~23 kg/m2,平均BMI(22.51±0.54)kg/m2。Child-Pugh C组中男性6例,女性6例;年龄32~59岁,平均年龄(45.47±6.06)岁;BMI 21~24 kg/m2,平均BMI(22.76±0.65)kg/m2。3组患者一般资料比较,差异均无统计学意义(均P>0.05),有可比性。本研究经庆阳市人民医院医学伦理委员会批准。纳入标准:⑴观察组患者均符合乙型病毒性肝炎肝硬化的诊断标准[6];⑵无凝血障碍者;⑶无精神病史者,意识清晰,可自主沟通者;⑷非妊娠期、哺乳期者。排除标准:⑴合并心、肾功能障碍者;⑵合并其他肝疾病者;⑶合并肝胆系统恶性肿瘤者;⑷存在免疫功能异常者。
1.2 研究方法 抽取所有研究对象的肘静脉血(空腹)5 mL,用离心机操作后取血清(离心参数设置:转速为3 000 r/min,时间为10 min,半径为10 cm)。采用化学发光免疫分析仪(武汉明德生物科技股份有限公司,鄂械注准20182222395,型号:CF10)测定血清VEGF、CTGF和TGF-β1水平(测量方法为酶联免疫吸附法)。
1.3 观察指标 ⑴比较对照组与观察组研究对象的血清VEGF、CTGF和TGF-β1水平。⑵比较乙型病毒性肝炎肝硬化不同肝功能分级患者的血清VEGF、CTGF和TGF-β1水平。⑶分析乙型病毒性肝炎肝硬化患者的血清VEGF、CTGF和TGF-β1水平与肝功能分级的相关性。
1.4 统计学分析 采用SPSS 22.0软件处理数据。计量资料以(x)表示,行t检验、F检验和LSD-t检验;相关性分析采用Spearman检验。以P<0.05为差异有统计学意义。
2 结果
2.1 对照组与观察组研究对象血清VEGF、CTGF和TGF-β1水平比较 与对照组研究对象比较,观察组患者血清VEGF、CTGF和TGF-β1 水平均更高,差异均有统计学意义(均P<0.05),见表1。
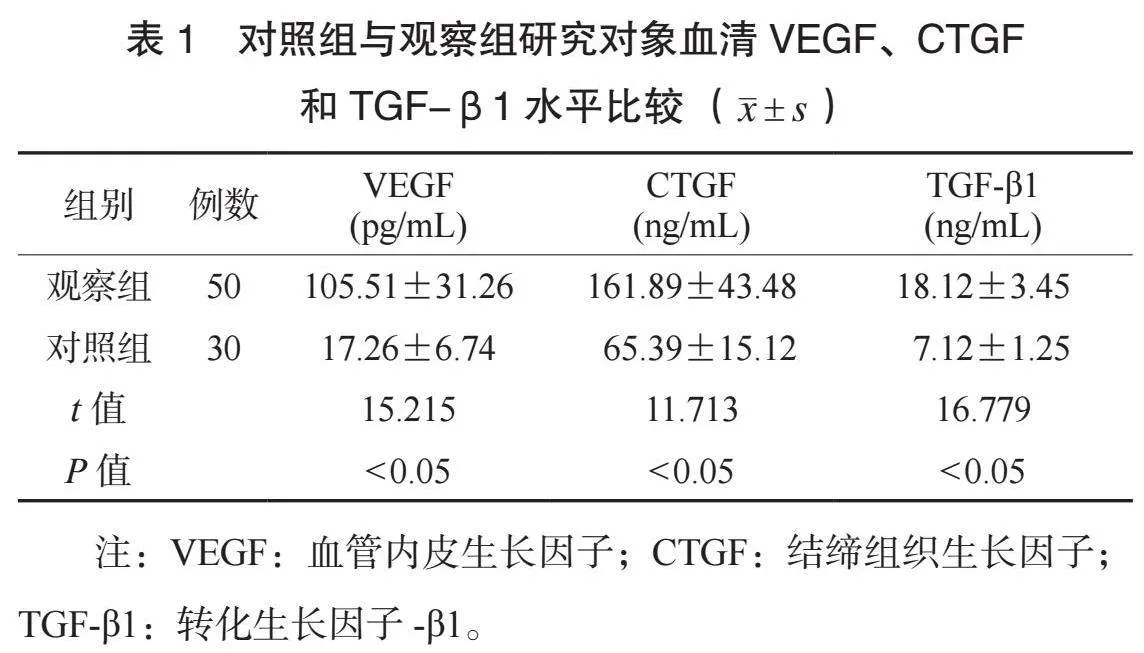
2.2 不同肝功能分级患者血清VEGF、CTGF和TGF-β1水平比较 与Child-Pugh A级组和Child-Pugh B级组比较,Child-Pugh C级组患者血清VEGF、CTGF和TGF-β1水平均更高;与Child-Pugh A级组比较,Child-Pugh B级组患者的血清VEGF、CTGF和TGF-β1水平均更高,差异均有统计学意义(均P<0.05),见表2。
2.3 乙型病毒性肝炎肝硬化患者血清VEGF、CTGF和TGF-β1水平与肝功能分级的相关性分析 Spearman相关性分析显示, 乙型病毒性肝炎肝硬化患者血清VEGF、CTGF和TGF-β1水平与其肝功能分级均呈正相关(均P<0.05),见表3。
3 讨论
肝脏病理穿刺活检作为肝纤维化诊断重要标准,但其具有一定创伤性,且穿刺取样结果可能出现假阳性,应用可能受到限制[7]。VEGF可加快血管内皮细胞增殖,其表达水平上升会促进肝内新血管形成和纤维化[8]。CTGF作为新型细胞因子,其异常表达与肾、肺部纤维化进展有关[9]。有研究表明,TGF-β1可以诱导肝星状细胞(HSCs)向成纤维细胞样细胞分化,使纤维化相关分子表达、合成,并抑制基质金属蛋白酶等降解基质的酶类活性,促进肝纤维化发展[10]。本研究探讨血清VEGF、CTGF和TGF-β1水平与乙型病毒性肝炎肝硬化分级的关系。
本研究结果显示,与对照组比较,观察组患者的血清VEGF、CTGF和TGF-β1水平均更高,提示乙型病毒性肝炎肝硬化患者的VEGF、CTGF和TGF-β1水平异常。分析原因,VEGF、CTGF均可加快细胞有丝分裂,TGF-β1可加快纤维细胞生成,抑制胶原降解,随着乙型病毒性肝炎肝硬化患者发病,其血清VEGF、CTGF和TGF-β1水平表达升高[11]。本研究结果显示,与Child-Pugh A级组和Child-Pugh B级组患者比较,Child-Pugh C级组的血清VEGF、CTGF和TGF-β1水平均更高,与Child-Pugh A级组患者比较,Child-Pugh B级组患者的血清VEGF、CTGF和TGF-β1水平均更高;Spearman相关性分析显示,血清VEGF、CTGF和TGF-β1水平与乙型病毒性肝炎肝硬化患者肝功能分级均呈正相关,这提示随着乙型病毒性肝炎肝硬化患者血清VEGF、CTGF和TGF-β1水平持续升高,其肝功能损伤越严重。分析原因,随着乙型病毒性肝炎肝硬化患者疾病发展,其肝组织缺血、缺氧加重,肝细胞坏死增多,释放大量炎症介质,刺激存活肝细胞和HSCs合成、提高VEGF水平,促进血管再生,血管再生为肝纤维组织增生提供有利环境,加速肝纤维化进程[12]。乙型病毒性肝炎肝硬化患者的肝脏长期损伤和炎症反应,导致肝脏组织结构被破坏,肝细胞大量死亡,肝功能降低,其血清CTGF水平上升是肝细胞损伤、炎症反应的结果,与肝功能恶化互相影响[13]。TGF-β1为诱导肝纤维化发展的重要细胞因子,乙型病毒性肝炎肝硬化体内乙型肝炎病毒通过诱导细胞因子,增加TGF-β1分泌,促使HSCs活化、分化和增殖,增加ECM合成、降解失衡,致使其在肝内过度沉积,导致肝组织纤维化发生、发展,TGF-β1大量释放,其增加与肝纤维化进程有关,且与肝功能分级呈正相关[14]。
综上所述,血清VEGF、CTGF和TGF-β1参与乙型病毒性肝炎肝硬化发生、发展,且患者的血清VEGF、CTGF和TGF-β1水平与肝功能分级呈正相关,可反映患者的疾病严重程度,应对上述指标进行严格监控。
参考文献
贾继东,侯金林,魏来,等.《慢性乙型肝炎防治指南(2019年版)》新亮点[J].中华肝脏病杂志, 2020, 28(1): 21-23.
王钰琛,王勤英.慢性乙型肝炎、乙型肝炎肝硬化伴肾损伤和早期诊断指标研究进展[J].肝脏, 2021, 26(10): 1181-1183.
陈伟锋.肝硬化患者血清Hcy、HIF-1、VEGF联合检测的临床研究[J].现代诊断与治疗, 2015, 26(11): 2579-2580.
唐先梅,张庆,刘杰,等.血清内皮细胞特异性分子-1和血管内皮生长因子与HCV感染相关肝细胞癌相关性研究[J].胃肠病学和肝病学杂志, 2020, 29(1): 27-31.
张燕,范晓翔,章美武,等. NLRC5调节转化生长因子-β1诱导的肝星状细胞活化和逆转对肝纤维化的影响[J].中国全科医学, 2020, 23(24): 3051-3059.
中华医学会肝病学分会.肝硬化诊治指南[J].中华肝脏病杂志, 2019, 27(11): 846-865.
饶洁,阎红琳,袁静萍,等.肝脏穿刺病理活检在诊断肝脏恶性肿瘤中的应用和其规范化管理[J].诊断病理学杂志, 2020, 27(12): 909-912.
王国强,张晟春,赵春平,等.乙型肝炎患者体液免疫功能、肝纤维化指标和α1-MG、TGF-β1水平分析[J].现代生物医学进展, 2020, 20(4): 772-775.
郝雁雁,王威雪,王瑞萍,等.替诺福韦酯联合虫草胶囊治疗慢性乙型肝炎肝硬化患者血清TGFβ1、ET-1和CTGF水平变化[J].湖南师范大学学报(医学版), 2022, 19(1): 134-137.
李慧平,侯宝洲,魏思忱,等.血清VEGF、TK-1和T淋巴细胞亚群与乙型肝炎病毒相关性肝病发生和进展的关系[J].蚌埠医学院学报, 2022, 47(10): 1393-1396.
张婷焱,周宝勤,顾春燕.血清VEGF、CTGF和TGF-β1水平检测对CHB肝硬化患者肝功能Child-Pugh分级和疾病预后的评估价值[J].中西医结合肝病杂志, 2022, 32(5): 440-442, 446.
邹梦林,胡星星,张铭杨,等. ERK1/2信号通过钙蛋白酶调控结缔组织生长因子参与肺纤维化的形成[J].武汉大学学报(医学版), 2020, 41(5): 720-724.
殷洪敏,黄敏.血清VEGF、PDGF-BB、CTGF水平与肝硬化患者肝功能分级的关系[J].热带医学杂志, 2020, 20(7): 954-958, 976.
金路恒,杨培琰,赵阿会,等.转化生长因子-β1致肺成纤维细胞转分化过程中差异表达基因的筛选和验证[J].环境与职业医学, 2020, 37(3): 211-217.
作者简介:闫嘉茗,大学本科,主管技师,研究方向:临床检验医学。

