五加生脉饮对小鼠的抗疲劳作用及其机制

[摘 要] 目的:探讨五加生脉饮的抗疲劳作用,并阐明其作用机制。方法:36只雄性ICR小鼠随机分为对照组(等体积蒸馏水)、生脉饮组(500 mg·kg-1 生脉饮) 和五加生脉饮组(600 mg·kg-1 五加生脉饮)。每隔7 d 测定各组小鼠体质量,观察其精神状态。采用疲劳转棒实验和力竭负重游泳实验检测各组小鼠转棒停留时间和力竭游泳时间;试剂盒检测各组小鼠血清中血尿素氮(BUN) 和乳酸(LA) 水平及乳酸脱氢酶(LDH) 活性、肝脏组织中肝糖原(LG) 水平、肌肉组织中肌糖原(MG)和丙二醛(MDA) 水平及谷胱甘肽过氧化物酶(GSH-Px) 和超氧化物歧化酶(SOD) 活性;Western blotting法检测各组小鼠肝脏组织中糖代谢相关蛋白表达水平。结果:与实验前比较,实验后各组小鼠体质量均呈现增长趋势,但差异均无统计学意义(Pgt;0. 05)。疲劳转棒实验,与对照组比较,五加生脉饮组小鼠转棒停留时间明显增加(Plt;0. 01);力竭负重游泳实验,与对照组比较,生脉饮组和五加生脉饮组小鼠力竭游泳时间均明显增加(Plt;0. 01)。与对照组比较,生脉饮组和五加生脉饮组小鼠血清中BUN 水平均明显降低(Plt;0. 01), LDH 活性均明显升高(Plt;0. 01); 五加生脉饮组LA 水平明显降低(Plt;0. 01)。与生脉饮组比较,五加生脉饮组小鼠血清中BUN 和LA 水平均明显降低(Plt;0. 01),LDH 活性明显升高(Plt;0. 01)。与对照组比较,生脉饮组和五加生脉饮组小鼠肝脏组织中LG 水平和肌肉组织中MG 水平均明显升高(Plt;0. 01);与生脉饮组比较,五加生脉饮组小鼠肝脏组织中LG 水平和肌肉组织中MG 水平均明显升高(Plt;0. 01)。与对照组比较,生脉饮组和五加生脉饮组小鼠肌肉组织中GSH-Px 和SOD 活性均明显升高(Plt;0. 01),MDA 水平明显降低(Plt;0. 01);与生脉饮组比较,五加生脉饮组小鼠肌肉组织中GSH-Px 和SOD 活性均明显升高(Plt;0. 01),MDA 水平明显降低(Plt;0. 01)。Western blotting 法,与对照组比较,生脉饮组和五加生脉饮组小鼠肝脏组织中磷酸化磷脂酰肌醇3-激酶(p-PI3K)、磷酸化蛋白激酶B (p-AKT)、磷酸化糖原合成酶激酶3β(p-GSK3β) 及糖原合成酶(GS) 蛋白表达水平均明显升高(Plt;0. 05 或Plt;0. 01); 与生脉饮组比较,五加生脉饮组小鼠肝脏组织中p-PI3K、p-AKT、p-GSK3β 和GS 蛋白表达水平均明显升高(Plt;0. 01)。结论:五加生脉饮可通过激活磷脂酰肌醇3激酶 (PI3K)/蛋白激酶B(AKT)/糖原合成酶激酶3β (GSK3β) 信号通路,提高机体抗氧化能力并增加糖原合成,发挥抗疲劳作用。
[关键词] 五加生脉饮; 氧化应激; 抗疲劳; 糖代谢; 尿素氮; 乳酸
[中图分类号] R289.1 [文献标志码] A
疲劳是人类一种主观不适的感觉,表现为疲劳乏力和心力交瘁等非特异性症状,是临床上常见症状,属于亚健康类疾病,对身体多种脏器均产生影响。长期的疲劳会使机体发生一系列的生理和心理变化,并伴有精神紧张和烦躁易怒,严重时会出现神经衰弱、心悸气短和免疫力下降等情况,甚至诱发严重疾病[1]。疲劳的发生常与机体的能量缺乏有关, 可通过服用外源性补充剂, 提高运动时的耐力,缓解疲劳症状。生脉散为中医古方,具有养阴生津、益气复脉和缓解疲劳等功效[2]。生脉饮为生脉散衍生而来,由人参、麦冬和五味子3 种药材配伍组成,三味药分别作为君、臣和佐药合用,为中医常用的补益基础方剂,可通过药味加减用于治疗或改善各种疾病[3]。本研究在生脉饮中引入一味刺五加药材,制成五加生脉饮,相关配方及研究目前尚未见报道。刺五加中含有丰富的人参皂苷成分,具有调节中枢神经系统和抗疲劳等作用[4-5]。此外,刺五加归脾、肺、肾和心经,是中医常用的使药。五加生脉饮充分利用了刺五加的特性,将基础方剂的药效作用向全身组织脏器引导,改善机体疲劳状态,促进糖原的代谢,具有抗疲劳的功效。本研究探讨五加生脉饮对小鼠的抗疲劳作用,并阐明相关作用机制,为五加生脉饮改善机体运动水平和调节高强度运动引起的氧化应激反应提供参考。
1 材料与方法
1. 1 实验动物、药物、主要试剂和仪器
SPF 级ICR 小鼠, 雄性, 4~5 周龄, 体质量(20±2) g,由长春亿斯实验动物技术有限责任公司提供,动物生产许可证号: SCXK (吉) -2020-0002。人参、麦冬、五味子和刺五加由吉林市国安药业有限公司提供。 血尿素氮(blood urea nitrogen,BUN)、乳酸脱氢酶(lactate dehydrogenase, LDH)、乳酸(lactate, LA)、 肝糖原(liver glycogen, LG)、肌糖原(muscle glycogen,MG)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD) 和丙二醛(malondialdehyde,MDA) 试剂盒购自南京建成生物工程研究所, RIPA 裂解液和BCA 试剂盒购自北京鼎国昌盛生物技术有限责任公司,所有抗体均购自武汉ABclone 公司。紫外可见分光光度计购自日本岛津公司, 低温冰箱购自日本SANYO 公司,纯水仪购自美国密理博公司,恒温生化培养箱购自上海博讯实业有限公司,酶标仪购自瑞士TECAN 公司, 高速低温离心机购自美国EPPENDORF 公司,小鼠疲劳转棒仪购自四川成都泰盟科技有限公司。
1. 2 五加生脉饮制备
取人参100 g、麦冬200 g、五味子100 g 和刺五加100 g[6],剪碎后,以水为溶剂, 料液比为1∶10, 在100 ℃ 条件下, 混合提取1 h,提取2 次,提取条件通过正交实验确定。分次滤过,合并滤液,得五加生脉饮,冻干备用。在使用前以水为溶剂复溶。
1. 3 实验动物分组及给药
将36只小鼠随机分为对照组、生脉饮组和五加生脉饮组, 每组12 只。生脉饮组给予500 mg·kg-1 生脉饮,五加生脉饮组给予600 mg·kg-1 五加生脉饮,对照组给予等体积的蒸馏水,每日灌胃给药1 次,持续7 周。每隔7 d测定各组小鼠的体质量并记录相应数据,观察其精神状态。
1. 4 疲劳转棒实验检测各组小鼠转棒停留时间
将小鼠放入圆柱中央的一根转动棒上,小鼠要保持身体平衡,并跟随摇杆转动,以免滑倒;在小鼠跌落时,仪器会自动记录小鼠的转棒停留时间,以检测小鼠的疲劳耐受情况[7]。疲劳转棒实验于造模后第43~45 天进行, 给药30 min 后, 将小鼠置于疲劳转棒仪上,设定转速为30 r·min-1,连续训练3 d。造模后第46 天给药30 min 后,进行实验测试,以180 s 不坠落为标准,记录小鼠在转棒上的停留时间。
1. 5 力竭负重游泳实验检测各组小鼠力竭游泳时间
造模后第49 天给药30 min 后, 开始力竭负重游泳实验。称量质量为每只小鼠体质量5% 的铅丝,并系于小鼠尾部,然后将各组小鼠放入深度为40~50 cm 的恒温水浴箱中, 温度为(25±2) ℃,使其自由游泳,观察小鼠逐渐力竭下沉至全身浸入水中7 s, 小鼠无法用鼻子呼吸视为体力已耗尽,捞起并记录小鼠力竭游泳时间[8]。
1. 6 各组小鼠血清、肝脏组织和肌肉组织采集及处理
力竭负重游泳实验小鼠游泳体力耗尽后,休息30 min,进行眼球取血,将获得的血浆静置10 min后,置于低温离心机中,于4 ℃,3 000 r·min-1 离心15 min,取上清液100 μL 置于1. 5 mL 离心试管中, 放入-20 ℃的冰箱中冻存。取血后, 采用颈椎脱臼法将小鼠处死,取小鼠脑、肝脏和肌肉等组织,保存于-20 ℃冰箱中备用。
1. 7 试剂盒检测各组小鼠血清、肝脏组织和肌肉组织中生化指标
取冷冻保存的样品,采用紫外分光光度法,按试剂盒说明书操作,检测各组小鼠血清中BUN 和LA 水平及LDH 活性,肝脏组织中LG 水平, 肌肉组织中MG 和MDA 水平及GSH-Px 和SOD 活性。
1. 8 Western blotting法检测各组小鼠肝脏组织中糖代谢相关蛋白表达水平
取各组小鼠肝脏组织,剪碎后加入RIPA 组织裂解液,手动匀浆后,置于4 ℃低温离心机中, 5 000 r·min-1 离心10 min, 取上清液,采用BCA 试剂盒测定蛋白浓度。样品加热变性后, 采用12% SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis, SDSPAGE),10 μL 上样。电泳结束后,进行转膜,加入封闭液室温下封闭2 h,加入一抗后,于4 ℃下孵育过夜,加入HRP 标记的二抗(1∶1 000),室温下孵育1 h,ECL 法显影并拍照。采用Image J 软件分析蛋白条带灰度值,以β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1. 9 统计学分析
采用 SPSS 22. 0软件进行统计学分析。各组小鼠体质量、转棒停留时间和力竭游泳时间,血清中BUN 和LA 水平及LDH 活性,肝脏组织中LG 水平和磷酸化磷脂酰肌醇3- 激酶(phosphorylated phosphatidylinositol 3-kinase,p-PI3K)、磷酸化蛋白激酶B (phosphorylatedprotein kinase B, p-AKT)、磷酸化糖原合成酶激酶3β (phosphorylated gluconeogenesis synthasekinase 3β, p-GSK3β) 及糖原合成酶(glycogensynthase,GS) 蛋白表达水平,肌肉组织中MG 和MDA 水平及GSH-Px 和SOD 活性均符合正态分布, 以x±s 表示, 多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t 检验。以Plt;0. 05 为差异有统计学意义。
2 结 果
2. 1 各组小鼠体质量
与实验前比较,实验后各组小鼠体质量均呈现增长趋势, 增长情况略有差异,但各组间比较差异均无统计学意义(Pgt;0. 05)。见图1。
2. 2 各组小鼠转棒停留时间和力竭游泳时间
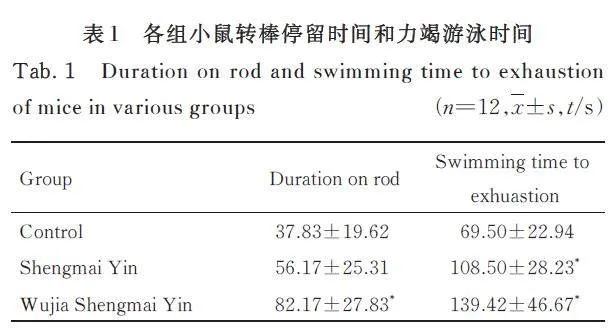
与对照组比较,生脉饮组小鼠转棒停留时间差异无统计学意义(Pgt;0. 05), 五加生脉饮组小鼠转棒停留时间明显增加(Plt;0. 01); 与生脉饮组比较,五加生脉饮组小鼠转棒停留时间差异无统计学意义(Pgt;0. 05)。与对照组比较,生脉饮组和五加生脉饮组小鼠力竭游泳时间均明显增加(Plt;0. 01);与生脉饮组比较,五加生脉饮组小鼠力竭游泳时间差异无统计学意义(Pgt;0. 05)。见表1。
2. 3 各组小鼠血清中 BUN 和 LA 水平及 LDH 活性
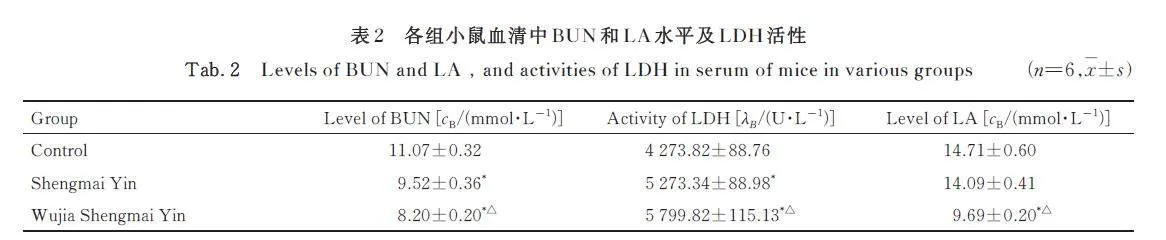
与对照组比较,生脉饮组和五加生脉饮组小鼠血清中BUN 水平均明显降低(Plt;0. 01),LDH 活性均明显升高(Plt;0. 01); 生脉饮组小鼠血清中LA 水平差异无统计学意义(Pgt;0. 05),五加生脉饮组小鼠血清中LA 水平明显降低(Plt;0. 01)。与生脉饮组比较,五加生脉饮组小鼠血清中BUN 和LA 水平均明显降低(Plt;0. 01),LDH 活性明显升高(Plt;0. 01)。见表2。
2. 4 各组小鼠肝脏组织中 LG 水平和肌肉组织中MG水平
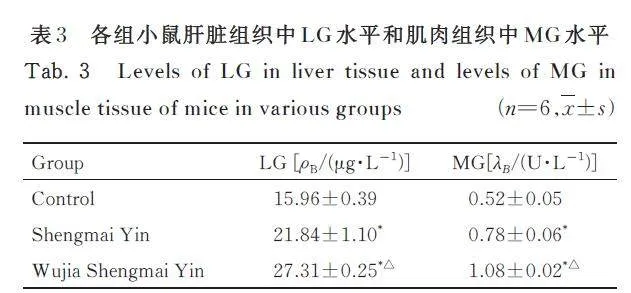
与对照组比较,生脉饮组和五加生脉饮组小鼠肝脏组织中LG 水平和肌肉组织中MG 水平均明显升高(Plt;0. 01)。与生脉饮组比较, 五加生脉饮组肝脏组织中LG 水平和肌肉组织中MG 水平均明显升高(Plt;0. 01)。见表3。
2. 5 各组小鼠肌肉组织中GSH-Px和SOD活性及MDA水平
与对照组比较,生脉饮组和五加生脉饮组小鼠肌肉组织中GSH-Px 和SOD 活性均明显升高(Plt;0. 01), MDA 水平明显降低(Plt;0. 01);与生脉饮组比较,五加生脉饮组小鼠肌肉组织中GSH-Px 和SOD 活性均明显升高(Plt;0. 01),MDA 水平明显降低(Plt;0. 01)。见表4。
2. 6 各组小鼠肝脏组织中糖代谢相关蛋白表达水平
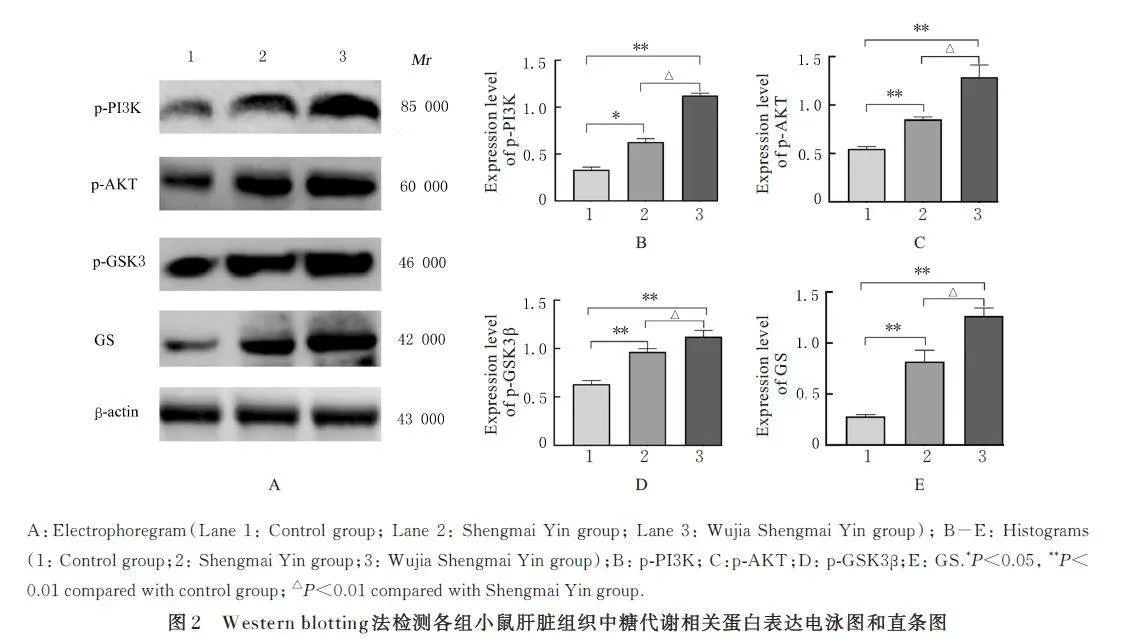
与对照组比较,生脉饮组和五加生脉饮组小鼠肝脏组织中p-PI3K、p-AKT、p-GSK3β 及GS 蛋白表达水平均明显升高(Plt;0. 05 或Plt;0. 01)。与生脉饮组比较,五加生脉饮组小鼠肝脏组织中p-PI3K、p-AKT、p-GSK3 和GS 蛋白表达水平均明显升高(Plt;0. 01)。见图2。
3 讨 论
本研究在生脉饮基础上,对经典名方进行二次开放, 制成五加生脉饮。生脉饮是著名的补益方剂,具有益气复脉和养阴生津的功效,临床上常通过加减方治疗各种体虚引起的全身性症状。中药刺五加是五加科植物刺五加的干燥根或根茎,为吉林长白山地区的道地药材,具有补气健脾、益肾强腰和养心安神等功效,对脾虚乏力、腰膝酸软和心悸失眠等症状具有较好的疗效,可与人参、蛤蚧和五味子等药物配伍使用[9]。根据中药配伍理论加味后制成的五加生脉饮,在原生脉饮方剂基础上,针对抗疲劳功效进行深入研究和开发,具有良好的应用前景。
本研究结果显示:五加生脉饮可明显延长小鼠的疲劳转棒停留时间和力竭游泳时间,提示五加生脉饮对小鼠运动疲劳具有明显的改善作用。此外,与生脉饮比较,五加生脉饮对小鼠的抗疲劳作用更明显。
BUN 是蛋白质的有氧代谢产物。长时间运动后,若脂肪和糖类的代谢无法满足机体所需的能量消耗,蛋白质和氨基酸代偿性地增加代谢分解,使机体BUN 水平升高。剧烈运动后,核苷酸代谢增强,分解产生大量氨,其转化为尿素进而引起BUN 水平升高。机体BUN 水平能够反映机体的疲劳程度,加快BUN 清除速度, 有助于尽快消除疲劳感[10]。在剧烈运动时,有氧代谢无法快速满足机体对能量的需要,以糖酵解为主要形式的无氧代谢水平迅速升高,MG 被快速消耗,产生大量的LA 堆积导致肌肉疲劳[11]。LDH 可以加速分解过量LA, 恢复机体功能,从而减轻疲劳症状[12]。MG 是糖在肌肉中的储存形式,机体运动时,血糖转变为MG 被消耗后,LG 分解并继续为机体供能,即MG 在运动中直接提供能量, LG 储备能量[13-14]。 本研究结果显示:五加生脉饮能够明显降低运动性疲劳小鼠血清中LA 和BUN 水平,升高MG 和LG 水平,提高LDH 活性。提示五加生脉饮可有效提高机体清除LA 和BUN 的能力,增强机体糖原的储备,发挥抗疲劳的作用。
研究[15-16] 显示: 运动耗能会使氧化系统和抗氧化系统失衡,机体会产生过多的自由基,导致骨骼肌和肝脏线粒体脂质过氧化损伤从而降低抗氧化能力,增加脂质过氧化物MDA 的产生,进而导致机体抗氧化物酶SOD 和GSH-Px 等活性降低[17]。大强度运动或者力竭运动时,人体对氧气需求量增加,骨骼肌的血流量也会产生变化,从而导致自由基的产生和肌肉稳态的紊乱、骨骼肌氧化损伤及肌肉疲劳[18]。本研究结果显示: 五加生脉饮能够提高疲劳小鼠肌肉组织中的SOD 和GSH-Px 活性并降低MDA 水平,提示五加生脉饮可调节小鼠体内氧自由基水平,增强其抗氧化能力和运动能力,从而缓解疲劳症状。
磷脂酰肌醇3- 激酶(phosphatidylinositol 3-kinase,PI3K) 为酪氨酸激酶和G 蛋白偶联受体的主要下游分子,其催化产生第二信使磷脂酰肌醇-3, 4, 5- 三磷酸(phosphatidylinositol-3, 4, 5-triphosphate, PIP3) 激活下游靶点蛋白激酶B(protein kinase B, AKT)、糖原合成酶激酶3β(gluconeogenesis synthase kinase 3β, GSK3β) 和GS 蛋白,激活信号传导通路,调节葡萄糖转运等生理过程[19-21]。PI3K/AKT 信号通路是调控糖原合成的关键通路, GS 是催化糖原合成的关键酶,PI3K 激活AKT 后会磷酸化GSK3 抑制其活性,进而促进GS 蛋白表达水平升高,将葡萄糖转化为糖原增加糖原合成[22-25]。本研究结果显示:五加生脉饮 可 以 激 活 PI3K/AKT/GSK3β 信号通路,促进p-PI3K 、p-AKT、p-GSK3β 和GS 蛋白的表达,增加糖原的合成,从而缓解机体疲劳。
综上所述,五加生脉饮对小鼠的运动疲劳具有明显的改善作用, 该作用可能与其调节 PI3K/AKT/GSK3β 信号通路和糖代谢及增加糖原生成有关。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:韩迦南参与研究实施、数据收集和论文撰写,刘倬睿参与数据收集和统计学分析,曾沛涌参与文献查阅、数据处理和图片整理,姜爽参与研究指导和论文修改,李洪宇参与研究设计和指导、论文撰写指导及修改。
[参考文献]
[1] 郑哲君, 李晓莉, 王 朔. 抗疲劳功能食品的研究进展[J]. 食品科技, 2006, 31(2): 4-7.
[2] WANG N L, LIOU Y L, LIN M T, et al. Chineseherbal medicine, Shengmai San, is effective forimproving circulatory shock and oxidative damage in thebrain during heatstroke[J]. J Pharmacol Sci, 2005,97(2): 253-265.
[3] ZHANG K, ZHANG J Y, WANG X R, et al.Cardioprotection of Sheng Mai Yin a classic formula onadriamycin induced myocardial injury in Wistar rats[J].Phytomedicine, 2018, 38: 1-11.
[4] HUANG L Z, HUANG B K, LIANG J, et al.Antifatigue activity of the liposoluble fraction fromAcanthopanax senticosus[J]. Phytother Res, 2011,25(6): 940-943.
[5] HUANG L Z, HUANG B K, YE Q, et al. Bioactivityguidedfractionation for anti-fatigue property ofAcanthopanax senticosus[J]. J Ethnopharmacol, 2011,133(1): 213-219.
[6] 国家药典委员会. 中华人民共和国药典-二部: 2020年版[M]. 北京: 中国医药科技出版社, 2020: 853.
[7] LEE B H, KIM J, LEE R M, et al. Gintonin enhancesperformance of mice in rotarod test: involvement oflysophosphatidic acid receptors and catecholaminerelease[J]. Neurosci Lett, 2016, 612: 256-260.
[8] NI W H, GAO T T, WANG H L, et al. Anti-fatigueactivity of polysaccharides from the fruits of four TibetanPlateau indigenous medicinal plants[J].J Ethnopharmacol, 2013, 150(2): 529-535.
[9] HUANG L Z, ZHAO H F, HUANG B K, et al.Acanthopanax senticosus: review of botany, chemistryand pharmacology[J]. Pharmazie, 2011, 66(2): 83-97.
[10]汪 洪, 方 昊, 冯 纬, 等. 生晒参-甘草-桂花提取物对 Balb/C 小鼠运动疲劳抗性的影响[J]. 食品工业科技, 2023, 44(5): 356-362.
[11]LAURENT D, SCHNEIDER K E, PRUSACZYK W K,et al. Effects of caffeine on muscle glycogen utilizationand the neuroendocrine axis during exercise[J]. J ClinEndocrinol Metab, 2000, 85(6): 2170-2175.
[12]XIN C, ZHAO M Y, WANG J H, et al. Hawthornpolyphenols, D-chiro-inositol, and epigallocatechingallate exert a synergistic hypoglycemic effect[J]. J FoodBiochem, 2021, 45(7): e13771.
[13]QU Y S, JI H W, SONG W K, et al. The anti-fatigueeffect of the Auxis thazard oligopeptide via modulationof the AMPK/PGC-1α pathway in mice [J]. FoodFunct, 2022, 13(3): 1641-1650.
[14]DING D X, WANG Y, YAN W, et al. MYCT1 altersthe glycogen shunt by regulating selective translation ofRACK1-mediated enzymes[J]. iScience, 2022, 25(3):103955.
[15]CUI X R, SAWASHITA J, DAI J, et al. Exercisesuppresses mouse systemic AApoAⅡ amyloidosisthrough enhancement of the p38 MAPK signalingpathway[J]. Dis Models Mech, 2022, 15(3): 1-16.
[16]LI D J, LI Y H, YUAN H B, et al. The novel exerciseinducedhormone irisin protects against neuronal injuryvia activation of the Akt and ERK1/2 signaling pathwaysand contributes to the neuroprotection of physicalexercise in cerebral ischemia[J]. Metabolism, 2017, 68:31-42.
[17]LIU X H, LIU T, YANG K L, et al. Antifatigue effectof asiaticoside in mice by attenuating oxidative stress[J].Discov Med, 2023, 35(176): 275-282.
[18]LU X D, CHEN J Q, HUANG L Y, et al. The antifatigueeffect of glycoprotein from hairtail fish(Trichiurus lepturus) on BALB/c mice[J]. Foods,2023, 12(6): 1245.
[19]DURONIO V. The life of a cell: apoptosis regulation bythe PI3K/PKB pathway[J]. Biochem J, 2008, 415(3):333-344.
[20]FRANKE T F, KAPLAN D R, CANTLEY L C.PI3K: downstream AKTion blocks apoptosis[J]. Cell,1997, 88(4): 435-437.
[21]ENGELMAN J A, CHEN L, TAN X H, et al.Effective use of PI3K and MEK inhibitors to treat mutantKras G12D and PIK3CA H1047R murine lungcancers[J]. Nat Med, 2008, 14(12): 1351-1356.
[22]REN Z L, ZHONG H, SONG C C, et al. Insulin promotes mitochondrial respiration and survival throughPI3K/AKT/GSK3 pathway in human embryonic stemcells[J]. Stem Cell Reports, 2020, 15(6): 1362-1376.
[23]LYU S Y, WANG H R, MA T J. Optimization ofsupercritical fluid CO2 extraction from yellow horn seedand its anti-fatigue and antioxidant activity [J].Molecules, 2023, 28(12): 4853.
[24]SUN W D, ZU S L, SHAO G F, et al. Long noncodingDANCR targets miR-185-5p to upregulate LIMand SH3 protein 1 promoting prostate cancer via theFAK/PI3K/AKT/GSK3β/snail pathway[J]. J GeneMed, 2021, 23(7): e3344.
[25]YADAV U C, NAURA A S, AGUILERAAGUIRREL, et al. Aldose reductase inhibitionprevents allergic airway remodeling through PI3K/AKT/GSK3β pathway in mice[J]. PLoS One, 2013, 8(2):e57442.
[基金项目] 吉林省教育厅“十三五”科学技术项目(JJKH20200078KJ)

