保留比值受损肺功能人群胸部CT特征的研究进展
黄锦海 李允 高怡

基金项目:国家重点研发计划项目(2018YFC1311900);广州国家实验室科研任务项目支持(SRPG22-018);广东省医学科学技术研究基金(C2021073)
引用本文:黄锦海,李允,高怡. 保留比值受损肺功能人群胸部CT特征的研究进展[J]. 中国全科医学,2024,27(29):3679-3684. DOI:10.12114/j.issn.1007-9572.2023.0370.[www.chinagp.net]
HUANG J H,LI Y,GAO Y. Research progress on chest CT features of the preserved ratio impaired spirometry population[J]. Chinese General Practice,2024,27(29):3679-3684.
? Editorial Office of Chinese General Practice. This is an open access article under the CC BY-NC-ND 4.0 license.
【摘要】 保留比值受损肺功能(PRISm)是一种常见的肺功能障碍,其被认为是慢性阻塞性肺疾病前期阶段,近年来颇受学术界的关注。尽管目前已有研究者对PRISm群体病因、流行病学、危险因素等方面进行了综述,但是有关胸部CT影像学的检查尚缺乏较为全面的综述。为了更加深入且全面地了解这一人群,本文对PRISm人群胸部CT影像学特征进行总结,评估方法包括视觉评估及定量评估,评估内容包括气道、肺实质及血管的特征变化。本文表明PRISm人群单纯根据胸部CT视觉评估得到的CT影像学特征的参考价值有限,胸部CT的定量评估及其联合肺功能检查指标有利于深入了解PRISm人群的肺部结构特征,并建议在未来开展更多的系统性研究,如前瞻性、大样本、多中心队列研究,以阐述PRISm人群的胸部影像学特征。
【关键词】 保留比值受损肺功能;慢性阻塞性肺疾病;胸部CT;肺功能检查;综述
【中图分类号】 R 563.9 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2023.0370
Research Progress on Chest CT Features of the Preserved Ratio Impaired Spirometry Population
HUANG Jinhai,LI Yun,GAO Yi*
The First Affiliated Hospital of Guangzhou Medical University/National Clinical Research Center of Respiratory Disease/National Respiratory Medical Center,State Key Laboratory of Respiratory Disease/Guangzhou Institute of Respiratory Health,Guangzhou 510010,China
*Corresponding author:GAO Yi,Professor;E-mail:misstall2@163.com
【Abstract】 Preserved ratio impaired spirometry (PRISm) is a common pulmonary functional impairment,considered a pre-chronic obstructive pulmonary disease stage and has received increased attention from the academic community in recent years. Despite a comprehensive review of the etiology,epidemiology,and risk factors of the PRISm population,there is a lack of systematic review for chest CT imaging. To gain a more comprehensive understanding of this population,this article summarizes the chest CT imaging features of the PRISm population using both visual and quantitative assessment methods,including the characteristic changes of airways,lung parenchyma,and vessels. The article indicates that the reference value of visual assessment of chest CT results for the PRISm population is limited,while quantitative assessment of chest CT,combined with pulmonary function testing,is advantageous in gaining a deeper understanding of the lung structural features of the PRISm population. Future studies are expected to employ a more systematic approach through prospective,large-sample,multi-center cohort studies to elucidate the characteristics of the PRISm population in chest imaging.
【Key words】 Preserved ratio impaired spirometry;Chronic obstructive pulmonary disease;Chest CT;Pulmonary function test;Review
2021年欧洲呼吸学会(European Respiratory Society)和美国胸科学会(American Thoracic Society)联合发布了更新版的常规肺功能检查解释策略技术标准,将用力肺活量(FVC)和/或第1秒用力呼气末容积(FEV1)降低、FEV1/FVC和肺总量(TLC)正常定义为“非特异性肺功能障碍”;而在TLC无法测量的吸烟人群中“非特异性肺功能障碍”又被定义为保留比值受损肺功能(preserved ratio impaired spirometry,PRISm)[1]。虽然PRISm人群并未满足慢性阻塞性肺疾病全球倡议(GOLD)诊断慢性阻塞性肺疾病(COPD)的标准,但既往研究发现该人群的发病率、全因死亡率较正常肺功能者显著增高[2-5]。因此,该群体也引起了学术界的普遍关注。
国内有学者对PRISm人群特征进行了较为详细的阐述[6-7],包括流行病学、预后、转归等方面[2-3,8-10],也有学者对PRISm的临床特征与COPD的相关性进行了探讨[11],PRISm群体随着时间推移,部分患者进展为COPD,因此有学者认为其是COPD的前期阶段。众所周知,计算机断层扫描(CT)能为COPD患者提供更多的肺结构功能异常的相关信息[12]。然而,目前已有的研究尚未对PRISm人群胸部CT检查等影像学特征进行总结。
因此,本文通过检索近年来关于PRISm的研究,重点总结PRISm人群的影像学特征(主要为胸部CT检查),为深入了解PRISm人群的临床特征提供参考价值。
1 本文文献检索策略
本文通过在PubMed、中国知网(CNKI)、中华医学期刊网等数据库,使用中文检索词“保留比值受损肺功能”以及英文检索词“Preserved ratio impaired spirometry”“PRISm”“CT”进行检索,检索时间设定为建库至2023年5月。共获取原始文献数量353篇,阅读题目及摘要后,初步排除不相关文献257篇,详细阅读96篇涉及PRISm人群相关研究和综述文献,特别是在胸部CT检查方面的研究。在排除与本文主题无关以及质量较差的文献后,最终纳入40篇文献,具体筛选流程见图1。
2 针对PRISm人群的研究现状
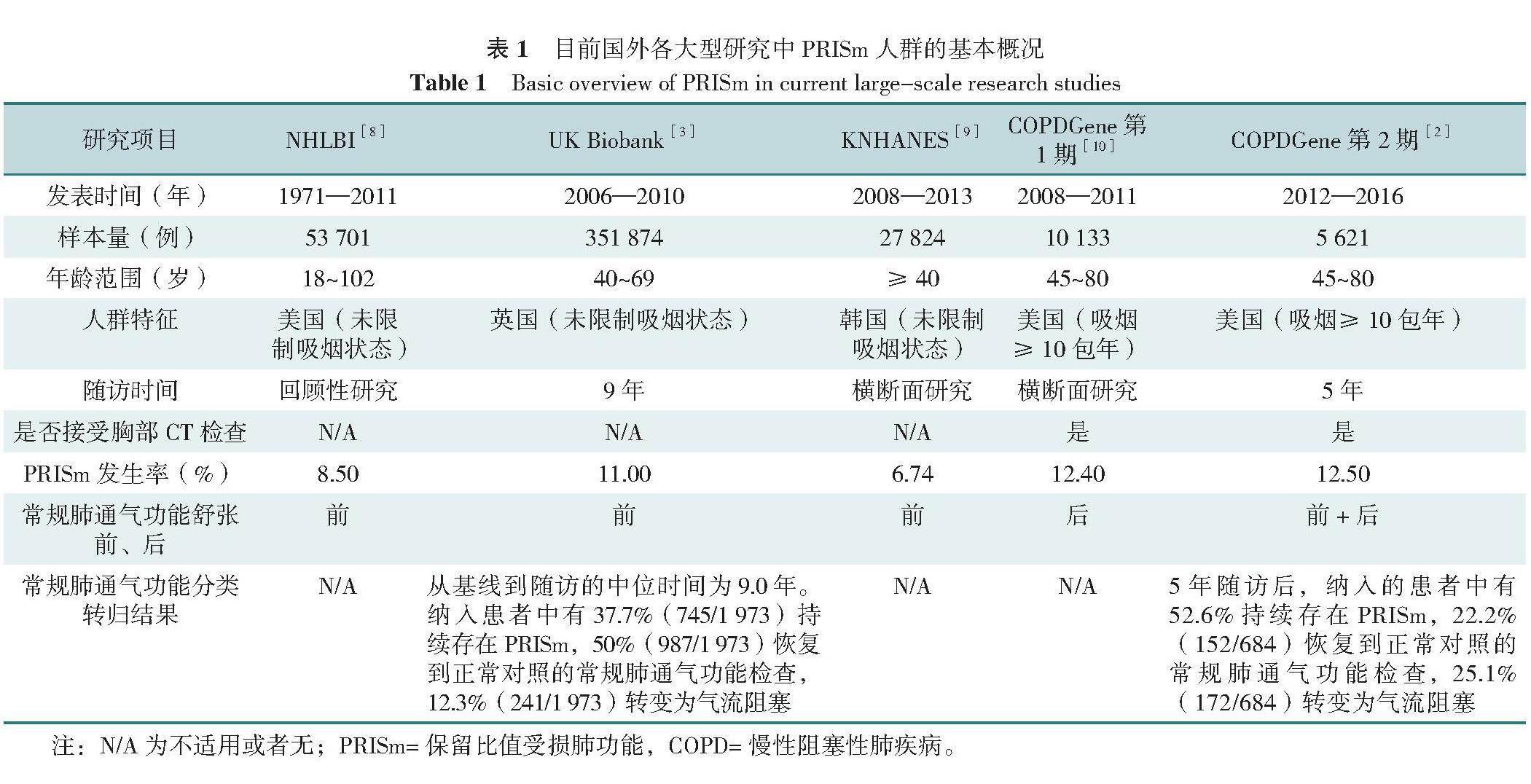
目前国内针对PRISm人群的大型队列研究较少,国外影响力较高的大型相关研究结果显示PRISm的发生率为6.74%~12.50%,具体见表1。在目前已发表的研究中,PRISm人群的危险因素主要包括吸烟、心力衰竭、高血压、肥胖、缺血性心肌病、痴呆、2型糖尿病、肺癌、慢性肾脏病、阻塞性睡眠呼吸暂停综合征、甲状腺疾病、高免疫球蛋白A血症和高免疫球蛋白G血症等[7,13-18]。通过对PRISm的临床指标进行主成分分析和非监督聚类分析发现,PRISm人群可分为类似COPD(FEV1升高,并且出现类似COPD的肺纹理改变)、限制性(肺气肿和气体陷闭程度和肺总量同时降低)、高代谢性(合并糖尿病和其他疾病的比例更高)3种临床亚型,随着时间推移,PRISm人群的肺功能可转变为正常、保留或者气流受限状态[10,19]。由于PRISm可能存在不同亚组,单纯应用肺功能检查评估PRISm人群可能无法满足该人群的深入研究需求,而胸部CT影像学检查更有助于识别这一人群肺部组织结构的改变。因此,综合胸部CT影像学检查可为PRISm人群肺部健康情况的量化评估提供更多信息。
3 胸部CT评估方法
相当一部分有呼吸道症状和影像学异常的吸烟者没有表现出正常人群定义的气流受限,由于这些个体具有显著的死亡和疾病进展风险,有学者建议通过综合环境暴露、临床症状、CT成像和肺活量测定标准综合进行COPD诊断[20]。PRISm可能是COPD亚临床或者前期阶段,目前对于PRISm人群胸部影像学表现的评估尚无统一标准。LYNCH等[21]提出并阐述的分类系统为COPD的视觉和定量评估提供了一种结构化方法,对PRISm人群胸部影像学特征评估有一定的参考价值。该方法视觉评估内容包括肺气肿、气道壁增厚、炎性小气道疾病、气管异常、肺间质异常、肺动脉扩张和支气管扩张等。定量评估主要包括以下参数:(1)肺实质主要参数,主要包括肺气肿指数(EI)、空气潴留指数(ATI)、吸气平均肺密度(MLD)、参数响应映射(PRM)、PRM中小气道功能障碍的百分比(PRMfSAD)等;(2)气道参数主要包括壁厚、壁面积、管腔面积等;(3)血管参数主要包括血管总容积、血管数、血管平均直径、血管面积、表面低衰减面积等。视觉评估主要靠医生视觉判断显得更加主观而定量评估,靠各项指标与参考值做比较会显得更加量化。
图 1 文献筛选流程
Figure 1 Flow chat of literature screening
4 PRISm人群胸部CT视觉评估特征
目前针对PRISm人群胸部CT表现的研究结果表明,该人群存在一定的气道管壁增厚、肺气肿表现[22],特别是在吸烟人群。但PRISm人群CT结果与GOLD 0级的人群的总体CT正常率大致相当(52.7%与 51%)[2]。
另有研究表明PRISm人群中的吸烟者的间隔旁型肺气肿(PSE)和小叶中心型肺气肿(CLE)患病率(44.6%和46.7%)高于PRISm人群中的非吸烟者,但与肺功能正常的吸烟者相当,证明吸烟是PRISm人群的危险因素。相比于存在气流受限的吸烟者,PRISm人群的PSE和CLE患病率明显降低。针对两种不同类型肺气肿的多变量分析结果显示,在PRISm人群的吸烟者中,合并CLE与FVC/TLCCT的降低(提示空气潴留)呈独立相关,而PSE与FVC/TLCCT无关,表明CLE比PSE更能反映PRISm人群中吸烟者的空气潴留状态[23]。
针对单纯气道病变组(APD)、单纯肺气肿病变组(EPD)和APD-EPD联合组三组不同CT视觉评估结果的比较显示,APD组年龄更低,FEV1占预计值百分比(FEV1%)更低[24],推测其原因可能为小气道病变先于肺气肿的发生[25]。小气道的炎症逐渐进展,将导致气道收缩和狭窄。随着时间的推移,小气道的炎症和气道收缩继续加重,最终导致肺气肿的发生。单纯APD组死亡率为26%,单纯EPD组死亡率为21%,APD-EPD联合组死亡率为54%。显然,小气道病变与肺气肿共同存在时PRISm人群的危险程度最高。另有研究表明,与GOLD 0~4级相比,一开始就有肺气肿的PRISm群体中更有可能存在肺气肿继续进展的风险(OR=5.73;P<0.01)[26]。
此外,AMAZA等[27]比较了胸部CT的医师视觉评估与定量评估两种方式肺气肿诊断准确度,结果显示两种方法只有61%的一致性(Kappa=0.22)。相比于定量评估,CT影像学结果的视觉评估对影像学结果的判读精准度更差,造成这种差异的主要原因可能是视觉评估主要依靠医生的视觉判断,而视觉本身就是主观判断,同时可能受到不同医师阅片经验的影响。
总结以上研究,胸部CT视觉评估对PRISm人群胸部影像学结果的判定有一定的辅助作用,但单纯视觉评估结果的参考价值有限。
5 PRISm人群胸部CT定量评估特征
5.1 气道特征
PRISm可能代表了COPD发展的早期阶段,在肺实质未被破坏或者破坏不明显之前,小气道可能已经存在改变[25]。VASILESCU等[28]认为基于PRMfSAD可以识别肺终末细支气管的损伤、狭窄和梗阻的区域。与健康对照者相比,PRISm患者小气道功能障碍(SAD)更加严重,TLCCT更低[29]。此外,有研究发现,与正常组相比,PRISm组患者左肺上叶第五级支气管壁面积百分比增加[30]。正常组与PRISm组气道参数有显著差异,提示管腔面积也可作为区分正常人和PRISm患者的依据,而PRISm组与轻至中度COPD组气道参数无显著差异[31]。最后该团队建立了一个二元Logistic模型用于预测COPD患者的病情,模型中包含了吸烟、MLD、PRMfSAD和管腔面积等因素,经过验证具有较好的拟合优度和受试者工作特征曲线下面积(AUC)值,模型AUC值为0.786(灵敏度为82.35%,特异度为65.96%)。以上研究均表明PRISm组气道参数如PRMfSAD、管壁面积、管腔面积与轻至中度COPD组气道参数十分接近,与正常人群差异较大,因此胸部CT气道参数更有可能作为识别PRISm组与正常人群的参考依据。在后续的研究中,模型需通过增加样本量和添加外部验证数据以进一步完善,提高模型的可靠性和临床应用价值。
5.2 肺实质特征
目前对于肺实质的影像学特征研究多于小气道及肺血管的相关研究。即使在吸烟指数≥10包年的PRISm人群中,也仅有1/3合并有肺活量异常,而超过2/3合并有肺气肿或小气道疾病的胸部影像学异常[32],由此可推断胸部影像学比肺功能检查更能直观地反映肺结构异常。
5.2.1 通过调整后肺密度(ALD)评估PRISm组肺实质变化:有学者对COPDGene?分析吸气相定量CT测量结果的5年变化情况进行分析[33],结果提示,PRISm组、GOLD0组和GOLD1-4组的调整后ALD平均值在5年内均有变化(PRISm组、GOLD0组和GOLD1-4组分别为-2.26、-1.67 g/L和-5.26 g/L),表明PRISm人群5年ALD下降量较正常人群略高,提示ALD可在一定程度上反映PRISm组肺实质的改变情况。
5.2.2 CT定量指标相比于肺量计结果指标更加精准:多数肺部定量CT参数与肺功能参数有轻度至中度相关性[31]。使用肺活量测定法或症状对吸烟引起的肺部疾病的诊断不足,而CT扫描在敏感性和特异性方面有显著改善[34]。SPIROMICS队列研究表明,在所有的PRISm受试者中,即便FEV1/FVC正常,CT测量的残余容积(RVCT)与TLCCT的比率(RVCT/TLCCT)有很大的差异,为21%~59%,随访(2.5±0.7)年后,较高RVCT/TLCCT相比于较低的受试者每年下降速度快0.66%(95%CI:0.06%~1.27%),RVCT/TLCCT较高者相比于较低者更有可能发展为肺功能测量的COPD(OR=5.7,95%CI=2.4~13.2)[35],由此可以推断RVCT/TLCCT比值较FEV1/FVC比值更精准。
5.2.3 肺总容量调整肺密度(TLC-PD15)与FEV1相关较强:在吸烟者中,肺实质以炎症和肺气肿为特征,这些过程可导致局部肺组织的减少。CT测量肺密度可以反映肺组织的变化。有研究采用多变量混合模型评估PRISm人群TLC-PD15与FEV1的纵向关系,结果显示不同GOLD分期患者的肺密度与肺功能的关系不同。在患有PRISm的吸烟者中,TLC-PD15每降低1 g/L,FEV1增加2.8 mL (P=0.02)。相反,在GOLD Ⅲ期至Ⅳ期的吸烟者中,TLC-PD15每降低1 g/L,FEV1降低
4.1 mL(P=0.002)[36]。因此TLC-PD15未来可能可作为肺功能下降的替代终点。
5.2.4 胸部CT定量评估与肺计量检查两种联合指标对PRISm人群进行评估:由于在COPD同时存在限制性通气不足的患者中,FVC相对于TLC可能出现不相称的下降,因此有研究用FVC/TLCCT来评估肺部空气潴留的情况,FVC为舒张后的值,而TLCCT则通过吸入性胸部CT扫描的容积测量[37]。按照FVC/TLCCT从小到大将PRISm人群分为极低、低、高、极高四组。其中,极低FVC/TLCCT四分位数(比值<0.53)与平均3.31%的高放射学气体潴留相关。在5年随访时肺活量测定有效的参与者中,极低、低、高、极高四组PRISm人群发展为COPD的概率分别为35.9%、23%、22%、17%,由此可见在PRISm人群中,FVC/TLCCT降低与COPD进展相关。四组患者中分别有26%、18%、16%和20%至少发生过一次严重呼吸加重,四组加重情况存在着趋向显著性的趋势(Cochran-Armitage P=0.095)[37]。也有研究表明,四组人群的死亡率分别为12.9%、11%、11.3%、5.9%[23]。以上数据证实极低FVC/TLCCT四分位组(比值<0.53)更需要引起关注,但该队列仅包括吸烟者,因此该研究结果无法推广到非吸烟人群,未来需要在独立队列中进一步验证该结果。
5.3 血管特征
目前对于应用胸部CT定量评估COPD患者肺部血管的研究较多,如卷积神经网络(CNNs)能为准确测量胸部CT图像上的血管提供帮助,并具备生理相关性的优点;血管横截面积≤0.61,肺动脉与主动脉(PA/A)横截径之比≥0.87的患者发生重度COPD的风险可能更高[38-40],有助于COPD临床特征的综合评估。但对于PRISm人群胸部定量评估血管的研究则较少。LU等[31]采用自动分割软件评估肺功能正常患者、PRISm患者和轻中度COPD患者三组人群在定量高分辨率CT参数与肺功能参数方面的相关性,结果发现大多数血管参数存在显著差异,总血管容积无显著差异。这可能是因为早期病变主要发生在小血管,对整体血管影响不大。总体而言,PRISm人群的CT特征主要表现为小血管病变,可以看出与正常人之间存在差别,多数血管指标显示更加靠近轻中度COPD组。未来仍需要针对PRISm人群胸部CT血管特征开展进一步研究。
6 总结与展望
本文介绍了PRISm人群胸部CT影像特征,重点介绍胸部CT视觉评估及定量评估的研究进展。胸部CT视觉评估对PRISm人群的胸部CT特点评价有一定的辅助作用,但单靠视觉评估结果的参考价值有限。CT定量评估显示PRISm组气道参数与轻至中度COPD组气道参数十分接近,与正常人群差异较大,因此胸部CT气道参数更有可能作为识别PRISm组与正常人群的依据。肺实质指标RVCT/TLCCT比值较FEV1/FVC比值更精准。极低FVC/TLCCT四分位数与PRISm人群进展为COPD高危人群后的死亡风险相关。此外,PRISm人群胸部CT的特征主要表现为小血管病变,多数指标与轻中度COPD患者相似。
虽然目前国际上已有针对PRISm人群的大型队列研究,但大多数研究没有纳入胸部CT结果,特别是对CT结果的定量评估。其次,可能需要综合肺功能检查(弥散功能检查、脉冲强迫振荡肺功能测定技术等)、胸部CT、临床表现、伴随疾病、炎症指标等构建PRISm人群风险预测模型,才能提高模型的灵敏度及特异度,更加精准地评估PRISm人群。
作者贡献:黄锦海负责文章的构思与设计、研究资料的收集与整理、表格编辑及论文撰写;李允与高怡负责论文修订、文章的质量控制及审校及监督管理;李允与高怡对文章整体负责。
本文无利益冲突。
参考文献
STANOJEVIC S,KAMINSKY D A,MILLER M R,et al. ERS/ATS technical standard on interpretive strategies for routine lung function tests[J]. Eur Respir J,2022,60(1):2101499. DOI:10.1183/13993003.01499-2021.
WAN E S,FORTIS S,REGAN E A,et al. Longitudinal phenotypes and mortality in preserved ratio impaired spirometry in the COPDGene study[J]. Am J Respir Crit Care Med,2018,198(11):1397-1405. DOI:10.1164/rccm.201804-0663OC.
HIGBEE D H,GRANELL R,DAVEY SMITH G,et al. Prevalence,risk factors,and clinical implications of preserved ratio impaired spirometry:a UK Biobank cohort analysis[J]. Lancet Respir Med,2022,10(2):149-157. DOI:10.1016/S2213-26002100369-6.
PAREKH T M,BHATIA S,CHERRINGTON A,et al. Factors influencing decline in quality of life in smokers without airflow obstruction:the COPDGene study[J]. Respir Med,2020,161:105820. DOI:10.1016/j.rmed.2019.105820.
WASHIO Y,SAKATA S,FUKUYAMA S,et al. Risks of mortality and airflow limitation in Japanese individuals with preserved ratio impaired spirometry[J]. Am J Respir Crit Care Med,2022,
206(5):563-572. DOI:10.1164/rccm.202110-2302OC.
赵宁宁,周玉民,保留比值受损肺功能人群研究进展[J]. 中华结核和呼吸杂志,2022,45(10):1046-1050. DOI:10.3760/cma.j.cn112147-20220518-00426.
王一如,王海龙,李婷,等. 肺功能保留研究现状及展望[J]. 国际呼吸杂志,2022,42(20):1597-1600.
WAN E S,BALTE P,SCHWARTZ J E,et al. Association between preserved ratio impaired spirometry and clinical outcomes in US adults[J]. JAMA,2021,326(22):2287-2298. DOI:10.1001/jama.2021.20939.
HEO I R,KIM H C,KIM T H. Health-related quality of life and related factors in persons with preserved ratio impaired spirometry:data from the Korea national health and nutrition examination surve[J]. Medicina,2020,57(1):4. DOI:10.3390/medicina57010004.
WAN E S,CASTALDI P J,CHO M H,et al. Epidemiology,genetics,and subtyping of preserved ratio impaired spirometry (PRISm) in COPDGene[J]. Respir Res,2014,15(1):89. DOI:10.1186/s12931-014-0089-y.
周天然,朱惠莉. 保留比例肺功能受损与慢性阻塞性肺疾病的临床探讨[J]. 国际呼吸杂志,2022,42(18):1410-1414. DOI:10.3760/cma.j.cn131368-20220626-00541.
Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary diseas (2023 report)[EB/OL]. [2023-06-11]. https://goldcopd.org/2022?gold?reports?2/.
XIAO T,WIJNANT S R A,LICHER S,et al. Lung function impairment and the risk of incident dementia:the Rotterdam study[J]. J Alzheimer's Dis,2021,82(2):621-630. DOI:10.3233/jad-210162.
LI G C,JANKOWICH M D,LU Y Q,et al. Preserved ratio impaired spirometry,metabolomics,and the risk of type 2 diabetes[J]. J Clin Endocrinol Metab,2023,108(9):e769-778. DOI:10.1210/clinem/dgad140.
KAAKS R,CHRISTODOULOU E,MOTSCH E,et al. Lung function impairment in the German Lung Cancer Screening Intervention Study (LUSI):prevalence,symptoms,and associations with lung cancer risk,tumor histology and all-cause mortality[J]. Transl Lung Cancer Res,2022,11(9):1896-1911. DOI:10.21037/tlcr-22-63.
ZHENG J Z,ZHOU R,ZHANG Y C,et al. Preserved ratio impaired spirometry in relationship to cardiovascular outcomes[J]. Chest,2023,163(3):610-623. DOI:10.1016/j.chest.2022.11.003.
ZHANG C,WEI S S,WANG Y X,et al. Association between preserved ratio impaired spirometry and sleep apnea in a Chinese community[J]. Curr Med Res Opin,2023,39(4):621-626. DOI:10.1080/03007995.2023.2182531.
KHAN S R,VANOVERSCHELDE A,LAHOUSSE L,et al. Serum immunoglobulins,pneumonia risk,and lung function in middle-aged and older individuals:a population-based cohort study[J]. Front Immunol,2022,13:868973. DOI:10.3389/fimmu.2022.868973.
WAN E S,HOKANSON J E,REGAN E A,et al. Significant spirometric transitions and preserved ratio impaired spirometry among ever smokers[J]. Chest,2022,161(3):651-661. DOI:10.1016/j.chest.2021.09.021.
LOWE K E,REGAN E A,ANZUETO A,et al. COPDGene? 2019:redefining the diagnosis of chronic obstructive pulmonary disease[J]. Chronic Obstr Pulm Dis,2019,6(5):384-399. DOI:10.15326/jcopdf.6.5.2019.0149.
LYNCH D A,AUSTIN J H M,HOGG J C,et al. CT-definable subtypes of chronic obstructive pulmonary disease:a statement of the fleischner society[J]. Radiology,2015,277(1):192-205. DOI:10.1148/radiol.2015141579.
WAN E S,HOKANSON J E,MURPHY J R,et al. Clinical and radiographic predictors of GOLD-unclassified smokers in the COPDGene study[J]. Am J Respir Crit Care Med,2011,
184(1):57-63. DOI:10.1164/rccm.201101-0021oc.
SHIRAISHI Y,SHIMADA T,TANABE N,et al. The prevalence and physiological impacts of centrilobular and paraseptal emphysema on computed tomography in smokers with preserved ratio impaired spirometry[J]. ERJ Open Res,2022,8(2):00063-2022. DOI:10.1183/23120541.00063-2022.
YOUNG K A,REGAN E A,HAN M K,et al. Subtypes of COPD have unique distributions and differential risk of mortality[J]. Chronic Obstr Pulm Dis,2019,6(5):400-413. DOI:10.15326/jcopdf.6.5.2019.0150.
MCDONOUGH J E,YUAN R,SUZUKI M,et al. Small-airway obstruction and emphysema in chronic obstructive pulmonary disease[J]. N Engl J Med,2011,365(17):1567-1575. DOI:10.1056/NEJMoa1106955.
POMPE E,MOORE C M,MOHAMED HOESEIN F A A,et al. Progression of emphysema and small airways disease in cigarette smokers[J]. Chronic Obstr Pulm Dis J COPD Found,2021,
8(2):198-212. DOI:10.15326/jcopdf.2020.0140.
AMAZA I P,O'SHEA A M J,FORTIS S,et al. Discordant quantitative and visual CT assessments in the diagnosis of emphysema[J]. Int J Chron Obstruct Pulmon Dis,2021,16:1231-1242. DOI:10.2147/COPD.S284477.
VASILESCU D M,MARTINEZ F J,MARCHETTI N,et al. Noninvasive imaging biomarker identifies small airway damage in severe chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med,2019,200(5):575-581. DOI:10.1164/rccm.201811-2083oc.
ZHAO N N,WU F,PENG J Q,et al. Preserved ratio impaired spirometry is associated with small airway dysfunction and reduced total lung capacity[J]. Respir Res,2022,23(1):298. DOI:10.1186/s12931-022-02216-1.
WEI X,DING Q,YU N,et al. Imaging features of chronic bronchitis with preserved ratio and impaired spirometry
(PRISm)[J]. Lung,2018,196(6):649-658. DOI:10.1007/s00408-018-0162-2.
LU J J,GE H Y,QI L,et al. Subtyping preserved ratio impaired spirometry (PRISm) by using quantitative HRCT imaging characteristics[J]. Respir Res,2022,23(1):309. DOI:10.1186/s12931-022-02113-7.
TRAN T V,KINNEY G L,COMELLAS A,et al. Prevalence of abnormal spirometry in individuals with a smoking history and no known obstructive lung disease[J]. Respir Med,2023,208:107126. DOI:10.1016/j.rmed.2023.107126.
POMPE E,STRAND M,VAN RIKXOORT E M,et al. Five-year progression of emphysema and air trapping at CT in smokers with and those without chronic obstructive pulmonary disease:results from the COPDGene study[J]. Radiology,2020,295(1):218-226. DOI:10.1148/radiol.2020191429.
STRINGER W W,PORSZASZ J,BHATT S P,et al. Physiologic insights from the COPD genetic epidemiology study[J]. Chronic Obstr Pulm Dis J COPD Found,2019,6(3):256-266. DOI:10.15326/jcopdf.6.3.2019.0128.
ARJOMANDI M,ZENG S Y,BARJAKTAREVIC I,et al. Radiographic lung volumes predict progression to COPD in smokers with preserved spirometry in SPIROMICS[J]. Eur Respir J,2019,54(4):1802214. DOI:10.1183/13993003.02214-2018.
ALEJANDRO A,DIAZ,MD M,et al. Disease severity dependence of the longitudinal association between CT lung density and lung function in smokers[J]. Chest,2018,153(3):638-645. DOI:10.1016/j.chest.2017.10.012.
FORTIS S,COMELLAS A,KIM V,et al. Low FVC/TLC in Preserved Ratio Impaired Spirometry (PRISm) is associated with features of and progression to obstructive lung disease[J]. Sci Rep,2020,10(1):5169. DOI:10.1038/s41598-020-61932-0.
CAO X X,GAO X Y,YU N,et al. Potential value of expiratory CT in quantitative assessment of pulmonary vessels in COPD[J]. Front Med,2021,8:761804. DOI:10.3389/fmed.2021.761804.
NARDELLI P,ROSS J C,SAN JOS? EST?PAR R. Generative-based airway and vessel morphology quantification on chest CT images[J]. Med Image Anal,2020,63:101691. DOI:10.1016/j.media.2020.101691.
YANG T,CHEN C H,CHEN Z Y L. The CT pulmonary vascular parameters and disease severity in COPD patients on acute exacerbation:a correlation analysis[J]. BMC Pulm Med,2021,21(1):34. DOI:10.1186/s12890-020-01374-6.
(收稿日期:2023-06-29;修回日期:2023-08-02)
(本文编辑:曹新阳)

