干旱胁迫下南瓜CmGolS1表达量及相关生理指标的变化
吴连周 程玉琦 陈敏氡 王彬 刘建汀 林锦辉 叶新如 曾美娟 温庆放 朱海生
摘要 [目的]通过分析干旱胁迫下“蜜本”南瓜基因CmGolS1(肌醇半乳糖苷合成酶基因1)的表达情况和可溶性糖含量的变化,解析干旱条件下南瓜的生理生化及基因水平变化,提高南瓜耐干旱能力。[方法]选用南瓜属品种‘蜜本南瓜作为试验材料,干旱处理2~7 d。通过荧光定量PCR和可溶性糖含量测定,获得CmGolS1基因表达量的变化和细胞可溶性糖含量的变化。[结果] CmGolS1在未干旱处理的对照组几乎不表达,随着干旱处理时间延长,表达量上调,在处理第3天达到峰值,随后在干旱处理3~7 d出现一定波动,但始终相对对照组维持在高表达。对照组南瓜第一片真叶的可溶性糖含量在220 μg/g左右;在干旱处理第3天开始显著上升,随后维持在320~330 μg/g,可溶性糖含量在干旱处理中后期维持相对稳定。[结论]干旱胁迫下,CmGolS1上调表达,其合成产物半乳糖是多种可溶性糖的前体,可能与生理生化中可溶性糖的上调有关。可溶性糖的积累是植物抗旱过程中的一项重要生理反应,有助于降低细胞水势,抵御干旱环境。CmGolS1基因可为南瓜干旱胁迫下的生理生化变化及抗旱育种的分子机制提供重要信息。
关键词 南瓜;干旱;GolS;可溶性糖
中图分类号 S 642.1 文献标识码 A 文章编号 0517-6611(2024)12-0066-05
doi:10.3969/j.issn.0517-6611.2024.12.013
Changes of CmGolS1 Expression and Related Physiological Indexes in Pumpkin Under Drought Stress
WU Lian-zhou1,2,3,4, CHENG Yu-qi1,2,3,4,CHEN Min-dong2,3,4 et al
(1.College of Horticulture,Fujian Agriculture and Forestry University,Fuzhou,Fujian 350002;2.Crop Research Institute, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350013;3.Fujian Key Laboratory of Vegetable Genetics and Breeding, Fuzhou, Fujian 350013;4.Fujian Engineering Technology Research Center for Vegetable, Fuzhou, Fujian 350013)
Abstract [Objective] By analyzing the expression of CmGolS1(galactinol synthase1) and the changes of soluble sugar content in ‘Miben pumpkin under drought stress, the physiological, biochemical and gene level changes of pumpkin under drought stress were analyzed, so as to improve the drought tolerance of pumpkin. [Method] The Cucurbita cultivar ‘Miben was selected as the research material and treated with drought for 2-7 days. The changes of CmGolS1 gene expression and soluble sugar content were detected by fluorescence quantitative PCR and soluble sugar content assay. [Result] CmGolS1 was almost not expressed in the control group, but with the progress of drought treatment, its expression level increased significantly, reached a significant high value on the third day of drought treatment, and then fluctuated within 3-7 days of drought treatment, but remained high compared with the control group. The soluble sugar content of the first true leaf of pumpkin in the control group was maintained at about 220 μg/g;it began to increase significantly at 3 days after drought treatment, and then maintained at 320-330 μg/g. The soluble sugar content remained relatively stable in the middle and late stage of drought treatment. [Conclusion] Under drought stress, the expression of CmGolS1 is up-regulated, and its synthetic product galactose is the precursor of a variety of soluble sugars, which may be related to the up regulation of soluble sugars in physiology and biochemistry. The accumulation of soluble sugar is an important physiological response in the process of plant drought resistance, which helps to improve cell water potential and resist drought environment. CmGolS1 gene can provide important information for physiological and biochemical changes of pumpkin under drought stress and molecular mechanism of drought resistance breeding.
Key words Pumpkin;Drought;GolS;Soluble sugar
基金项目 福建省属公益类科研院所基本科研专项(2022R1031007);福建省农科院科技创新平台专项(CXPT2021001);福建省自然科学基金项目(2021J01494);国家大宗蔬菜产业技术体系福州综合试验站(CARS-23-G-53)。
作者简介 吴连周(1992—),男,福建福州人,研究实习员,从事蔬菜育种与生物技术研究。
*通信作者,研究员,从事蔬菜育种与生物技术研究。
收稿日期 2023-07-04
南瓜(Cucurbita ssp.)在世界各地普遍栽培。其果实作肴馔,亦可替代粮食,营养丰富,果肉富含果胶、戊聚糖、甘露糖、多种氨基酸、维生素C、胡萝卜素及多种矿物质,其耐旱性、适应性强,是我国人民喜爱的传统蔬菜,在我国广泛种植。我国是世界上南瓜最大的生产和消费国[1-2]。我国广大的北方地区常年缺水,南方丘陵地区也同样存在季节性干旱问题。如果植物水分供给不足,将会严重限制植物生长发育,影响产量。而灌溉用水不断增加,将会激化水资源的供需矛盾,也必然会使当前已经存在的水资源失衡问题进一步恶化,这将成为农业可持续发展的障碍。不利的干旱环境,不仅会影响作物内在的许多生理代谢过程,也会影响作物体内物质的运输及植物的光合效率,影响产量和品质。在实际生产过程中夏季南瓜常会遇到干旱环境的影响。当蔬菜受到干旱环境影响时,其光合作用减弱,根系的吸收能力下降,并出现生理生化代谢紊乱,从而导致蔬菜作物出现发育不良或早衰、生长停滞和间歇性结果。
植物受到环境胁迫时,可以迅速合成并积累不同种类的渗透调节物质来维持植物细胞内正常的生理机能,避免植物受到胁迫伤害,棉子糖系列寡糖即为一种小分子渗透调节物质。正常生长条件下,棉子糖系列寡糖在植物体内积累量相对较少,而受到外界胁迫时,其含量会迅速增加。肌醇半乳糖苷合成酶是棉子糖合成过程中的关键酶,因此,认为GolS是植物应对环境胁迫的关键基因[3]。目前,在GolS的研究上,研究者从表达分析、生理研究到遗传转化均做了大量工作,主要研究其在大豆[4-5]、芝麻[6]、巴西橡胶[7]、拟南芥[8-9]、巨桉[10]、刺齿报春[11]、玉米[12]、棉花[13]、新疆沙冬青[14]、梅花[15]等植物体内的表达情况。在对大豆的研究中发现,在多种非生物胁迫作用下,GolS的表达量均受到影响,其中尤其以干旱胁迫下的表达变化最为显著,推测该基因受干旱胁迫影响显著[4]。
CmGolS1基因是一个糖类合成的关键基因,在先期转录组测序研究中,发现该基因表达变化大,前人研究发现,该基因是干旱胁迫的关键基因,且在南瓜中尚未有研究。
笔者通过结合可溶性糖含量的变化,来解释该基因在干旱胁迫下的表达变化以及相关的干旱生理反应,以初步揭示该基因参与的南瓜干旱的生理生化和基因表达进程,为抗旱育种和栽培管理提供参考。
1 材料与方法
1.1 试验材料
供试材料为福建金品农业科技发展有限公司生产苗期正常生长状态下的南瓜属(Cucurbita)品种“蜜本”南瓜。
1.2 试验方法
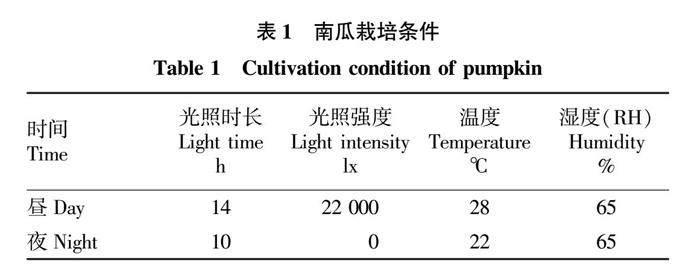
选取苗期两叶一心时期,干旱胁迫2、3、4、5、7 d,分别记作D2、D3、D4、D5、D7,对照组选用处理0天的幼苗,记作D0。培养环境见表1。处理第0天14:00将每个穴盘中加入1 L水,1 h后将水倒去,沥干,并记作第0天,此后不再浇水。以后每次取样时间均为15:00。穴盘选用28孔穴盘苗,边取样,边疏苗。
1.3 可溶性糖含量的测定
1.3.1
蒽酮乙酸乙酯的制备。将1 g蒽酮溶解于50 mL乙酸乙酯中,备用。
1.3.2
可溶性糖标准曲线的制作。选取50 mL离心管若干,分别加入0、 0.2、0.4、0.6、0.8、1.0 mL 100 μg/mL的蔗糖溶液,用水补齐至2 mL编号后分别加入0.5 mL的蒽酮乙酸乙酯和5 mL浓硫酸。密封后快速充分振荡,振荡后立即将试管放入100 ℃水浴中加热10 min,而后取出冷却至室温,以不加蔗糖溶液的对照管在630 nm波长下调零,其他各管依次测定吸光值,求出标准曲线方程。
1.3.3
样品可溶性糖含量测定。剪下待测南瓜第一片真叶0.3 g,剪碎后加入15 mL玻璃试管中,向管中加入5 mL超纯水,密封后快速充分振荡,振荡后立即将试管放入100 ℃水浴中加热10 min,加热之后用漏斗和滤纸将提取液过滤到25 mL有刻度的试管中,用蒸馏水洗涤漏斗上残留2次并收集清洗之后的液体,将试管中液体定容至25 mL,得到的溶液即为样品提取液。吸取样品提取液1 mL,并用玻璃试管盛放,依表2进行加样,提取液代替蔗糖溶液,蒸馏水体积均调整为1 mL。取出冷却至室温,在630 nm波长下测样品管的吸光值,重复测定,数值稳定后,取最后一次数值。并根据标准曲线方程计算可溶性糖含量。
1.4 叶片水势的测定
使用未受干旱胁迫的南瓜叶片进行预试验,确定未受干旱胁迫下南瓜叶片的水势,并设置不同水势梯度对应的蔗糖浓度范围。
标准浓度的蔗糖溶液配制:取若干干燥试管,给各管依次编号并排在试管架上。配制好预设的不同浓度的蔗糖溶液,并分别取20 mL作为标准蔗糖浓度试验用液体,剩余液体保存供不同干旱程度的南瓜叶片测定用。
选择不同干旱时期的南瓜第一片真叶,液氮冷冻粉碎后,取0.1 g放入试管中,分别倒入4 mL不同浓度的蔗糖溶液,静置或抽真空,待南瓜叶片完全沉入溶液底部。向各管加入一滴甲烯蓝溶液,轻轻振荡后溶液呈蓝色。使用20 μL枪头,弯折后从各管中按蔗糖溶液浓度从小到大依次吸取适量少许着色的液体,然后伸入与之相对应的不同浓度的标准蔗糖溶液,轻轻挤压毛细滴管使其尖端横向流出一滴着色液体,并观察着色液滴的移动方向。若液滴上移则表示试验组蔗糖溶液浓度降低,即叶片水势对应蔗糖浓度大于蔗糖溶液浓度,叶片失水,反之亦然,若液滴高度不变,则该浓度下的蔗糖溶液水势即为叶片水势。
水势的计算公式:Ψw=-iCRT(MPa)
1.5 荧光定量PCR
1.5.1 内参基因的筛选。
通过NCBI获得南瓜18S rRNA序列,使用primer premier 5进行引物设计,获得备选的内参基因引物。对备选的引物进行qPCR验证,观察备选内参基因的稳定性及其溶解曲线,最终选定内参基因。
1.5.2 引物设计。
对CmGolS1基因进行引物设计,挑选出3对引物,送往生物公司进行引物合成。对合成的引物,进行qPCR验证,观察备选基因的溶解曲线,最终确定所使用引物。
1.5.3 基因表达情况验证。
(1)RNA提取。对不同干旱处理时期的南瓜第一片真叶总RNA的提取,采用诺唯赞公司生产的RNA提取试剂盒。提取后,对总RNA进行质量检测。
RNA浓度测定。取南瓜RNA提取样品,用超微量分光光度计测定每管南瓜叶片RNA样品的OD230/260、OD260/280及RNA浓度。
RNA质量检测。配制1% TAE电泳胶,以120 V电压进行电泳,约30 min,通过凝胶成像仪检测RNA电泳结果。
(2)反转录。反转录使用南京诺唯赞生物科技股份有限公司生产的试剂盒,流程见表2。
(3)qPCR反应。为防止试验出现的操作误差,试验过程中设置3个生物学重复,每个反应做2个复孔,结果使用方法计算,以浓度100 ng/mL的cDNA为模板,分别在PCR管中加入2×ChamQ Universal SYBR q PCR Master mix 10.0 μL,
Primer 1(10 μmol/L)0.4 μL,
Primer 2(10 μmol/L)0.4 μL,
Template DNA/cDNA 100 ng,加ddH2O至20.0 μL。qPCR反应流程见表3。
对于任一处理DX的基因,其相对表达量的计算方法为2^(CT内参-CTDX),每一个处理天数下的内参基因均与该处理天数下的所有基因同时进行qPCR扩增,用以校正单日的基因表达量。
2 结果与分析
2.1 干旱胁迫对南瓜幼苗可溶性糖含量的影响
使用标准浓度蔗糖溶液制作可溶性糖标准曲线,结果见图1,可溶性糖含量回归方程为y=224.18x,其中y为可溶性糖含量(μg),x为溶液620 nm处吸光值。
由图2可知,对照组南瓜第一片真叶的可溶性糖含量在220 μg/g左右;在干旱处理3 d开始显著上升,随后维持在320~330 μg/g。
2.2 干旱胁迫对南瓜幼苗叶片水势的影响
由图3可知,对照组叶片水势在-0.60 MPa左右;随着干旱胁迫的加剧,干旱处理2 d,南瓜第一片真叶水势下降至-0.75 MPa;干旱处理3 d,叶片水势下降至低点,此后一直在-1.00 MPa以下。
2.3 干旱胁迫下南瓜CmGolS1表达量的变化
由图4可知,CmGolS1基因在对照组中几乎不表达,而随着干旱胁迫的加剧,其表达量大幅提高,在第2天即表达量显著提高,第3天之后在较高值附近波动。
2.4 干旱胁迫下南瓜基因表达变化和生理生化变化的相关性分析
由表4与图5可知,CmGolS1基因在干旱处理下的mRNA相对表达量与第一片真叶中可溶糖含量呈显著正相关(P<0.01),相关系数为0.88。
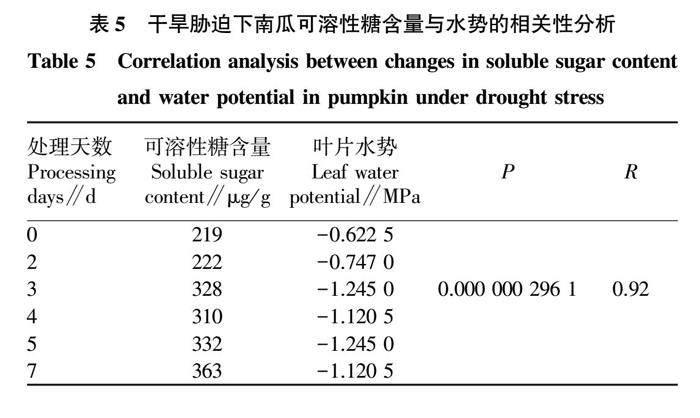
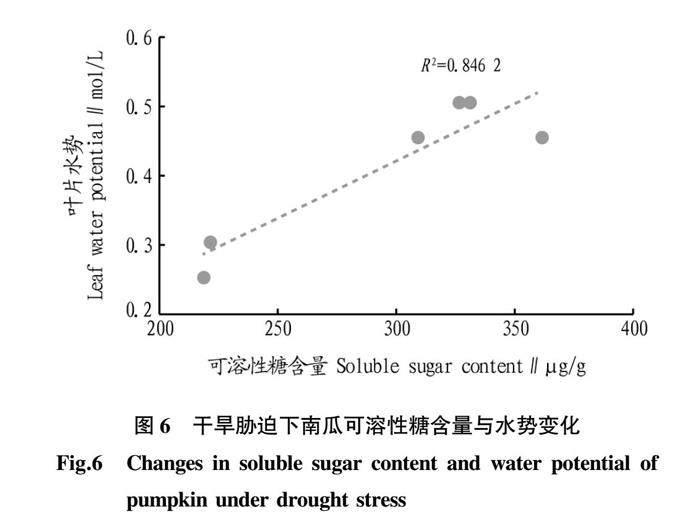
由表5与图6可知,叶片可溶性糖含量在干旱处理下与叶片水势呈显著负相关(P<0.01),相关系数为0.92。
3 讨论
肌醇半乳糖苷合成酶(GolS)是植物在抵御多种非生物胁迫过程中合成棉子糖的第一个限速酶,其催化蔗糖逐步叠加半乳糖基团而合成棉子糖家族低聚糖(RFOs),并参与植物对低温、干旱、非选择性接触性除草剂、机械伤害和活性氧等非生物胁迫过程的防御和应答[16],目前多在参与种子或叶片等组织器官中RFOs的积累与抗性的关系中有研究。因此,RFOs代谢途径与植物抗逆性之间关系密切,而GolS是RFOs生物合成起始的关键限速酶,其催化肌醇半乳糖苷的合成,并以此为供体,在棉籽糖合成酶和水苏糖合成酶的作用下,将蔗糖合成为棉籽糖和水苏糖等寡糖[17]。这些可溶性糖不仅可以在细胞中作为渗透调节物质,还可以作为植物响应环境的信号物质[18]。而正常生长条件下,棉子糖系列寡糖在植物体内积累量相对较少,在受到外界的胁迫时,含量迅速增加。将大豆GmGolS1克隆并进行烟草转基因试验发现,GmGolS1基因的过表达,可以提高烟草的耐高温性[19]。因此,认为GolS是植物应对环境胁迫的关键基因。
在对南瓜可溶性糖含量的测定中发现,南瓜在干旱第3天即在叶片内大量积累可溶性糖,随后维持在较高水平。这与前人在干旱对兴安落叶松[20]、小叶锦鸡儿幼苗[21]以及刺槐幼苗[22]干旱胁迫下可溶糖含量变化的研究结果相一致,且研究表明,可溶性糖含量的增加来源于淀粉的分解。结合可溶性糖的抗旱作用,表明南瓜植株在干旱胁迫下表现出比较稳定的抗旱性,且反映出南瓜在干旱第3天已经出现抗旱生理反应。对水势的观察中发现,南瓜叶片水势响应干旱胁迫较为迅速,在干旱胁迫初期的第3天,其第一片真叶水势便下降至低点,以响应干旱胁迫,随后水势维持在较低水平,推测这可能与可溶性糖的积累有关。研究发现,干旱胁迫下叶片水势的变化,与气孔闭合存在一定关系[23-24],而水势的高低,不仅意味着植株抗旱能力的强弱,也预示着植株吸水潜能的强弱。较低的水势,往往伴随着较高的吸水潜能[25],吸水潜能越高,则植株在复水后,往往可以越快地恢复生长[26]。可溶性糖含量的增加,加强了植株的抗旱能力;淀粉作为可溶性糖的前体,在水中的溶解度较低[27-30],故淀粉的减少对水势下降的影响较少。在qPCR验证中,发现CmGolS1基因的上调表达,与生理生化试验中可溶性糖含量增加和水势下降变化高度一致,推测CmGolS1基因的上调表达与可溶性糖含量的积累和水势的下降高度相关,并最终作用于植株,使植株具有一定的抗旱性。
相关性分析中发现,CmGolS1基因表达量变化与可溶性糖含量变化的P值小于0.01,且相关性R值为0.88,呈显著相关;可溶性糖含量变化与叶片水势变化的P值小于0.01,且相关性R值为0.92,呈显著相关。因此推测,CmGolS1基因在干旱胁迫中表达量的提高,引起了可溶性糖的大量积累,继而引起叶片水势下降,以使叶片维持在较高的渗透压下不易失水,以应对干旱胁迫。
CmGolS1受多种逆境条件诱导上调表达,该试验验证了其受干旱胁迫上调表达。但具体受干旱胁迫上调表达的原因尚不明晰,推测其上游启动子中可能存在响应给干旱胁迫及其他胁迫的元件,有待进一步验证。前人研究中发现,AtTGA7[31]、Atpmyb35[32]、Oshox24P[33]基因都是重要的干旱诱导转录因子,MYB家族[34]、WRKY家族[35-36]中亦有许多干旱相关的转录因子,可作为未来研究的突破口。
4 结论
通过“蜜本”南瓜干旱胁迫的可溶性糖含量变化、叶片水势变化和CmGolS1基因表达量变化的研究发现,2项生理指标与CmGolS1含量的变化均高度相关。可溶性糖含量在第3天升高之后稳定于高点,而叶片水势在第3天降低之后稳定于低点,推测可溶性糖为植株抗旱的重要物质,其在干旱胁迫进程中持续为植株提供抗旱能力,避免细胞过量失水,并造成细胞处于低水势,可以用作衡量南瓜抗旱性的指标之一,可以作为其他品种南瓜抗旱性的鉴定指标。
“蜜本”南瓜干旱胁迫过程中的生理指标,结合CmGolS1基因表达量的变化,可为南瓜抗旱育种的分子机制提供重要信息,并可以进行后续敲除、过表达等试验,验证其基因功能。
参考文献
[1] 李新峥,杨鹏鸣,刘振威,等.中国南瓜主要性状遗传特性的研究[J].华南农业大学学报,2011,32(1):7-10.
[2] 郑道君,云天海,张治礼,等.中国南瓜海南农家品种资源遗传多样性和亲缘关系研究[J].核农学报,2016,30(5):869-877.
[3] 范洁.木薯肌醇半乳糖苷合成酶基因MeGolS5的抗旱功能研究[D].海口:海南大学,2015.
[4] 邱爽,张军,何佳琦,等.大豆肌醇半乳糖苷合成酶基因GmGolS克隆及非生物胁迫表达分析[J].西南农业学报,2021,34(5):945-949.
[5] 张军,邱爽,何佳琦,等.大豆GmGolS基因植物表达载体构建及烟草遗传转化[J].齐齐哈尔大学学报(自然科学版),2020,36(6):22-25.
[6] 刘爱丽,魏梦园,黎冬华,等.芝麻肌醇半乳糖苷合成酶基因SiGolS6的克隆及功能分析[J].中国农业科学,2020,53(17):3432-3442.
[7] 卢基来,王志勇,龙翔宇,等.巴西橡胶树GolS和RS家族基因理化特性与表达特征分析[J].分子植物育种,2020,18(20):6665-6670.
[8] 沈阳,贾博为,王金玉,等.拟南芥肌醇半乳糖苷酶AtGolS2基因在非生物胁迫应答中的功能分析[J].分子植物育种,2021,19(11):3588-3597.
[9] 郑小芬,李晓霞,黄金兰,等.拟南芥肌醇半乳糖苷合成酶与棉子糖合成酶的体外催化活性比较[J].生物技术,2019,29(1):69-76.
[10] 从青.巨桉抗逆相关基因EgrGolS3的鉴定及功能研究[D].杭州:浙江农林大学,2019.
[11] 覃信梅,卢永彬,江祈贵,等.刺齿报春苣苔肌醇半乳糖苷合成酶基因的鉴定及序列分析[J].江苏农业科学,2019,47(8):56-60.
[12] 谷雷.玉米肌醇半乳糖苷合成酶2基因(ZmGOLS2)的功能和表达调控研究[D].杨凌:西北农林科技大学,2018.
[13] 任岩岩.棉花Gols基因的克隆及抗旱耐盐新种质的创制[D].西安:西北大学,2018.
[14] 易萌萌.新疆沙冬青AnGolS2基因的克隆及表达调控研究[D].沈阳:沈阳农业大学,2018.
[15] 左静.梅花肌醇半乳糖苷和棉子糖合成酶基因的克隆与功能初探[D].武汉:华中农业大学,2017.
[16] ZUTHER E,BCHEL K,HUNDERTMARK M,et al.The role of raffinose in the cold acclimation response of Arabidopsis thaliana[J].FEBS letters,2004,576(1/2):169-173.
[17] PETERBAUER T,RICHTER A.Biochemistry and physiology of raffinose family oligosaccharides and galactosyl cyclitols in seeds[J].Seed science research,2001,11(3):185-197.
[18] SHEEN J,ZHOU L,JANG J C.Sugars as signaling molecules[J].Current opinion in plant biology,1999,2(5):410-418.
[19] 李铭杨,邱爽,何佳琦,等.大豆GmGolS1的克隆及转基因烟草耐高温性鉴定[J].植物遗传资源学报,2022,23(2):575-582.
[20] 杜尧,韩轶,王传宽.干旱对兴安落叶松枝叶非结构性碳水化合物的影响[J].生态学报,2014,34(21):6090-6100.
[21] 雷虹,王凯,田浩,等.小叶锦鸡儿幼苗非结构性碳水化合物积累及分配对干旱胁迫的响应[J].生态学杂志,2017,36(11):3168-3175.
[22] 张婷,曹扬,陈云明,等.生长季末期干旱胁迫对刺槐幼苗非结构性碳水化合物的影响[J].水土保持学报,2016,30(5):297-304.
[23] 王晶晶,莫伟平,贾文锁,等.干旱条件下葡萄叶片气孔导度和水势与节位变化的关系[J].中国农业科学,2013,46(10):2151-2158.
[24] 纪文龙,范意娟,李辰,等.干旱胁迫下葡萄叶片气孔导度和水势动态的变化规律[J].中国农业大学学报,2014,19(4):74-80.
[25] 王丁,姚健,杨雪,等.干旱胁迫条件下6种喀斯特主要造林树种苗木叶片水势及吸水潜能变化[J].生态学报,2011,31(8):2216-2226.
[26] 郝卫平.干旱复水对玉米水分利用效率及补偿效应影响研究[D].北京:中国农业科学院,2013.
[27] 赵佳.水—热处理对淀粉理化特性的影响[D].杨凌:西北农林科技大学,2012.
[28] 张令文,计红芳,白师师,等.不同品种绿豆淀粉的功能特性比较研究[J].现代食品科技,2015,31(6):84-90.
[29] 李志伟,钟雨越,吴权明,等.高直链玉米淀粉的理化特性研究[J].西北农林科技大学学报(自然科学版),2014,42(7):53-60.
[30] 李欣,高菲,刘紫薇,等.高粱淀粉-多酚复合物与高粱淀粉的理化性质比较分析[J].中国粮油学报,2022,37(6):98-102.
[31] 吴娟娟.拟南芥转录因子TGA7参与植物响应干旱胁迫的机制研究[D].北京:中国农业大学,2014.
[32] 吴宪.拟南芥干旱诱导型启动子的克隆及功能分析[D].长春:吉林大学,2013.
[33] 杨梅,熊立仲.水稻干旱诱导型启动子Oshox24P的分离与鉴定[J].华中农业大学学报,2011,30(5):525-531.
[34] 刘蕾,杜海,唐晓凤,等.MYB转录因子在植物抗逆胁迫中的作用及其分子机理[J].遗传,2008,30(10):1265-1271.
[35] 李冉,娄永根.植物中逆境反应相关的WRKY转录因子研究进展[J].生态学报,2011,31(11):3223-3231.
[36] 谢政文,王连军,陈锦洋,等.植物WRKY转录因子及其生物学功能研究进展[J].中国农业科技导报,2016,18(3):46-54.

