MgCl2-MgBr2-H2O体系323.15K体系的稳定相平衡研究
谢庆国 曹国栋 李瑞琛
摘 要: 对323.15 K下MgCl2-MgBr2-H2O的稳定相平衡的研究,并利用等温溶解法进行实验。研究测量了多个参数,如平衡溶解度、折光率和pH值,并成功绘制了一张有序的相平衡图。通过分析相平衡图,观察发现该三元体系中存在引人注目的固溶体结晶区域,即Mg(Cl,Br)2·6H2O固溶体。这个固溶体的组成呈现出盐与盐之间过渡的规律,并具有明显连续性。溶液物理化学特性随着MgCl2浓度变化而变化。
关键词: 稳定相平衡 溶解度 固溶体 结晶
中图分类号: O642.4+2文献标识码: A文章编号: 1679-3567(2024)03-0086-04
SResearch on the Stable Phase Equilibrium of the MgCl2-MgBr2-H2O System at 323.15 K
XIE Qingguo* CAO Guodong LI Ruichen
Shandong Lixing Advanced Material Co.,Ltd., Linyi, Shandong Province, 276000 China
Abstract: The stable phase equilibrium of MgCl2-MgBr2-H2O at 323.15 K is studied and tested by the isothermal method. The study measures several parameters, such as equilibrium solubility, the refractive index and pH, and successfully draws an ordered phase equilibrium diagram. By analyzing the phase equilibrium diagram, it is found that there is a striking solid solution crystalline region in the ternary system, namely the Mg(Cl,Br)2·6H2O solid so‐lution, the composition of this solid solution shows the law of transition among salt and has obvious continuity, and that the physicochemical properties of the solution change with the concentration of MgCl2.
Key Words: Stable phase equilibrium; Solubility; Solid solution; Crystal
西部地区的盐湖资源蕴含着丰富的钾、镁、锂、硼、溴等矿产[1],这些矿产对于工业、农业、医药等行业都具有重要的应用价值[2]。通过合理地开发和利用,可以进一步满足我国经济的需求,推动相关产业的发展。
相平衡和相图是开发盐湖卤水资源的基石[3],深入了解盐湖中各种矿物质的性质和它们之间的相互关系具有重要意义。通过分析相平衡和相图的规律,能够制订综合利用方案,探究盐湖地球化学特征和成矿规律[4],为战略性地有效开发盐湖资源提供关键支持。
本研究基于溶液相化学的发展,旨在针对MgCl2-MgBr2-H2O体系在323.15 K下的稳定相平衡进行深入研究。通过精确测量其稳定平衡液相的成分[5-6]以及关键的物化性质(如折光率和pH值),同时采用湿渣法确定相应的平衡固相,计划绘制出相图以及物化性质-组成图。
1 实验部分
1.1 实验试剂
去离子水(σ≤1.8×10-4S·m-1;pH≈6.6);六水合氯化镁(AR,东莞市勋业化学试剂有限公司);六水合溴化镁(AR,上海新宝精细化工厂)。
1.2 实验仪器
数控超声波清洗器KQ500DE型(青岛聚创环保);阿贝折射仪WYA-2WAJ型(山东博普电子科技);MP230型pH计(Mettler-Toledo上海);pH-3C型数字酸度计(山东德天环保设备);电子分析天平FA1004C-2004CS型(青岛聚创环保);TLYCS-50AF型水浴恒温振荡器(江苏天翎仪器);超级恒温槽CH2006型(青岛明博科技)。
1.3 实验方法
实验选取等温溶解的方法,从次一级系统的共饱点起,渐渐地加入另一种盐。根据相图的预测,在塑料容器中制备了卤水,并将其放置在恒温振荡器中进行等温溶解。在恒温振荡器中平稳搅拌并恒温323.15±0.2 K。在这个温度下,定期监测表面清液的组成情况。经过约48 h后,溶解体系达到了平衡状态,其中的组分保持稳定不变。一旦达到平衡状态,取液相和湿渣样品进行检测和分析[3-7]。对于固相成分的检验,则采用湿渣法进行[7],同时测定体系的pH值及折光率。


2 在323.15 K下稳定相平衡研究(MgCl2-MgBr2-H2O)
2.1 相平衡实验结果
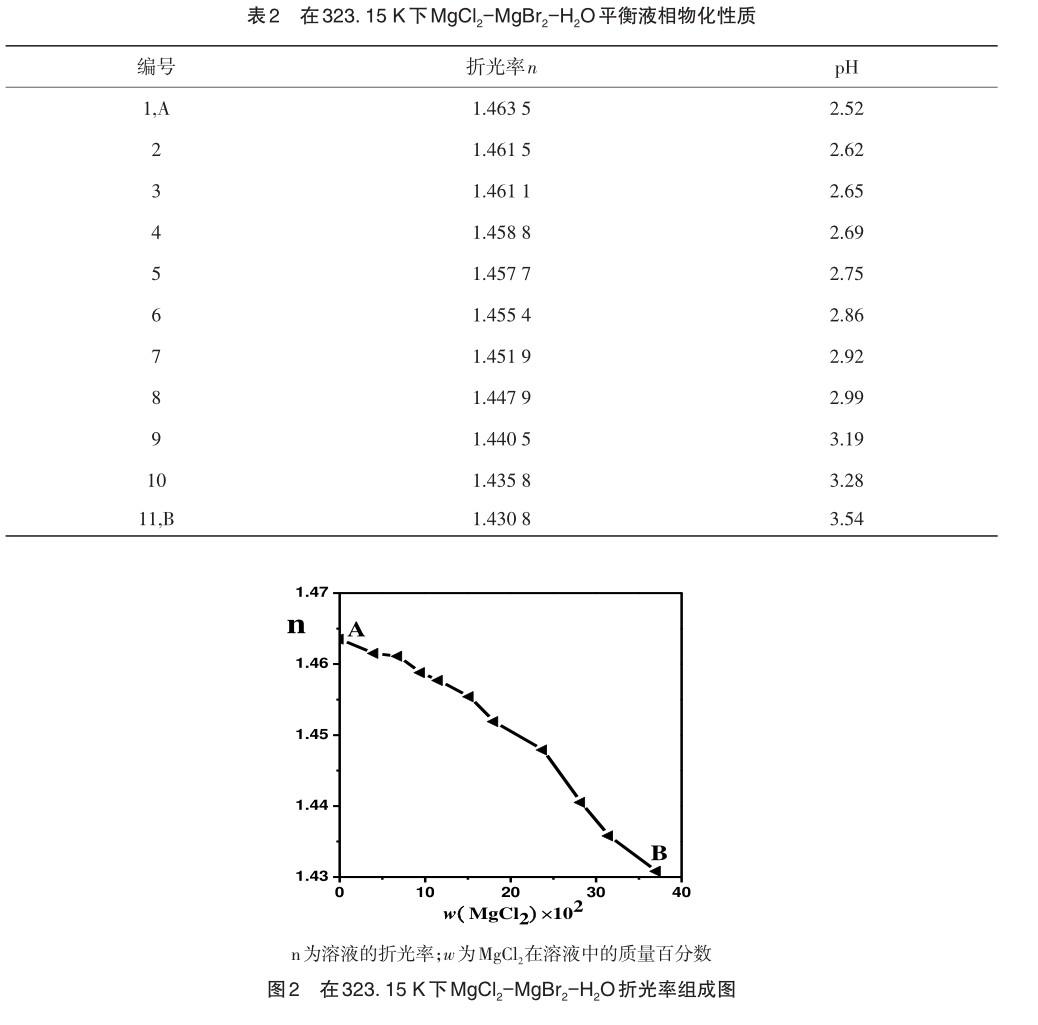
如表1所示的平衡溶解度测定,基于这些数据,绘制了相图,图1展示了相图的具体形态和特征。表1和图1中w(MgCl2)和w(MgBr2)为质量百分数。
图1和表1变化趋势可判断MgCl2、MgBr2和H2O互溶且溶解区域连续,呈互溶相图。在这个相图中,只观察到一个Mg(Cl,Br)2·6H2O固溶体的结晶区域,没有其他非平衡的相存在,固相从纯MgCl2逐渐过渡到纯MgBr2,无共饱和点,并连续过渡。
2.2 物化性质研究结果
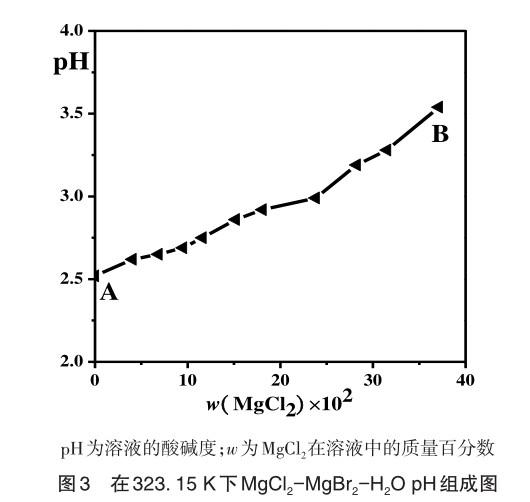
表2数据为物化性质测定。图2以氯化镁在溶液中的质量分数为自变量,在不同浓度下测量了溶液的物化性质,并用作纵坐标。根据表2、图2和图3的结果可以观察到,MgCl2-MgBr2-H2O三元体系中溶液的物化性质随着浓度的变化呈现出一定的规律,MgCl2的浓度和折光率变量呈负相关。这可以解释为MgBr2在相同浓度下具有更高的溶解度,并且具有较高的折光率。因此,当增加MgCl2的浓度时,MgBr2的含量相应减少,这导致了整体溶液的折光率降低。pH值和MgCl2浓度正相关,一同增长,这是因为同等条件下pH值对比而言MgCl2较高。因此MgCl2浓度逐渐升高,MgBr2浓度则反降,从而导致整体溶液的pH值升高。
2.3 折光率的计算
在本研究中,采用了经验公式,该公式由宋彭生等人[8]提出,用于计算溶液的折光率。

上式中,n和n0分别为溶液和水的折光率(同温),n0在323.15 K时的值为1.329 04。Ai为第i种盐的特征系数,Wi为第i种盐在溶液中的质量百分数。
通过三元体系溶解度计算得到MgBr2、MgCl2的Ai值分别为0.001 864和0.001 989,折光率理论值偏差在0~0.51%(见表3),理论值与实验值差异较小。
3 结论
(1)在本研究中,针对MgCl2-MgBr2-H2O三元体系进行了研究,并在特定温度范围内发现了一种含有结晶水的完全互溶固溶体Mg(Cl,Br)2·6H2O。通过实验和分析,确定该固溶体的固相点位于MgCl2·6H2O和MgBr2·6H2O这两个组成点之间的线上。
(2)在本研究中,在323.15 K下测定了MgCl2-MgBr2-H2O体系中各平衡液相点的折光率和pH值,并绘制出相应的物化性质图。研究体系的物化性质和 MgCl2浓度呈规律性的演变。这符合相图连续性原理,即在相图中相邻相之间的性质变化是平滑的、连续的。

(3)在本研究中,使用了一种经验公式来对MgCl2-MgBr2-H2O体系中稳定平衡液相的折光率进行理论计算。折光率计算值与实测值对比,差值小于0.52%。
参考文献
[1]纪春明.西部地区矿产资源型上市公司投资效率和影响因素研究:基于Richardson投资模型[J].上海商业,2021(4):65-67.
[2]谢登科.新疆硕尔湖硼矿矿体特征及找矿前景分析[J]. 新疆有色金属,2020,43(1):8-9.
[3]闫芳宁,郭锦春,黄雪莉,等.258.15 K下五元体系Li+, Na+,Mg2+∥SO42-,Cl--H2O相平衡研究[J].无机盐工业,2023,55(2):61-66.
[4]郭文婷.五元体系(Li+,Na+//Cl-,SO42-,BO2--H2O)相平衡与相图研究[D].天津:天津科技大学,2021.
[5]姚智豪,孟浩,于旭东,等.三元体系KCl+CaCl2+H2O在278.2 K及308.2 K下的稳定相平衡研究[J].矿产保护与利用,2021,41(6):112-116.
[6]中国科学院青海盐湖研究所分析室.卤水和盐的分析方法(第二版)[M].北京:科学出版社,1988.
[7]宋彭生.湿渣法在水盐体系相平衡研究中的应用[J].盐湖研究,1991,1(15):15-25.
[8]宋彭生,杜宪惠,许恒存.三元体系Li2B4O7-Li2SO4-H2O25℃相关系和溶液物化性质的研究[J].科学通报,1983(2):106-110.

