应激下人类情景记忆巩固的神经重放机制
刘威 陈瑞欣 郭金朋
摘 要 记忆巩固通常在记忆编码后的休息或睡眠期间缓慢发生。然而, 在应激状态下, 记忆有可能被快速巩固。鉴于长期以来缺乏对人类记忆巩固期神经活动的量化方法, 应激状态下记忆快速巩固的机制尚未明确。本研究拟采用计算神经科学手段, 详细刻画应激状态下人类情景记忆巩固期的神经重放过程。此外, 我们还将整合认知心理学、脑成像技术、机器学习、神经内分泌调控、应激诱发及生理生化检测等跨学科方法, 来验证应激对神经重放的“双刃剑”效应假说: 尽管应激可能会加快神经重放的速度, 促进记忆巩固, 但它同时也可能会降低神经重放的准确性并干扰其顺序。本研究将: (1)比较应激和非应激状态下神经重放的多维特征差异; (2)探寻应激状态下神经重放与记忆提取和编码的交互作用; (3)尝试利用神经内分泌和环境策略来调控人类的应激反应, 进而影响神经重放。本研究能够有助于确定促进记忆巩固的理想大脑状态, 并整合人类和动物的神经重放研究。同时, 本研究还可能为保护应激状态下的情景记忆功能, 以及干预应激类精神疾病中的记忆障碍提供全新策略。
关键词 记忆巩固, 记忆提取, 应激, 神经重放, 情景记忆
分类号 B845
1问题提出
现代社会中, 超负荷的应激和精神压力已悄然成为威胁我国人民生活质量和精神健康水平的重要因素。科学研究表明: 应激不仅可能短期内损害认知功能, 还可能转变为慢性压力, 从而成为一系列精神疾病(如抑郁症、焦虑症、创伤后应激障碍)的关键风险因素(de Kloet et al., 2005)。因此, 加强应激相关的科学研究, 深入探讨其潜在的负性影响及其机制, 并开发有效的调节手段,
是面向人民生命健康进行科学创新的重要研究课题。
精神压力(或广义的压力)包含急性压力(Acute Stress)和慢性压力(Chronic Stress)。未经干预的急性压力有一定概率转化为慢性压力。本研究中的应激指急性压力, 强调特定时间窗口内的生理?心理反应。如各种令人精神高度紧张、极具威胁性的突发事件。小到如突然受到伤害、意外受伤、重要考试及升学、就业面试, 大到亲身经历或目睹的严重事故或自然灾害, 如: “MH370”失联、“5?12”汶川大地震、“9?11”飞机失事。从实验/生理心理学角度考虑, 急性应激的生理指标明确, 且可以在实验室中, 符合人类实验伦理的程序下进行诱发操作, 适合脑成像研究。
应激如何作用于记忆是应激研究领域的一个核心问题(Schwabe et al., 2022)。早在科学尚不发达的中世纪, 民众就有了应激与记忆之间关系的感性认识。中世纪的一些部落居民有着这样一种习俗: 当成人希望部落中的幼儿记住一些具有历史意义的庆典时, 会在幼儿参与完庆典后把他们立即丢入水中。因为他们相信这样可以在幼儿脑中留下关于庆典终生难忘的记忆(McGaugh, 2003)。
上述民间习俗表明: 人们早已认识到应激对于促进记忆巩固, 形成持久记忆痕迹的潜在作用。迄今为止, 我们对于记忆巩固的机制理解主要来自于动物模型的分子神经科学研究(Ambrose et al., 2016; Carr et al., 2011; Karlsson & Frank, 2009)。尽管动物研究可以深入解析记忆巩固的神经环路, 但受限于动物可执行的记忆任务类型, 难以把其记忆巩固期神经活动和具体记忆表现关联起来。人类无创神经成像尝试解释记忆巩固期神经活动和随后记忆表现之间的关联, 但因长期缺乏对记忆巩固期神经活动进行精确量化的方法, 往往局限于利用脑活动强度、模式和功能连接粗略描述记忆巩固, 并未对记忆巩固期记忆重放的动态神经过程进行描述(Tambini et al., 2010;
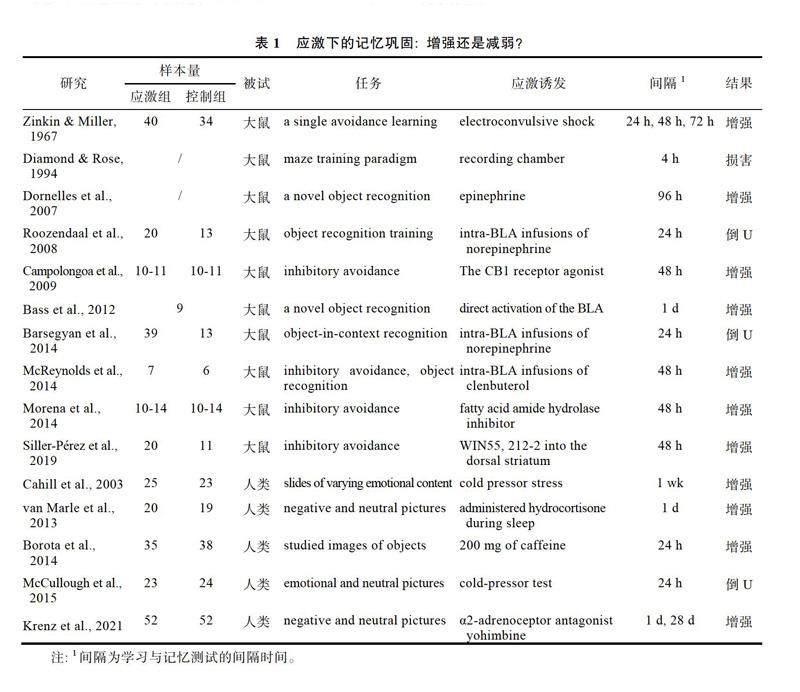
Tambini & Davachi, 2013, 2019)。然而, 近年来, 随着高时间分辨率的无创脑成像与机器学习及计算建模深度结合, 使得描述人类记忆巩固期的神经重放(Neural Replay)成为可能(Liu, Dolan et al., 2019; Liu, Dolan et al., 2021; Schuck & Niv, 2019a; Wittkuhn & Schuck, 2021)。以往研究聚焦于正常状态下的神经重放, 并重点考察其与决策等高级智能的关系(Kurth-Nelson et al., 2023; Liu, Mattar et al., 2021), 对于应激如何影响记忆巩固期的人类神经重放这一科学问题, 尚缺乏研究。我们通过文献检索, 总结了应激对记忆巩固影响的前期文献, 并制作为表1。通过表1可以看到, 在不考虑记忆准确性和顺序性的情况下, 前人研究大多发现应激对记忆巩固的促进作用。尚未有研究通过多种的记忆提取范式探测应激对记忆巩固的双刃剑效应。
本研究旨在整合认知心理学、脑成像技术、机器学习、计算建模、神经内分泌调控和应激的生理生化检测等跨学科方法, 利用计算神经科学手段揭示应激下记忆快速巩固的认知神经机制, 并考察应激下神经重放特征与记忆提取及编码的关系及其如何受到神经内分泌和环境调控。本研究为记忆巩固寻找理想的大脑状态(Seek for the optimal state for memory consolidation)以及整合人类和动物的应激和神经重放研究有理论意义; 同时实践上也能为保护应激下记忆功能, 理解和干预应激类精神疾病的记忆受损提供参考与指导。
2国内外研究现状和发展动态分析
2.1应激的生理心理效应及其对记忆功能的影响
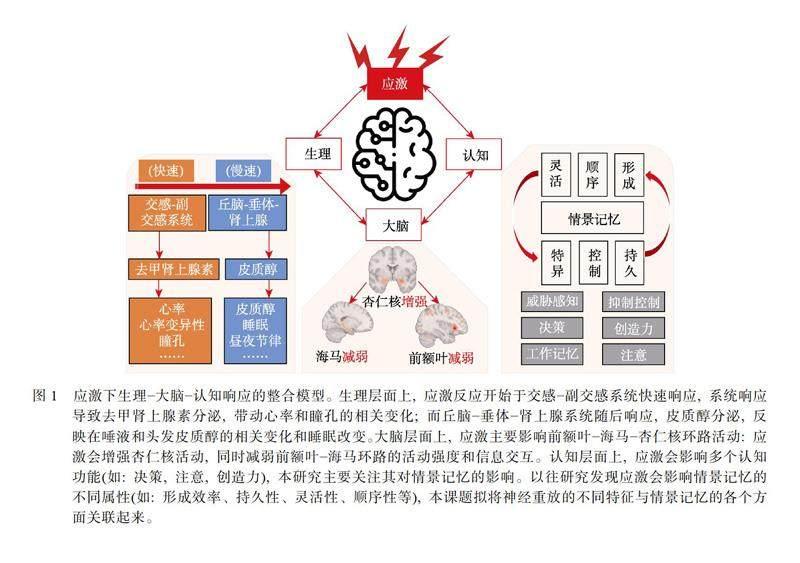
应激是一把双刃剑: 一方面, 它让我们快速察觉危险, 为未来挑战做好准备; 另一方面, 它也使得我们难以集中注意力, 在复杂环境中做出理性决策(de Kloet et al., 2005)。应激会触发复杂的神经内分泌?大脑?认知变化(图1)。虽然应激下的神经内分泌反应可以在动物模型上进行量化研究(Armario et al., 2008; Rao et al., 2012; Yuen et al.,
2009), 但由于伦理和技术限制, 人脑中神经内分泌的动态变化无法得到实时描述。相比之下, 人类应激研究主要集中于利用无创脑成像技术(如: 功能磁共振, 脑电图, 脑磁图等)探索应激下神经活动改变与认知功能的关联。比如, 国内学者对应激下工作记忆及威胁刺激注意(Luo et al., 2018)、创造力(Duan et al., 2019, 2020)、抑制控制等功能的改变进行了探索(Chang et al., 2020; Chang & Yu, 2019)。
本研究关注应激对人类记忆巩固(Memory Consolidation)的影响。以往研究发现, 应激对记忆不同阶段(即编码、巩固和提取)的影响各不相同。具体来说, 应激对记忆编码的影响因记忆材料的效价差异而有所不同: 应激会增强情绪信息的记忆编码, 同时减弱中性信息的记忆编码(Buchanan & Lovallo, 2001)。而应激与记忆提取之间的关系似乎更加直接(即应激损害记忆提取), 其底层机制也较为明确(Gagnon et al., 2019; Wolf, 2017)。应激和记忆巩固之间的关系虽有研究但无简单定论: 通常认为应激会增强记忆巩固, 但也有研究发现两者之间的倒U型曲线: 中等程度的图1 应激下生理?大脑?认知响应的整合模型。生理层面上, 应激反应开始于交感?副交感系统快速响应, 系统响应导致去甲肾上腺素分泌, 带动心率和瞳孔的相关变化; 而丘脑?垂体?肾上腺系统随后响应, 皮质醇分泌, 反映在唾液和头发皮质醇的相关变化和睡眠改变。大脑层面上, 应激主要影响前额叶?海马?杏仁核环路活动: 应激会增强杏仁核活动, 同时减弱前额叶?海马环路的活动强度和信息交互。认知层面上, 应激会影响多个认知功能(如: 决策, 注意, 创造力), 本研究主要关注其对情景记忆的影响。以往研究发现应激会影响情景记忆的不同属性(如: 形成效率、持久性、灵活性、顺序性等), 本课题拟将神经重放的不同特征与情景记忆的各个方面关联起来。
应激压力会增强记忆巩固, 而过强的应激压力则会损害记忆巩固(Cahill et al., 2003; McCullough et al., 2015)。
人类通过无创脑成像技术揭示了应激是如何通过调节海马?前额叶?杏仁核环路来对记忆编码和提取产生影响的。(A)应激状态下分泌的糖皮质激素主要作用于海马, 这是记忆至关重要的脑区之一。在一些啮齿类和人类研究中, 研究人员确实发现应激状态下的糖皮质激素水平上升和海马相关的记忆提取成绩受损有关(de Quervain et al., 1998; Lindauer et al., 2006; Newcomer et al., 1999; Roozendaal et al., 2006)。人类功能磁共振实验直接比较了应激和非应激条件下记忆相关的神经活动, 发现应激压力减弱了海马在记忆提取时的激活水平(Gagnon et al., 2019)。(B)此外, 应激下的记忆受损, 可能也与前额叶功能受损有关(Arnsten, 2009)。比如研究表明应激压力降低了工作记忆(Working Memory)时的背外侧前额叶神经活动强度(Qin et al., 2009)和神经振荡(G?rtner et al., 2014)。药物诱发的糖皮质激素分泌(即应激压力主要触发的生理生化反应)损害了前额叶在记忆提取任务中的活动强度(Oei et al., 2007)。(C)荷兰Donders脑研究中心的Guillén Fernández院士团队利用无创脑成像探索了应激下杏仁核活动的活动特征。总体来说, 应激会增强杏仁核对于情绪面孔的反应(van Marle et al., 2009), 但是增强的强度受到个体基因表型的调控(Cousijn et al., 2010)。情绪应激下杏仁核神经活动的增强, 是其影响记忆活动的基础(Cahill et al., 1995, 1996; Dolcos et al., 2004; LaBar & Cabeza, 2006)。人脑直接脑刺激(Direct Brain Stimulation)发现电刺激杏仁核可以提高人类情景记忆编码(Inman et al., 2018)。因此, 应激所致的杏仁核活动增强对记忆功能将有着深刻影响。值得注意的是, 以往的应激与记忆交互研究, 大多单独观察海马?杏仁核?前额叶在应激下的活动特点, 仅有少数几个研究从大尺度脑网络切入。Guillén Fernández 团队整合利用心理学实验范式、无创脑成像技术、神经内分泌操纵、生理生化检测、瞳孔测量等工具揭示了应激对人脑大尺度网络的影响, 成果发表于Science上(Hermans et al., 2011)。该研究发现应激改变脑网络之间的动态平衡和资源分配, 且具有“双刃剑”效应: 应激使得认知资源集中于以杏仁核为核心的凸显网络(Salience Network; 又称情绪应激网络), 从而对恐惧和警觉刺激敏感, 同时, 以前额叶为核心的执行控制网络(Executive Control Network)获取的资源会减少, 从而使得高认知负荷的任务(如: 记忆与决策)表现受损。基于此, 团队提出了人脑应对应激压力的大尺度网络动态适应模型(Hermans et al., 2014), 该模型对后续的人类应激脑成像研究产生了广泛影响。
尽管有这些进展, 但我们对于应激如何影响记忆巩固的理解仍然有限, 这可能是因为记忆编码和提取研究更符合认知神经科学的标准研究范式。这类研究通常通过把记录到的神经信号与记忆编码或提取的成功与失败事件对应, 来揭示成功记忆过程的神经基础(Ferna?ndez et al., 1999; Frankland et al., 2019; Liu, Shi et al., 2022)。然而, 记忆巩固的研究挑战在于需要对自发神经活动中所包含的认知信息进行精准量化(Fox & Raichle, 2007)。尽管我们可以记录到记忆巩固期神经活动, 但很难直接知道这些神经活动背后的底层认知过程, 以及这些过程的起始和终止时间点。因此, 为理解应激下记忆巩固, 我们需要首先寻找到可量化的神经指标, 来描述记忆巩固期的神经动态过程。
2.2神经重放作为记忆巩固的神经基础
科学家们一直在搜寻记忆巩固的神经基础, 并且已经建立起相当的理解框架(Squire et al., 2015)。记忆巩固既可以发生在清醒状态(Awake Consolidation), 也可以发生在睡眠状态(Sleep Consolidation) (Klinzing et al., 2019; Wamsley, 2022)。与记忆巩固相关的两个重要概念是记忆重激活(Memory Reactivation)和记忆重放(Memory Replay)。记忆重激活指的是当特定(单个)记忆被唤起时, 大脑中出现类似感知阶段的神经模式。而记忆重放强调(多个)记忆痕迹在大脑中按照一定顺序在大脑中被再次激活。神经重放(Neural Replay)被认为是记忆重放的底层神经机制, 本项目主要关注清醒状态下的神经重放过程。
作为记忆巩固的神经基础, 需满足以下三条特征: (1)在没有外界感知信息输入情况下, 记忆对应的神经表征反复出现; (2)发生在记忆编码后(Post-encoding), 并可持续一段时间; (3)与广泛的皮质区域的神经活动联动, 使得本来依赖海马的记忆表征转移到广泛皮层区域(Carr et al., 2011)。在啮齿类动物中发现的空间记忆在随后清醒或睡眠时的神经重放现象满足上述所有特征(Davidson et al., 2009; Foster & Wilson, 2006; Ji & Wilson, 2007)。由于技术所限, 人类神经重放研究依赖于间接手段, 如通过对比记忆巩固前后的记忆提取时的神经活动, 对记忆巩固期的神经基础进行推测(Takashima, Petersson et al., 2006; Takashima, Nieuwenhuis et al., 2009)。然而, 随着人类静息态功能磁共振技术的发展, 直接研究人类记忆巩固成为可能(Guerra-Carrillo et al., 2014)。Tambini和Davachi研究团队使用多体素模式分析(Pairwise multi voxel correlation analysis)和脑区间功能连接方法(Inter-region functional connectivity)方法对比了记忆编码时和记忆巩固期神经活动模式, 发现在记忆巩固期以海马为核心的局部和全局活动模式非常类似于记忆编码阶段, 而区别于任务开始前的纯粹休息期(Tambini et al., 2010; Tambini & Davachi, 2013, 2019)。但是, 考虑到记忆重放的时间特征和功能磁共振的时间分辨率, 一般认为功能磁共振观察到的记忆巩固过程, 更有可能是多个记忆信息重现的叠加结果。不过, 也有研究报道, 利用功能刺激磁共振神经解码, 也可探测出神经重放中的序列信息(Schuck & Niv, 2019b; Wittkuhn & Schuck, 2021)。总之, 基于人类功能磁共振的神经重放研究在记忆类型上延展了动物神经重放研究; 证实了不光是空间信息在记忆巩固期进行重放, 非空间的抽象记忆信息也可以在人类巩固期进行重放。柳昀哲等人基于脑磁图数据, 利用机器学习和计算建模, 对静息状态下的神经活动中包含神经重放过程进行了精准量化。借助于脑磁图毫秒级的时间分辨率和新方法在回归因素控制和基于置换检验的统计思路进步, 神经科学家们可以量化出不同记忆信息在记忆巩固期出现的时间点和具体顺序, 从而在数学上实现了人类神经重放的多维度精准刻画(Liu, Dolan et al., 2021; Liu et al., 2019; Liu, Mattar et al., 2021; Nour et al., 2021)。
确定神经重放作为记忆巩固的神经基础的关键步骤是将记忆巩固期的神经活动与随后记忆提取的成绩进行关联。动物研究发现清醒神经重放的强度可以预测随后的记忆表现(Dupret et al., 2010), 人类静息态功能连接研究也发现记忆巩固期的海马功能连接模式可预测关联记忆(Associative Memory)的个体差异(Tambini et al., 2010; Tambini & Davachi, 2013)。关联记忆范式并未神经重放行为管理的理想测量范式, 因为这一范式仅仅反映神经重放的局部特征。例如, 神经重放强调多个序列信息的前后顺序, 而尚未有人类记忆巩固研究在随后的记忆提取阶段加入对记忆顺序属性的任务测量。因此, 尽管人类神经重放已有了新的量化手段, 我们对神经重放的不同特征与情景记忆的不同特性间(如: 持久性, 特异性, 顺序性)的关系仍知之其少。为此, 我们需要在记忆巩固后, 有针对性地设计不同记忆任务范式, 对记忆表现的不同侧面进行测量。
2.3寻找记忆巩固的理想大脑状态
上述研究已证实利用无创脑成像手段可以捕捉人脑中神经重放, 那么我们可以通过观察神经重放的变化来寻找记忆巩固的理想大脑状态(Seek for the optimal brain state for memory consolidation)。以往研究主要关注记忆材料的特征如何影响记忆巩固期的重激活: 如奖赏(Murayama & Kitagami, 2014; Murayama & Kuhbandner, 2011), 情绪效价(Sharot & Phelps, 2004), 与未来行为的关系(Wilhelm et al., 2011), 与过去知识的关联(Tse et al., 2007; van Kesteren et al., 2010)。尚未有研究探索: 已经过巩固的记忆, 会在记忆巩固期表现出何种特征?传统的系统巩固学说(System Consolidation)认为: 记忆形成后, 随着时间推移, 会发生缓慢而自然的记忆巩固过程, 记忆表征涉及的位置会从海马转移到广泛的皮层区域(Frankland & Bontempi, 2005)。而最近研究发现: 通过提取练习增强编码效率, 可以起到“快速”记忆巩固的作用(Fast Consolidation Hypothesis, 快速巩固假说) (Antony et al., 2017)。研究者们使用多变量模式分析技术(Cohen et al., 2017), 已初步证实提取练习的记忆增强效应与记忆快速巩固有关(Ferreira et al., 2019; Liu, Kohn et al., 2019; Ye et al., 2020; Zhuang et al., 2021)。从神经机制来看: 提取练习增强了后顶叶皮层(Posterior Parietal Cortex, PPC)和视觉皮层的表征独特性(Representational Distinctiveness)。
除记忆本身的特征外, 大脑的整体状态(Global state)也会影响记忆巩固时的神经重放。动物模型和人类记忆解码的研究均发现神经重放在精神分裂症中的异常(Nour et al., 2021; Suh et al., 2013)。考虑到幻觉及妄想是精神分裂症的核心症状(McCutcheon et al., 2020), 我们可以推测异常的神经重放可能是幻觉妄想产生的神经机制。除了大脑疾病状态之外, 因为大脑状态的延续性, 记忆巩固之前的大脑状态会对巩固过程中的神经活动产生系统性影响。在记忆编码和提取领域已有大脑状态延续性的证据: Tambini等人发现先前进行的情绪记忆编码触发的大脑状态会持续到随后的中性记忆编码, 并伴有情绪刺激对应的大脑活动和功能连接模式持续, 并对中性记忆编码进行增强(Tambini et al., 2017)。
在记忆提取后进行记忆控制的难度更大, 其神经机制在于适用于记忆提取的脑网络需要快速重构, 来适应后来的记忆控制任务要求。如果快速重构失败, 记忆提取的大脑状态持续到记忆控制, 则记忆控制面临失败的风险(Liu, Kohn et al., 2021)。类似的, 我们推测当在记忆巩固前诱发被试的应激会影响随后的记忆巩固过程。
在动物模型中科学家发现利用电击或药物诱发其应激反应, 可以起到增强记忆巩固的效果(Zinkin & Miller, 1967)。自此以后, 一系列研究揭示了应激荷尔蒙增强记忆巩固的神经内分泌机制(McGaugh, 2018), 即应激后去甲肾上腺素的快速反应和糖皮质激素的慢速反应的交互作用(Roozendaal et al., 2006)。但是, 上述神经内分泌变化并不能直接影响认知功能, 而是通过影响对应的脑区的神经活动对认知表现产生间接影响。目前尚无人类研究利用无创脑成像技术揭示应激下记忆巩固的动态变化过程。根据上文所述的应激对大尺度网络的“双刃剑效应(Hermans et al., 2014), 我们推测应激对记忆巩固期的神经重放也有“双刃剑效应”, 即应激对记忆巩固并非单纯的增强作用, 而是对神经重放的不同特征同时具有增强和减弱作用(应激虽然会加快神经重放的速度, 但会降低重放过程中记忆表征的准确性且扰乱神经重放的顺序)。
2.4神经重放的调控手段及其神经机制
神经重放在动物模型中, 可以通过光遗传学(Optogenetics)进行精准调控(Deisseroth, 2011): 通过建立实时的神经重放监测体系, 科学家们可以延长或缩短啮齿动物记忆巩固期的神经重放的时间, 并影响随后的记忆提取成绩(Ego-Stengel & Wilson, 2009; Fernández-Ruiz et al., 2019)。人类研究中, 一个可能的手段是靶向记忆重激活(Targeted Memory Reactivation, TMR), 通过在记忆巩固期(通常是睡眠中)给予被试与记忆编码信息配对的感知觉刺激(如声音或味道), 可以重激活编码的记忆, 并观察到对应的认知和大脑变化(Hu et al., 2020; Rasch et al., 2007)。然而, 对于TMR是否有效调控了神经重放仍有争议: 第一, 有观点认为, 在记忆巩固期给予特定的感知觉刺激, 实际上是触发了记忆提取过程, 从而破坏了记忆巩固的自发性。第二, TMR通常只能重激活单个信息, 而神经重放更强调多个记忆信息的动态重现。TMR能否诱发一系列记忆的重放仍有待研究。另一个记忆巩固可能的调控手段是无创脑刺激(Non- invasive Brain Stimulation)。Tambini等人利用无创脑刺激调控了记忆巩固过程: 在巩固期刺激视觉皮层可以阻碍记忆重激活和海马?皮层交互, 并在提取任务中观察到记忆行为表现下滑(Tambini & DEsposito, 2020)。然而, 人类无创脑刺激仅能刺激一个皮层脑区, 且难以触及大脑深处的海马结构。因此应被视为对神经重放产生间接影响。综上所述, 现有的人类神经重放调控手段, 仅仅能在单个刺激或单个脑区层面影响记忆巩固, 与理想中的记忆巩固调控手段仍有距离。既然神经重放难以在人类上进行精准调控, 或许可以通过调控应激反应, 而间接调控应激下神经重放。以往研究尝试从神经内分泌和脑科学两条通路出发调控人类应激下的记忆功能。从神经内分泌机制入手, 健康被试在服用普萘洛尔(Propranolol, 非选择性β受体阻断剂, 又称心得安)后, 应激对记忆提取的损害效应减弱消失(de Quervain et al., 2007; Schwabe et al., 2009), 而情绪唤起对记忆编码的促进作用消失(Cahill et al., 1994)。从脑科学机制入手, 研究者们通过脑刺激特定脑区(比如背外侧前额叶)来调控应激下的工作记忆, 取得良好效果(Bogdanov & Schwabe, 2016)。环境神经科学(Environmental Neuroscience)是应激调控的新兴手段。环境神经科学发现人类应激很大程度上受到生活环境的影响, 并开始揭示其神经机制(Berman et al., 2019; Liu et al., 2023; Tost et al., 2015)。其中一个重要的影响因素是城市化: 天津医科大学余春水团队发现, 地区城市化水平对于青年人群的大脑结构和认知功能有显著影响(Xu et al., 2021)。应激的神经成像研究也发现, 生活在城市的人群, 在面对社会压力时会表现出更强的杏仁核活动(Lederbogen et al., 2011)。城市化可以通过多种因素影响人类应激与大脑, 其中一个较为明确的机制是城市化导致的绿色环境减少, 而绿色环境恰恰可以作为应激的保护因素(Berto, 2014)。COVID-19流行期的大数据分析发现: 疫情期间的人体如果能更多的接触绿色环境, 则能更好地维持心理健康(Lee et al., 2023)。德国马普所的Kühn 团队通过干预研究发现: 一小时的自然绿色环境接触, 相比于城市环境接触, 可以有效地增强人类应激抗性, 使得其面对应激时, 杏仁核的活动降低(Sudimac et al., 2022)。利用绿色环境对抗应激的研究虽还在起步阶段, 但有其独特优势: 相比于神经内分泌或脑刺激研究, 绿色环境接触不但成本低, 适用场景广, 而且可以安全应用于儿童青少年及老年人群。理论推测认为: 绿色环境的抗压作用, 应区别于药物或脑刺激, 但未有实验验证。本研究拟将自然环境策略作为新兴策略通过降低应激反应来调控应激下神经重放。自然环境接触不但可以作为外界调控应激反应的实验操纵手段之一, 而且可以进一步对比环境和神经内分泌调控的效率和机制异同。
3研究构想
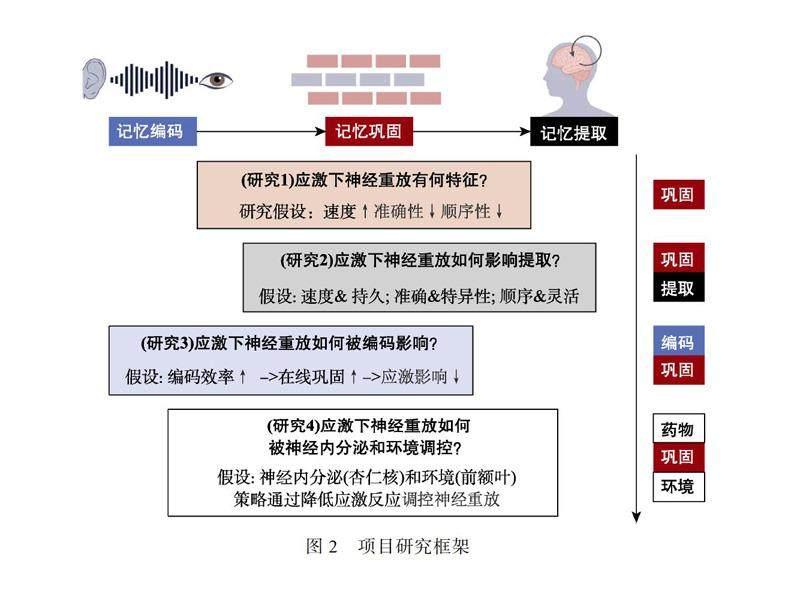
本研究拟通过4个研究揭示应激下快速记忆巩固的神经重放机制(图2), 研究1单独考察应激状态如何影响记忆巩固期的神经重放现象。研究2同时关注巩固和提取期, 探索应激所致的神经
重放异常如何影响随后的记忆提取。研究3同时关注编码和巩固期, 研究记忆编码期效率如何影响应激下巩固期的神经重放。基于研究1至3所揭示的神经机制, 研究4将引入外部调控策略(神经内分泌和环境)通过降低个体应激反应来调控应激下的神经重放。
3.1研究1:应激下神经重放有何特征改变?
实验1拟探讨应激如何影响记忆巩固期的神经重放特征。采用单因素(应激/非应激)被试内实验设计, 将招募健康大学生进行应激和非应激状态下的脑电实验。本实验主要包括记忆编码?测试、应激诱发和捕捉神经重放三大阶段。具体来说被试在记忆编码阶段会学习图片序列, 学习完成后马上进行记忆测试以了解被试的学习效果。应激诱发阶段使用特里尔社会应激测试(Trier Social Stress Test, TSST)和数学运算任务(Math Calculation)诱发被试的应激压力。整个实验过程中采集5次唾液(实验开始前, 基线记忆测试后, 应激诱发后, 脑电采集中段, 脑电采集末段), 进行皮质醇定量分析以确定应激诱发的有效性及状态维持时间。应激诱发后立即通过脑电技术记录被试记忆巩固期的神经活动(持续5分钟)。已有计算神经手段可量化记忆巩固期的神经重放活动(Liu, Dolan et al., 2019; Liu, Dolan et al., 2021), 在此基础上, 本研究将分别量化神经重放的速度结合神经解码和计算模型刻画人类记忆巩固期的神经重放。(A)记忆编码后, 多个记忆信息会进入巩固阶段。此时, 海马和广泛的皮层区域会发生信息交互, 记忆信息会在大脑中以一定顺序(顺序或倒序)重新出现, 这种现象称之为神经重放(Neural Replay)。神经重放被认为是记忆巩固(Memory Consolidation)的关键神经过程。(B)为了在实验数据中捕捉到人类神经重放, 我们首先需要建立神经模式与外界刺激(通常是视觉, 如地点, 物品, 人脸)的关联, 即训练出机器学习算法可以解码记忆内容。然后, 通过把机器学习算法应用到记忆巩固期的自发神经活动, 可以获得在特点时间点, 各类外界刺激在大脑中表征的概率信息。最后, 通过进一步建立不同记忆出现时间点的顺序模型(Liu, Dolan et al., 2021; Liu, Nour et al., 2022), 从而对神经重放进行量化。
(Speed)、准确性(Precision)和顺序性(Order), 并比较其在应激和非应激条件下的差异。将本实验关键假设为: 应激虽然会加快神经重放的速度, 但会降低重放过程中记忆表征的准确性且扰乱神经重放的顺序。这意味着, 尽管应激能够促进大脑快速重放信息, 但这种快速可能以牺牲记忆质量为代价, 导致记忆表征的精确性和组织性下降。
3.2研究2:应激下神经重放如何影响记忆提取?
实验2考察应激下神经重放特征改变与不同记忆提取任务的表现有何关系, 采用2 (应激条件: 应激/非应激) × 3 (记忆提取任务: 再认/选择提取/记忆推理)的被试内实验设计。在实验1的基础上, 实验2增加记忆提取阶段。通过三种记忆提取范式(即再认, 选择, 记忆推理)以分别量化情景记忆的形成/持久、特异性和灵活性。三类范式的具体测试顺序在不同被试间进行平衡, 以保证三种范式均有相等的概率出现在记忆提取阶段之初。在再认任务(测量记忆形成/持久性), 被试对所见图片进行新旧判断, 其中半数图片并未在记忆编码阶段出现。在选择提取任务(测量记忆特异性), 被试被要求在三张类似图片中选择刚学习过的图片, 选项中另2张为类似的诱饵图片。在记忆推理任务(测量记忆灵活/顺序性), 被试需要根据编码的图片顺序, 灵活的对信息进行顺序检索。本实验的研究假设为: (1)神经重放速度的加快有利于记忆形成和持久性(以单个图片新/旧再认测试成绩为记忆指标); (2)神经重放的准确性降低会减弱记忆的特异性(以多个相似图片的选择成绩为记忆指标); (3)神经重放顺序性的扰乱会削弱记忆的灵活性(以基于序列的记忆提取成绩为记忆指标)。
3.3研究3:应激下神经重放如何被记忆编码影响?
实验3考察应激诱发前增强记忆编码效率如何影响应激下神经重放, 采用2 (编码调控策略: 测试练习/重复学习) × 2 (应激条件: 应激/非应激)的混合实验设计。其中, 编码调控策略为被试间变量。实验3在实验2的基础上, 加入了对应激前记忆编码效率的操纵。实验3将探讨在记忆编码后应激诱发前, 通过提取练习提高编码效率对应激下神经重放的影响。记忆编码后, 被试将被随机分到提取练习和重复学习组。在随后的记忆巩固期, 利用脑电技术记录的神经信号量化神经重放特征(同实验1和2); 最后的记忆提取阶段, 利用功能磁共振技术记录记忆提取时前额叶?海马?杏仁核活动及其大尺度网络交互情况。实验3的关键假设是: 提取练习可以促进记忆在线巩固, 从而在应激诱发前完成巩固。经过巩固的记忆, 在记忆巩固期受到应激的影响较小, 在记忆提取时表现将类似于非应激条件。
3.4研究4:应激下神经重放如何被神经内分泌和环境策略调控?
研究4拟考察应激下神经重放是否及如何被外界(即神经内分泌和环境)策略调控。一方面为应激下神经重放特征改变提供因果证据, 另一方面为潜在的应激下记忆功能保护措施开发奠定基础。包括两个子实验。
3.4.1应激诱发前使用肾上腺受体阻断剂如何影响应激下神经重放
实验4采用2 (神经内分泌调控: 普蒙洛尔/安慰剂) × 2 (应激条件: 应激/非应激)的混合实验设计, 其中, 神经内分泌调控为被试间变量, 应激条件为被试内变量, 拟探讨在记忆编码后, 应激诱发前1小时, 口服β肾上腺受体阻断剂(普蒙洛尔, Propranolol, 又称心得安)对应激下神经重放的影响。与实验3类似, 记忆编码结束后, 被试将被随机分到药物干预组和安慰剂组。本实验的假设是: 神经内分泌干预可以降低被试应激状态下的皮质醇水平, 从而保护应激下的神经重放和优化随后的记忆提取成绩。从脑网络机制来看, 神经内分泌策略主要通过抑制杏仁核活动来恢复前额叶一海马记忆环路的正常功能(图4B)。
3.4.2应激诱发前进行自然环境行走如何影响应激下神经重放?
实验5采用2 (环境策略: 自然环境行走/城市环境行走) × 2 (应激条件: 应激/非应激)的混合实验设计, 其中, 环境策略为被试间变量, 应激条件为被试内变量, 探讨在记忆编码后记忆巩固前, 进行自然环境行走对应激下神经重放的影响。本实验受试者招募, 实验流程, 应激诱发与监测, 实验任务等与实验4完全相同, 唯一不同是用自然环境行走(环境策略)代替神经内分泌策略。本实验的核心假设是: 应激前进行自然环境行走可以增强个体的应激抗性, 从而降低被试应激状态下的生理反应, 达到保护应激下的神经重放和优化记忆提取的目的。从脑网络机制来看, 我们假设环境策略主要通过增强前额叶对杏仁核自上而下的调控来恢复前额叶?海马记忆环路的正常功能(图4C)。
图4 应激下脑网络交互模式及其调控机制。(A)应激下的记忆功能主要涉及三大网络: 以海马为核心的记忆网络, 以杏仁核为核心的情绪网络, 和以前额叶为核心的控制网络。(B)神经内分泌策略调控应激响应的可能神经机制在于: 降低杏仁核的神经活动, 以恢复前额叶?海马环路正常的信息交互。(C)环境策略调控应激响应的可能神经机制的可能机制在于: 增强前额叶活动和前额叶对杏仁核的控制, 以恢复前额叶?海马环路的正常活动。
4理论建构
过往的动物实验及部分人类研究提示: 应激可能会加强记忆巩固。本研究提出一种“双刃剑”效应的理论模型(图5), 认为应激对人类记忆巩固同时具有增强和减弱效应, 并设计相应的实证研究进行验证。具体而言, 应激并非只是简单地增强(或削弱)记忆巩固, 而是能够加快记忆重放的速度, 但这一过程可能会伴随记忆内容的扭曲, 包括记忆准确性和顺序性的下降。为了实验验证这一理论, 研究设计包含以下几个要点: (1)神经重放指标的探索。研究将通过脑电技术等神经成像手段来监测和量化应激状态下参与者的神经重放特征, 包括重放的速度、准确性和顺序性。(2)记忆提取范式的丰富。实验范式允许从多个维度(持久性、特异性和灵活性)评估记忆的质量。持久性测试: 评估参与者能否长期保持记忆; 特异性测试: 评估参与者能否准确回忆特定的记忆细节, 而非泛化的或错误的信息; 灵活性测试: 评估参与者能否灵活运用记忆信息进行问题解决或适应新的情境。(3)脑与行为关联分析。通过对记忆提取测试的结果分析, 研究将确定应激状态下神经重放特征变化的具体行为后果。如果神经重放的速度确实增快, 记忆提取的持久性应该得到增强。同时, 如果神经重放的准确性和顺序性降低, 那么特异性和灵活性在记忆提取时也应该相应减弱。
本研究的理论构建具有以下创新之处:
(1)深化对于人类清醒状态下记忆巩固的理解。
本研究将立足于睡眠记忆巩固的系列研究基础(Klinzing et al., 2019; Rasch et al., 2007), 重点关注人类清醒状态下的记忆巩固过程, 以及该过程如何受到应激的影响。过往的研究多集中于睡眠状态下的记忆巩固机制。睡眠被广泛认为是记忆巩固的关键时期, 期间发生的神经重放活动对记忆的长期存储至关重要(Wilhelm et al., 2011), 但为了探索应激对记忆巩固的影响, 在应激状态下入睡显然不可行, 而清醒记忆巩固是更合适的研究窗口。这一视角拓宽了对记忆巩固理论的理解, 同时考虑到在现实生活中, 人们经常在清醒状态下遭遇应激情境, 因此这一研究对于了解记忆机制具有高度的现实意义。
(2)提出人类记忆巩固的多维量化手段, 并整合动物与人类的记忆重放研究。
记忆编码后的神经重放可能是记忆巩固的神经基础, 但在人类身上进行神经重放研究却困难重重。早期的人类记忆巩固研究利用静息态功能磁共振对比记忆巩固时和记忆编码时的神经活动相似性来描述记忆巩固过程(Tambini et al., 2010)。近年来, Liu等人利用机器学习和计算建模, 对静息状态下的神经活动进行了精准量化, 刻画了神经重放出现的时间点和具体顺序(Liu, Dolan et al., 应激对人类记忆巩固的“双刃剑”效应假说。通过采集记忆巩固时的高时间分辨率的脑电图或脑磁图信号, 项目将利用计算神经科学工具分别量化神经重放的速度, 准确性和顺序性。理论假设为: 应激并非只是简单地增强(或削弱)记忆巩固, 而是加速神经重放的速度, 但同时会扰乱其准确性和顺序性。为了探究应激状态下神经重放指标变化的行为后果, 项目将在记忆提取阶段, 采用不同范式对记忆的持久性、特异性和灵活性三方面进行测试。
2019; Liu, Dolan et al., 2021; Liu, Nour et al., 2022; Nour et al., 2021)。这一系列发现与啮齿类动物在空间记忆重放中的发现相类似(Carr et al., 2011; Davidson et al., 2009; Ji & Wilson, 2007; Karlsson & Frank, 2009)。然而, Liu等人的研究主要关注神经重放是否存在, 而本研究则为了验证应激对记忆巩固的“双刃剑”假说, 提出了神经重放信号的多维量化方法, 即同时量化神经重放的速度、准确度和顺序性。神经重放的多维量化方法之所以能够整合动物与人类的神经重放研究是因为: 一方面, 本文提出的神经重放多维量化方法可以从人类情景记忆研究迁移到量化动物空间记忆的神经重放。具体来说动物电生理数据的神经重放速度(Speed)可以用压缩率(Compression Rate)量化, 神经重放准确率可以根据特定位置细胞(Place Cell)神经发放时, 无关位置细胞的发放来量化, 神经重放的顺序性可以根据神经重放时位置细胞的发放顺序与空间记忆编码时位置细胞的发放顺序相似性量化; 另一方面, 技术进步使得可以让头部固定的大鼠(head-fixed mice)观看不同类型的视觉刺激来模拟人类情景记忆, 这使得在动物模型中研究基于视觉的情景记忆变得更加容易(Nguyen et al., 2023)。比如Nguyen在动物模型上观察到在记忆巩固期出现的, 对应特定视觉刺激的神经模式重激活(stimulus-specific reactivations)。
(3)探索新型应激调控手段及其对人类应激下记忆巩固的影响。
记忆巩固过程可以通过光遗传(Ego-Stengel & Wilson, 2009; Fernández-Ruiz et al., 2019)、标靶记忆重激活(Hu et al., 2020)、无创脑刺激(Tambini & DEsposito, 2020)等方式进行调控, 本研究专注于应激这一特殊的生理心理状态如何影响记忆巩固。此外, 本研究也将采用神经内分泌和环境手段, 通过影响应激反应来间接调控记忆巩固, 从而应对日益加剧的应激和精神压力, 它们已成为威胁国人生活质量和精神健康的主要因素。本项工作推动了新型应激调控策略的开发和实践应用, 促进了基础脑科学研究成果向心理健康领域的转化。
通常, 记忆巩固被认为是一个漫长的过程, 需时数小时乃至数日。然而, 研究表明在特定条件下, 例如应激状态, 记忆可以在几分钟到几小时内迅速巩固。本项目聚焦于应激条件下记忆快速巩固的神经机制研究, 并结合计算神经科学、认知心理学、脑成像、机器学习、神经内分泌调节、应激诱导以及生理生化检测等多学科方法, 考察应激如何产生对神经重放有益与有害并存的“双刃剑”效应。这项研究可望为保护个体在应激环境中的记忆功能提供新见解和策略, 并为应激相关精神疾病的患者的记忆康复带来新的理念。同时, 它也将有助于我们更全面地理解大脑中的神经重放现象, 并探索促进人类记忆功能的理想脑状态。
参考文献
Ambrose, R. E., Pfeiffer, B. E., & Foster, D. J. (2016). Reverse replay of hippocampal place cells is uniquely modulated by changing reward.Neuron, 91(5), 1124?1136. https://doi.org/10.1016/j.neuron.2016.07.047
Antony, J. W., Ferreira, C. S., Norman, K. A., & Wimber, M. (2017). Retrieval as a fast route to memory consolidation.Trends in Cognitive Sciences, 21(8), 573?576. https:// doi.org/10.1016/j.tics.2017.05.001
Armario, A., Escorihuela, R. M., & Nadal, R. (2008). Long-term neuroendocrine and behavioural effects of a single exposure to stress in adult animals.Neuroscience & Biobehavioral Reviews, 32(6), 1121?1135. https://doi.org/ 10.1016/j.neubiorev.2008.04.003
Arnsten, A. F. T. (2009). Stress signalling pathways that impair prefrontal cortex structure and function.Nature Reviews Neuroscience, 10(6), 410?422. https://doi.org/10. 1038/nrn2648
Barsegyan, A., McGaugh, J. L., & Roozendaal, B. (2014). Noradrenergic activation of the basolateral amygdala modulates the consolidation of object-in-context recognition memory.Frontiers in Behavioral Neuroscience, 8, 160. https://doi.org/10.3389/fnbeh.2014.00160
Bass, D. I., Partain, K. N., & Manns, J. R. (2012). Event- specific enhancement of memory via brief electrical stimulation to the basolateral complex of the amygdala in rats.Behavioral Neuroscience, 126(1), 204?208. https:// doi.org/10.1037/a0026462
Berman, M. G., Kardan, O., Kotabe, H. P., Nusbaum, H. C., & London, S. E. (2019). The promise of environmental neuroscience.Nature Human Behaviour, 3(5), 414?417. https://doi.org/10.1038/s41562-019-0577-7
Berto, R. (2014). The role of nature in coping with psycho- physiological stress: A literature review on restorativeness. InBehavioral Sciences(Vol. 4, Issue 4, pp. 394?409). MDPI Multidisciplinary Digital Publishing Institute. https://doi.org/10.3390/bs4040394
Bogdanov, M., & Schwabe, L. (2016). Transcranial stimulation of the dorsolateral prefrontal cortex prevents stress- induced working memory deficits.The Journal of Neuroscience, 36(4), 1429?1437. https://doi.org/10.1523/ JNEUROSCI.3687-15.2016
Borota, D., Murray, E., Keceli, G., Chang, A., Watabe, J. M., Ly, M., Toscano, J. P., & Yassa, M. A. (2014). Post-study caffeine administration enhances memory consolidation in humans.Nature Neuroscience, 17(2), 201?203. https://doi. org/10.1038/nn.3623
Buchanan, T. W., & Lovallo, W. R. (2001). Enhanced memory for emotional material following stress-level cortisol treatment in humans.Psychoneuroendocrinology, 26(3), 307?317. https://doi.org/10.1016/S0306-4530(00)00058-5
Cahill, L., Babinsky, R., Markowitsch, H. J., & McGaugh, J. L. (1995). The amygdala and emotional memory.Nature,377(6547), 295?296. https://doi.org/10.1038/377295a0
Cahill, L., Gorski, L., & Le, K. (2003). Enhanced human memory consolidation with post-learning stress: Interaction with the degree of arousal at encoding.Learning & Memory, 10(4), 270?274. https://doi.org/10.1101/lm.62403
Cahill, L., Haier, R. J., Fallon, J., Alkire, M. T., Tang, C., Keator, D., … McGaugh, J. L. (1996). Amygdala activity at encoding correlated with long-term, free recall of emotional information.Proceedings of the National Academy of Sciences, 93(15), 8016?8021. https://doi.org/ 10.1073/pnas.93.15.8016
Cahill, L., Prins, B., Weber, M., & McGaugh, J. L. (1994). β-adrenergic activation and memory for emotional events.Nature, 371(6499), 702?704. https://doi.org/10.1038/371702a0
Campolongo, P., Roozendaal, B., Trezza, V., Hauer, D., Schelling, G., McGaugh, J. L., & Cuomo, V. (2009). Endocannabinoids in the rat basolateral amygdala enhance memory consolidation and enable glucocorticoid modulation of memory.Proceedings of the National Academy of Sciences of the United States of America, 106(12), 4888?4893. https://doi.org/10.1073/pnas.0900835106
Carr, M. F., Jadhav, S. P., & Frank, L. M. (2011). Hippocampal replay in the awake state: A potential substrate for memory consolidation and retrieval.Nature Neuroscience, 14(2), 147?153. https://doi.org/10.1038/nn.2732
Chang, J., Hu, J., Li, C.-S. R., & Yu, R. (2020). Neural correlates of enhanced response inhibition in the aftermath of stress.NeuroImage, 204, 116212. https://doi.org/10. 1016/j.neuroimage.2019.116212
Chang, J., & Yu, R. (2019). Hippocampal connectivity in the aftermath of acute social stress.Neurobiology of Stress, 11, 100195. https://doi.org/10.1016/j.ynstr.2019.100195
Cohen, J. D., Daw, N., Engelhardt, B., Hasson, U., Li, K., Niv, Y., … Willke, T. L. (2017). Computational approaches to fMRI analysis.Nature Neuroscience, 20(3), 304?313. https://doi.org/10.1038/nn.4499
Cousijn, H., Rijpkema, M., Qin, S., van Marle, H. J. F., Franke, B., Hermans, E. J., … Fernández, G. (2010). Acute stress modulates genotype effects on amygdala processing in humans.Proceedings of the National Academy of Sciences, 107(21), 9867?9872. https://doi.org/10.1073/ pnas.1003514107
Davidson, T. J., Kloosterman, F., & Wilson, M. A. (2009). Hippocampal replay of extended experience.Neuron,63(4), 497?507. https://doi.org/10.1016/j.neuron.2009.07. 027
de Kloet, E. R., Jo?ls, M., & Holsboer, F. (2005). Stress and the brain: From adaptation to disease.Nature Reviews Neuroscience, 6(6), 463?475. https://doi.org/10.1038/nrn1683
de Quervain, D. J.-F., Aerni, A., & Roozendaal, B. (2007). Preventive effect of β-Adrenoceptor blockade on glucocorticoid- induced memory retrieval deficits.American Journal of Psychiatry, 164(6), 967?969. https://doi.org/10.1176/ajp. 2007.164.6.967
de Quervain, D. J.-F., Roozendaal, B., & McGaugh, J. L. (1998). Stress and glucocorticoids impair retrieval of long-term spatial memory.Nature, 394(6695), 787?790. https://doi.org/10.1038/29542
Deisseroth, K. (2011). Optogenetics.Nature Methods, 8(1), 26?29. https://doi.org/10.1038/nmeth.f.324
Diamond, D. M., & Rose, G. M. (1994). Stress impairs LTP and hippocampal-dependent memory.Annals of the New York Academy of Sciences, 746, 411?414. https://doi.org/ 10.1111/j.1749-6632.1994.tb39271.x
Dolcos, F., LaBar, K. S., & Cabeza, R. (2004). Interaction between the amygdala and the medial temporal lobe memory system predicts better memory for emotional events.Neuron, 42(5), 855?863. https://doi.org/10.1016/ S0896-6273(04)00289-2
Dornelles, A., de Lima, M. N. M., Grazziotin, M., Presti- Torres, J., Garcia, V. A., Scalco, F. S., Roesler, R., & Schr?der, N. (2007). Adrenergic enhancement of consolidation of object recognition memory.Neurobiology of Learning and Memory, 88(1), 137?142. https://doi.org/10.1016/j.nlm. 2007.01.005
Duan, H., Wang, X., Hu, W., & Kounios, J. (2020). Effects of acute stress on divergent and convergent problem-solving.Thinking & Reasoning, 26(1), 68?86. https://doi.org/10. 1080/13546783.2019.1572539
Duan, H., Wang, X., Wang, Z., Xue, W., Kan, Y., Hu, W., & Zhang, F. (2019). Acute stress shapes creative cognition in trait anxiety.Frontiers in Psychology, 10. https://doi.org/ 10.3389/fpsyg.2019.01517
Dupret, D., ONeill, J., Pleydell-Bouverie, B., & Csicsvari, J. (2010). The reorganization and reactivation of hippocampal maps predict spatial memory performance.Nature Neuroscience, 13(8), 995?1002. https://doi.org/10.1038/ nn.2599
Ego-Stengel, V., & Wilson, M. A. (2009). Disruption of ripple-associated hippocampal activity during rest impairs spatial learning in the rat.Hippocampus, https://doi.org/ 10.1002/hipo.20707
Ferna?ndez, G., Effern, A., Grunwald, T., Pezer, N., Lehnertz, K., Du?mpelmann, M., … Elger, C. E. (1999). Real-time tracking of memory formation in the human rhinal cortex and hippocampus.Science, 285(5433), 1582?1585. https://doi.org/10.1126/science.285.5433.1582
Fernández-Ruiz, A., Oliva, A., Fermino de Oliveira, E., Rocha-Almeida, F., Tingley, D., & Buzsáki, G. (2019). Long-duration hippocampal sharp wave ripples improve memory.Science, 364(6445), 1082?1086. https://doi.org/ 10.1126/science.aax0758
Ferreira, C. S., Charest, I., & Wimber, M. (2019). Retrieval aids the creation of a generalised memory trace and strengthens episode-unique information.NeuroImage, 201, 115996. https://doi.org/10.1016/j.neuroimage.2019.07.009
Foster, D. J., & Wilson, M. A. (2006). Reverse replay of behavioural sequences in hippocampal place cells during the awake state.Nature, 440(7084), 680?683. https://doi. org/10.1038/nature04587
Fox, M. D., & Raichle, M. E. (2007). Spontaneous fluctuations in brain activity observed with functional magnetic resonance imaging.Nature Reviews Neuroscience, 8(9), 700?711. https://doi.org/10.1038/nrn2201
Frankland, P. W., & Bontempi, B. (2005). The organization of recent and remote memories.Nature Reviews Neuroscience, 6(2), 119?130. https://doi.org/10.1038/nrn1607
Frankland, P. W., Josselyn, S. A., & K?hler, S. (2019). The neurobiological foundation of memory retrieval.Nature Neuroscience, 22(10), 1576?1585. https://doi.org/10.1038/ s41593-019-0493-1
Gagnon, S. A., Waskom, M. L., Brown, T. I., & Wagner, A. D. (2019). Stress impairs episodic retrieval by disrupting hippocampal and cortical mechanisms of remembering.Cerebral Cortex, 29(7), 2947?2964. https://doi.org/10.1093/ cercor/bhy162
G?rtner, M., Rohde-Liebenau, L., Grimm, S., & Bajbouj, M. (2014). Working memory-related frontal theta activity is decreased under acute stress.Psychoneuroendocrinology, 43, 105?113. https://doi.org/10.1016/j.psyneuen.2014.02.009
Guerra-Carrillo, B., Mackey, A. P., & Bunge, S. A. (2014). Resting-state fMRI.The Neuroscientist, 20(5), 522?533. https://doi.org/10.1177/1073858414524442
Hermans, E. J., Henckens, M. J. A. G., Jo?ls, M., & Fernández, G. (2014). Dynamic adaptation of large-scale brain networks in response to acute stressors.Trends in Neurosciences, 37(6), 304?314. https://doi.org/10.1016/ j.tins.2014.03.006
Hermans, E. J., van Marle, H. J. F., Ossewaarde, L., Henckens, M. J. A. G., Qin, S., van Kesteren, M. T. R., … Fernández, G. (2011). Stress-related noradrenergic activity prompts large-scale neural network reconfiguration.Science, 334(6059), 1151?1153. https://doi.org/10.1126/ science.1209603
Hu, X., Cheng, L. Y., Chiu, M. H., & Paller, K. A. (2020). Promoting memory consolidation during sleep: A meta- analysis of targeted memory reactivation.Psychological Bulletin, 146(3), 218?244. https://doi.org/10.1037/bul0000223
Inman, C. S., Manns, J. R., Bijanki, K. R., Bass, D. I., Hamann, S., Drane, D. L., … Willie, J. T. (2018). Direct electrical stimulation of the amygdala enhances declarative memory in humans.Proceedings of the National Academy of Sciences, 115(1), 98?103. https://doi.org/10.1073/pnas. 1714058114
Ji, D., & Wilson, M. A. (2007). Coordinated memory replay in the visual cortex and hippocampus during sleep.Nature Neuroscience, 10(1), 100?107. https://doi.org/10.1038/nn1825
Karlsson, M. P., & Frank, L. M. (2009). Awake replay of remote experiences in the hippocampus.Nature Neuroscience, 12(7), 913?918. https://doi.org/10.1038/nn. 2344
Klinzing, J. G., Niethard, N., & Born, J. (2019). Mechanisms of systems memory consolidation during sleep.Nature Neuroscience, 22(10), 1598?1610. https://doi.org/10.1038/ s41593-019-0467-3
Krenz, V., Sommer, T., Alink, A., Roozendaal, B., & Schwabe, L. (2021). Noradrenergic arousal after encoding reverses the course of systems consolidation in humans.Nature Communications, 12(1), 6054. https://doi.org/10. 1038/s41467-021-26250-7
Kurth-Nelson, Z., Behrens, T., Wayne, G., Miller, K., Luettgau, L., Dolan, R., … Schwartenbeck, P. (2023). Replay and compositional computation.Neuron, 111(4), 454?469. https://doi.org/10.1016/j.neuron.2022.12.028
LaBar, K. S., & Cabeza, R. (2006). Cognitive neuroscience of emotional memory.Nature Reviews Neuroscience, 7(1), 54?64. https://doi.org/10.1038/nrn1825
Lederbogen, F., Kirsch, P., Haddad, L., Streit, F., Tost, H., Schuch, P., … Meyer-Lindenberg, A. (2011). City living and urban upbringing affect neural social stress processing in humans.Nature, 474(7352), 498?501. https://doi.org/ 10.1038/nature10190
Lee, K. O., Mai, K. M., & Park, S. (2023). Green space accessibility helps buffer declined mental health during the COVID-19 pandemic: Evidence from big data in the United Kingdom.Nature Mental Health, 1(2), 124?134. https://doi.org/10.1038/s44220-023-00018-y
Lindauer, R. J. L., Olff, M., van Meijel, E. P. M., Carlier, I. V. E., & Gersons, B. P. R. (2006). Cortisol, learning, memory, and attention in relation to smaller hippocampal volume in police officers with posttraumatic stress disorder.Biological Psychiatry, 59(2), 171?177. https://doi.org/ 10.1016/j.biopsych.2005.06.033
Liu, F., Xu, J., Guo, L., Qin, W., Liang, M., Schumann, G., & Yu, C. (2023). Environmental neuroscience linking exposome to brain structure and function underlying cognition and behavior.Molecular Psychiatry, 28(1), 17?27. https://doi.org/10.1038/s41380-022-01669-6
Liu, W., Kohn, N., & Fernández, G. (2019). Intersubject similarity of personality is associated with intersubject similarity of brain connectivity patterns.NeuroImage, 186, 56?69. https://doi.org/10.1016/j.neuroimage.2018.10.062
Liu, W., Kohn, N., & Fernández, G. (2021). Dynamic transitions between neural states are associated with flexible task switching during a memory task.Journal of Cognitive Neuroscience, 33(12), 2559?2588. https://doi.org/ 10.1162/jocn_a_01779
Liu, W., Shi, Y., Cousins, J. N., Kohn, N., & Fernández, G. (2022). Hippocampal-medial prefrontal event segmentation and integration contribute to episodic memory formation.Cerebral Cortex, 32(5), 949?969. https://doi.org/10.1093/ cercor/bhab258
Liu, Y., Dolan, R. J., Higgins, C., Penagos, H., Woolrich, M. W., ?lafsdóttir, H. F., … Behrens, T. E. (2021). Temporally delayed linear modelling (TDLM) measures replay in both animals and humans.eLife, 10. https:// doi.org/10.7554/eLife.66917
Liu, Y., Dolan, R. J., Kurth-Nelson, Z., & Behrens, T. E. J. (2019). Human replay spontaneously reorganizes experience.Cell, 178(3), 640-652.e14. https://doi.org/10.1016/j.cell. 2019.06.012
Liu, Y., Mattar, M. G., Behrens, T. E. J., Daw, N. D., & Dolan, R. J. (2021). Experience replay is associated with efficient nonlocal learning.Science, 372(6544). https:// doi.org/10.1126/science.abf1357
Liu, Y., Nour, M. M., Schuck, N. W., Behrens, T. E. J., & Dolan, R. J. (2022). Decoding cognition from spontaneous neural activity.Nature Reviews Neuroscience, 23(4), 204?214. https://doi.org/10.1038/s41583-022-00570-z
Luo, Y., Fernández, G., Hermans, E., Vogel, S., Zhang, Y., Li, H., & Klumpers, F. (2018). How acute stress may enhance subsequent memory for threat stimuli outside the focus of attention: DLPFC-amygdala decoupling.NeuroImage, 171, 311?322. https://doi.org/10.1016/j.neuroimage.2018.01.010
McCullough, A. M., Ritchey, M., Ranganath, C., & Yonelinas, A. (2015). Differential effects of stress-induced cortisol responses on recollection and familiarity-based recognition memory.Neurobiology of Learning and Memory, 123, 1?10. https://doi.org/10.1016/j.nlm.2015.04.007
McCutcheon, R. A., Reis Marques, T., & Howes, O. D. (2020). Schizophrenia—An overview.JAMA Psychiatry,77(2), 201?210. https://doi.org/10.1001/jamapsychiatry. 2019.3360
McGaugh, J. L. (2003).Memory and emotion: The making of lasting memories. Columbia University Press.
McGaugh, J. L. (2018). Emotional arousal regulation of memory consolidation.Current Opinion in Behavioral Sciences, 19, 55?60. https://doi.org/10.1016/j.cobeha.2017. 10.003
McReynolds, J. R., Anderson, K. M., Donowho, K. M., & McIntyre, C. K. (2014). Noradrenergic actions in the basolateral complex of the amygdala modulate Arc expression in hippocampal synapses and consolidation of aversive and non-aversive memory.Neurobiology of Learning and Memory, 115, 49–57. https://doi.org/10.1016/ j.nlm.2014.08.016
Morena, M., Roozendaal, B., Trezza, V., Ratano, P., Peloso, A., Hauer, D., Atsak, P., Trabace, L., Cuomo, V., McGaugh, J. L., Schelling, G., & Campolongo, P. (2014). Endogenous cannabinoid release within prefrontal-limbic pathways affects memory consolidation of emotional training.Proceedings of the National Academy of Sciences of the United States of America, 111(51), 18333–18338. https://doi.org/10.1073/pnas.1420285111
Murayama, K., & Kitagami, S. (2014). Consolidation power of extrinsic rewards: Reward cues enhance long-term memory for irrelevant past events.Journal of Experimental Psychology: General, 143(1), 15?20. https://doi.org/10.1037/ a0031992
Murayama, K., & Kuhbandner, C. (2011). Money enhances memory consolidation ? But only for boring material.Cognition, 119(1), 120?124. https://doi.org/10.1016/j.cognition. 2011.01.001
Newcomer, J. W., Selke, G., Melson, A. K., Hershey, T., Craft, S., Richards, K., & Alderson, A. L. (1999). Decreased memory performance in healthy humans induced by stress-level cortisol treatment.Archives of General Psychiatry, 56(6), 527?533.
Nguyen, N.D., Lutas, A., Amsalem, O. et al. (2023). Cortical reactivations predict future sensory responses.Natures. https://doi.org/10.1038/s41586-023-06810-1
Nour, M. M., Liu, Y., Arumuham, A., Kurth-Nelson, Z., & Dolan, R. J. (2021). Impaired neural replay of inferred relationships in schizophrenia.Cell, 184(16), 4315? 4328.e17. https://doi.org/10.1016/j.cell.2021.06.012
Qin, S., Hermans, E. J., van Marle, H. J. F., Luo, J., & Fernández, G. (2009). Acute psychological stress reduces working memory-related activity in the dorsolateral prefrontal cortex.Biological Psychiatry, 66(1), 25?32. https://doi.org/10.1016/j.biopsych.2009.03.006
Rao, R. P., Anilkumar, S., McEwen, B. S., & Chattarji, S. (2012). Glucocorticoids protect against the delayed behavioral and cellular effects of acute stress on the amygdala.Biological Psychiatry, 72(6), 466?475. https://doi.org/ 10.1016/j.biopsych.2012.04.008
Rasch, B., Bu?chel, C., Gais, S., & Born, J. (2007). Odor cues during slow-wave sleep prompt declarative memory consolidation.Science, 315(5817), 1426?1429. https://doi. org/10.1126/science.1138581
Roozendaal, B., Castello, N. A., Vedana, G., Barsegyan, A., & McGaugh, J. L. (2008). Noradrenergic activation of the basolateral amygdala modulates consolidation of object recognition memory.Neurobiology of Learning and Memory, 90(3), 576?579. https://doi.org/10.1016/j.nlm.2008. 06.010
Roozendaal, B., Okuda, S., de Quervain, D. J.-F., & McGaugh, J. L. (2006). Glucocorticoids interact with emotion-induced noradrenergic activation in influencing different memory functions.Neuroscience, 138(3), 901? 910. https://doi.org/10.1016/j.neuroscience.2005.07.049
Schuck, N. W., & Niv, Y. (2019a). Sequential replay of nonspatial task states in the human hippocampus.Science, 364(6447). https://doi.org/10.1126/science.aaw5181
Schuck, N. W., & Niv, Y. (2019b). Sequential replay of nonspatial task states in the human hippocampus.Science,364(6447). https://doi.org/10.1126/science.aaw5181
Schwabe, L., Hermans, E. J., Jo?ls, M., & Roozendaal, B. (2022). Mechanisms of memory under stress.Neuron,110(9), 1450?1467. https://doi.org/10.1016/j.neuron.2022. 02.020
Schwabe, L., R?mer, S., Richter, S., Dockendorf, S., Bilak, B., & Sch?chinger, H. (2009). Stress effects on declarative memory retrieval are blocked by a β-adrenoceptor antagonist in humans.Psychoneuroendocrinology, 34(3), 446?454. https://doi.org/10.1016/j.psyneuen.2008.10.009
Sharot, T., & Phelps, E. A. (2004). How arousal modulates memory: Disentangling the effects of attention and retention.Cognitive, Affective, & Behavioral Neuroscience, 4(3), 294?306. https://doi.org/10.3758/CABN.4.3.294
Siller-Pérez, C., Fuentes-Iba?ez, A., Sotelo-Barrera, E. L., Serafín, N., Prado-Alcalá, R. A., Campolongo, P., Roozendaal, B., & Quirarte, G. L. (2019). Glucocorticoid interactions with the dorsal striatal endocannabinoid system in regulating inhibitory avoidance memory.Psychoneuroendocrinology, 99, 97?103. https://doi.org/ 10.1016/j.psyneuen.2018.08.021
Squire, L. R., Genzel, L., Wixted, J. T., & Morris, R. G. (2015). Memory consolidation.Cold Spring Harbor Perspectives in Biology, 7(8), a021766. https://doi.org/ 10.1101/cshperspect.a021766
Sudimac, S., Sale, V., & Kühn, S. (2022). How nature nurtures: Amygdala activity decreases as the result of a one-hour walk in nature.Molecular Psychiatry, 27(11), 4446?4452. https://doi.org/10.1038/s41380-022-01720-6
Suh, J., Foster, D. J., Davoudi, H., Wilson, M. A., & Tonegawa, S. (2013). Impaired hippocampal ripple- associated replay in a mouse model of schizophrenia.Neuron, 80(2), 484?493. https://doi.org/10.1016/j.neuron. 2013.09.014
Takashima, A., Nieuwenhuis, I. L. C., Jensen, O., Talamini, L. M., Rijpkema, M., & Fernández, G. (2009). Shift from hippocampal to neocortical centered retrieval network with consolidation.The Journal of Neuroscience, 29(32), 10087?10093. https://doi.org/10.1523/JNEUROSCI.0799-09. 2009
Takashima, A., Petersson, K. M., Rutters, F., Tendolkar, I., Jensen, O., Zwarts, M. J., … Fernández, G. (2006). Declarative memory consolidation in humans: A prospective functional magnetic resonance imaging study.Proceedings of the National Academy of Sciences, 103(3), 756?761. https://doi.org/10.1073/pnas.0507774103
Tambini, A., & Davachi, L. (2013). Persistence of hippocampal multivoxel patterns into postencoding rest is related to memory.Proceedings of the National Academy of Sciences, 110(48), 19591?19596. https://doi.org/10.1073/pnas. 1308499110
Tambini, A., & Davachi, L. (2019). Awake reactivation of prior experiences consolidates memories and biases cognition.Trends in Cognitive Sciences, 23(10), 876?890. https://doi.org/10.1016/j.tics.2019.07.008
Tambini, A., & DEsposito, M. (2020). Causal contribution of awake post-encoding processes to episodic memory consolidation.Current Biology, 30(18), 3533?3543.e7. https://doi.org/10.1016/j.cub.2020.06.063
Tambini, A., Ketz, N., & Davachi, L. (2010). Enhanced brain correlations during rest are related to memory for recent experiences.Neuron, 65(2), 280?290. https://doi.org/10. 1016/j.neuron.2010.01.001
Tambini, A., Rimmele, U., Phelps, E. A., & Davachi, L. (2017). Emotional brain states carry over and enhance future memory formation.Nature Neuroscience, 20(2), 271?278. https://doi.org/10.1038/nn.4468
Tost, H., Champagne, F. A., & Meyer-Lindenberg, A. (2015). Environmental influence in the brain, human welfare and mental health.Nature Neuroscience,18(10), 4121?4131. https://doi.org/10.1038/nn.4108
Tse, D., Langston, R. F., Kakeyama, M., Bethus, I., Spooner, P. A., Wood, E. R., … Morris, R. G. M. (2007). Schemas and memory consolidation.Science, 316(5821), 76?82. https://doi.org/10.1126/science.1135935
van Kesteren, M. T. R., Fernández, G., Norris, D. G., & Hermans, E. J. (2010). Persistent schema-dependent hippocampal-neocortical connectivity during memory encoding and postencoding rest in humans.Proceedings of the National Academy of Sciences, 107(16), 7550?7555. https://doi.org/10.1073/pnas.0914892107
van Marle, H. J. F., Hermans, E. J., Qin, S., & Fernández, G. (2009). From specificity to sensitivity: How acute stress affects amygdala processing of biologically salient stimuli.Biological Psychiatry, 66(7), 649?655. https://doi.org/ 10.1016/j.biopsych.2009.05.014
van Marle, H. J. F., Hermans, E. J., Qin, S., Overeem, S., & Fernández, G. (2013). The effect of exogenous cortisol during sleep on the behavioral and neural correlates of emotional memory consolidation in humans.Psychoneuroendocrinology, 38(9), 1639?1649. https://doi. org/10.1016/j.psyneuen.2013.01.009
Wamsley, E. J. (2022). Offline memory consolidation during waking rest.Nature Reviews Psychology, 1(8), 441?453. https://doi.org/10.1038/s44159-022-00072-w
Wilhelm, I., Diekelmann, S., Molzow, I., Ayoub, A., M?lle, M., & Born, J. (2011). Sleep selectively enhances memory expected to be of future relevance.The Journal of Neuroscience, 31(5), 1563?1569. https://doi.org/10.1523/ JNEUROSCI.3575-10.2011
Wittkuhn, L., & Schuck, N. W. (2021). Dynamics of fMRI patterns reflect sub-second activation sequences and reveal replay in human visual cortex.Nature Communications, 12(1), 1795. https://doi.org/10.1038/s41467- 021-21970-2
Wolf, O. T. (2017). Stress and memory retrieval: Mechanisms and consequences.Current Opinion in Behavioral Sciences, 14, 40?46. https://doi.org/10.1016/j.cobeha.2016. 12.001
Xu, J., Liu, X., Li, Q., Goldblatt, R., Qin, W., Liu, F., … Schumann, G. (2021). Global urbanicity is associated with brain and behaviour in young people.Nature Human Behaviour, 6(2), 279?293. https://doi.org/10.1038/s41562- 021-01204-7
Ye, Z., Shi, L., Li, A., Chen, C., & Xue, G. (2020). Retrieval practice facilitates memory updating by enhancing and differentiating medial prefrontal cortex representations.eLife, 9. https://doi.org/10.7554/eLife.57023
Yuen, E. Y., Liu, W., Karatsoreos, I. N., Feng, J., McEwen, B. S., & Yan, Z. (2009). Acute stress enhances glutamatergic transmission in prefrontal cortex and facilitates working memory.Proceedings of the National Academy of Sciences, 106(33), 14075?14079. https://doi.org/10.1073/pnas.0906 791106
Zhuang, L., Wang, J., Xiong, B., Bian, C., Hao, L., Bayley, P. J., & Qin, S. (2021). Rapid neural reorganization during retrieval practice predicts subsequent long-term retention and false memory.Nature Human Behaviour, 6(1), 134?145. https://doi.org/10.1038/s41562-021-01188-4
Zinkin, S., & Miller, A. J. (1967). Recovery of memory after amnesia induced by electroconvulsive shock.Science, 155(3758), 102?104. https://doi.org/10.1126/science.155. 3758.102
The neural replay mechanisms of episodic memory
consolidationunder stress in humans
LIU Wei, CHEN Ruixin, GUO JinPeng
(Key Laboratory of Adolescent Cyberpsychology and Behavior (CCNU), Ministry of Education;Key Laboratory
of Human Development and Mental Health of Hubei Province;School of Psychology, Central
China Normal University, Wuhan 430079, China)
Abstract: Memory consolidation typically occurs slowly during rest or sleep periods following memory encoding. Under stress, though, the consolidation of memories may accelerate considerably. The mechanisms underlying this rapid memory consolidation in stressful circumstances remain unclear, primarily due to the longstanding absence of quantitative methodologies for investigating the neural activities during the human memory consolidation. This research aims to employ computational neuroscience techniques to meticulously characterize neural replay during the consolidation of episodic memory under stress. Specifically, we propose an integrated approach involving cognitive psychology, neuroimaging, machine learning, neuroendocrine regulation, stress induction, and physiological and neuroendocrine assessments to examine the 'double-edged sword' hypothesis related to stress and neural replay. Although stress might hasten the rate of neural replay, thereby facilitating memory consolidation, it could simultaneously compromise the accuracy of neural replay and disrupt its sequentiality. Our study will: (1) juxtapose the multi-dimensional characteristics of neural replay under stress and non-stress conditions; (2) probe the interplay between neural replay and memory retrieval and encoding in stressful conditions; and (3) strive to employ neuroendocrine and environmental tactics to modulate human stress responses, which in turn could influence neural replay during consolidation. The implications of this research are twofold: it could help identify the optimal brain state to enhance memory consolidation and bridge the gap between human and animal studies on neural replay. At the same time, it could illuminate new strategies for preserving episodic memory function under stress and intervening in memory deficits seen in stress- associated psychiatric disorders.
Keywords:memory consolidation, memory retrieval, acute stress, neural replay, episodic memory

