CCC和B9对杜鹃花芽诱导及其形态结构和生理生化的影响
罗培润 樊玥 谢倩 王威 陈清西


摘要:以杜鹃为试材,采用析因试验和单因素试验将生长抑制剂矮壮素(CCC)、丁酰肼(B9)喷施于杜鹃叶片上,对杜鹃进行花芽诱导,研究生长抑制剂CCC、B9对杜鹃花芽外部形态、内部分化结构及生理生化指标(可溶性糖含量、淀粉含量、可溶性蛋白含量、叶绿素含量及内源激素含量)变化的影响,以期为进一步研究公园绿化用杜鹃花期调控技术提供参考依据。结果表明,与对照(清水)相比,喷施不同浓度CCC、B9均可不同程度地诱导花芽提早形成,花芽形成率提高了2.45~15.73百分点,花芽形成时间缩短了14.00~27.83 d,但花芽形成高峰期时间、花芽形成持续时间差异不显著。其中,以2 000 mg/L CCC处理的效果最佳,花芽形成率较对照显著提高了15.73百分点(P<0.05),花芽形成时间较对照缩短了27.83 d,花芽形成高峰期时间、花芽形成持续时间与对照间的差异不显著。CCC处理可显著提高杜鹃叶片可溶性糖、淀粉、可溶性蛋白和叶绿素a、叶绿素b、总叶绿素及玉米素(ZT)含量,抑制杜鹃叶片赤霉素(GA3)、生长素(IAA)合成,使ZT/GA3、ZT/IAA、ABA/GA3和ABA/IAA值均显著提高。在杜鹃花芽形成过程中,花芽外部形态与内部分化结构存在对应关系,CCC处理能够促进杜鹃花芽分化,增加花原基数量。由研究结果看出,在谢花后30 d喷施2 000 mg/L CCC是诱导杜鹃花芽形成、调控花期的一项重要措施。
关键词:杜鹃;生长抑制剂;花芽诱导;矮壮素;丁酰肼;形态结构;生理生化
中图分类号:S685.210.1文献标志码:A
文章编号:1002-1302(2024)09-0204-09
杜鹃(Rhododendron)属杜鹃花科杜鹃花属多年生木本植物,是我国南方园林绿地常用的木本花卉之一,主要应用于公园绿地,多以花坛中或以花丛的形式种植[1]。杜鹃花期集中于每年3—5月,错过了国庆、元旦和春节等节日,难以满足特定时间点人们对公园绿地的观赏需求[2]。
花芽分化是植物开花的先决条件,诱导植物花芽分化有利于使花期提前、增加开花数量和提高开花品质[3]。植物生长抑制剂如矮壮素(CCC)、多效唑(PP333)、丁酰肼(B9)等可通过抑制植物营养生长而使叶色浓绿,从而促进开花、提高开花数量[4]。例如,用0.3% CCC浇灌盆栽山茶可以促进花芽形成[5]。在柠檬花芽分化前用300~400 mg/L PP333喷洒树冠2次,可以促进花芽分化,从而提高开花质量[6]。在柑橘花芽分化期喷施2 000~3 000 mg/L B9,可以促进柑橘花芽分化、增加翌年开花数[7]。在杜鹃花芽分化前混合施用2 000 mg/L CCC和 120 mg/L PP333,可使花芽分形态分化时期提前 18 d[8]。由此可见,适当喷施植物生长抑制剂有利于诱导植物花芽分化。
目前,用植物生长调节剂诱导杜鹃花芽形成的过程中花芽内外部结构变化与相关生理相结合的研究较少。因此,本研究以杜鹃御代之荣为试验材料,采用析因试验与单因素试验,筛选花芽诱导的最适种类和浓度,观察花芽分化过程中的内外形态变化,以期建立花芽外部形态与内部分化结构的对应关系,为推测杜鹃花芽形成时期提供理论参考。同时,通过研究植物生长抑制剂对其内源激素、碳水化合物和叶绿素等生理生化的影响,探究植物生长抑制剂对杜鹃花芽形成的生理效应,以期在促进花芽提前形成后使其提前开花,为杜鹃花期调控实践提供理论依据,对公园绿化杜鹃花期调控技术的实践应用与推广具有一定的意义。
1 材料与方法
1.1 试验地概况试验在玻璃温室内进行,具体场景见图1。试验期间进行环境温湿度的记录(图2),1 h记录1次,每个处理重复3次。温度计悬挂于温室东、南、西、北及中心5个方位,距植株顶端约30 cm。
1.2 试验材料
杜鹃御代之荣(Rhododendron ‘Miyo-no-Sakae)购自浙江省金华市永根杜鹃花有限公司,为3年生扦插苗,于2021年6月种植于福建农林大学园艺学院文洛型玻璃温室内,用方形塑料容器(上口径为边长20 cm的正方形,下口径为边长 18 cm 的正方形,高度是25 cm)栽培,统一管理,基质配方为泥炭土与蛭石体积比为3 ∶1。
主要试剂:矮壮素,购自安阳全丰生物科技有限公司;丁酰肼,购自河南康云化工有限公司。
1.3 试验方法
如图3所示,在2022年4月14日(记作谢花后1 d)摘除残花及余花。于谢花后30 d(2022年5月14日,此时植株处于营养生长期,当年生春梢刚半木质化)进行试验处理。用1 000、1 500、2 000 mg/L CCC(记作A)和B9(记作B)按照2因素3水平进行析因设计(表1),共9个处理。根据析因试验主效应分析结果,进行A、B单因素试验处理。
整株喷施至叶面滴水为限,每隔7 d喷施1次,连续喷施3次。以喷施清水作为对照(CK),每个处理10盆,重复3次。第1次处理后进行第1次采样,此后每隔7 d采样1次,共7次。每次各处理随机采集30个顶芽用于形态结构观测,采集顶芽下方第3~5张功能叶片,清洗后剪去主叶脉,液氮处理后存于-80 ℃冰箱中,用于生理指标测定。
1.4 项目测定
1.4.1 花芽形成情况统计 第1次处理后,每隔10 d统计1次花芽形成情况并挂牌标记。选择以下指标对花芽情况进行分析:花芽形成所需时间(第1次处理后至第1个花芽形成所需时间);花芽形成高峰期(第1个花芽形成后至日花芽数达到最大值时所需的时间,d);花芽形成持续时间(第1个花芽形成至最后1个花芽形成所需的总时间,d);花芽形成率=(花芽数/总芽数)×100%。
1.4.2 形态结构观察 每隔10 d随机摘取各处理枝条顶部10个芽体,至谢花后180 d观察花芽外部形态。用数显游标卡尺(精度为0.01 mm)测量花芽长度、宽度,重复3次。
花芽解剖结构的观察。将测量完长、宽的芽体纵切后置于体视显微镜下,观察并统计花芽内部生长点花原基形成情况,每个处理统计10个芽体,重复3次。将统计完花原基数量的芽体放入FAA固定液(5 mL福尔马林+5 mL冰乙酸+90 mL 70%乙醇)中固定24 h,采用常规石蜡切片法进行番红固绿染色后再进行制片观察。
1.4.3 生理生化相关指标的测定 采用蒽酮比色法测定叶片中的可溶性糖、淀粉含量;采用考马斯亮蓝G-250法测定叶片的蛋白质含量;采用乙醇浸提法测定叶绿素含量;采用酶联免疫法(ELSA)测定叶片内源激素GA3、IAA、ABA、ZT含量,每个样品设3个生物学重复[9]。
1.5 数据分析
用Excel 2010进行数据统计,用SPSS 26.0软件中的单因素方差分析(ANOVA)检验差异显著性,用一般线性模型进行主效应分析,用Duncans多重比较法进行相关分析,用GraphPad Prism 8.0绘图。
2 结果与分析
2.1 CCC+B9析因组合对杜鹃花芽形成的影响
由图4可知,不同浓度CCC+B9析因组合处理均有利于诱导杜鹃花芽形成。A3B2处理花芽形成时间较对照提前24 d,在谢花后130 d,花芽形成率达80%以上,且花芽形成率高于其余处理,较对照提高14.59%;A1B2处理花芽形成时间最短,较对照缩短35.50 d;A2B3处理花芽形成高峰期最早,较对照显著提前26.00 d;A3B3处理花芽形成持续时间最短,较对照缩短15.33 d。
对析因试验9个处理进行花芽形成率、花芽形成所需时间、花芽形成高峰期和花芽形成持续时间4个维度的主效应分析,结果如表2所示。结果表明,不同浓度CCC处理对花芽形成率、花芽形成时间的影响主效应显著(P<0.05),即CCC浓度对花芽形成率的影响较大;不同浓度B9处理对花芽形成率影响的主效应不显著,即B9浓度对花芽形成率的影响较小;2因素交互效应不显著,即CCC+B9配合施用对杜鹃花芽形成率和花芽形成所需时间之间不存在互相影响。不同浓度CCC、B9对花芽形成高峰期和花芽形成持续时间的主效应均不显著。
由此可以看出,CCC浓度对杜鹃花芽形成率、花芽形成时间的影响较大,且浓度愈高,影响愈大;对形成高峰期、持续时间的影响较小。B9浓度对杜鹃花芽形成率、花芽形成时间、花芽形成高峰期、花芽形成持续时间的影响较小。且二者的影响相互独立。
2.2 CCC、B9处理对杜鹃花芽诱导的效应
为进一步探究CCC、B9浓度对杜鹃花芽诱导的影响,进行单因素试验。由图5可见,CCC、B9单因素处理均有利于诱导花芽形成。随着CCC浓度、B9浓度升高,花芽形成率均先上升后下降。各处理的花芽形成率均在谢花后150 d达到最高点并保持相对稳定。在A3、B2处理下,花芽形成率到达80%的时间点分别较对照提前36、26 d。
由表3可知,A3处理花芽形成率为96.41%,较对照显著提高了15.73百分点;花芽形成所需时间为18.67 d,较同期对照缩短了27.83 d,优于其余处理,且与对照差异显著;B2处理花芽形成时间显著短于对照,仅为15.67 d,较对照缩短了30.83 d。上述结果表明,谢花后30 d喷施2 000 mg/L CCC、1 500 mg/L B9对杜鹃花芽的诱导效果显著,且喷施2 000 mg/L CCC能使花芽形成率提高至各处理的最高水平。
2.3 CCC处理对杜鹃花芽外部形态及解剖结构的影响
芽体由叶芽转向花芽的过程通常难以观察,故本研究采用外部形态和解剖结构相结合的方式进行观测。通过单因素方差分析和主效应分析,以花芽形成率、花芽形成所需时间、花芽形成高峰期时间和花芽形成持续时间4个维度筛选出效果最优的A3处理,即将2 000 mg/L CCC处理与对照进行花芽外部形态和解剖结构变化的比较。
由图6、图7可知,在谢花后40~50 d,A3处理芽体均处于分化初期,此时顶端分生组织的生长点突起变宽,呈半球形,花原基形成,芽体长宽比由0.40增长至1.52,此时对照芽体仍处于未分化期;在谢花后60~70 d,A3处理芽体处于花萼花瓣形成期,花原基外侧花萼原基增大、伸长,内侧花瓣原基突起,芽体长宽比由[KG*4]1.52[KG*4]增长为[KG*4]1.79,对照仍处于未分化期;在谢花后80~90 d,A3处理芽体处于雌雄蕊形成期,较对照明显提前,此时芽体花萼、花瓣原基已伸长并包裹住花原基,花瓣原基内侧出现雄蕊原基突起,雄蕊原基内方中心出现突起,即为雌蕊原基,芽体长宽比由1.79增长至1.90,此时对照芽体长宽比由1.24增长至1.42,但生长点未出现变化,芽体仍处于未分化期;在谢花后100 d,A3处理芽体的雌雄蕊原基进一步发育,雄蕊原基进一步伸长,形成花药和花丝,雌蕊原基进一步伸长,形成花柱,此时芽体长宽比由1.90增长至2.10,对照处于分化初期,长宽比显著增加。上述结果说明,A3处理后芽体较对照提前开始形态分化,且芽体大小与花芽内部形态结构的发育变化过程存在对应关系,可根据花芽大小的显著变化判断杜鹃芽体是否进入花芽形态分化期。
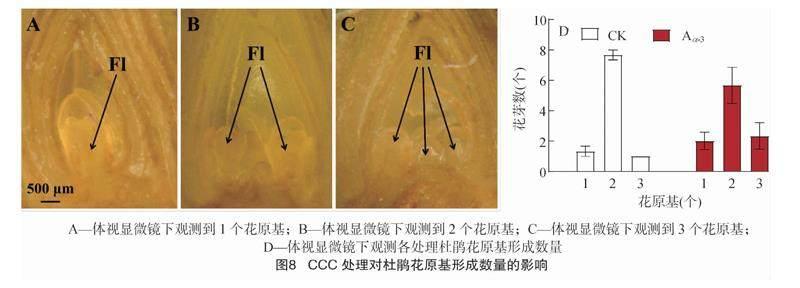
由图8可知,杜鹃芽体中花原基数有1~3个,花原基数量增加是开花数量增加的前提。在A3处理下,每个芽体中有3个花原基的数量略有提高,说明喷施2 000 mg/L CCC有利于提高芽体中花原基的数量。
2.4 CCC处理对杜鹃叶片生理指标的影响
综合主效应分析和单因素方差分析,以花芽形成率、花芽形成所需时间、花芽形成高峰期时间和花芽形成持续时间4个维度筛选出效果最优的处理A3,结合对照比较杜鹃叶片生理指标的变化。
2.4.1 CCC处理对叶片光合色素的影响 由图9可知,A3处理后,杜鹃叶片中的叶绿素a、叶绿素b、总叶绿素含量在谢花后51 d均较同期对照显著升高,说明A3处理能够显著提高谢花后51 d杜鹃叶片中各光合色素的含量。在谢花后51 d,对照叶绿素a/b的值显著高于A3处理,说明A3处理增强了叶片对光能的捕捉能力。
2.4.2 CCC处理对叶片营养物质的影响 在谢花后30~44 d,A3处理与对照杜鹃叶片中的可溶性糖、淀粉含量均呈上升趋势,对照的变化趋势较为平稳;在花芽形成后期,杜鹃叶片中的可溶性糖、淀粉含量均显著下降,且淀粉含量始终低于可溶性糖含量(图10-A、图10-B)。此外,由图10-C可以看出,在花芽形成过程中,杜鹃叶片中的可溶性蛋白含量总体呈现波动升高的变化趋势,在谢花后 51 d,A3处理的可溶性蛋白含量显著高于同期对照。上述结果说明,花芽诱导需要积累大量的可溶性糖和淀粉,A3处理有利于杜鹃叶片中碳水化合物和蛋白质的积累。
2.4.3 CCC处理对叶片内源激素及比值的影响 由图11可知,在A3处理下,杜鹃叶片中的GA3含量整体显著低于同期对照;在谢花后30~44 d,杜鹃叶片内的GA3含量显著降低,直至最低点;在谢花后 44~51 d内,杜鹃叶片内的GA3含量逐步回升,直至与同期对照差异不显著;并在谢花后51~72 d波动下降,与同期对照相比差异显著。在谢花后 30~72 d,A3处理的脱落酸(ABA)含量持续降低,并在谢花后65 d达到最低,与同期对照相比差异显著。在A3处理下,杜鹃叶片中的生长素(IAA)含量较同期对照显著降低,在谢花后58 d降低至最低点,在谢花后72 d回升。A3处理杜鹃叶片中ZT含量的整体变化趋势与对照相似,在谢花后44、58~72 d均显著高于同期对照。
由图12可知,在A3处理下,杜鹃叶片中ZT/GA3的值始终高于对照,在谢花后44~72 d内较同期对照差异极显著。A3处理ZT/IAA的值整体高于对照,在谢花后30~58 d时的变化趋势与对照相似;谢花后58 d,A3处理ZT/IAA的值较对照显著升高,除谢花后58 d外,均与同期对照间差异极显著。A3处理ABA/GA3的值始终显著高于同期对照,在谢花后44 d时达到最高峰后下降,整体变化趋势与对照相反。A3处理ABA/IAA的值始终显著高于同期对照,在谢花后37 d时达到最高峰后下降。
上述结果说明,在谢花后30 d,A3处理能够显著降低杜鹃叶片中的GA3、IAA含量,显著提高叶片中的ZT含量。较低的GA3含量和较高的ZT含量有利于杜鹃花芽诱导。在谢花后30 d,A3处理对杜鹃叶片ZT/GA3值、ZT/IAA值、ABA/GA3值和ABA/IAA值的影响显著,可见较高的ZT/GA3值、ZT/IAA值、ABA/GA3值和ABA/IAA值有利于花芽诱导。
3 讨论与结论
花芽形成是杜鹃成花的先决条件,是植物生长调节剂调控公园绿化杜鹃花期措施中的首要环节。CCC和B9既是生长抑制剂也是赤霉素合成抑制剂,在果树和花卉生产中主要用于控制新梢生长、促进花芽形成及提高开花数等[10]。有研究发现,2 000 mg/L CCC、B9能够显著缩短杜鹃春梢长度、增加花芽数量[11]。本研究发现,CCC、B9处理均可不同程度地促进杜鹃花芽提前形成,提高花芽形成率,增加花原基数量,其中以2 000 mg/L CCC处理最佳,花芽形成率显著提高15.73百分点,花芽形成所需时间缩短27.83 d。
植物光合作用依赖叶绿素a、叶绿素b和类胡萝卜素等光合色素捕捉光能,叶片中叶绿素含量升高有利于叶片捕捉更多的光子,以供光反应需要,从而提高植株光合作用强度[12]。研究发现,杜鹃在花芽形成前,叶绿素含量升高[12]。本研究发现,外施CCC能提高杜鹃叶绿素含量,增强叶片对光能地捕捉能力。内源激素参与调控植物营养生长和生殖生长的多个过程,其中GAS刺激植株顶端分生组织细胞延长,IAA参与调动植株营养物质的向上供应,GAS促进顶端分生组织中IAA含量增加,二者相互促进植株营养生长[7]。此外,植株花芽形成并不取决于单一的某个激素,而是与各激素平衡密切相关[13-14]。研究发现,喷施PP333、CCC和B9等生长抑制剂可抑制植株内源赤霉素(GAs)的生物合成,其中CCC主要是通过抑制GAs合成前体物质内根-古巴焦磷酸合成酶(CPS)和内根-贝壳杉烯合成酶(KS)的活性,进而抑制GAs的生物合成;B9不仅抑制GAs合成途径中KS和GA20氧化酶(GA20ox)的活性,还抑制IAA合成前体物质色氨酸的代谢[15-16]。山茶花、夏黑葡萄、苹果和杧果等木本植物喷施生长抑制剂后,内源激素GA3、IAA含量降低,ABA和ZT含量及ZT/GA3的值提高,且较高的ZT/GA3有利于花芽形成[17-20]。生长抑制剂PP333、CCC和B9处理是通过降低杜鹃顶芽GAs、IAA水平,进而诱导花芽形成[21]。本研究结果表明,与对照相比,喷施CCC后杜鹃叶片可溶性糖、淀粉、可溶性蛋白及ZT含量显著升高,GA3、IAA含量显著降低,使得ZT/GA3、ZT/IAA、ABA/GA3和ABA/IAA均显著提高。这与前人在对金花茶[22]、马缨杜鹃[23]成花过程中叶片营养物质变化的研究结果类似。CCC处理增强了叶片对光能的捕捉能力,促进叶片可溶性糖、淀粉及蛋白的积累,诱导杜鹃花芽提早形成;较低的GA3、IAA含量及较高的ZT/GA3、ZT/IAA、ABA/GA3、ABA/IAA有利于诱导花芽形成。但本研究仅从杜鹃花芽内外部形态变化和生理水平进行考察,而CCC调控花芽形成的分子机制有待进一步探究。
喷施不同浓度植物生长抑制剂CCC和B9均可诱导杜鹃花芽提前形成。其中,在谢花后30 d,每隔7 d喷施2 000 mg/L CCC、喷施3次处理诱导杜鹃花芽形成和增加花芽数量的效果最佳。
参考文献:
[1] 徐 忠,张春英. 上海杜鹃花栽培及应用[M]. 北京:中国林业出版社,2014:192.
[2]潘远智. 园林花卉学[M]. 重庆:重庆大学出版社,2021:428.
[3]韦三立. 观赏植物花期控制[M]. 北京:中国农业出版社,1999:322.
[4]何生根. 植物生长调节剂在观赏植物上的应用[M]. 3版. 北京:化学工业出版社,2019:23-44.
[5]Chandel A,Thakur M,Singh G,et al. Flower regulation in floriculture:an agronomic concept and commercial use[J]. J Plant Growth Regul,2023,42(4):2136-2161.
[6]王三根. 植物生长调节剂在林果生产中的应用[M]. 北京:金盾出版社,2003:166.
[7]Tejeda-Sartorius O,Soto-Hernandes R M,San Miguel-Chávez R,et al. Endogenous hormone profile and sugars display differential distribution in leaves and pseudobulbs of Laelia anceps plants induced and non-induced to flowering by exogenous gibberellic acid[J]. Plants,2022,11(7):845.
[8]Christiaens A,Pauwels E,Gobin B,et al. Flower differentiation of azalea depends on genotype and not on the use of plant growth regulators[J]. Plant Growth Regul,2015,75(1):245-252.
[9]王学奎. 植物生理生化实验原理与技术[M]. 3版. 北京:高等教育出版社,2015:171-187.
[10] 毛景英,闫振领. 植物生长调节剂调控原理与实用技术[M]. 北京:中国农业出版社,2005:565.
[11]Marosz A,Amrosz I,MatysiakA B,et al. Influence of growth retardants on growth and flower bud formation in rhododendron and azalea[J]. Dendrobiology,2005,54(1):35-40.
[12]黄元森,杨虚杰. 光合作用机理的寻觅者[M]. 济南:山东科学技术出版社,2004:217.
[13]Chakraborty A,Chaudhury R,Dutta S,et al. Role of metabolites in flower development and discovery of compounds controlling flowering time[J]. Plant Physiol Bioch,2022,190(2):109-118.
[14]Guo Y Y,An L Z,Yu H Y,et al. Endogenous hormones and biochemical changes during flower development and florescence in the buds and leaves of Lycium ruthenicum Murr[J]. Forests,2022,13(5):763.
[15]Xia Y,Xue B G,Shi M,et al. Comparative transcriptome analysis of flower bud transition and functional characterization of EjAGL17 involved in regulating floral initiation in loquat[J]. PLoS One,2020,15(10):239-382.
[16]Nishijima T. Use of plant growth regulators for floriculture in Japan[J]. Sci Hortic,2023,309(5):111630.
[17]Wei X J,Wu S Y,Liang X J,et al. Paclobutrazol modulates endogenous level of phytohormones in inducing early flowering in Camellia tamdaoensis hakoda et ninh,a golden Camellia Species[J]. HortScience,2021,56(10):1258-1262.
[18]韩佳宇,林 玲,曹雄军,等. 摘心与矮壮素处理对“夏黑”葡萄枝条内源激素及生长的影响[J]. 中国南方果树,2021,50(5):116-118,123.
[19]梁 飞,许文天,武红霞,等. 赤霉素生物合成抑制剂促进杧果成花的作用和对顶芽代谢谱的影响[J]. 果树学报,2022,39(6):957-969.
[20]Fan S,Zhang D,Gao C,et al. Mediation of flower induction by gibberellin and its inhibitor paclobutrazol:mRNA and miRNA integration comprises complex regulatory cross-talk in apple[J]. Plant Cell Physiol,2018,11(59):2288-2307.
[21]Meijón M,Caal M J,Valledor L,et al. Epigenetic and physiological effects of gibberellin inhibitors and chemical pruners on the floral transition of azalea[J]. Physiol Plantarum,2011,141(3):276-288.
[22]崔 佳. 四季金花茶和金花茶成花诱导差异的分子机制探究[D]. 南宁:广西大学,2022.
[23]Zhang L,Song J,Peng L C,et al. Comprehensive biochemical,physiological,and transcriptomic analyses provide insights into floral bud dormancy in Rhododendron delavayi Franch[J]. Front Genet,2022,13(1):856922.
收稿日期:2023-06-20
基金项目:福建农林大学横向科技创新基金(编号:102-KHF200005);福建农林大学科技创新专项基金(编号:CXZX2018087);福建省花卉苗木品种引进与研发创新项目(编号:H2014015)。
作者简介:罗培润(1997—),女,福建三明人,硕士研究生,主要从事花卉生理生化研究。E-mail:675692537@qq.com。
通信作者:陈清西,博士,教授,主要从事园艺植物栽培生理研究。E-mail:cqx0246@163.com。

