娄彻氏链霉菌HM85 的鉴定及其对甜菜的防病促生作用
杨智敏 张慧豪 张园园 杜红岩 刘晓东 侯亚光 王毅 徐道龙 黄金贵 程晓宁 随洋 王瑞利 于超 赵玲玲 陈春梅 雅茹 贾丽 张明月 王宏伟 姚淞耀 赵莹 邵科

摘要:由甜菜尾孢菌(Cercospora beticola)引起的甜菜褐斑病是一种广泛发生、危害严重的真菌性病害,严重制约了我国糖料产业的发展。为挖掘对甜菜褐斑病具有生防应用潜力的拮抗菌株,从内蒙古自治区呼伦贝尔黑土地采集甜菜健康植株根际土壤样本,通过梯度稀释平板法和对峙培养法进行分离、纯化、筛选,获得1株具有良好拮抗效果的菌株HM85。基于其形态学特征和生理生化特征,结合16S rRNA基因序列分析将菌株HM85鉴定为娄彻氏链霉菌(Streptomyces rochei)。平板对峙试验结果显示,菌株HM85对甜菜尾孢菌HB2-2-2菌株的生长有明显抑制作用,抑菌率为58.68%。盆栽试验结果表明,HM85在防治甜菜褐斑病的同时对甜菜植株具有一定的促生作用,株高、株鲜重、根长、根鲜重和根直径与对照组相比分别增加22.73%、20.47%、36.10%、32.52%和75.03%。由此可见,娄彻氏链霉菌HM85具有作为促生菌剂和生防菌剂的研发潜力。
关键词:娄彻氏链霉菌;甜菜尾孢菌;甜菜褐斑病;拮抗活性;促生作用
doi:10.13304/j.nykjdb.2024.0144
中图分类号:S182 文献标志码:A 文章编号:10080864(2024)05014808
食糖被列为国家的重要战略储备,对我国经济发展和人民生活有着非常重要的意义。甜菜(Beta vulgaris L.)作为主要糖料作物之一,其产糖量约占世界年产糖量的25%[1]。甜菜褐斑病(Cercospora leaf spots,CLS)是由甜菜尾孢菌(Cercospora beticola Sacc.)引起的叶部病害,在世界范围内最具破坏性,影响1/3以上的甜菜种植区[23]。该病在我国东北、华北和西北三大甜菜产区发病普遍,每年均有不同程度的发生,一般可使块根减产15%~20%,含糖率下降0.8~2.0 个百分点,叶茎损失40%~70%[45];病情指数每增加1个单位,根重减少1.3 g,含糖率降低0.046个百分点[6]。
甜菜褐斑病发病初期叶片呈现褐色或紫色小圆斑,随后斑点逐渐扩大,直径达2~5 mm,斑点周围呈褐色。后期病斑中央呈现灰白色霉层,即病菌的分生孢子和分生孢子梗。病斑因发病程度、叶片大小而不同,每片病叶上病斑可达数十个至上千个,病斑连片后,叶片干枯死亡。一般褐斑病先侵染外层生理成熟的叶片,逐渐向中层叶片发展,发病重的外层、中层叶片陆续枯死,影响甜菜的光合作用和养分输送,导致植株生长势衰弱、甜菜块根产量下降、含糖量降低、块根中灰分和有害氮增加、原料产量和质量下降[7] 。
在甜菜种植中,除了选用抗病品种、合理轮作外,褐斑病治以化学防治为主。但化学杀菌剂的长期不合理使用不仅引起环境污染、食品药物残留、非靶标生物毒害等问题,还导致病原菌的选择压力和抗药性增强[8-10]。生物防治是植物病害综合防治的重要措施,可通过有益微生物及其代谢产物调节微生态、直接或间接抑制病原菌生长繁殖等途径达到控制病害的目的,具有环境友好、高效无污染、改善土壤微生态等优点。近年来,利用拮抗菌防治褐斑病的研究越来越被关注。研究发现,多粘芽孢杆菌(Paenibacillus polymyxa)对甜菜褐斑病有抑制作用[7];青霉对尾孢菌(Cercosporabeticola)有抑制作用,其抑制作用与粘合剂水平有关[11];解淀粉芽孢杆菌(Bacillus amyloliquefaciens)TL6对花生褐斑病具有较好的防治效果,其发酵液原液对花生褐斑病防治效果为69.17%[12]。放线菌资源丰富,在土壤中分布广泛,多数可产生抗菌物质,其中链霉菌属及其相似类菌群是植物病害生物防治中最主要的资源。链霉菌是产生抗生素的主要来源,约80%的抗生素应用在农业生产上。链霉菌制成的菌剂已有多种被应用于农业生产,如链霉素、井岗霉素、农抗120、多效霉素、S-921等。放线菌对多种植物病原菌有拮抗作用,如葡萄孢菌、杨树腐烂病菌、灰霉病菌以及白菜软腐病菌等[13]。目前,关于放线菌防治甜菜褐斑病的研究较少,挖掘、筛选和利用拮抗放线菌对甜菜褐斑病进行生物防治具有重要意义。本研究从内蒙古呼伦贝尔黑土地采集甜菜健康植株根际土样,从中分离筛选对甜菜褐斑病病原菌具有拮抗作用的放线菌,旨在为甜菜褐斑病的生物防治奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试甜菜
试验所用甜菜品种为KWS2314,种子由内蒙古敕勒川糖业有限责任公司提供。其属于丰产偏高糖品种,抗病性居于中等水平,为内蒙古产区主栽品种之一。
1.1.2 供试土样
2021年9月,在内蒙古自治区呼伦贝尔甜菜生产田采集甜菜根际土样品2份。每份样本随机选择5株健康甜菜植株,小心用铁锹将植株挖起,使劲摇晃,除去大颗粒土壤。将附着在根上1~5 mm的土壤用无菌滤纸条充分刮取,装于无菌自封袋内,-80 ℃保藏[14]。
1.1.3 供试病原菌
甜菜褐斑病病原菌甜菜生尾孢(Cercospora beticola)HB2-2-2 菌株由河南农业大学植物病害生物防治研究室分离、鉴定和保存。
1.1.4 供试培养基
高氏1号培养基(1 L):淀粉20.0 g、KNO3 1.0 g、Na2HPO4 0.5 g、MgSO4·7H2O0.5 g,NaCl 0.5 g、FeSO4·4H2O 0.01 g、琼脂18.0 g,121 ℃,1×105 Pa高压蒸汽灭菌20 min。PDA培养基(1 L):马铃薯 200.0 g、葡萄糖 20.0 g,琼脂18.0 g。淀粉水解培养基(1 L):可溶性淀粉 10.0 g、NaCl0.5 g、MgCO3 1.0 g、K2HPO4 0.3 g、KNO3 1.0 g,pH调至7.2,琼脂20 g。明胶液化培养基(1 L):明胶200.0 g、葡萄糖 20.0 g、蛋白胨5.0 g,pH调至7.2。牛奶凝固与胨化培养基(1 L):脱脂牛奶1 000 g、CaCO3 0.02 g。纤维素水解培养基(1 L):MgSO4·7H2O 0.5 g、K2HPO4 0.5 g、NaCl 0.5 g、KNO31.0 g,pH调至7.2。碳源利用培养基(1 L):(NH4)2SO42.64 g、K2HPO4 0.5 g、KH2PO4 0.5 g、MgSO4·7H2O0.5 g、CuSO4·5H2O 0.006 4 g、 FeSO4·7H2O 0.001 g、MnCl2·4H2O 0.001 g、ZnSO4·7H2O 0.001 g,pH 调至7.2,琼脂15 g。氮源利用培养基(1 L):葡萄糖10.0 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、FeSO4·7H2O0.01 g、KH2PO4 0.1 g,pH调至7.2,琼脂15.0 g。所需试剂均购自天津市铠通化学试剂有限公司。
1.2 试验方法
1.2.1 土样预处理
采集的土壤样品室温自然风干2~3 d后,称取土壤2 g置于装有18 mL灭菌生理盐水的锥形瓶中,放置在摇床150 r·min-1震荡2 h,保存备用。
1.2.2 菌株分离
取预处理土壤悬液1 mL加入9 mL灭菌生理盐水中,依次进行梯度稀释。分别吸取200 μL稀释度10-3和10-4的土壤悬液到分离培养基高氏1号培养基平板上,每个稀释度设置3个重复,用无菌涂布棒均匀涂布,置于生化培养箱(宁波莱福科技有限公司)28 ℃倒置培养。培养5~7 d后,观察菌落生长情况,用接种环挑选单菌落至高氏1号培养皿上纯化培养,并根据菌落形态特征对分离得到的放线菌菌株去重,加入25%(体积分数)甘油在-80 ℃保存备用[15]。
1.2.3 拮抗菌株初筛
以甜菜褐斑病病原菌为靶标菌进行拮抗菌株的筛选。用接种针挑取甜菜生尾孢HB2-2-2菌饼(直径5 mm)置于PDA 平板中央,在其四周 3.0 cm处划线接种不同放线菌纯培养,以单独接种靶标菌为空白对照,在28 ℃培养箱中倒置培养。培养7~10 d后(空白对照菌落直径长至培养皿约3/4处,但未长满),拍照并记录具有拮抗活性的菌株。
1.2.4 拮抗菌株的复筛
根据初筛结果,选择对靶标菌有抑制作用的菌株进行复筛试验。以甜菜生尾孢菌为靶标菌,在距靶标菌(直径5 mm)3.0 cm 处用接种环划线接种初筛中有拮抗活性的菌株,以仅接种靶标菌为空白对照,每个处理设置3个重复。倒置培养7~10 d后,统计菌丝直径并计算菌丝生长抑制率(公式1),从中挑出抑菌效果最佳的菌株进行下一步研究。
1.2.5 形态特征观察
将筛选出的放线菌HM85划线接种于新鲜的高氏1号培养基上,28 ℃倒置培养48 h,拍照并记录生防菌的菌落形状、颜色及边缘形态等特征。
1.2.6 生理生化特性测定
参考《常见细菌系统鉴定手册》[15]中描述的方法对菌株 HM85的碳源和氮源利用、分解纤维素、明胶液化以及产H2S能力等特性进行测定。
1.2.7 16S rRNA基因序列分析
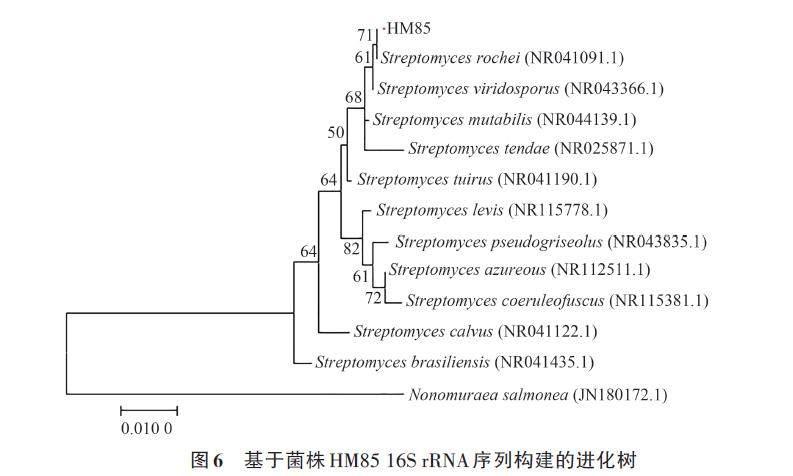
采用CTAB法[15]提取放线菌基因组DNA,利用引物243F(5'-GGATGAGCCCGCGGCCTA-3') 和A3R (5'-CCAGCCCCACCTTCGAC-3')扩增16S rRNA 基因。PCR反应体系:2×PCR mix 12.5 μL,243F/A3R引物各1.0 μL,DNA模板1.0 μL,无菌水9.5 μL。扩增程序:95 ℃ 5 min;94 ℃ 1 min,59 ℃ 30 s,72 ℃1.5 min,35个循环; 72 ℃延伸10 min。将扩增得到的PCR产物用1 %的琼脂糖凝胶电泳进行特异性检测,并送往生工生物工程(上海)股份有限公司进行测序。将获得的序列在NCBI数据库(https://www.ncbi. nlm. nih. gov/)进行BLAST 比对分析。用MEGA7 软件采用极大似然法(maximum likelihood)重复1 000次进行聚类分析并构建系统进化树。
1.2.8 拮抗菌株HM85对甜菜促生效果测定
用无菌土种植甜菜种子,在25 ℃、光照强度为600 lx的温室日夜交替培养30 d(每天黑暗培养8 h,光照培养16 h),在甜菜幼苗第4片叶时,将不同处理的菌液或培养基灌根接种至甜菜根部。处理组A:每株先接种拮抗菌株HM85发酵液15 mL,待24 h 后接种病原菌甜菜生尾孢HB2-2-2 孢子液15 mL(取甜菜生尾孢在PDA平板上生长的菌饼于PDB培养基中180 r·min-1、28 ℃培养7 d,3层滤纸过滤后用血球计数板计数孢子含量,调整孢子含量为1×106 cell·mL-1)。处理组B:每株同时接种灭菌的高氏1号液体培养基和病原菌甜菜生尾孢HB2-2-2孢子液各15 mL。对照组:每株加入灭150菌的高氏1号液体培养基和PDA培养基各15 mL灌根。处理后的甜菜苗在温室中培养,30 d后调查统计株高、根长、根直径、鲜重等生理指标。试验重复3次,每处理8株甜菜苗。
促生效率=(A-B)/B×100% (2)
式中,A 和B 分别为处理组A和处理组B的株高、鲜重和根长等性状。
1.2.9 数据统计和分析
使用Excel进行数据统计和整理,GraphPad Prism8.0.2绘制柱状图,使用IBM SPASS Statistics 26软件进行数据分析,采用单因素ANOVA检验对数据进行差异显著性分析。
2 结果与分析
2.1 拮抗菌株的筛选结果
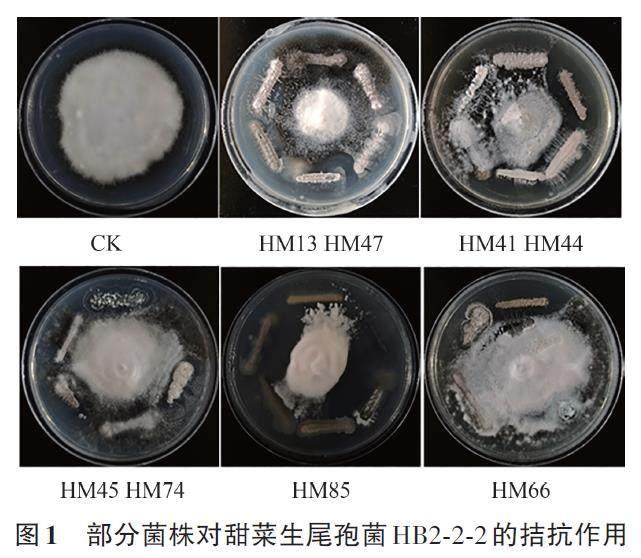
用高氏1号培养基对采集的甜菜根际土样放线菌进行分离、培养,纯化,得到43株放线菌分离物。通过平板对峙法对分离获得的放线菌株进行筛选,获得8株对甜菜褐斑病病原菌甜菜生尾孢HB2-2-2具有抑制效果的拮抗菌株,分别为HM13、HM41、HM44、HM47、HM45、HM66、HM74 和HM85(图1)。
复筛结果(图2和表1)表明,供试的8株放线菌对甜菜褐斑病病原菌菌丝生长的抑菌半径为(0.71±0.03)~(2.37±0.06)cm,抑菌率为(17.56%±0.70%)~(58.68%±1.60%),其中,菌株HM85对甜菜褐斑病病原菌菌丝生长抑制作用最强,抑菌半径为(2.37±0.06) cm,抑菌率为(58.68%±1.60%)。因此,选定菌株HM85进行后续研究。
2.2 菌株HM85 对甜菜的防病促生作用
盆栽实验结果(图3)表明,与空白对照组相比,仅接种甜菜生尾孢菌HB2-2-2孢子液的甜菜植株出现生长势衰弱、叶片发黄等症状,株高、株鲜重、根鲜重、根直径分别降低17.27%、9.83%、14.35%和8.02%。而先接种HM85发酵液再接种HB2-2-2孢子液的甜菜植株长势良好,同时叶片呈绿色无发黄症状。
如图4所示,加入生防菌株HM85发酵液的处理组与仅接种病原菌的甜菜植株相比,根长无显著性差异,但株高、根鲜重、根直径及地上部分鲜重等生理指标显著提高,对不同指标的促生效率从20.47%~75.03%不等,其中对根直径的促生效率最为明显,为75.03%(表2)。表明菌株HM85在防治甜菜褐斑病的同时对植株有一定的促生作用。
2.3 菌株HM85 的分类鉴定结果
2.3.1 菌株HM85的形态学特征
菌株HM85在高氏1号培养基上的形态特征如图5所示,气生菌丝颜色为牡蛎白,基内菌丝颜色为黑色。
2.3.2 菌株HM85的生理生化性质分析
从表3可以看出,菌株HM85 能够利用木糖、棉子糖、L-阿拉伯糖、L-鼠李糖、果糖、葡萄糖、甘露醇、水杨苷作为单一碳源生长,不能利用蔗糖、肌醇作为单一碳源生长,能使牛奶凝固与胨化,能使明胶液化,可以产H2S和黑色素,能使淀粉水解,能够分解纤维素。
2.3.3 菌株HM85 的分子生物学鉴定
菌株HM85的16S rRNA 基因序列比对结果(图6)显示,菌株HM85与供试链霉菌的同源性为99.72%~98.45%。其中,与娄彻氏链霉菌S. roche(VITLG012)的同源性最高(99.72 %),说明二者的亲缘关系最近;基于16S rRNA构建的系统进化树也显示其与娄彻氏链霉菌(S. roche)(VITLG012)聚为同一分支,结合形态特征和生理生化特性等结果,将菌株HM85鉴定为娄彻氏链霉。
3 讨论
甜菜褐斑病的流行严重影响着甜菜块根产量、含糖率、灰分和有害氮含量,导致原料产量和质量下降,影响甜菜糖的加工效率与质量。同时,尾孢菌不仅为甜菜褐斑病发生的主要病原菌,还是大豆、玉米等粮食作物病害发生的主要病原。已有研究表明,玉蜀尾胞菌(Cercosporazeaemaydis)、大豆尾孢菌(Cercospora sojina)等是引起玉米和大豆灰斑病和褐斑病的重要病原菌[16-18]。因此,本研究结果在丰富甜菜褐斑病生防优质菌种资源的同时,为其他植物与粮食作物相关病害的防治防控研究提供了重要参考。
放线菌是植物病害生物防治的重要微生物资源。其中,链霉菌产生的抗生素广泛应用于医疗与制药领域,是放线菌门中最为庞大且极富物种多样性的分支。链霉菌经过多年来系统深入研究,在系统分类学、多样性以及天然产物资源勘探与应用等领域都取得了巨大进展。弗氏链霉菌(S. fradiae) [19]、黄麻链霉菌(S. corchorusii) [20]、毒三素链霉菌(S. toxytricini)[21]等被用于作物枯萎病的防治;疮痂链霉菌(S. scabiei)和藤黄灰链霉菌(S.luteogriseus)可以防治花生白绢病等[22]。本研究从内蒙古自治区呼伦贝尔黑土地甜菜根际土壤分离得到43株可培养放线菌,从中筛选出8株对甜菜褐斑病病原菌具有拮抗作用的菌株,其中,最具生防应用潜力的菌株HM85 鉴定为娄彻氏链霉菌(S. roche)。
前期研究发现,娄彻氏链霉菌(S. roche)XL-6无菌发酵液显著降低茄子青枯病发病率和病情指数[23];苹果内生娄彻氏链霉菌A-m1发酵滤液对葡萄座腔菌(Botryosphaeria dothidea)、苹果拟茎点霉(Phomopsis mali)、胶孢炭疽菌(Colletotrichumgloeosporioides)等病原菌表现出抑菌作用[24]。HM85对峙培养试验结果显示,该菌对甜菜生尾孢菌的生长有较强抑制作用,并且在防褐斑病的同时对甜菜有一定的促生作用。由此可见,娄彻氏链霉菌HM85具有良好的研发和应用潜力,围绕该菌对甜菜褐斑病的生防机理还有待进一步探究。
参考文献
[1] KHAN M F R. Success and limitations of using fungicides tocontrol cercospora leaf spot on sugar beet [J/OL]. Agric. Res.Technol. Open Access. J., 2018,14(2): 555909 [2024-04-03].https://doi.org/10.19080/ARTOAJ.2018.14.555909.
[2] TAN W B, LI K X,LIU D L, et al ..Cercospora leaf spot diseaseof sugar beet [J/OL].Plant Signal. Behav., 2023,18(1): 2214765[2024-04-02]. https://doi.org/10.1080/15592324.2023.2214765.
[3] 邹锋康, 丁广洲, 贾海伦, 等. 甜菜褐斑病及种质资源抗性研究进展[J]. 中国糖料, 2019, 41(4):63-69.
ZOU F K, DING G Z, JIA H L, et al .. Research progress on leafspot disease (Cerecospora beticola Sacc.) and germplasmresistance of sugar beet [J]. Sugar Crops oChina, 2019, 41(4):63-69.
[4] 林杰, 刘梅, 吴学宏, 等. 甜菜褐斑病菌三种分子检测方法的比较[C]//中国植物病理学会,中国植物病理学会2010年学术年会论文集.中国农业科学技术出版社,2010:164.
[5] 王录红,周翔,李王胜,等.甜菜褐斑病菌分离培养及病程分子鉴定[J].中国糖料, 2022,44(1):60-63.
WANG L H, ZHOU X, LI W S, et al .. Isolation of cercosporabeticola and molecular identification of sugar beet leaf spotcourse [J]. Sugar Crops China, 2022,44(1):60-63.
[6] 乔志文.高抗褐斑病性和含糖率甜菜品种田间鉴定[J].中国农学通报, 2019,35(7):123-127.
QIAO Z W. Identification of sugar beet varieties with highresistance to cercospora leaf spot and high sugar content infield [J]. Chin. Agric. Sci. Bull., 2019,35(7):123-127.
[7] 史应武,娄恺,李春,等.甜菜褐斑病内生拮抗菌的筛选、鉴定及其防效测定[J].植物病理学报, 2009,39(2):221-224.
[8] BUDAKOV D, NAGL N, STOJSIN V, et al .. Sensitivity ofcercospora beticola isolates from serbia to carbendazim andflutriafol [J]. Crop Protection, 2014, 66: 120-126.
[9] TRKULJA N R, MILOSAVLJEVIC A G, MITROVIC M S,et al .. Molecular and experimental evidence of multi-resistanceof Cercospora beticola field populations to MBC, DMI and QoIfungicides [J]. Eur. J. Plant Pathol., 2017, 149: 895-910.
[10] 林杰,刘梅,吴学宏,等.甜菜褐斑病菌抗药性分子机理研究进展[J].中国糖料, 2012 (4): 60-64.
LIN J, LIU M, WU X H, et al .. Progress in fungicide resistancemolecular mechanisms of beet leaf spot disease [J]. SugarCrops China, 2012 (4): 60-64.
[11] EL-FAWY M M, EL-SHARKAWY R M I, ABO-ELUOUSR KA M. Evaluation of certain Penicillium frequentans isolatesagainst cercospora leaf spot disease of sugar beet [J]. Egy. J.Biol. Pest Control, 2018, 28: 1-7.
[12] 张海东,刘晓舟,梁春浩,等.花生褐斑病生防菌筛选及田间防效评价[J].花生学报, 2023,52(3):42-47.
ZHANG H D, LIU X Z, LIANG C H, et al .. Screening ofbiocontrol agents against peanut early leaf spot and evaluationof its field control effect [J]. J. Peanut Sci., 2023,52(3):42-47.
[13] 钟伏付,苏娜,杨廷宪,等.魔芋品种选育与改良研究进展[J].湖北农业科学, 2011, 50(3): 446-449.
ZHONG F F, SU N, YANG Y X, et al .. Advances in varietybreeding of Amorphophallus konjac [J]. Hubei Agric. Sci., 2011,50(3): 446-449.
[14] LEI S N, XU X H, CHENG Z Q, et al .. Analysis of thecommunity composition and bacterial diversity of therhizosphere microbiome across different plant taxa [J/OL].Microbiologyopen, 2019, 8(6): e00762 [2024-04-02]. https://doi.org/10.1002/mbo3.762.
[15] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:1-419.
[16] 徐秀德,董怀玉,姜钰,等.玉米灰斑病抗性鉴定技术[J].植物保护学报,2003(2):129-132.
XU X D, DONG H Y, JIANG Y, et al .. The technique foridentification of resistance to gray leaf spot on maize [J]. J.Plant Protect., 2003(2):129-132.
[17] 钟兆西,王伟,张桂荣.大豆灰斑病菌(Cercospora sojina)生物学特性的研究[J].大豆科学,1989(3):288-294.
ZHING Z X, WANG W, ZHANG G R. Study on the biologicalcharacteristics of Cercospora sojina [J]. Soybean Sci., 1989(3):288-294.
[18] 张海涛,殷丽华,柯希望,等.绿豆叶斑病菌分生孢子的产生和萌发条件研究[J]. 农学学报,2016,6(10):78-82
ZHANG H T, YIN L H, KE X W, et al .. Conidia productionand germination conditions of mung bean leaf spot pathogen [J]. J.Agric., 2016,6(10):78-72.
[19] 刘秋,齐小辉,闫建芳,等.瓜类枯萎病拮抗放线菌 H628 的鉴定[J].沈阳农业大学学报, 2008(2): 178-181.
LIU Q, QI X H, YAN J F, et al .. Identification of actinomycesH628 against Fusarium oxysporum f. sp. cucumerinum [J]. J.Shenyang Agric. Univ., 2008(2): 178-181.
[20] 燕照玲,孙虎,施艳,等.黄瓜枯萎病拮抗放线菌 S24 的分离、鉴定及发酵条件优化[J]. 河南农业科学, 2014, 43(9): 88-92, 100.
YAN Z L, SUN H, SHI Y, et al .. Isolation,identification andfermenting condition optimization of antagonistic actinomycetesS24 against Fusarisum oxysporum f.sp. cucumebrium [J]. HenanAgric. Sci., 2014, 43(9): 88-92,100.
[21] 刘金秀,马正,申屠旭萍,等.黄瓜枯萎病拮抗放线菌筛选及其生防作用鉴定[J]. 园艺学报, 2012, 39(6): 1123-1130.
LIU J X, MA Z, SHEN T X P, et al .. Isolation andidentification of antagonistic actinomycetes and theirapplication in the biocontrol of Fusarium oxysporum f. sp.cucumerinum [J]. Acta Hortic. Sin., 2012, 39(6): 1123-1130.
[22] 职永玺, 何海荣, 周琳, 等. 防控花生白绢病的根际放线菌分离鉴定及防效评价[J]. 农药学学报, 2023, 26(1): 101-113.
GNEG Y X, HE H R, ZHOU L, et al .. Isolation, identificationand evaluation of rhizosphere actinomycetes for control ofpeanut southern blight [J]. Chin. J. Pestic. Sci., 2023, 26(1):101-113.
[23] 李威,肖熙鸥,李可,等.娄彻氏链霉菌 XL-6 的抑菌活性及对茄子幼苗的防病促生效应[J].中国生物防治学报, 2017, 33(4):531-536.
LI W, XIAO X O, LI K, et al .. The antibiotic activity offermentation broth produced from streptomyces rochei XL-6and its influence on bacterial wilt control and plant growth ineggplant seedling [J]. Chin. J. Biol. Control, 2017, 33(4):531-536.
[24] 李永丽,王亚红,周洲,等.新疆野苹果内生娄彻氏链霉菌 Am1的鉴定和发酵条件优化及抑菌广谱作用[J].林业科学,2020, 56(7): 70-81.
LI Y L, WANG Y H, ZHOU Z, et al .. Identification andoptimization of fermentation conditions and antibacterialactivity of endophytic Streptomyces rochei A-m1 from thebranch of Malus sieversii [J]. Forestry Sci., 2020, 56(7): 70-81.
(责任编辑:温小杰)
基金项目:内蒙古自治区科技计划项目(2020GG0271);国家糖料产业技术体系建设项目(CARS-170725);内蒙古自治区“ 揭榜挂帅”项目(2022JBGS0029); 内蒙古自治区科技成果转化专项资金项目(2021CG0042)。

