菌糠水提液对马铃薯致病疫霉的抑制机理
莫雯婧 陈洪森 桂芳泽 洪慈清 蔡鑫铠 关雄 潘晓鸿
摘要:菌糠是菌菇生产后残留的物质,含有丰富的无机盐和有机质等成分。利用热水浸提法制备香菇菌糠水提液(water extract from spent mushroom substrate,WESMS),通过紫外分光光度计和Zeta电位及粒径仪对其紫外吸收情况、表面电荷和水中分散粒径进行表征,采用平板渗透法及十字交叉测量直径法计算WESMS对致病疫霉的抑制率,利用光学显微镜和扫描电镜观察病原菌细胞形态的损伤程度,并采用琼脂糖凝胶电泳法分析WESMS 对致病疫霉 DNA 的影响。结果表明,WESMS 在紫外线A(UVA,315~400 nm)、B(UVB,280~315 nm)和C(UVC,100~280 nm)波段均有吸收,在水中的分散粒径为3 649.27 nm。抑菌试验表明,WESMS对病原菌的生长具有抑制作用,随着提取液体积百分浓度的增加,抑制效果更明显,在高体积百分浓度(6.25%WESMS)作用下对病原菌的抑制率近100%。经WESMS处理后病原菌的菌丝更加扭曲、扁平,且褶皱明显增多,表明WESMS可对细胞造成明显破坏;WESMS处理组的DNA条带亮度暗于对照组,损伤程度与WESMS体积百分浓度呈正相关。研究结果为菌糠的资源化利用及其对马铃薯晚疫病的有效防治提供科学依据和技术支撑。
关键词:香菇菌糠;马铃薯晚疫病;致病疫霉;抗菌机理
doi:10.13304/j.nykjdb.2023.0159
中图分类号:S435.32;X712 文献标志码:A 文章编号:10080864(2024)05012909
随着马铃薯主粮化战略的开展,马铃薯成为我国四大主粮作物之一,马铃薯产业也在保障我国粮食安全、保护生态环境稳定等方面发挥着重要作用[1]。根据联合国粮农组织(Food andAgriculture Organization,FAO,https://www.fao.org/home/en)2022年的数据,全世界种植马铃薯的国家和地区有158个,种植面积1 920.50万hm2,总产量达3.85 亿t,平均单产20.10 t·hm-2。我国马铃薯种植面积和总产量均居世界第1位,但单产水平与发达国家仍存在差距[2]。由致病疫霉(Phytophthora infestans)引起的马铃薯晚疫病是马铃薯生产中最具毁灭性的病害之一,具有发生范围广、流行速度快、危害损失重、防治难度大的特点[3]。该病常发生于10~25 ℃的温度范围内,故在秋冬季发生率较高,被感染的叶缘及叶尖表面可见颜色为绿褐色、类似于水渍的斑点,斑点周边可见浅绿色晕圈,如果环境湿度过高,斑点颜色为褐色,表面覆盖有白色霉层[4]。目前,该病害大部分通过化学试剂来防治,如烯酰吗啉和嘧菌酯等化学农药[56],而化学试剂会引发一系列的环境以及人体安全健康等问题,所以寻找绿色环保的新型抗菌材料成为安全、有效地降低该病害发生的关键手段。
香菇菌糠(spent mushroom substrate,SMS)是香菇生产过程中残留下来的基质,研究表明,每生产1 kg菌菇将产生5 kg菌糠[7]。我国是世界上最大的菌类农产品生产国和消费国,每年平均产生约1 320万t的菌糠[8]。由于菌糠含有丰富的氮和磷等营养成分,未经处理直接丢弃于环境中会造成严重的地下水体污染[9],因此寻找廉价可靠的方法对菌糠进行资源化利用具有重要的研究意义。当前,菌糠主要应用于饲料添加剂、植物肥料、能源供应、污染物处理、二次培养与发酵以及植物病害防控等方面[10-15]。研究发现,香菇菌糠作为堆肥基质能有效降低黄瓜炭疽病的发病程度[16],其水提液对辣椒疫霉菌(Phytophthora)也具有抑制作用[17];杏鲍菇菌糠提取液对灵芝、真姬菇、秀珍菇和平菇菌丝具有抗菌活性,且其对4种食用菌菌丝的生长具有不同程度的抑制作用[18]。以上研究表明,菌糠具有作为新型抗菌材料的潜力,但当前对菌糠提取物的抗菌机理还有待进一步全面深入地分析。
本研究通过干燥、粉碎、过筛等方式将香菇菌糠原料进行预处理,得到菌糠粉末,将用热水浸提获取的菌糠水提液(water extract from spentmushroom substrate,WESMS)作为抗菌材料,利用平板渗透试验来观察抑菌效果,通过十字交叉测量直径法计算平均抑菌率。采用光学显微镜和扫描电镜观察WESMS 对病原菌细胞的损伤程度、通过琼脂糖凝胶电泳法比较对照组与处理组DNA条带损伤情况,以期为菌糠作为农业病原菌抗菌剂提供理论基础和技术支撑。
1 材料与方法
1.1 试验材料
1.1.1 样品采集
香菇菌糠原料取自福建农林大学国家菌草工程技术研究中心,致病疫霉菌由福建农林大学病原菌群体遗传与进化研究国际团队馈赠。
1.1.2 培养基
培养基为黑麦(rye)固体培养基:60 g黑麦用单蒸水冲洗2~3遍,然后用单蒸水浸泡放于4 ℃冰箱过夜,次日倒掉浸泡用水,再用单蒸水清洗1~2遍,用破壁机匀浆3~4 min,研磨到肉眼不见大颗粒。混合液55 ℃水浴2 h,盖上戳洞的保鲜膜。水浴后用4 层纱布过滤,定容至1 L,然后用250 mL锥形瓶分装,加入WESMS,配成体积百分浓度分别为0.00%、0.33%、0.66%、1.64%、3.23%和6.25%的培养基,每100 mL液体培养基中加入2 g琼脂条,高压蒸汽灭菌,制备成固体培养基平板后备用。
1.2 试验方法
1.2.1 香菇菌糠的前处理
将香菇菌糠外包装上的污泥清理干净,脱去外包装,将其揉碎至无较大块状物,放于干燥箱(DH-9070A,上海一恒科学仪器有限公司)60 ℃干燥4~6 d,取出粉碎,过60目筛,得到菌糠粉末,用自封袋密封包装备用。将菌糠粉末与水以1 g∶3 mL的比例混合均匀,高压蒸汽锅(HVE-50,日本三洋公司)121 ℃灭菌20 min,待冷至室温,9 500 r·min-1离心10 min,取出上清液,先用2层滤纸和0.45 μm针式过滤器过滤,再用0.22 μm针式过滤器过滤,装到灭菌的蓝盖瓶中[19]。
1.2.2 WESMS的表征
对香菇菌糠母液进行稀释,超声15 min 后,使用紫外可见吸收光谱仪(UV1800,上海奥析科学仪器有限公司)测定WESMS 在紫外线A(ultraviolet A,UVA)、B(UVB)以及C (UVC)波段的紫外吸收情况,并利用粒度分析仪(Zetasizer Nano ZS90,美国赛默飞公司)测定其在水中的分散粒径大小。
1.2.3 抑菌试验
使用平板渗透的方法来评估WESMS的抑菌效果。将直径为6 mm的菌饼接种至已配制好的含不同WESMS 体积分数(0.00%、0.33%、0.66%、1.64%、3.23% 和6.25%)的平板中央,其中,含0.00% WESMS的平板是加入最大体积百分比浓度等量无菌水的黑麦培养平板,为空白对照(CK),每组3个重复。18 ℃恒温培养,采用十字交叉法分别测量5、7、9 和11 d 的菌丝直径,计算菌落生长距离和抑制率[20]。
菌落净生长距离(mm)=菌落直径-菌饼直径 (1)
菌落生长抑制率=(对照菌落生长距离-处理菌落生长距离)/对照菌落生长距离×100% (2)
1.2.4 光学显微镜观察
取20 μL的无菌水于载玻片上,将培养了一定天数的空白对照组(CK)与处理组的菌丝分别用灭过菌的牙签沿着边缘刮取一小块下来,放于载玻片中摊平,盖上盖玻片于光学显微镜(ECLIPSE E100,日本尼康公司)下观察菌丝形貌。
1.2.5 扫描电镜观察
将空白对照组(CK)与处理组菌落从平板上完整撕取下来,用无菌水清洗,置于2.5% 的戊二醛溶液中,放于4 ℃冰箱固定12 h。用1% OsO4后固定样品1 h;然后,再次使用磷酸盐缓冲液(pH=7.0)洗涤处理样品3次,用一系列体积百分乙醇(30%、50%、70%、80%、90%、95%、100%)脱水15 min。将样品转移到无水乙醇和异戊乙酸(体积比1∶1)的混合物中30 min[21];然后在空气中自然干燥,使用扫描电镜(SU8020,日本日立公司)进行观察。
1.2.6 DNA损伤情况观察。
采用真菌DNA提取试剂盒(Fungal DNA Kit D3390, Omega)提取空白对照组与处理组菌的DNA,通过微量紫外分光光度计(Nano-100,杭州奥盛谱尔科学仪器公司)检测提取DNA 的纯度。以15 kD 的Marker 作为参照,进行琼脂凝胶电泳检测,对比DNA损伤情况。
1.2.7 Zeta 电位测定WESMS 和病原菌表面电荷
将WESMS稀释100倍,超声15 min。将正常生长的马铃薯致病疫霉菌落从平板上完整撕取下来,放于无菌水中重悬一段时间,采用Zeta电位及粒度分析仪(Zetasizer Nano ZS90,美国赛默飞公司)测定WESMS和病原菌表面电荷,并进行比较分析。
1.3 数据统计与分析
抑菌率数据采用Origin 2018[22]和IBM SPSSStatistics 26 软件进行分析,使用单因素ANOVA分析进行显著性检验,P<0.05 代表具有显著性差异。
2 结果与分析
2.1 香菇菌糠水提液获取与表征分析
香菇菌糠原料质地较厚实,带有水分,干燥完成后颜色变浅。粉碎后得到棕褐色粉末,热水浸提、离心、过滤后得到近黑色菌糠水提液(WESMS)(图1A)。将母液进行稀释后,超声15 min,测定其紫外可见光吸收情况,结果显示,其在UVA(315~400 nm)、UVB(280~315 nm)以及UVC(190~280 nm)3个波长范围内都具有紫外吸收(图1B)。将母液稀释100倍后,其分散在水中的粒径平均为3 649.27 nm。
2.2 WESMS 对马铃薯致病疫霉菌的抑制效果
WESMS中含有草酸、水杨酸及其他酚酸类物质,因而可能具有一定的抗菌活性[17 , 2324]。本研究结果表明,WESMS 对病原菌具有较强的抑制作用,且随着WESMS体积百分浓度的增加,菌丝生长范围更加有限,抑制作用更加明显(图2)。表1为不同体积百分浓度的香菇菌糠水提液对马铃薯致病疫霉菌的抑制率结果,在WESMS 体积百分浓度为1.64% 时,抑制率总体上大于50%,当WESMS体积百分浓度达到6.25%时,抑制率接近100%;此外还发现,抑菌率随着培养天数的增加总体上呈现递减的趋势,表明WESMS 对病原菌的生长造成了严重影响。WESMS体积百分浓度越高,向外生长的菌丝数量越少,且培养前期的抑制作用整体上大于培养后期,可能是WESMS 影响了核酸和蛋白质的合成与活性。
2.3 抑菌机理研究分析
2.3.1 显微镜及扫描电镜观察分析
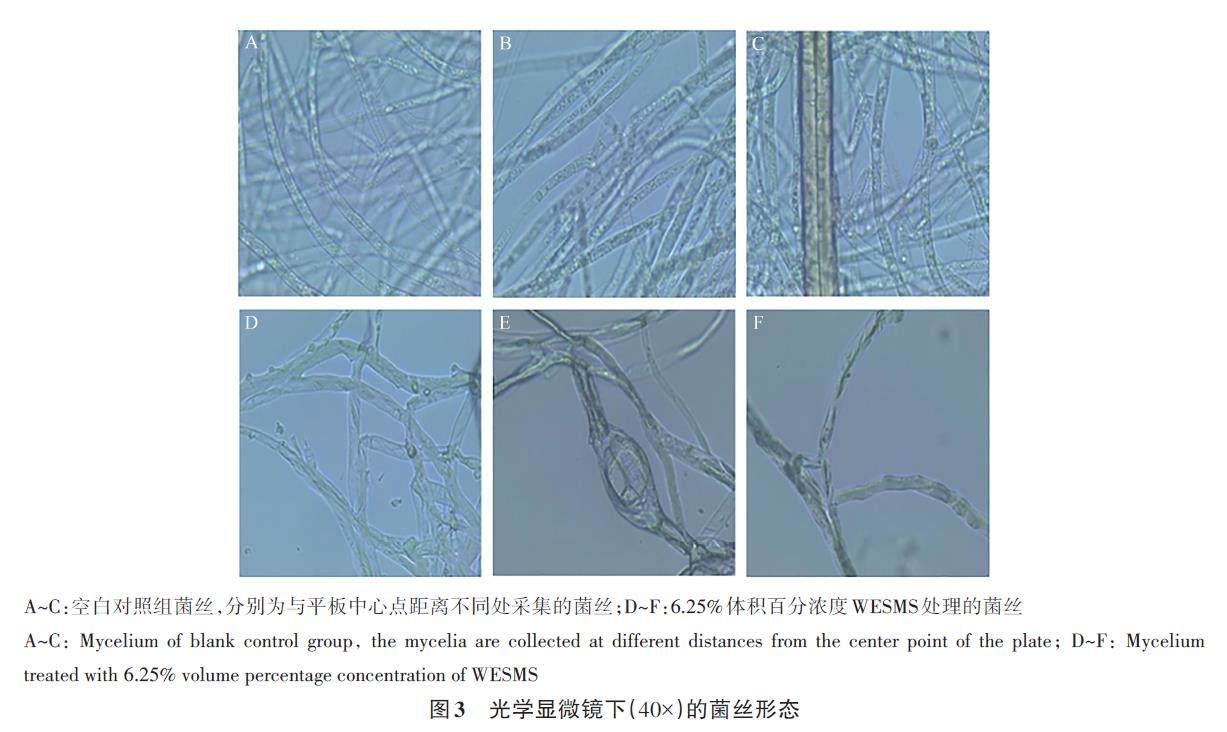
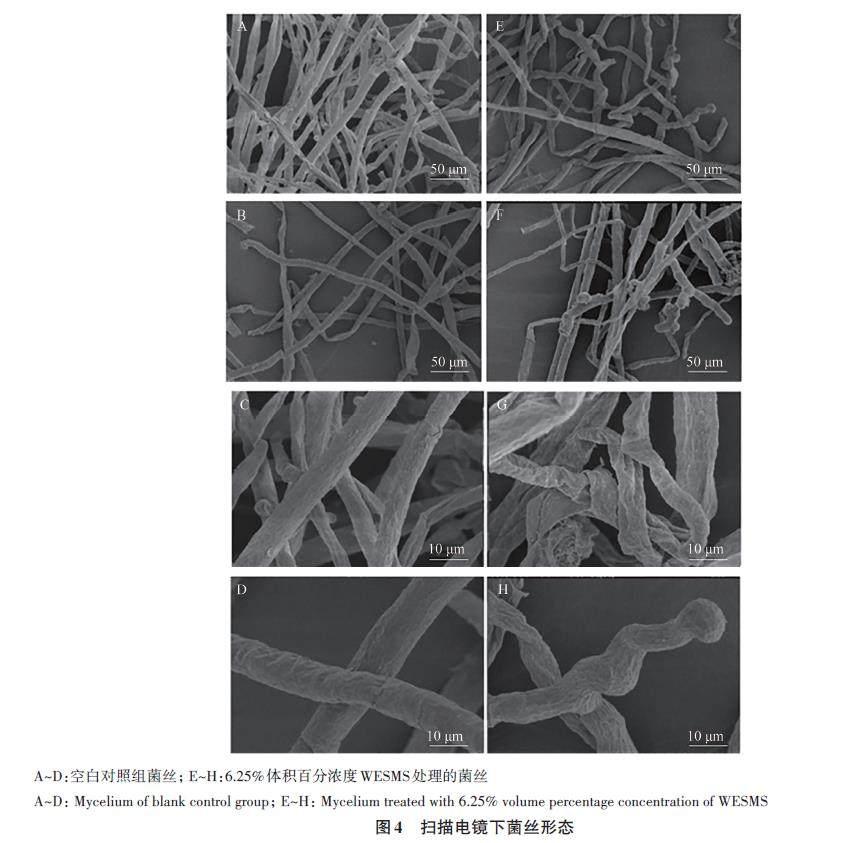
正常生长的菌丝表面光滑圆润,粗细较均匀[25-27],空白对照组菌丝形态(图3A、B、C)符合正常生长样貌,饱满健康,而经高体积百分浓度(6.25%)WESMS处理过的菌丝表面不光滑,部分菌体收缩,有较多分支,出现大量的突起,弯曲程度严重(图3D),内容物分布不均匀,可能造成空腔等畸变现象(图3E),有菌丝“截断”现象(图3F)。在扫描电镜下观察发现,空白对照组菌丝较圆润饱满,粗细均匀,笔直(图4A~D),而6.25%WESMS 处理组菌丝粗细不均,且似有内容物流出现象,扁平,褶皱较多,大多缠绕在一起(图4E~G),末端扭曲程度严重(图4H)。以上结果表明,WESMS对致病疫霉菌的抗菌活性抑制主要是引起其细胞壁及细胞膜受损破坏,可能是WESMS 中具有抗菌活性的物质在与病原菌细胞相互作用时结合在细胞上,从而进入到细胞内起干扰作用。
2.3.2 DNA 损伤情况分析
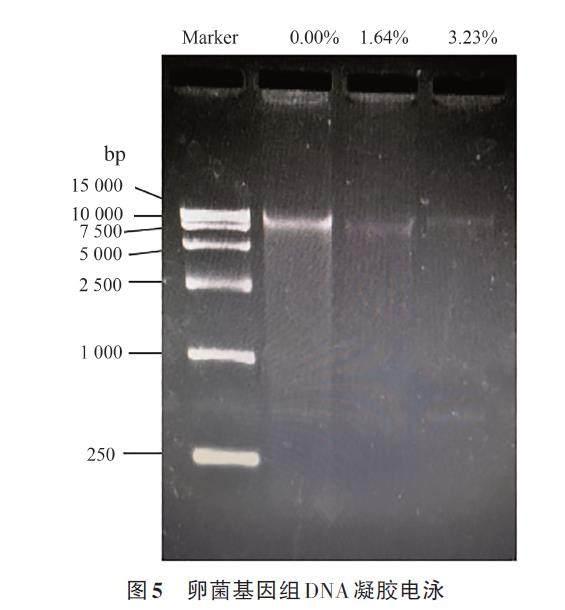
测定所提取病原菌DNA的OD600/800,发现OD600/800均在1.8~2.1,表明提取得到的DNA较纯。以相对分子质量为15 kD的Marker作为参考[21],进行琼脂糖凝胶电泳检测分析DNA损伤情况,由图5可知,对照组总DNA条带亮度高于处理组,随着WESMS 体积百分浓度的增加,DNA含量越低,受损程度越高,电泳条带亮度越低,说明DNA损伤程度与WESMS体积百分浓度呈正相关, 香菇菌糠水提液对病原菌的DNA造成了伤害,可能引发DNA链的断裂与位点突变、双链畸变、基因突变等多种形式的DNA损伤。与此同时,DNA 损伤又会引发多种细胞反应,其中包括了氧化应激[28]。
2.3.3 Zeta电位测定分析
Zeta电位是评价胶体分散体稳定性的重要指标[29]。电位正负表示试样粒子电荷的正负性,电位绝对值反映颗粒之间相互作用的强度,绝对值越大分散体系越稳定,胶体越不易凝聚。由表2可知,WESMS的平均Zeta电位为-29.25 mV,病原菌的平均Zeta电位为-38.57 mV,根据WESMS的Zeta电位绝对值可以判断其在水溶液中会变得比较不稳定,吸引力超过了排斥力,容易发生团聚。通过二者的Zeta电位结果可知,二者表面带有相同电荷,具有排斥作用,WESMS与病原菌之间的反应可能不是由静电吸附力驱动的。以上研究表明,WESMS对病原菌的生长造成延滞。
3 讨 论
目前,通过现代杀菌剂来防控植物病虫害是一种十分重要的手段,但是病原菌极易对现代杀菌剂产生抗性,最终导致化学防治失败[30]。食用菌菌糠是一种具有广泛再利用价值的农业资源[3132]。菌糠作为一种菌菇生产过程中的废弃物,如果随意丢弃,会对环境造成严重的不良影响,特别会对水体环境造成严重污染,因此对菌糠进行资源化利用具有重要意义。研究表明,香菇菌糠水提物可以减轻稻瘟病的发生,其对稻瘟病孢子有直接抑制作用,起到抑制作用的为3种酚酸化合物,为香菇分解菌糠原料蔗渣所得到的产物[24]。将香菇和杏鲍菇(Pleurotus eryngii)菌糠水提取物喷洒在黄瓜(Cucumis sativus Linn.)叶片表面,或直接将菌糠与营养土混合后用于黄瓜栽培,均能显著减轻黄瓜白粉病和角斑病的发生[33]。且相较于化学杀菌剂,由于其多是生物来源,故不易引发病原菌产生抗性,并且对植物几乎没有毒害作用,成本较低。对比生物源抑菌剂,其抑菌效果优于某些生物制剂,如甲壳胺、申嗪霉素、乙蒜素[34]等,也优于某些拮抗菌株[35]。以上结果说明,香菇菌糠水提液具有成为防治植物病害的新型材料的潜力。
本研究将得到的香菇菌糠原材料经过去污、揉碎、干燥、粉碎以及过筛处理得到菌糠粉末,再用热水浸提、离心、过滤得到香菇菌糠水提液(WESMS),并对其粒径大小以及Zeta电位正负进行测定,结果表明,其Zeta电位绝对值较小,粒径在几千纳米级别,具有进入卵菌细胞膜的潜力。用WESMS来拮抗马铃薯致病疫霉菌,结果表明,WESMS对该病原菌具有很强的抑制作用,且随着体积百分浓度的升高,抑菌效果也更好,在6.25%WESMS下,抑菌率可达到近100%。菌糠是一种成分复杂的混合物[36],有研究推测其抗菌作用主要是由木质素被分解后产生的草酸所引起的,而大多数真菌具有产生木质素氧化酶的能力[16]。除了抗卵菌,其对细菌,如金黄色葡萄球菌和铜绿假单胞菌均有抑制活性,原因在于菌糠富含多种活性物质,如多糖、多酚和萜类等,不同组成的菌糠具有不同的抗菌谱。然而对于其与菌在作用过程中是何种物质起到抗菌作用的研究还有待进一步探索。
本研究对WESMS抗菌机理进行了较系统的研究,发现WESMS 处理组的菌丝形态较对照组有较大差异,内容物分布不均,有外渗现象,且扭曲严重,大部分缠绕在一起,表面上出现较多的小突起,壁面粗糙,还出现顶端部分膨大现象。通过凝胶电泳分析,WESMS处理组的DNA 确实受到了一定程度的损伤,条带相较于空白对照组的暗,且随着WESMS体积百分浓度的升高,DNA 损伤程度越大。通过测定病原菌的Zeta电位发现,其和WESMS 一样同为负电位,在产生排斥作用的同时,可能对于营养物质的摄取造成影响。通过抗菌效果以及机理的研究发现,WESMS不仅对报道的常见农业病原菌具有抑制作用,对马铃薯致病疫霉同样具有良好效果,故WESMS 具有成为防控植物病害的新型抑菌剂的潜力。合理运用菌糠资源,不仅能提高农作物的品质与产量、保障人们的健康生活,还能降低菌糠过多堆积对环境造成的影响。
参 考 文 献
[1] 杨雅伦,郭燕枝,孙君茂.我国马铃薯产业发展现状及未来展望[J].中国农业科技导报, 2017,19(1): 29-36.
YANG Y L, GUO Y Z, SUN J M. Present status and futureprospect for potato industry in China [J]. J. Agric. Sci. Technol.,2017,19(1): 29-36.
[2] 李文华,吕典秋,闵凡祥.中国、荷兰和比利时马铃薯生产概况对比分析[J].中国马铃薯, 2018,32(1): 54-60.
LI W H, LYU D Q, MIN F X. Comparative analysis of potatoamong China, Holland and Belgium [J]. China Potato J., 2018,32(1): 54-60.
[3] 夏善勇,牛志敏,李庆全,等.马铃薯晚疫病致病疫霉菌遗传多样性及防治研究进展[J]. 黑龙江农业科学, 2022(12):89-94.
XIA S Y, NIU Z M, LI Q Q, et al .. Research progress ongenetic diversity of Phytophthora infestans in potato late blightand its control [J]. Heilongjiang Agric. Sci., 2022(12): 89-94.
[4] 陈小勇. 马铃薯病害及防治技术[J]. 世界热带农业信息,2023(4): 48-49.
[5] 刘洋,赵秀梅,郑旭,等.马铃薯晚疫病对甲霜灵和精甲霜灵抗药性的田间药效试验[J].黑龙江农业科学, 2022(6): 53-56,83.
LIU Y, ZHAO X M, ZHENG X, et al .. Field efficacy test ofpotato late blight resistance to metalaxyl and metalaxyl-M [J].Heilongjiang Agric. Sci., 2022(6): 53-56,83.
[6] 刘冠求,万博,崔亮,等.不同杀菌剂对马铃薯晚疫病和早疫病的田间防治效果[J].园艺与种苗, 2022,42(4): 53-54,75.
LIU G Q, WAN B, CUI L, et al .. The field control effects ofdifferent fungicides on potato late blight and potato early blight [J].Hortic. Seed, 2022,42(4): 53-54,75.
[7] LAU K L, TSANG Y Y, CHIU S W. Use of spent mushroomcompost to bioremediate PAH-contaminated samples [J].Chemosphere, 2003, 52(9): 1539-1546.
[8] HUANG J L, LIU J Y, CHEN J C, et al .. Combustion behaviorsof spent mushroom substrate using TG-MS and TG-FTIR:thermal conversion, kinetic, thermodynamic and emissionanalyses [J]. Bioresour. Technol., 2018, 266: 389-397.
[9] HU T, WANG X J, ZHEN L S, et al .. Effects of inoculating withlignocellulose-degrading consortium on cellulose-degrading genesand fungal community during co-composting of spent mushroomsubstrate with swine manure [J]. Bioresour. Technol., 2019, 291:121876-121885.
[10] FAZAELI H, SHAFYEE-VARZENEH H, FARAHPOOR A, et al..Recycling of mushroom compost wheat straw in the diet offeedlot calves with two physical forms [J]. Int. J. Recyc.Organic Waste Agric., 2014, 3(3): 65-72.
[11] NGAN N M, RIDDECH N. Use of spent mushroom substrate asan inoculant carrier and an organic fertilizer and their impactson roselle growth (Hibiscus sabdariffa L.) and soil quality [J].Waste Biomass Valori., 2020, 12: 3801-3811.
[12] LIN Y Q, GE X M, LI Y B. Solid-state anaerobic co-digestionof spent mushroom substrate with yard trimmings and wheatstraw for biogas production [J]. Bioresour. Technol., 2014, 169:468-474.
[13] WU J G, XIA A Q, CHEN C Y, et al .. Adsorptionthermodynamics and dynamics of three typical dyes onto bioadsorbentspent substrate of Pleurotus eryngii [J]. Int. J.Environ. Res. Public Health, 2019, 16(5): 679-689.
[14] ECONOMOU C N, PHILIPPOUSSIS A N, DIAMANTOPOULOUP A. Spent mushroom substrate for a second cultivation cycleof Pleurotus mushrooms and dephenolization of agro-industrialwastewaters [J/OL]. FEMS Microbiol. Lett., 2020, 367(8):fnaa060 [2023-02-16]. https://doi.org/10.1093/femsle/fnaa060.
[15] FUJITA R, YOKONO M, UBE N, et al .. Suppression ofAlternaria brassicicola infection by volatile compounds fromspent mushroom substrates [J]. J. Biosci. Bioeng., 2021, 132(1):25-32.
[16] INAGAKI H, YAMAGUCHI A. Spent substrate of shiitake(Lentinula edodes) inhibits symptoms of anthracnose incucumber [J]. Mushroom Sci. Biotechnol., 2009, 17(3): 113-115.
[17] KANG D S, MIN K J, KWAK A M, et al .. Defense responseand suppression of Phytophthora blight disease of pepper bywater extract from spent mushroom substrate of Lentinulaedodes [J]. Plant Pathol. J., 2017, 33(3): 264-275.
[18] 张国广,王丽霞,占凌云,等.杏鲍菇菌糠提取液对4种食用菌菌丝生长影响[J].中国食用菌, 2009,28(5): 19-20,23.
ZHANG G G, WANG L X, ZHAN L Y, et al .. Effects of spentsubstrate of Pleurotus eryngii on the mycelia growth of fouredible fungi [J]. Edible Fungi China, 2009, 28(5): 19-20,23.
[19] RAO W H, ZHANG D Y, GUAN X, et al .. Recycling of spentmushroom substrate biowaste as an anti-UV agent for Bacillusthuringiensis [J/OL]. Sustainable Chem. Pharm., 2022, 30:100811 [2023-02-16]. https://doi.org/10.1016/j.scp.2022.100811.
[20] 张顶洋,邱赛飞,饶文华,等.不同形貌纳米氢氧化镁对芒果叶斑病原真菌的抑制作用[J]. 中国农业科技导报, 2022,24 (3): 140-147.
ZHANG D Y, QIU S F, RAO W H, et al .. Inhibitory effect ofNano-Mg(OH)2 with different morphology on pathogen mangophoma leaf spot [J]. J. Agric. Sci. Technol., 2022,24(3): 140-147.
[21] 陈赛黎. 纳米二氧化硅对马铃薯晚疫病菌的抗菌机制[D].福州: 福建农林大学, 2019.
CHEN S L. Antibacterial mechanism of nano-silica againstPhytophthora infestans [D]. Fuzhou: Fujian Agriculture andForestry University, 2019.
[22] 张荷花,蒋继志,张红霞,等.拮抗菌W-7抑制马铃薯致病疫霉机理初步研究[J].中国植保导刊, 2019,39(9): 5-10, 20.
ZHANG H H, JIANG J Z, ZHANG H X, et al .. Preliminarystudy on mechanism of inhibition effect of W-7 strain onPhytophthora infestens [J]. China Plant Prot., 2019, 39(9): 5-10, 20.
[23] ISHIHARA A, ANDO K, YOSHIOKA A, et al .. Induction ofdefense responses by extracts of spent mushroom substrates inrice [J]. J. Pestic. Sci., 2019, 44(2): 89-96.
[24] ISHIHARA A, GOTO N, KIKKAWA M, et al .. Identification ofantifungal compounds in the spent mushroom substrate ofLentinula edodes [J]. J. Pestic. Sci., 2018, 43(2): 108-113.
[25] 刘紫英,袁斌,肖花美,等.马铃薯致病疫霉及其拮抗菌的筛选与鉴定[J].浙江农业学报, 2020,32(5): 840-848.
LIU Z Y, YUAN B, XIAO H M, et al .. Screening, identificationof Phytophthora infestans and its antagonistic bacterial strain [J].Acta Agric. Zhejiangensis, 2020,32(5): 840-848.
[26] 蒋继志,李莎,王会仙. 3株致病疫霉拮抗放线菌复合发酵及其抑制机理[J]. 河北大学学报(自然科学版), 2010,30(1):78-82.
JIANG J Z, LI S, WANG H X. Culture condition optimizationof three actinomyces mixed fermentation against Phytophthorainfestans and mechanism [J]. J. Hebei Univ. (Nat. Sci.), 2010,30(1): 78-82.
[27] 郭会婧. 几种微生物源提取物抑制致病疫霉及其机理的研究[D].保定: 河北大学,2008.
GUO H J. Inhibition mechanisms of extracts from microorganismsagainst Phytophthora infestans [D]. Baoding: Hebei University,2008.
[28] 冉茂良,高环,尹杰,等. 氧化应激与DNA损伤[J].动物营养学报, 2013,25(10): 2238-2245.
RAN M L, GAO H, YIN J, et al .. Oxidative stress and DNAinjury [J]. Chin. J. Anim. Nutr., 2013,25(10): 2238-2245.
[29] 陈立亚,于宝珠,赵慧芳. Zeta电位及其在药学分散体系研究中的应用[J].药物分析杂志, 2006,26(2): 281-285.
CHEN L Y, YU B Z, ZHAO H F. Zeta potential and its application in the study of pharmaceutical dispersion systems [J].Chin. J. Pharm. Anal., 2006,26(2): 281-285.
[30] 甘瑾, 马李一, 张弘, 等. 芒果采后病原菌的分离及天然抗菌物质的筛选[J]. 食品科学, 2008,29(10): 414-417.
GAN J, MA L Y, ZHANG H, et al .. Isolation of mangopostharvest pathogenic fungi and screening of natural plantantimicrobial substances against them [J]. Food Sci., 2008, 29(10):414-417.
[31] 黄小云,沈华伟,韩海东,等.食用菌产业副产物资源化循环利用模式研究进展与对策建议[J]. 中国农业科技导报,2019,21(10): 125-132.
HUANG X Y, SHEN H W, HAN H D, et al .. Researchprogress and countermeasures on recycling utilization mode ofedible fungi industry by-products [J]. J. Agric. Sci. Technol.,2019,21(10): 125-132.
[32] 周晚来,杨睿,张冬冬,等.菌渣基质化利用中存在的问题与应对策略探讨[J].中国农业科技导报, 2021,23(10): 117-123.
ZHOU W L, YANG R, ZHANG D D, et al .. Problems andcountermeasures in substrate utilization of spent mushroomsubstrates [J]. J. Agric. Sci. Technol., 2021,23(10): 117-123.
[33] PARADA R Y, MURAKAMI S, SHIMOMURA N, et al ..Suppression of fungal and bacterial diseases of cucumberplants by using the spent mushroom substrate of Lyophyllumdecastes and Pleurotus eryngii [J]. J. Phytopathol., 2012, 160(7-8):390-396.
[34] 张博,马立国,张悦丽,等.几种生物制剂对致病疫霉的毒力测定[J].农药, 2017,56(2): 138-140.
ZHANG B, MA L G, ZHANG Y L, et al .. Toxicity tests ofSseveral biological agents in vitro to Phytophthora infestansfrom potatoes [J]. Agrochemicals, 2017, 56(2): 138-140.
[35] 任兴波,武志华,崔海辰,等.致病疫霉拮抗菌株YR-7的分离鉴定及其活性物质[J].微生物学通报, 2016,43(7): 1513-1523.
REN X B, WU Z H, CUI H C, et al .. Isolation andidentification of the strain YR-7 against Phytophthora infestansand study on its antibiotic substances [J]. Microbiol. China,2016,43(7): 1513-1523.
[36] PHAN C W, SABARATNAM V. Potential uses of spentmushroom substrate and its associated lignocellulosic enzymes [J].Appl. Microbiol. Biot., 2012, 96(4): 863-873.
(责任编辑:胡立霞)
基金项目:国家重点研发计划项目(2022YFD1400700);福建农林大学茶树绿色栽培与生态茶园建设研究项目 (K1520007A03);福建农林大学科技发展资金项目( KFB23012)。

