玉米木质素合成途径基因ZmCCoAOMT1 功能研究及转录组分析
徐佳睿 王逸茹 赵绍赓 李坤 郑军
摘要:青贮玉米是一种优良的饲料作物,是畜牧业的优质粗饲料来源。咖啡酰辅酶A-O-甲基转移酶(caffeoyl-CoA-O-methyltransferase, CCoAOMT)是木质素合成途径中的关键甲基转移酶。从玉米自交系B73的EMS突变体库获得了ZmCCoAOMT1 基因的单碱基突变体,通过表型分析、生理生化分析、基因表达分析验证了ZmCCoAOMT1 的功能。研究发现,ZmCCoAOMT1 突变造成茎秆木质化程度降低、木质素含量显著减少、G型木质素(guaiacyl lignin)和S型木质素(syringa lignin)含量下降、体外干物质消化率提高。此外,突变体茎秆中ZmCCoAOMT1 的表达量也显著低于野生型。转录组分析表明,ZmCCoAOMT1 基因的突变可能调控苯丙烷代谢途径中相关基因的表达,进而引起木质素含量和单体组成发生变化。因此,ZmCCoAOMT1 基因是培育高消化率优质青贮玉米品种的重要基因资源,研究结果为木质素合成代谢途径遗传机理研究提供了重要理论依据。
关键词:青贮玉米;木质素;转录组分析;ZmCCoAOMT1
doi:10.13304/j.nykjdb.2024.0186
中图分类号:S513,Q78 文献标志码:A 文章编号:10080864(2024)05003014
玉米(Zea mays L.)是我国主要粮食作物之一,也是重要的饲料来源。近年来,由于国内畜牧业的迅速扩张,导致人畜之间的粮食竞争愈加激烈[1],因此,培育高产优质的玉米品种至关重要。青贮玉米是指在籽粒乳熟末期至蜡熟前期收获的地上全部绿色植株(包括果穗)经过青贮发酵后制作而成的青贮饲料,具有青绿多汁、产量高、适口性好、耐贮存等特点[2]。20世纪80年代之前,我国尚未培育出专用的青贮玉米品种,为了满足青贮饲料的需求,许多地区采用籽粒玉米品种替代[3]。青贮玉米中木质素含量过高可能导致牲畜对饲料的消化利用效率下降,严重影响家畜的生产性能。
木质素是由苯丙烷基为基本结构单元组成的高分子材料,在植物体内占比约为15%~36%,具有紧凑的分子结构[4]。植物苯丙烷代谢途径(phenylpropanoid metabolic pathway)主要分为3部分:首先是莽草酸途径,通过糖的代谢过程将葡萄糖转化为莽草酸,再转化为色氨酸、酪氨酸和苯丙氨酸;其次是公共苯丙烷途径,这个过程从苯丙氨酸出发,经多级酶联反应,最终生成相应的辅酶A;最后是特异木质素合成途径,将催化生成的中间产物辅酶A转化为相应的木质素单体:对香豆醇(对羟苯基木质素,P-hydroxyphenyl lignin,H型木质素)、松柏醇(愈创木基木质素,guaiacyllignin,G型木质素)和芥子醇(紫丁香基木质素,syringa lignin,S 型木质素),进而参与木质素合成[5]。
CCoAOMT 属于S- 腺苷-L- 甲硫氨酸(Sadenosylmethionine,SAM)甲基转移酶,在苯丙烷代谢通路中存在于公共苯丙烷途径,主要负责将咖啡酰辅酶A转化为阿魏酰辅酶A,在木质素合成中起重要作用[6]。其最早在欧芹[7]中发现,之后在百日草[8] 中首次被证实参与木质素合成。CCoAOMT具备催化诸如黄酮类、生物碱等化合物生成甲基化酚类代谢产物的能力[9],其以咖啡酰辅酶A为底物,将S-腺苷甲硫氨酸中的甲基基团传递至木质素单体,从而促进G 型木质素的合成[10]。Chen 等[11]揭示了CCoAOMT 基因可以甲基化咖啡酰辅酶A的C3位,进一步催化生成木质素单体的前体阿魏酰辅酶A。在拟南芥中有2种类型的CCoAOMT:Ⅰ类包含CCoAOMT1,Ⅱ类则包含CCoAOMT2-7[12],CCoAOMT1 在CCoAOMT 家族基因中是最早被确认参与木质素合成的[13]。
目前,已从拟南芥、苜蓿、小麦、毛白杨等植物中克隆获得CCoAOMT 基因。例如,在烟草中抑制CCoAOMT 基因的表达,导致植株明显矮化,木质素含量下降22.3%,S型和G型木质素单体的比例(S/G)增加[14]。在苜蓿中,抑制CCoAOMT1 基因的表达,转基因植株的G型木质素含量下降50%左右,而S型木质素的含量保持不变,因此S/G显著上升,细胞壁的消化率显著增加[15]。同时,CCoAOMT对生物和非生物胁迫有重要调控作用,例如在拟南芥中过量表达CCoAOMT1 可以提高其对丁香假单胞菌DC3000 的抗性[16];Chun 等[17]发现,AtCCoAOMT1 还可以通过ROS和ABA信号通路提高拟南芥的抗旱性,且在同等环境下拟南芥转基因植株吸收镉的能力是野生型的2倍,证明了CCoAOMT1 基因能够降低重金属对植株的影响,提高植物的修复能力[18]。
迄今,在玉米基因组中共发现4个CCoAOMT基因,分别是ZmCCoAOMT1、ZmCCoAOMT2、ZmCCoAOMT3、ZmCCoAOMT4。Fornalé 等[19] 对ZmCOMT2 和ZmCCoAOMT1 的突变体进行研究发现,当ZmCCoAOMT1下调表达时,茎秆中H型单体的含量有所上升,S型单体略有减少,木质素含量减少6.7%。Brenner 等[20] 通过分析40 份青贮玉米自交系发现,ZmCCoAOMT1 和ZmCCoAOMT2 均与秸秆细胞壁消化率高度关联;Yang 等[21] 对ZmCCoAOMT2 的突变体进行研究发现,ZmCCoAOMT2 对小斑病和灰斑病具有显著抗性。上述研究表明,ZmCCoAOMT 在控制木质素含量和不同单体组成以及植物抗逆性方面发挥重要作用。目前ZmCCoAOMT 基因在玉米中的研究仍然较少。本研究利用ZmCCoAOMT1 基因的单碱基突变体,结合表型分析、生理生化分析、基因表达分析和转录组分析来探究ZmCCoAOMT1 的遗传机制,对于理解木质素合成及代谢途径具有极其重要的参考价值。
1 材料与方法
1.1 材料和田间试验
供试材料ZmCCoAOMT1(Zm00001d036293)基因EMS单碱基突变体(ems-0869cd,ccoaomt1)和同一世代分离的野生型(WT)来自B73玉米突变体库(www.elabcaas.cn/memd/)。田间试验在北京市中国农业科学院作物科学研究所顺义基地完成,2022年夏季播种,行长4 m,行距0.6 m,株距0.25 m,每行20穴,每小区3行。收获时每个小区随机选取15株测定株高(plant height,PH)、穗位高(ear height,EH)等农艺性状[22]。
1.2 基因组DNA、RNA 的提取以及cDNA 的制备
取2 叶1 心期的玉米幼苗第2 片叶,用植物DNA提取试剂盒(天根生化科技有限公司)提取DNA;分别在玉米拔节期(V9)和吐丝期取地上部第3 节茎部,RNA prep pure 植物总 RNA 提取试剂盒(Vazyme,南京)提取RNA并使用反转录试剂盒(Vazyme,南京)制备cDNA。
1.3 EMS 材料筛选与鉴定
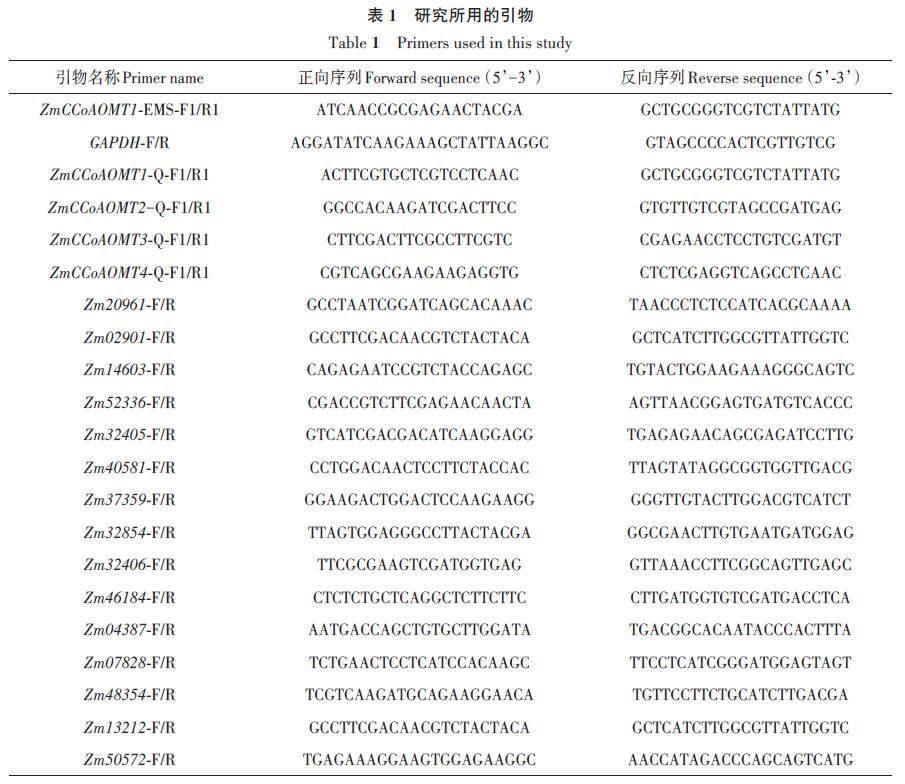
利用玉米基因组数据库MaizeGDB(https://maizegdb.org)检索ZmCCoAOMT1 基因(登录号:Zm00001d036293)序列,设计引物ZmCCoAOMT1-EMS-F1/R1(表1)进行PCR。反应体系50 μL:Phanta Uc Super-Fidelity DNA Polymerase 1 μL、正反向引物各2 μL、dNTP Mix 1 μL、5 × Uc Bufferfor Library Amplification 10 μL、DNA 2 μL、ddH2O32 μL。反应程序:95 ℃预变性 3 min;95 ℃变性15 s,58 ℃退火 15 s,72 ℃延伸 60 s,30 个循环;72 ℃终延伸 5 min。将扩增产物送生工生物工程股份有限公司测序。
1.4 木质素染色
取成熟期的突变体和野生型地上部第3茎节节间,浸泡在FAA 固定液(70% 乙醇90 mL、38%甲醛5 mL、冰醋酸5 mL、甘油5 mL)中固定2 h后取出,用3% 琼脂糖包埋,进而用震荡切片机(LeicaVT1000s,德国)切片,厚度为45 μm。将切片平整展于载玻片上,加Wiesner试剂染色2 min[23],用体式显微镜(Leica M205 FA,德国)观察拍照。
1.5 木质素相关性状测定
在玉米授粉后30~40 d,选取8株长势一致的植株,截取地上部倒数第3~4茎节,立即在105 ℃下杀青30 min,65 ℃烘干至恒重,用粉碎机粉碎,过40目网筛,再次烘干,粉末用于木质素总量、消化品质和单体组成测量。每次实验进行3次生物学重复和3次技术重复。
1.5.1 木质素含量测定
取研磨好的玉米茎秆粉末2 mg,使用木质素含量测定试剂盒(科铭生物有限公司)进行处理,将木质素中的酚羟基乙酰化后生成乙酰木质素,使用Multiskan SkyHigh酶标仪(赛默飞世尔科技公司,美国)测定280 nm波长处的特征吸收峰,通过吸光值的变化定量木质素的含量。
1.5.2 木质素消化品质测定
将研磨好的玉米茎秆粉末装满于10 mL西林瓶中,放置在MPA近红外光谱仪(布鲁克科技有限公司,德国)的样品旋转池中,每个样品重复3次,分别测定酸性洗涤木质素(acid detergent lignin,ADL)、酸性洗涤纤维(acid detergent fiber,ADF)、中性洗涤纤维(neutral detergent fiber,NDF)和体外干物质消化率(in vitro dry matter digestibility,IVDMD)[24]。
1.5.3 木质素单体测定
取研磨好的玉米茎秆粉末1 g,采用硫代酸解法对玉米茎秆粉末进行处理使木质素分子链上的β-O-4醚键断裂,生成木质素单体,利用GCMS-TQ 8050 NX液相色谱-质谱联用仪(SHIMADZU,日本)测定对羟基苯甲醛(H型)、丁香醛(S型)、香草醛(G型)3种木质素单体含量[25]。
1.6 基因表达量分析
qRT-PCR 用荧光定量试剂盒ChamQUniversal SYBR qPCR Master Mix(Vazyme,南京)检测ZmCCoAOMT 基因在玉米不同生长时期的表达量,所用引物为ZmCCoAOMT1-Q-F1/R1、ZmCCoAOMT2-Q-F1/R1、ZmCCoAOMT3-Q-F1/R1、ZmCCoAOMT4-Q-F1/R1,内参基因选择玉米三磷酸甘油醛脱氢酶基因GAPDH(表1)。反应体系20 μL:2 × AceQ qPCR SYBR Green Master Mix10 μL、正反向引物各0.4 μL、cDNA 2 μL、ddH2O7.2 μL。反应程序:95 ℃预变性 5 min;95 ℃变性10 s,60 ℃退火30 s,40 个循环。用2-ΔΔCT 法[26]计算基因的相对表达水平。
1.7 转录组分析
分别在突玉米拔节期(V9)和吐丝期取变体和野生型的的茎秆提取RNA,送安诺优达基因科技有限公司(北京)构建cDNA测序文库。样品分成Ⅰ(V9-WT)、Ⅱ(V9-ccoaomt1)、Ⅲ(吐丝-WT)和Ⅳ(吐丝-ccoaomt1)4个组,3次重复。对其文库质量进行检测,质量合格的cDNA文库用Illumina 高通量测序平台进行测序。用RSEM软件对样本中的基因丰度进行定量分析,用FPKM方法对各个样本中的基因表达量进行计算,比较不同样本间的数据筛选出差异表达基因,用 DESeq 进行差异基因分析,以FDR<0.05且|log2 FC|>1(FC为变异倍数,fold change)为标准筛差异表达基因(differentially expressed genes,DEGs)。
对差异表达基因(DEGs)进行GO[27](geneontology,http://www.geneontologyorg/)功能富集分析;以及利用KEGG[28](kyoto encyclopedia ofgenes and genomes,http://www.genome.jp/kegg/)进行通路(pathway)富集分析,以 KEGG 数据库中通路为单位,以参考基因组背景为对照,将差异基因显示于KEGG通路图上。阈值设置为显著性P<0.05,使用R 软件中clusterProfiler 语言包对差异表达基因进行富集分析和可视化[29],并利用ggplot2语言包作图。
为了验证转录组测序(RNA-seq)的准确性,随机挑选了15个在2个时期苯丙氨酸途径的差异基因进行qRT-PCR验证。
2 结果与分析
2.1 ZmCCoAOMT1 突变体的鉴定
为了探究ZmCCoAOMT1 基因的功能,从B73玉米突变体库获得了ZmCCoAOMT1 单碱基突变体ccoaomt1,突变类型为翻译提前终止,CDS序列第558 位碱基由C 突变成T(图1A~C),野生型为同一世代分离出的显性纯合体。对突变体和野生型进行qRT-PCR,结果表明,突变体中ZmCCoAOMT1 基因的表达量与野生型相比显著降低(图1D),说明该单碱基突变对ZmCCoAOMT1基因表达有显著影响。
2.2 ZmCCoAOMT1 的进化树分析
ZmCCoAOMT1 的开放阅读框长度为792 bp,编码258个氨基酸,通过Protein BLAST数据库筛选出与ZmCCoAOMT家族编码的同源性较高的物种,包括拟南芥(Arabidopsis thaliana)、小麦(Triticum aestivum)、稷(Panicum miliaceum)等。CCoAOMT氨基酸序列分为5类(图2):Ⅰ类包括ZmCCoAOMT1和ZmCCoAOMT2和绝大部分高粱CCoAOMT 氨基酸序列,Ⅱ类包括ZmCCoAOMT3和大部分烟草CCoAOMT氨基酸序列,Ⅲ和Ⅳ为拟南芥CCoAOMT 的氨基酸序列,Ⅴ 类仅有ZmCCoAOMT4。结果表明,ZmCCoAOMT1 和ZmCCoAOMT2亲缘关系最近,与ZmCCoAOMT3和ZmCCoAOMT4亲缘关系较远。
2.3 ZmCCoAOMT1 突变对株型的影响
对突变体和野生型农艺性状进行分析发现,ccoaomt1 突变体的株高和穗位高与野生型相比略有增高,但不显著,分别增加了1.4% 和6.9%(图3A和B),说明ZmCCoAOMT1 单碱基突变未对玉米株高等株型性状产生显著正向作用。
2.4 ZmCCoAOMT1 突变对木质素合成代谢的影响
2.4.1 ZmCCoAOMT1 突变对木质素染色的影响
为了初步探究ZmCCoAOMT1 突变对木质素的影响,对野生型和突变体茎秆进行木质素染色,与野生型相比,突变体茎秆的染色变浅,木质化程度明显降低,细胞中的维管束和厚壁组织有所减少,表明ZmCCoAOMT1 基因的单碱基突变影响植株的木质素含量(图4)。
2.4.2 ZmCCoAOMT1 突变对木质素含量、组成及消化品质的影响
为了进一步探究ZmCCoAOMT1突变对木质素组分的影响,对突变体和野生型的ADL、ADF、NDF、IVDMD和木质素单体等关键成分进行比较,结果如图5和表2所示。与野生型相比,突变体茎秆中木质素含量显著降低,ADF和NDF略微下降,消化率提高了6.8%。木质素单体中G型含量下降4.9%,S型含量下降18.8%,H型因峰图出现干扰而造成数据波动较大。上述结果表明,ZmCCoAOMT1 基因的突变会降低木质素含量并提高消化率,G型和S型木质素显著下降。
2.5ZmCCoAOMT 基因表达量分析
为了探究ZmCCoAOMT1 基因突变是否会对该家族其他基因表达造成影响,在V9期和吐丝期利用qRT-PCR 检测ZmCCoAOMT1、ZmCCoAOMT2、ZmCCoAOMT3、ZmCCoAOMT4 基因在茎中的表达量。结果(图6)发现,在V9 期ccoaomt1 突变体中,ZmCCoAOMT1 表达量呈显著下降,ZmCCoAOMT2 略微上升,ZmCCoAOMT3 略微下降,ZmCCoAOMT4 略微上升;在吐丝时期ccoaomt1突变体中,ZmCCoAOMT1 基因表达量呈极显著下降,ZmCCoAOMT2 呈极显著上升,ZmCCoAOMT3略微上升,ZmCCoAOMT4略微下降。上述结果说明ZmCCoAOMT2对ZmCCoAOMT1基因可能存在补偿效应。
2.6 野生型和ccoaomt1 突变体在V9 时期和吐丝期的转录组分析
2.6.1 差异表达基因的qRT-PCR 验证
为了验证转录组分析中RNA-seq 结果的准确性,利用qRT-PCR对随机挑选15个差异表达基因进行表达量分析验证。结果表明,qRT-PCR的表达量结果与RNA-Seq的结果一致(图7A),两种方法检测的结果之间相关系数(r)为0.934 9(图7B),验证了RNA-Seq分析结果的可靠性。
2.6.2 差异表达基因分析
对V9期和吐丝期的野生型和ccoaomt1 突变体进行转录组分析,经过测序数据质控和数据比对,结果发现在V9时期一共筛选出3 976 个DEGs,其中有1 637 个基因上调,2 339 个基因下调;在吐丝时期一共筛选出2 542个DEGs,其中有904个基因上调,1 638个基因下调。V9时期和吐丝时期共同表达的基因为682个,突变体中同时上调的基因为258个,同时下调的基因为424个(图8)。
2.6.3 差异表达基因的GO富集分析和KEGG分析
对显著的差异表达基因进行GO分析,结果如图9所示。在V9期,GO富集分析DEGs共106个条目,主要富集到脱氧核糖核酸转录(DNAtemplatedtranscription) 、细胞质膜(plasmamembrane)、DNA 结合转录因子活性(DNAbindingtranscription factor activity)等类别( 图9A)。在吐丝期,GO富集分析DEGs共29个条目,主要富集到防御反应(defense response)、细胞质膜(plasma membrane)、DNA 结合(DNA binding)等类别(图9B)。
2.6.4 差异表达基因的GO富集分析和KEGG分析
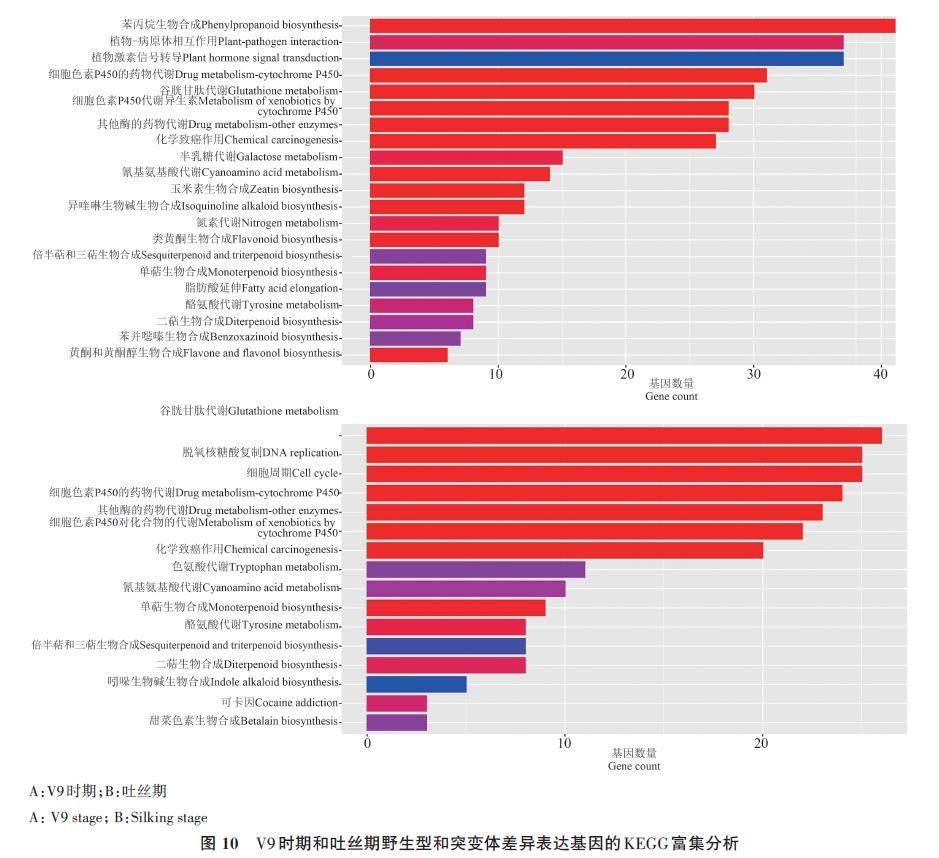
为了进一步分析DEGs的功能,对鉴定到的DEGs进行KEGG富集分析。结果(图10)显示,在V9 期主要被富集到苯丙烷生物合成(phenylpropanoid biosynthesis)、植物-病原体相互作用(plant?pathogen interaction)、植物激素信号转导(plant hormone signal transduction)等相关的通路(图10A);在吐丝期主要被富集到谷胱甘肽代谢(glutathione metabolism)、脱氧核糖核酸复制(DNA replication)等相关的通路(图10B)。
2.6.5 木质素苯丙烷合成通路相关基因表达分析
根据KEGG分析结果,V9期差异表达基因主要富集到与木质素合成代谢通路相关的苯丙烷生物合成途径。转录组分析发现,25个与木质素合成代谢有关的基因差异表达,其中4个基因表达量上调,均为编码过氧化物酶(peroxidase,POD)基因;21个表达量下调基因,其中编码过氧化物酶基因13个,以及CCR、HCT、CSE 等控制木质素合成的关键酶基因8个(表3)。
3 讨论
3.1 ZmCCoAOMT1 基因突变影响玉米木质素合成和消化率
咖啡酸-O-甲基转移酶(COMT)、咖啡醜辅酶A-O-甲基转移酶(CCoAOMT)和阿魏酸5-羟基化酶(F5H)是参与调节植物木质素特异生物合成的3 类主要酶类。Fornalé 等[19]发现,ZmCCoAOMT1的突变会引起突变体的株高略微下降,但没有引起显著性差异,叶中脉未出现褐色显色变化。本研究发现,和野生型相比,ccoaomt1 突变体株高和穗位高略微增加但并没有发生显著改变,叶中脉无褐色显色反应,与上述结论一致。木质素是制约动物消化的关键因素,利用酸性间苯三酚(wiesner试剂)染色观察茎部的木质化部位,茎部维管束染色略有降低,且靠近维管束内部红色较深,维管束鞘颜色较浅,说明ZmCCoAOMT1基因的突变会造成茎秆中次生细胞壁的木质化程度降低。进一步分析发现,突变体中木质素总含量极显著降低,G型和S型木质素单体含量都有下降趋势,但未达到极显著水平,且体外干物质消化率略有提高。木质素合成通路中,CCoAOMT 基因编码的酶是主要控制向G型木质素单体转化的关键甲基转移酶,而本研究中G、S型木质素单体含量变化差异未达到极显著水平,在Fornalé 等[19] 的研究中发现,ZmCCoAOMT1 基因的敲除对木质素总量和单体含量均未造成明显改变,推测可能是由于ZmCCoAOMT 蛋白家族的其他成员在ZmCCoAOMT1 基因突变后维持了部分甲基转移酶的丰度。
3.2 ZmCCoAOMT2 对ZmCCoAOMT1 基因表达存在补偿效应
利用qRT-PCR 对突变体和野生型ZmCCoAOMT 家族4 个基因在V9 和吐丝期的表达量进行比较,发现V9 期和吐丝期突变体中ZmCCoAOMT1 表达量呈现下降趋势,ZmCCoAOMT2 的表达量增加,ZmCCoAOMT3 和ZmCCoAOMT4 在2个时期之间变化趋势不同,且均未达到显著水平。RNA-seq 结果显示,ZmCCoAOMT2 在V9 期和吐丝期的表达量增高,尽管表达量差异未达到显著但趋势与qRT-PCR结果相同。通过进化分析发现,在玉米ZmCCoAOMT 基因家族中ZmCCoAOMT1 与ZmCCoAOMT2 之间亲缘关系更近,而ZmCCoAOMT3、ZmCCoAOMT4 与ZmCCoAOMT1之间关系较远。从表达模式上可以推测ZmCCoAOMT2 对ZmCCoAOMT1 基因可能存在补偿效应。
3.3 ZmCCoAOMT1 对木质素合成通路的影响
对突变体和野生型植株进行转录组分析发现,在V9和吐丝2个时期共同差异表达的基因共682 个,经过GO 富集分析显示,在V9 期,ZmCCoAOMT1 表达量变化主要参与调节植物的转录、对环境胁迫的响应以及细胞膜类的组成等方面;在吐丝期,ZmCCoAOMT1 突变对生物过程(biological process,BP)影响减少,对细胞组分(cell composition, CC)影响增加。说明该基因在发育前期可能主要参与调控植物的转录激活及对外环境胁迫的响应,在后期主要通过调节植物的细胞组分(CC)来调控植物生长发育。
苯丙烷是包括类黄酮、木质素在内的一大类植物次级代谢产物的总称,木质素合成途径属于苯丙烷代谢途径的分支[30],KEGG分析显示,在生育前期差异表达基因主要富集在苯丙烷代谢通路中, ZmCCoAOMT1 基因的突变可能导致了苯丙烷代谢途径中若干基因表达量的变化进而引起木质素含量甚至单体组成发生了改变。对比V9期野生型和突变体,富集在苯丙烷代谢途径中的差异表达基因中绝大多数都为下调表达,与突变体中ZmCCoAOMT1 基因的表达量变化一致,符合预期。在苯丙烷代谢途径中差异表达基因主要包括若干过氧化物酶基因,其编码木质素生物合成最后一步反应的酶,将木质素单体催化脱氢后聚合产生大分子木质素[31]。由于植物细胞壁中过氧化物酶存在多种同工酶,其在木质素合成过程中具有的多样化作用对木质素合成调控作用也因单体不同而造成差异[32]。本研究中过氧化物酶基因的下调表达可能对突变体中木质素总含量和单体含量下降发挥了作用。除此之外,突变体中位于CCoAOMT 基因上下游的HCT、CSE、CCR 等基因的表达量也显著降低,是由于ZmCCoAoMT1 基因的下调表达引起产物阿魏酸辅酶A减少后对上下游酶产生的反馈调节[33]。这些结果为进一步理解木质素合成与代谢提供参考,但还需要进一步分子生物学论证。
参考文献
[1] 李海燕,魏建民,安小虎,等.青贮玉米的发展现状及栽培技术[J].畜牧与饲料科学, 2011, 32(6): 27,43.
[2] 戴忠民,高凤菊,王友平,等.青贮玉米的育种及发展趋势[J].玉米科学,2004, 12(4): 9-11.
DAI Z M, GAO F J, WANG Y P, et al .. Silage maize breedingand its development trend [J]. J. Maize Sci., 2004, 12(4): 9-11.
[3] 王东军. 青贮玉米育种目标与育种方法分析[J]. 新农业,2020, 1(15): 14-15.
[4] ZHONG R, MORRISON W H, HIMMELSBACH D S, et al ..Essential role ofcaffeoyl coenzyme A-O-methyltransferase inlignin biosynthesis in woody poplar plants [J]. Plant Physiol.,2000, 124(2): 563-578.
[5] 薛永常,李金花,卢孟柱,等.木质素单体生物合成途径[J].林业科学, 2003, 39(6): 146-153.
XUE Y C, LI J H, LU M Z, et al .. The lignin subunitsbiosynthesis pathway and its rewriting [J]. Sci. Silvae Sin.,2003, 39(6): 146-153.
[6] KUMAR M, CAMPBELL L, TURNER S. Secondary cell walls:biosynthesis and manipulation [J]. J. Exp. Bot., 2016, 67(2):515-531.
[7] SCHMITT D, PAKUSCH A E, MATERN U. Molecular cloninginduction and taxonomic distribution of caffeoyl-CoA 3-Omethyltransferase,an enzyme involved in disease resistance [J]. J.Biol. Chem., 1991, 266(26): 17416-17420.
[8] YE Z H, KNEUSEL R E, MATERN U, et al .. An alternativemethylation pathway in lignin biosynthesis in Zinnia [J]. PlantCell, 1994, 6(10): 1427-1439.
[9] YE Z H. Association of caffeoyl coenzyme A 3-Omethyltransferaseexpression with lignifying tissues in severaldicot plans [J]. Plant Physiol., 1997, 115(4): 1341-1350.
[10] 王华美,于延冲,付春祥,等.木质素合成关键酶咖啡酰辅酶A 氧甲基转移酶的研究进展[J]. 基因组学与应用生物学,2014, 33(2): 458-466.
WANG H M, YU Y C, FU C X, et al .. Progress of a keyEnzyme-Caffeoyl-CoA 3-O-methyltransferase in lignin biosynthesis[J]. Genom. Appl. Biol., 2014,33(2): 458-466.
[11] CHEN C, MEYERMANS H, BURGGRAEVE B, et al .. Cellspecificand conditional expression of caffeoyl-coenzyme A-3-O-methyltransferase in poplar [J]. Plant Physiol., 2000, 123(3):853-868.
[12] RAES J, ROHDE A, CHRISTENSEN J H, et al .. Genome-widecharacterization of the lignification toolbox in Arabidopsis [J].Plant Physiol., 2003, 133(3): 1051-1071.
[13] DO C T, POLLET B, TH?VENIN J, et al .. Both caffeoylCoenzyme A 3-O-methyltransferase 1 and caffeic acid Omethyltransferase1 are involved in redundant functions forlignin, flavonoids and sinapoyl malate biosynthesis inArabidopsis [J]. Planta, 2007, 226(5): 1117-1129.
[14] PIN?ON G, MAURY S, HOFFMANN L, et al .. Repression ofO-methyltransferase genes in transgenic tobacco affects ligninsynthesis and plant growth [J]. Phytochemistry, 2001, 57(7):1167-1176.
[15] GUO D, CEN F, INOUE K, et al .. Downregulation of cafeicacid 3-O-methyltransferase and cafeoyl CoA 3-O-methyltransferasein transgenic alfalfa: impacts on lignin structure and implicationsfor the biosynthesis of G and S lignin [J]. Plant Cell, 2001, 13(1):73-88.
[16] KWON H, CHO D J, LEE H, et al.. CCOAOMT1, a candidatecargo secreted via VAMP721/722 secretory vesicles in Arabidopsis[J]. Biochem. Biophys. Res. Commun., 2020, 524(4): 977-982.
[17] CHUN H J, LIM L H, CHEONG M S, et al .. ArabidopsisCCoAOMT1 plays a role in drought stress response via ROSandABA-dependent manners [J/OL]. Plants, 2021, 10(5): 831[2024-04-02]. https://doi.org/10.3390/plants10050831.
[18] XIA Y, LIU J, WANG Y, et al .. Ectopic expression of Viciasativa Caffeoyl-CoA-O -methyltransferase (VsCCoAOMT) increasesthe uptake and tolerance of cadmium in Arabidopsis [J]. Environ.Exp. Bot., 2018, 145(1): 47-53.
[19] FORNAL? S, RENCORET J, GARC?A C L, et al .. Changes incell wall polymers and degradability in maize mutants lacking3- and 5-O-methyltransferases involved in ligninbiosynthesis [J]. Plant Cell Physiol., 2017, 58(2): 240-255.
[20] BRENNER E A, ZEIN I, CHEN Y, et al .. Polymorphisms in Omethyltransferasegenes are associated with stover cell walldigestibility in European maize (Zea mays L.) [J/OL]. BMCPlant Biol., 2010, 10:27 [2024-04-02]. https://doi.org/10.1186/1471-2229-10-27.
[21] YANG Q, HE Y J, KABAHUMA M, et al .. A gene encodingmaize caffeoyl-CoA O-methyltransferase confers quantitativeresistance to multiple pathogens [J]. Nat. Genet., 2017, 49(9):1364-1372.
[22] 刘玄,王梅,李玉龙,等.玉米主要农艺性状相关性分析[J].安徽农学通报, 2021, 27(24): 39-41,79.
[23] GEIGER H, FUGGERERA H. ?ber den chemismus derwiesner-reaktion auf lignin on the chemistry of the wiesnerreaction on lignin [J]. Zeitschrift Fur Naturforschung B, 1979,34: 1471-1472.
[24] 马飞前.玉米茎秆纤维性状QTL定位[D].北京:中国农业科学院, 2014.
MA F Q. Mapping of quantitative trait loci (QTL) for stalk fibertraits in maize [D]. Beijing:Chinese Academy of AgriculturalSciences, 2014.
[25] HARMAN-WARE A E, FOSTER C, HAPPS R M, et al .. Athioacidolysis method tailored for higher-throughput quantitativeanalysis of lignin monomers [J]. Biotechnol. J., 2016, 11(10):1268-1273.
[26] LIVAK K J, SCHMITTGEN T D. Analysis of relative geneexpression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method [J]. Methods, 2001, 25(4): 402-408.
[27] CHALMEL F, LARDENOIS A, THOMPSON J D, et al ..GOAnno: GO annotation based on multiple alignment [J].Bioinformatics, 2005, 21(9): 2095-2096.
[28] KANEHISA M, GOTO S. KEGG: kyoto encyclopedia of genesand genomes [J]. Nucleic. Acids. Res., 2000, 28(1): 27-30.
[29] YU G C, WANG L G, HAN Y Y, et al .. ClusterProfiler: an Rpackage comparing biological themes among gene clusters [J].OMICS, 2012,16(5): 284-287.
[30] ZAKZESKI J, BRUIJNINCX P C A, JONGERIUS A L, et al .. Thecatalytic valorization of lignin for the production of renewablechemicals [J]. Chem. Rev., 2010, 110(6): 3552-3599.
[31] 龙国辉,武鹏雨,付嘉智,等.过氧化物酶调控木质素合成研究进展[J].现代农业科技, 2021(23): 47-49,54.
LONG G H, WU P Y, FU J Z, et al .. Research progress onregulation of peroxidase on lignin synthesis [J]. Modern Agric.Sci. Technol., 2021(23): 47-49.
[32] DIXON R A, BARROS J. Lignin biosynthesis: old roadsrevisited and new roads explored [J/OL]. Open Biol., 2019,9(12):190215 [2024-04-02].https://doi.org/10.1098/rsob.190215.
[33] VANHOLME R, CESARINO I, RATAJ K, et al .. Caffeoylshikimate esterase (CSE) is an enzyme in the ligninbiosynthetic pathway in Arabidopsis [J]. Science, 2013, 341(6150): 1103-1106.
(责任编辑:温小杰)
基金项目:国家重点研发计划项目(2023YFD1200500)。

