农药残留快速检测试纸条的研制及应用
孙召伟,赵小中,胡波,赵伊行,许雪,杜苗,翁海波


摘 要:简单快速地筛查有机磷和氨基甲酸酯类农药残留对食品安全具有重要意义。采用酶抑制法,以重氮固红RC盐为指示剂、乙酸吲哚酚为乙酰胆碱酯酶(AChE)底物,设计开发了一种一步式快速检测试纸条。该试纸条底部为塑料胶板,上面依次粘贴样品垫、酶垫、阻滞垫、底物垫、吸附垫和固定有重氮固红RC盐的硝酸纤维素(NC)膜,通过检测区域颜色的变化可以实现农药残留的定性或定量分析,操作方法简单快捷。不同农药的检出限分别如下:马拉硫磷为0. 6 mg·L-1,氧化乐果为0. 4 mg·L-1,乙酰甲胺磷为1.3 mg·L-1,敌敌畏为0.1 mg·L-1,呋喃丹为0. 1 mg·L-1,涕灭威为0.07 mg·L-1,且在实际果蔬样品检测中显示出良好的重现性和高灵敏度。
关键词:乙酰胆碱酯酶;农药残留;快速检测;试纸条
中图分类号:S482.3 文献标志码:A 文章编号:1673-2871(2024)06-111-08
Construction and application of paper test strip for rapid detection of pesticide residues
SUN Zhaowei1, ZHAO Xiaozhong2, HU Bo2, ZHAO Yihang1, XU Xue1, DU Miao1, WENG Haibo1
(1. School of Life Sciences, Zhengzhou University, Zhengzhou 450001, Henan, China; 2. Zhengzhou Agricultural Products Quality Inspection and Circulation Center, Zhengzhou 450006, Henan, China)
Abstract: Simple and rapid screening of organophosphorus and carbamate pesticide residues is of great significance for food safety. In this study, the authors designed and developed a one-step rapid test strip using enzyme inhibition method, with the diazo red RC salt as indicator and indoxyl acetate as substrate of acetylcholinesterase(AChE). The bottom of the test strip is a plastic rubber plate, which is successively pasted with sample pad, enzyme pad, block pad, substrate pad, adsorption pad and nitrocellulose (NC) film that fixed with diazo red RC salt. Qualitative or quantitative analysis of pesticide residues can be achieved by detecting changes in the color of the detection area, and the operation method is simple and fast. The detection limits of different pesticides are as follows: 0.6 mg·L-1 for malathion, 0.4 mg·L-1 for omethoate, 1.3 mg·L-1 for acephate, 0.1 mg·L-1 for dichlorvos, 0.1 mg·L-1 for carbofuran, 0.07 mg·L-1 for aldicarb. It shows good reproducibility and high sensitivity in actual fruit and vegetable samples.
Key words: Acetylcholinesterase; Pesticide residue; Rapid detection; Test strip
随着社会的进步和生活水平的提高,人们对果蔬的消耗量日益增加,农业生产中杀虫剂的使用越来越趋向于大量化、多样化,其中广泛应用的一大类为有机磷和氨基甲酸酯类农药[1-2]。他们通过结合乙酰胆碱酯酶 (AChE) 活性位点,抑制其活性,阻止神经递质的传递,致使昆虫死亡[3]。乙酰胆碱酯酶是中枢神经系统的关键酶,能降解乙酰胆碱,终止神经递质对突触后膜的兴奋作用,保证神经信号在生物体内的正常传递。大量杀虫剂的使用不仅污染环境,而且经常造成农药残留超标,危害人们的身体健康。因此,果蔬在进入销售、食用之前,对其进行农药残留检测是非常必要的。
在现有检测方法中,气相色谱和高效液相色谱法是分析农业和环境样品中农药残留的成熟方法[4-7]。这些技术方法需要复杂、昂贵的仪器设备和专业的技术操作人员,因此,通常无法在常规筛查和快速检测中推广应用。基于AChE酶抑制的检测方法更为简便快捷,适合于现场快速筛检样本中复合农药残留是否超标[8-9]。目前已开发出多种基于酶抑制法的农药残留快速检测技术,包括比色法、荧光法、免疫化学法和生物传感器技术等[10-14]。但是,目前这些方法仍然严重依赖技术设备和专业操作人员,不适用于临时市场或偏远地区的快速应用,因此开发一种便携、快捷、灵敏的农药残留检测分析方法迫在眉睫。
基于试纸条的分析方法在现场筛选方面具有多种优势:试纸价格低廉、数量充足、可一次性使用;纸张还具有无需动力即可通过毛细作用移动流体的独特特性,有效分离混合物中的成分;这些便携式试纸条可用于缺乏设备的偏远地区,操作简单,无需专业人员[15-16]。笔者基于AChE的抑制原理,以重氮固红RC盐为指示剂,以乙酸吲哚酚为AChE底物,结合新材料和化学分析等方法,研究和开发了一站式、快捷速测试纸条,可通过检测区域颜色的变化进行农药残留的快速、准确的定性和定量分析。
1 材料与方法
1.1 材料与仪器
试验于2023年2-6月在郑州大学生命科学学院进行。
乙酰胆碱酯酶购自郑州贝贝生物科技有限公司;果蔬样品购自郑州当地超市;农药分析标准品购自国家标准物质认证信息中心;乙酸吲哚酚、重氮固红RC盐、乙酰硫代氯化胆碱、二甲基甲酰胺、5,5-二硫代双(2-硝基苯甲酸)(DTNB)等化学试剂购自上海阿拉丁试剂有限公司;聚酯纤维- KL43,VL78,玻璃纤维- KB50,RB65,SB08和吸水纸- SX18、聚酯纤维膜、硝化纤维素膜、聚氯乙烯(PVC)胶板购自上海金生物科技有限公司。无水甲醇、二甲基甲酰胺、磷酸二氢钾、无水磷酸氢二钾购自上海阿拉丁试剂有限公司,均为分析纯。MilliQ试剂水系统(Millipore,Billerica,MA)制备超纯水。UV-Vis紫外分光光度计用于酶活性测定。
1.2 溶液的配置
取适量乙酰胆碱酯酶冻干粉溶于水中,配置3000 U·mL-1的酶溶液;取17.518 mg乙酸吲哚酚溶于1 mL无水甲醇中,配制浓度为100 mmol·L-1乙酸吲哚酚溶液备用;称取60 mg重氮固红RC盐溶于1 mL 含有15%(φ)的二甲基甲酰胺水溶液,配制成质量浓度为60 mg·mL-1的重氮固红RC溶液备用;取0.63 g磷酸二氢钾与12.28 g无水磷酸氢二钾溶于1 L超纯水中,配制PBS(pH 8.0)缓冲溶液;用丙酮稀释不同农药,配制农药原液(100 mg·mL-1),-20 ℃避光保存。
1.3 试纸条制备工艺参数的优化
1.3.1 酶膜片及浓度的优化 将100 μL 3500 U·mL-1的AChE溶液 固定于玻璃纤维(KB50、RB65、CB08)、聚酯纤维(KL43、VL78)和吸水纸(SX18)等不同固定材料的膜片上,优化酶膜片。将100 μL的AChE溶液 (1500、2000、3000、3500、4000、4500 U·mL-1)固定于玻璃纤维RB65膜片上,优化酶浓度。膜片干燥后,放入含有100 μL磷酸盐缓冲液的1.5 mL离心管中,依据Ellmam法测定酶活性,计算酶活性回收率。酶活性回收率(R)计算公式为:R/%=ΔA1/ΔA2 ×100。同时,将AChE膜片浸泡在不同浓度的灭虫威和敌敌畏农药中,检测农药对乙酰胆碱酯酶的实时抑制率。根据AChE的回收率和抑制率确定AChE的最佳浓度和膜片。每组试验选择2组样本数,3次重复。
1.3.2 底物膜片及浓度的优化 将100 μL 100 mmol·L-1的乙酸吲哚酚溶液固定于玻璃纤维(KB50、RB65、CB08)、聚酯纤维(KL43、VL78)和吸水纸(SX18)等不同固定材料的膜片上,优化底物膜片。将100 μL乙酸吲哚酚(10、50、100、200 mmol·L-1)固定在聚酯纤维VL78膜片上,优化底物浓度。膜片干燥后,放入含有100 μL磷酸盐缓冲液的1.5 mL离心管中,取上清液,与等量乙酰胆碱酯酶混合,室温下进行不同时间孵育。乙酰胆碱酯可催化无色乙酸吲哚酚水解生成吲哚酚,吲哚酚被空气迅速氧化生成靛蓝(靛蓝的最大吸收波长为605 nm),通过测量605 nm处的吸光度选择最佳底物膜片。根据检测区的最终颜色强度确定AChE的最佳底物浓度和膜片。每组试验选择2组样本数,3次重复。
1.3.3 重氮固红RC盐浓度的优化 采用不同质量浓度重氮固红RC盐(10、20、40、60、100 mg·mL-1)对检测区进行划线,通过观测检测区的颜色强度变化来确定最适浓度。每组试验选择2组样本数,3次重复。
1.3.4 干燥方式的优化 酶片采用冷冻、4 ℃和37 ℃ 3种温度干燥20 min进行酶片的固定,测定干燥后酶活性回收率,选择最适干燥条件。每组试验选择2组样本数,3次重复。
1.4 试纸条的制备与条件优化
1.4.1 试纸条的制备 按照优化后的工艺参数,选择最适的玻璃纤维、聚酯纤维或吸水纸切成正方形(3 mm × 3 mm),分别滴加乙酰胆碱酯酶、乙酸吲哚酚溶液,制备酶片和底物片。将选择好的硝化纤维素膜、样品片、酶片、阻滞片、底物片和吸附片剪成4 mm×10 mm的长条,硝化纤维素膜上用最适浓度重氮固红RC盐溶液进行划线,酶片和底物片分别用镊子依次粘贴塑料胶板上,制成试纸条备用。
1.4.2 试纸条使用条件的优化 将试纸条分别放置4、25和37 ℃反应20 min,记录不同时间和温度条件下的反应结果,优化反应时间和温度。每组试验选择2组样本数,3次重复。
1.5 试纸条检测性能的测试
1.5.1 标准农药的测试 用磷酸缓冲盐溶液(PBS)将有机磷农药(OP):马拉硫磷、氧化乐果、乙酰甲胺磷、敌敌畏和氨基甲酸酯类农药(CM):呋喃丹、涕灭威稀释至不同浓度,作为农药残留检测样本。分析时,其中一个在样品片上滴加70 μL纯净水作为检测阴性对照,其他依次滴加农药样本液,室温反应15 min。分别利用国家标准法[17]和市售农残速测试剂盒测定不同种农药的检出限(LOD,规定为农药可以抑制50%酶活性的农药浓度,即IC50,与该试纸条进行比较)。
1.5.2 实际果蔬样品的测试 选择食用频率高的果蔬样本,轻轻擦拭表面泥土,以1 mL·g-1的量喷洒不同浓度的氧化乐果农药,氧化乐果溶液质量浓度分别为0、1、2、4、6、8、10、20、30、40、50 μg·mL-1。室温放置24 h后,剪成碎片,称取2 g样品,放入烧杯中,加入5 mL磷酸盐缓冲液,震摇2 min后静置,上清液备用。分析时,其中一个在样品片上滴加70 μL纯净水作为检测阴性对照,其他依次滴加果蔬样本液,室温反应15 min。同时利用乙腈提取一些喷洒不同浓度农药的白菜样品,进行气相色谱-质谱分析。每组试验2组样本数,3次重复。
1.6 试纸条存储稳定性的测试
将试纸条密封于暗处,在4 ℃、室温(RT,25 ℃)和37 ℃条件下保存60 d以上,每隔10 d在样品垫上滴入分析液(70 μL)进行检测,测定颜色强度,并与新制备的颜色强度进行比较。
1.7 统计分析
通过获取数字图像并使用Photoshop软件分析图像来量化颜色强度。阴性对照不含任何抑制剂的棕红色赋值为100,阳性对照不含酶的淡黄色赋值为0。试验采用完全随机设计,每个试验重复3次。使用GraphPad Prism软件于Fishers LSD(最小显著性差异)法进行差异显著性分析,采用Excel 2019 绘制图表。
2 结果与分析
2.1 试纸条的原理
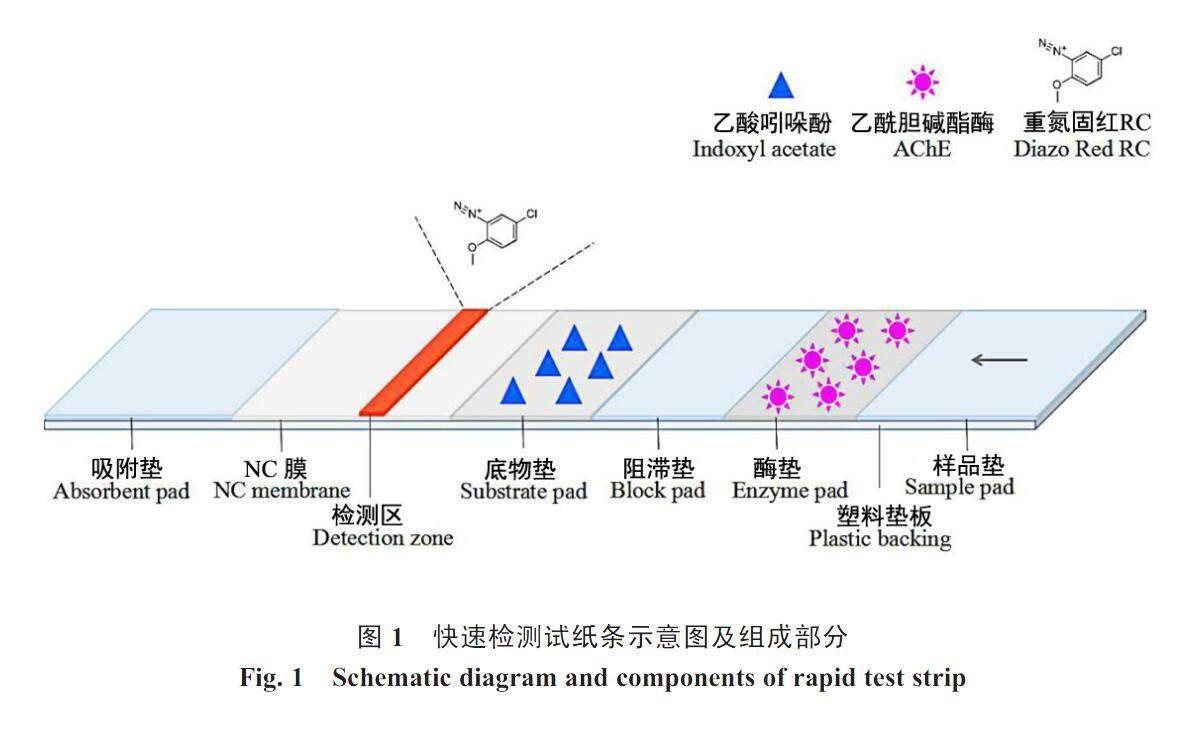
试纸条由带有样品垫、酶垫、阻滞垫、底物垫、硝酸纤维素(NC)膜和吸附垫的塑料垫板组成(图1)。含有酶和底物的垫为亲水性膜,能够吸附和释放全剂量的酶或底物。在吸水纸的毛细血管作用下,样品垫上的样品液经过酶片时,酶膜上的乙酰胆碱酯酶可快速溶于水中,并继续移动,经过阻滞片后到达底物片,与底物乙酸吲哚酚发生反应生成亲核芳香化合物靛蓝,继而在水的作用下移动到NC膜上与重氮固红RC盐发生耦合反应,产生棕红色指示带。随着滴加的样品液中农药残留浓度的提高,检测孔的颜色从棕红色依次递浅,可根据颜色强度的差异判断样品中的农药残留量。
2.2 固定材料的确定
2.2.1 酶膜片的确定 酶和底物的最佳固定化材料应该是生物惰性的,这样就不会受到生物活性物质的影响,能够达到完全吸附且完全释放的效果。因此,笔者以玻璃纤维(KB50、RB65、CB08)、聚酯纤维(KL43、VL78)和吸水纸(SX18)为固定材料,分别测定不同材料酶片酶活性的回收率,结果发现,不同材料作为酶片得到的酶活性回收率不同,玻璃纤维膜RB65的酶活性回收率最高,达75%(图2-A)。孵育不同时间后进行酶活性回收率检测,结果发现,其对酶活性影响不大(图2-B)。因此,确定玻璃纤维膜RB65为最适酶固定材料。
2.2.2 底物膜片的确定 对于底物片材料,将回收后的底物与酶反应,进行吸光度的检测。从图3可以看出,聚酯纤维素膜VL78在605 nm处的吸光度值随着反应时间的延长而增大,说明VL78膜片上的底物回收率最高。因此,确定聚酯纤维素膜VL78为最适底物固定材料。
2.3 固定浓度的确定
2.3.1 酶浓度的确定 酶片上乙酰胆碱酯酶的浓度对试纸条检测结果影响较大。增加乙酰胆碱酯酶的浓度可以提高显色颜色强度。但是,如果酶量过多,灵敏度会降低。因此,色彩强度和测试灵敏度需要平衡。从图4-A~B可以看出,当酶片上AChE浓度从1500 U·mL-1增加到4500 U·mL-1时,回收率提高,抑制率降低。因此,酶的最佳浓度确定为3500 U·mL-1。
2.3.2 底物浓度的确定 底物浓度优化结果如图5-A~B所示,当乙酸吲哚酚浓度达到100 mmol·L-1时,颜色强度趋于稳定,不再增加。因此,乙酸吲哚酚最佳浓度确定为100 mmol·L-1。
2.3.3 重氮固红RC盐浓度的确定 重氮固红RC盐浓度优化结果如图6-A~B所示,当重氮固红RC盐质量浓度达到60 mg·mL-1时,颜色强度趋于稳定,不再增加。因此,重氮固红RC盐最佳质量浓度确定为60 mg·mL-1。
2.4 膜片干燥方式的确定
3种酶片干燥方式的酶活性回收率差异显著(图7),冷冻干燥20 min后酶活性回收率为78%,4 ℃条件下酶活性回收率为19%,37 ℃条件下酶活性回收率为56%,因此,酶片选择回收率最高的冷冻干燥方式。
由于乙酸吲哚酚溶解在甲醇中,容易蒸发,因此,底物片选择室温干燥方式。
2.5 反应时间和温度的确定
将速测试纸条分别放置4、25、37 ℃进行反应,实时检测结果如表1所示。无论在4、25℃,还是在37 ℃条件下进行反应,试纸条均在15 min内达到最大显色强度;在4 ℃条件下,颜色强度反应较弱,在25和37 ℃条件下,颜色强度差异不大,当温度为37 ℃时,测试条蒸发速度快,需要更多的液体溶液来反应。因此,确定最佳反应时间为15 min,最佳使用温度为25 ℃。
2.6 试纸条检测性能的测试
2.6.1 农药标准品的测试 农药标准品的测试结果如表2所示,试验结果利用颜色分析软件分析,阴性对照的蓝绿色颜色强度设为100,阳性结果的无色设为0。通过对颜色强度的分析,实现速测试纸条的LOD分析。农药的检出限规定为农药可以抑制50%酶活性的农药浓度,即IC50。从结果中可以看出,试纸条对于不同农药的检出限分别如下:马拉硫磷为0. 6 mg·L-1,氧化乐果为0. 4 mg·L-1,乙酰甲胺磷为1.3 mg·L-1,敌敌畏为0.1 mg·L-1,呋喃丹为0.1 mg·L-1,涕灭威为0.07 mg·L-1,均明显低于国家标准方法规定的检出限和市售农残快速检测卡的检出限,说明其具有较好的灵敏度和较低的检出限。
2.6.2 实际果蔬样品的测试 实际果蔬样品的测试结果如表3所示。随着果蔬表面喷洒农药浓度的提高,检测试纸条检测区域的颜色逐渐变浅,当喷洒农药的质量浓度高于6 mg·L-1时,与未喷施农药的阴性对照相比,可明显看到颜色差异。喷洒同样浓度的氧化乐果,3种不同果蔬检测结果基本一致,说明该试纸条在实际果蔬农药残留检测时具有良好的灵敏性、稳定性和重现性。
通过农药标准品和实际果蔬样品检测,本研究根据平均抑制比,设置阴性(-)、阳性(+)和强阳性(++)3个不同颜色水平作为筛选和检测标准,检测结果与之比对后,可简单、快速地实现果蔬中农药残留的检测(图8)。
为了验证试纸条在实际样品检测中的灵敏性,笔者与气相色谱-质谱分析进行了比较,结果如表4所示。当喷洒农药质量浓度为6 mg·L-1时,依据本研究标准色卡图,该试纸条显色结果为阳性(+),而GC-MS检测结果为0.51 mg·L-1,远低于国家标准可检测的LOD值(2.3 mg·L-1 )。当喷洒浓度为10 mg·L-1时,该试纸条显示结果为强阳性(++),GC-MS检测结果为2.05 μg·mL-1,说明该试纸条具有较高的灵敏性和较低的检出限。
2.7 试纸条存储稳定性的测试
试纸条存储稳定性测试结果如图9所示,4 ℃和室温(RT,25 ℃)密封避光保存60天,试纸条仍然保持75%的活性,37 ℃条件下剩余活性为55%。说明本研究中的试纸条稳定性好,室温放置2个月仍有较高的活性,可满足目前市场农药残留检测的要求。
3 讨论与结论
农药的过量使用导致果蔬中农药高浓度残留,愈来愈引起人们的重视。特别是冬季塑料大棚和温室环境,由于病虫害数量增加,果农对施药后的农产品快速上市销售,导致农药残留量急剧上升[18]。多种农药残留检测技术应运而生,如色谱分析、生化检测等[19]。然而,多数检测方法依赖于仪器设备和技术人员,检测过程复杂,耗时长,不适用于日常生活检测。因此,开发简便快捷、灵敏高效的新型检测方法对日常生活中农药残留的检测具有重要意义。
笔者基于酶抑制法原理,偶联重氮离子与芳香族化合物,研制开发了一种新型果蔬农药残留快速检测试纸条。该试纸条可根据检测区域颜色强度的变化,实现农药残留定性或定量的检测。通过对6种不同的有机磷和氨基甲酸酯类农药标样和3种果蔬样品的实际检测分析,均显示该试纸条具有较低的检出限、较高的灵敏度、良好的稳定性和重现性[17];通过放置于不同环境下密封保存,验证了该试纸条具有较好的稳定性,可室温保存2个月。然而,目前该方法仍处于试验阶段,采用的实际样本量不够丰富,需要进一步扩大样本量,探讨其在市场或家庭场所的实际应用情况;或可结合信号输出技术,开发可直接通过手机扫描即显示检测结果的装置,提高该检测试纸条的便捷性和智能性。
笔者设计的检测试纸条具有操作简单、使用方便、检测灵敏等优点,适用于企业、市场、家庭、餐厅等场所,可满足目前市场上快速检测的要求,是今后农药残留快速检测的主要发展方向和趋势。
参考文献
[1] MERCEY G,VERDELET T,RENOU J,et al.Reactivators of acetylcholinesterase inhibited by organophosphorus nerve agents[J].Accounts of Chemical Research,2012,45(5):756-766.
[2] AKTAR M W,SENGUPTA D,CHOWDHURY A,et al.Impact of pesticides use in agriculture:Their benefits and hazards[J].Interdisciplinary Toxicology,2009,2(1):1-12.
[3] MIAO Y Q,HE N Y,ZHU J J.History and new developments of assays for cholinesterase activity and inhibition[J].Chemical Reviews,2010,110(9):5216-5234.
[4] CACHO J I,CAMPILLO N,VINAS P,et al.In situ ionic liquid dispersive liquid-liquid microextraction coupled to gas chromatography-mass spectrometry for the determination of organophosphorus pesticides[J].Journal of Chromatography A,2018,1559:95-101.
[5] SIVAPERUMAL P,ANAND P,RIDDHI L,et al.Rapid determination of pesticide residues in fruits and vegetables,using ultra-high-performance liquid chromatography/time-of-flight mass spectrometry[J].Food Chemistry,2015,168:356-365.
[6] XU M L,GAO Y,HAN X X,et al.Detection of pesticide residues in food using surface-enhanced raman spectroscopy:A Review[J].Journal of Agricultural and Food Chemistry,2017,65(32):6719-6726.
[7] 戴运朋.果蔬中农药残留检测方法研究[J].南方农业,2021,15(2):236-237.
[8] ELLMAN G L,COURTNEY K D,ANDRES V J,et al.A new and rapid colorimetric determination of acetylcholinesterase activity[J].Biochemical Pharmacology,1961,7:88-95.
[9] UMAPATHI R,SONWAL S,LEE M J,et al.Colorimetric based on-site sensing strategies for the rapid detection of pesticides in agricultural foods:New horizons,perspectives,and challenges[J].Coordination Chemistry Reviews,2021,446:214061.
[10] MA J H,HU X L.TAO Y Q,et al.Gold nanoparticle-based biosensors for the assay of tumor marker proteins with clinical applications[J].Advanced Materials Letters,2017,8(2):1125-1131.
[11] CHEN J M,HUANG Y J,KANNAN P,et al.Flexible and adhesive surface enhance raman scattering active tape for rapid detection of pesticide residues in fruits and vegetables[J].2016,55(4):2149-2155.
[12] WANG X,MU Z D,SHANGGUAN F Q,et al.Rapid and sensitive suspension array for multiplex detection of organophosphorus pesticides and carbamate pesticides based on silica-hydrogel hybrid microbeads[J].Journal of Hazardous Materials,2014,273:287-292.
[13] 吕晓平,郭利静,李宁,等.乙酰胆碱酯酶生物传感器研究进展[J].食品工业,2020,41(2):221-224.
[14] 王春琼,曾彦波,李苓,等.酶抑制法在农药残留快速检测中的研究进展[J].农业与技术,2020,40(16):29-31.
[15] JAHANSHAHI-ANBUHI S,HENRY A,LEUNG V,et al.Paper-based microfluidics with an erodible polymeric bridge giving controlled release and timed flow shutoff[J].Lab on a Chip,2014,14(1):229-236.
[16] SIRIVIBULKOVIT K,NOUANTHAVONG S,SAMEENOI S,et al.Paper-based DPPH assay for antioxidant activity analysis[J].Analytcal Sciences,2018,34(7):795-800.
[17] 中华人民共和国卫生部,中国国家标准化管理委员会.蔬菜中有机磷和氨基甲酸酯类农药残留量的快速检测:GB/T 5009.199-2003[S].北京:中国标准出版社,2003.
[18] 李婵君,朱香玲,宋延娟.郑州市蔬菜中农药残留监测分析[J].中国瓜菜,2013,26(5):36-38.
[19] 冯建永,刘辉.蔬菜农药残留检测技术的比较分析[J].中国瓜菜,2017,30(9):38-40.

