HPLC法同时检测陕西平利绞股蓝中13种酚酸含量
王珂 周琼 李建科


摘要:为建立同时检测陕西平利绞股蓝(Gynostemma pentaphyllum)中13种酚酸含量的测定方法,采用高效液相色谱法(HPLC),利用甲醇水溶液(80%)常温涡旋,超声波提取,色谱柱为Dimensions C18(4.6 mm×150 mm,5 μm,P/N: 227-30011-07,C/N:18C03033),流动相为甲醇(100%)和磷酸水溶液(0.5%),洗脱方法为梯度洗脱,检测波长为280 nm,柱温为30 ℃,流速为1.0 mL/min,进样体积为5 μL。结果表明,13种酚酸在浓度为5~100 mg/L时线性关系良好,相关系数(R2)≥0.998;在样本加标回收试验中,平均加标回收率为61.8%~131.0%。该测定方法精密度、重复性、稳定性好,适用于陕西平利绞股蓝中酚酸含量的测定。
关键词:陕西平利绞股蓝(Gynostemma pentaphyllum);酚酸;高效液相色谱法(HPLC);含量
中图分类号:TS272 文献标识码:A
文章编号:0439-8114(2024)05-0182-05
DOI:10.14088/j.cnki.issn0439-8114.2024.05.032 开放科学(资源服务)标识码(OSID):
Simultaneous detection of 13 phenolic acids in Gynostemma pentaphyllum from Pingli, Shaanxi Province by HPLC
WANG Ke, ZHOU Qiong, LI Jian-ke
(School of Modern Agriculture and Biotechnology,Ankang University, Ankang 725000,Shaanxi,China)
Abstract: In order to establish a method for simultaneously detecting the content of 13 phenolic acids in Gynostemma pentaphyllum from Pingli, Shaanxi,high performance liquid chromatography (HPLC) was used. Methanol aqueous solution (80%) was used for room temperature vortex and ultrasonic extraction,the chromatographic column was Dimensions C18(4.6 mm×150 mm,5 μm,P/N: 227-30011-07, C/N: 18C03033), with a mobile phase of methanol (100%) and phosphoric acid aqueous solution (0.5%). The elution method was gradient elution, with a detection wavelength of 280 nm, column temperature of 30 ℃, flow rate of 1.0 mL/min, and injection volume of 5 μL. The results showed that there was a good linear relationship among the 13 phenolic acids at concentrations of 5~100 mg/L, with a correlation coefficient (R2) ≥ 0.998; in the sample spiking recovery experiment, the average spiking recovery rate was 61.8%~131.0%. This determination method had good precision, repeatability, and stability, and was suitable for the determination of phenolic acids content in Gynostemma pentaphyllum from Pingli, Shaanxi.
Key words: Gynostemma pentaphyllum from Pingli,Shaanxi; phenolic acid; high performance liquid chromatography (HPLC); content
收稿日期:2023-03-20
基金项目:陕西省科技厅创新人才推进计划基金项目(2019TD-042;2023AYPT06)
作者简介:王 珂(1999-),男,陕西汉中人,本科生,专业方向为果蔬贮藏与保鲜,(电话)15929597791(电子信箱)wk199955@163.com;
通信作者,周 琼(1971-),女,贵州瓮安人,教授,博士,主要从事植物资源的研发与利用研究,(电话)13992550047
(电子信箱)kanqiongtao@163.com。
王 珂,周 琼,李建科. HPLC法同时检测陕西平利绞股蓝中13种酚酸含量[J]. 湖北农业科学,2024,63(5):182-186.
绞股蓝(Gynostemma pentaphyllum)为葫芦科绞股蓝属多年生草质藤本植物,又名七叶胆[1]。陈武等[2]认为绞股蓝性寒,其药性应属平性偏微温、味甘、微苦,归肺、脾、心、肾经,具备清热解毒、清肺化痰止咳、补气养阴生津、养心安神、固精之效用。在中国秦岭和长江流域以南广大地区分布较广[3,4]。绞股蓝是药食同源类植物资源,有南方人参和第二人参的美誉。
酚酸是指结构中带有酚类基团的有机酸,它是植物中仅次于黄酮类化合物的第二大次生代谢物[5]。近年来,酚酸作为抵抗癌症和心脏病的潜在保护因子,受到学者越来越多的关注,其部分原因是它们潜在的抗氧化活性、抗癌作用、对慢性疾病的保健作用以及在植物源食品中的广泛存在性[6,7]。同时,已有研究表明,酚酸不仅具有抗氧化、抗自由基、抑制低密度脂蛋白的氧化及预防心血管疾病的作用,而且还具有抗癌、抗炎症和抗血小板凝聚等功能[8]。关于酚酸检测有较多报道,胡华等[9]建立了利用高效液相色谱法同时测定酱油中8种酚酸的方法;黄小兰等[10]建立了同时测定地笋中丹参素、原儿茶酸、原儿茶醛、绿原酸、咖啡酸、阿魏酸和迷迭香酸7种酚酸的高效液相色谱-二极管阵列检测法(HPLC-PDA)并对不同产地地笋中酚酸成分进行分析评价;陈少洲等[11]、翁芳华等[12]也分别针对向日葵籽和蓝莓酒建立了测定其酚酸含量的方法。综上,针对陕西平利绞股蓝,探究其酚酸类化合物的测定方法及其含量的测定,优化其提取分离工艺,探究其药效物质基础,从而为其进一步地开发利用提供理论依据。
本研究通过对色谱条件(流动相、检测波长、梯度洗脱条件等)进行优化,以期建立同时测定陕西平利绞股蓝中13种酚酸(鞣花酸、水杨酸、肉桂酸等)的一种简单快速准确的分析方法,为陕西平利绞股蓝中酚酸的检测提供技术依据,同时也为绞股蓝功能性成分的研究和绞股蓝资源开发利用提供参考。
1 材料与方法
1.1 材料
绞股蓝为陕西省平利县的陕西平利绞股蓝,中国国家地理标志产品;品种为平利1#、平利2#、平利3#、平利4#。
没食子酸、新绿原酸、绿原酸等对照品均购于成都曼思特生物科技有限公司,对照品信息如表1所示。
1.2 仪器与设备
LC-2040C PLUS型高效液相色谱仪(日本株式会社岛津制作所);SHZ-DⅢ型循环水真空泵(巩义市予华仪器有限责任公司);TDZ5-WS型医用离心机、电热鼓风干燥箱(上海跃进医疗器械有限公司);H1650R型离心机[梅特勒托利多科技(中国)有限公司];超声波清洗器(昆山力波超声波设备有限公司);CP224C型万分之一天平(天津瑞泽分析仪器有限公司);全新气流式超微粉机(上海一恒科技有限公司);标准分样筛(40目0.45 mm,上海力辰邦西仪器科技有限公司)。
1.3 色谱条件
色谱柱Dimensions C18(4.6 mm×150 mm,5 μm,P/N: 227-30011-07, C/N: 18C03033);流动相A为100%甲醇,流动相B为0.5%磷酸水溶液。采用低压梯度洗脱的分离方法,流速为1.0 mL/min,柱温为30 ℃,进样体积为5 μL。具体洗脱程序如表2所示。
1.4 试验方法
1.4.1 样品处理 使用万分之一天平准确称量5 g样品,移入50 mL离心管中,加入甲醇水溶液(80%)40 mL,涡旋振荡器涡旋1 min,超声波处理60 min,使样品中酚酸充分溶出,5 000 r/min 离心5 min,将上清液移入10 mL比色管,加入甲醇水溶液(80%)定容至10 mL,过0.22 μm膜,上机检测[13-15]。
1.4.2 对照品储备溶液和混合对照品使用液的配制 使用万分之一天平分别精确称取13种酚酸对照品10.00 mg,用甲醇(100%)溶解并定容至10 mL。此时,每个对照品储备溶液的浓度为1 000 mg/L,为了得到不同浓度的对照品储备溶液,进一步用甲醇(100%)稀释。分别准确吸取1 mL 1 000 mg/L的 13种对照品储备溶液,分别用甲醇(100%)定容至10 mL得到浓度为100 mg/L的对照品储备溶液。分别移取0.5 mL 100 mg/L的各对照品储备溶液,充分混匀,得到浓度为100 mg/L的混合对照品使用液。溶液置于4 ℃冰箱中避光保存。
2 结果与分析
2.1 色谱条件的优化
2.1.1 检测波长 将13种100 mg/L的对照品储备溶液稀释后上机测定,检测波长分别为280 nm和320 nm。通过比较2种波长下的色谱图及出峰情况,发现13种酚酸在检测波长为280 nm时有更好的吸收。
2.1.2 流动相 甲醇水溶液、乙腈水溶液可以作为流动相分离酚酸[16],但羟基在水溶液中容易发生电离,极性增强,在固定相表面形成双重保留,色谱峰拖尾严重。通过加入少量酸性调节剂可以改善此类情况。酸性调节剂有多种选择,如甲酸、乙酸、磷酸等[9],在预试验中,选择甲醇-0.5%乙酸水溶液作为流动相,将13种100 mg/L的对照品储备溶液上机检测,得到13种对照品储备溶液的出峰时间。由表3的出峰时间可以判断,以甲醇-0.5%乙酸水溶液作为流动相并不理想。同时,甲醇和乙腈均具有较好分离效果,但乙腈的毒性较大,因此选择甲醇作为有机流动相。综上,本试验以甲醇(100%)作为有机流动相(流动相A),以磷酸(0.5%)作为酸性调节剂(流动相B)。
2.1.3 梯度洗脱 采用等度洗脱的模式,流动相A(100%甲醇)与流动相B(0.5%磷酸水溶液)以1∶1的比例进行洗脱,总时长为1 h,流速为0.3 mL/min,在此模式下,分离度较差,达不到本试验的预期目的。因此将等度洗脱改为梯度洗脱,流速为1 mL/min,通过对13种酚酸色谱(280 nm)(图1)进行分析可知,梯度洗脱程序能很好地将13种酚酸分离,得到较好的色谱图。
2.2 标准曲线的建立
为了准确计算陕西平利绞股蓝样品中酚酸含量,分别取100 mg/L混合对照品使用液适量,用甲醇配制成5个不同浓度的混合对照品使用液,分别为100、50、25、10、5 mg/L,在280 nm波长和梯度洗脱条件下进样检测,以浓度为横坐标、峰面积为纵坐标绘制标准曲线。由表4可知,13种酚酸在浓度为5~100 mg/L范围内线性关系良好,相关系数(R2)≥0.998。
2.3 精密度试验
取平利3#样品,按照“1.4.1”方法对样品进行前处理,得到上机检测样品溶液,重复进样5次[17],记录峰面积,同时根据标准曲线计算溶液中酚酸含量,计算相对标准偏差(RSD),如表5所示。结果表明仪器精密度良好。
2.4 稳定性试验
取平利3#样品,按照“1.4.1”方法对样品进行前处理,分别在0、4、8、12、16、24 h进样[13]。计算峰面积、酚酸含量的相对标准偏差(n=6),如表6所示。结果表明样品溶液在24 h内稳定性良好。
2.5 重复性试验
取同一平利3#样品,按照“1.4.1”方法对样品进行前处理,平行5份[18,19],在波长280 nm和梯度洗脱条件下检测,记录峰面积以及计算酚酸含量,从而计算相对标准偏差(n=5),如表7所示。结果表明该方法重复性良好。
2.6 加标回收试验
根据本试验方法,分别精密称取5份平利3#粉末5 g,按“1.4.1”方法对样品进行前处理,精密加入0.5 mL 100 mg/L的混合对照品使用液,混匀后在280 nm波长和梯度洗脱条件下进行测定,重复进样5次,计算平均加标回收率[20,21],如表8所示。9种酚酸的平均加标回收率为61.8%~131.0%,表明该方法准确可靠,可用于绞股蓝中酚酸含量的测定。
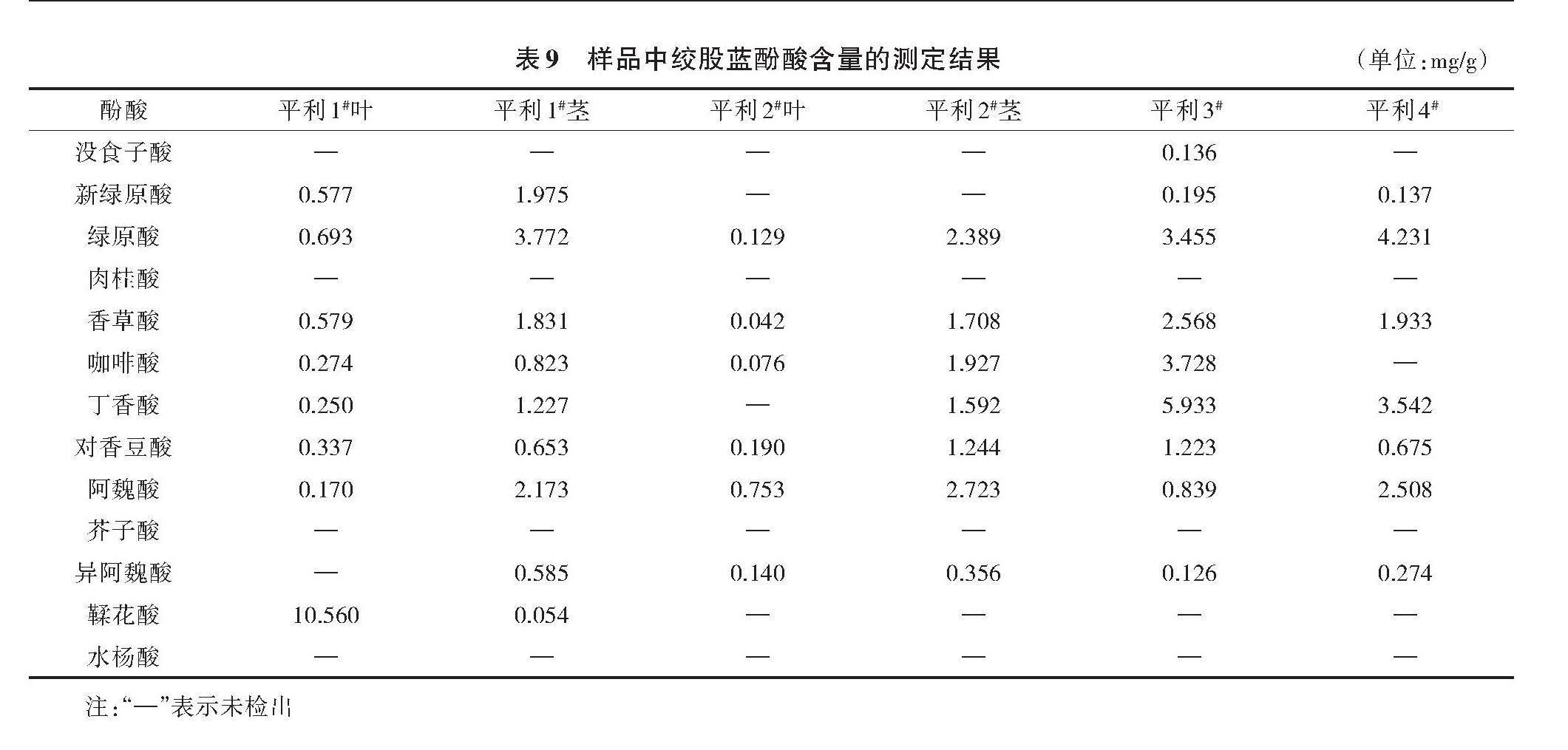
2.7 样品测定
由表9可知,平利1#叶样品检出8种酚酸,分别为新绿原酸、绿原酸、香草酸、咖啡酸、丁香酸、对香豆酸、阿魏酸、鞣花酸,总含量为13.440 mg/g,平均含量为1.680 mg/g。平利1#茎样品检出9种酚酸,总含量为13.093 mg/g,平均含量为1.455 mg/g。平利2#叶样品检出6种酚酸,总含量为1.330 mg/g,平均含量为0.222 mg/g。平利2#茎样品检出7种酚酸,总含量11.939为 mg/g,平均含量为1.706 mg/g。平利3#号样品检出9种酚酸,总含量为18.203 mg/g,平均含量为2.023 mg/g。平利4#样品检出7种酚酸,总含量为13.300 mg/g,平均含量为1.900 mg/g。
3 小结
不同品种、不同采集部位的陕西平利绞股蓝中13种酚酸含量存在较大差异,如平利1#叶中鞣花酸含量高达10.56 mg/g,而平利2#叶、平利2#茎、平利3#、平利4#中未检出鞣花酸。本研究建立同时检测陕西平利绞股蓝中13种酚酸含量的高效液相色谱法,以甲醇(100%)和磷酸水溶液(0.5%)作为流动相,该测定方法精密度、重复性、稳定性好,适用于陕西平利绞股蓝中酚酸含量的测定,可以为绞股蓝的进一步开发与利用提供参考。
参考文献:
[1] 牛俊峰,肖娅萍,姜东亮,等.5个不同地区绞股蓝中挥发性成分的SPME-GC-MS分析[J]. 药物分析杂志,2012(4):578-582.
[2] 陈 武,邹盛勤,伍晓春,等.绞股蓝无糖口含片的制备工艺[J].安徽农业科学,2007,35(18):5559-5561.
[3] 蒋伟哲,周燕文,席洁珍.广西6种栽培绞股蓝中多糖的分析[J].中国药师,2006,9(12):1107-1109.
[4] 吴宗群,王 艳.绞股蓝的化学成份和药理作用研究现状[J].中华全科医学,2011,9(1):116-117.
[5] 谢 越,俞 浩,汪建飞,等.高效液相色谱法同时测定滁菊样品中的9种酚酸[J].分析化学,2013,41(3):383-388.
[6] MATTILA P, KUMPULAINEN J. Determination of free and total phenolic acids in plant-derived foods by the HPLC with diode-array detection[J].Journal of agricultural & food chemistry,2002, 50(13):3660-3667.
[7] LODOVICI M, GUGLIELMI F, MEONI M,et al. Effect of natural phenolic acids on DNA oxidation in vitro[J]. Food & chemical toxicology,2001,39(12):1205-1210.
[8] REVILLA E, RYAN J M. Analysis of several phenolic compounds with potential antioxidant properties in grape extracts and wines by high-performance liquid chromatography-photodiode array detection without sample preparation[J]. Journal of chromatography A,2000,881(1):461-469.
[9] 胡 华,张惟广,肖昭竞,等.HPLC法测定酱油中的8种酚酸[J].食品与发酵工业,2009,35(8):122-125.
[10] 黄小兰,郭冬琴,王 骞,等.HPLC-PDA同时测定地笋中7种酚酸的含量[J].中国实验方剂学杂志,2020,26(15):156-162.
[11] 陈少洲,吕飞杰,台建祥.向日葵籽中酚酸含量的高效液相色谱测定方法研究[J].食品科学,2003(1):107-110.
[12] 翁芳华,陈建业,温鹏飞,等.蓝莓酒中11种酚酸的高效液相色谱测定[J].食品科学,2006,27(9):113-117.
[13] 张慧芳,许秀萍,孙宗淼.HPLC法同时测定杭菊中6种成分的含量[J].中药材,2014,37(11):2030-2033.
[14] 江 萍,徐贵华,刘东红,等.15种柑橘果皮中酚酸的含量测定[J].食品与发酵工业,2008,34(6):124-128.
[15] YAO L,DATTA N,TOMAS-BARBERAN F A,et al. Flavonoids, phenolic acids and abscisic acid in Australian and New Zealand Leptospermum honeys[J]. Food chemistry,2003,81(2):159-168.
[16] 吴燕华,刘文力,阎 红,等.高效液相色谱法测定苹果中的酚类物质[J].分析化学,2002,30(7):826-828.
[17] 匡凤元,吴光斌,张 珅,等.HPLC法同时测定采后莲雾果实木质素代谢途径中5 种酚酸的含量[J].食品科学,2020,41(8):121-125.
[18] 沈 薇,石晓峰,胡彩香,等. HPLC法同时测定雪松不同部位5种酚酸类成分的含量简[J]. 药物分析杂志,2016(12):56-61.
[19] 孙佳莹,刘 娟,王 宏,等. HPLC法对贺兰山东麓干红葡萄酒中酚类物质的测定与分析[J]. 中外葡萄与葡萄酒,2017(2):61-64.
[20] 周亚萍,魏东伟,孙武勇,等.高效液相色谱法测定玉米幼苗叶片中4种酚酸类化合物[J]. 中国农学通报,2019,35(13):36-41.
[21] 姜 莉,王玉堂.高效液相色谱法同时测定黑米酒中11种酚类物质[J].中国酿造,2014,33(2):134-137.

