根际细菌对番茄幼苗生长的影响
刁风伟 黄琰哲 许子荣 王保平 周静 王秀红
摘要 利用阿须贝氏无氮培养基在番茄根际土中筛选到5株细菌菌株,鉴定菌株生物学分类;然后以番茄为供试植物,分别添加5株菌株菌液为处理,研究根际细菌对番茄幼苗生长和根系结构的影响。结果显示,5株菌株均显著降低了番茄幼苗的株高和SPAD值。FN2和FN6菌株显著降低了植物的干重、鲜重和地上部的投影面积。FN6菌株还降低了植物的根总表面积和根总体积。5株菌株都未呈现出正向促进效应。该研究为开发根际细菌存在的潜在风险提供警惕。
关键词 根际细菌;番茄;根系结构;抑制生长
中图分类号 S641.2 文献标识码 A 文章编号 0517-6611(2024)11-0032-04
doi:10.3969/j.issn.0517-6611.2024.11.008
Effect of Rhizobacteria on Growth in Tomato Seedling
DIAO Feng-wei,HUANG Yan-zhe,XU Zi-rong et al
(Shanxi Institute of Organic Dryland Farming, Shanxi Agricultural University/Key Laboratory of Sustainable Dryland Agriculture (Co-construction by Ministry of Agriculture and Rural Affairs and Shanxi Province),Taiyuan, Shanxi 030031)
Abstract Five bacterial strains were selected in tomato rhizosphere soil using Ashbys nitrogen-free agar medium,and their biological classifications were identified,respectively. Tomato was used to study the effects of five rhizobacteria on growth and root architecture.The results showed that all five strains significantly decreased the plant height and SPAD index in tomato seedlings.FN2 and FN6 significantly decreased the dry weight,fresh weight and shoot projected area.FN6 also decreased the total root surface area and total root volume of tomato.In a word,the five rhizobacteria did not emerge a positive effect,and this study provided a vigilance against the potential risks on application of rhizobacteria.
Key words Rhizobacteria;Tomato;Root architecture;Inhibition of growth
基金项目 山西省青年科学研究项目(202103021223152);山西农业大学博士科研启动项目(2021BQ132);山西省博士毕业生、博士后研究人员来晋工作奖励经费科研项目(SXBYKY2022-084) 。
作者简介 刁风伟(1990—),男,山东聊城人,助理研究员,博士,从事微生物学研究。*通信作者,副研究员,博士,硕士生导师,从事微生物学研究。
收稿日期 2023-08-01
土壤微生物能分解和合成有机物,参与全球元素循环,它们能够以互利共生的方式活跃于植物根表,形成结构复杂的根际微生物群落,影响植物营养吸收和健康[1]。这些聚集于根际的微生物群落形成了植物“第二基因组”[2-3]。根际微生物与植物的关系类似于肠道微生物与人体的关系[4]。植物能通过根际分泌物以及免疫系统物质调节根际微生物群落的构成,而根际微生物也能通过代谢活动参与到植物的生长发育、养分吸收和胁迫响应等过程[1]。尽管越来越多的根际微生物被研究,揭示出有促生与生防功能,但根际微生物与植物建立的作用关系是否长久稳定,仍不清楚。
随着人们对过度施用化肥引起的生态环境问题的重视,农业绿色持续发展的关注,包括尿素、二胺等氮肥过剩引起的土壤元素不平衡、植物徒长、果实品质低和水体污染、富营养化,甚至诱发大气中氮氧化物等温室气体含量增加等问题[5]。在农业生产中,替代如氮肥等化肥,减轻其引起的环境问题,已经刻不容缓。微生物研究者关注到根际微生物的潜在价值,凭借微生物的固氮作用,探究施用菌剂替代氮肥的可行性。雷海英等[6]采用阿须贝氏(Ashby)无氮培养基,从苦参的根际土中筛选到2株根际固氮菌,分别隶属于芽孢杆菌属和假单孢菌属,将菌剂添加到苦参幼苗中,生长30 d后显示出添加菌剂增加了植株的株高和叶片数,促进了植物幼苗生长。薛智权等[7]采用Ashby无氮培养基筛选到2株具有固氮能力的细菌,黄芪种子分别经2种菌液浸泡后种植,与未浸泡菌液的对照相比,株高分别增加了17.8%和64.4%,叶片数也显著增加。程杰杰等[8]研究分离自玉米根际的固氮菌株对玉米和水稻的促生效果,结果显示,施用菌液对玉米和水稻的生长具有促进作用。然而,筛选的根际促生细菌是否能够稳定地促进植物生长,或者频繁地施加促生菌菌剂是否会对植物产生负效应,却鲜有报道。
番茄(Lycopersicon esculentum)属于管状花目茄科番茄属,是世界上价值较高的水果和蔬菜[9]。我国是世界上最大的番茄生产和消费国家之一,2021年我国番茄产量达6 609万t,在蔬菜作物中位居榜首[10-11]。我国番茄种植方式已从露天种植逐步转向大棚设施内,提质、增效和集约化管理、生物防治、减肥减药的原则逐渐深入人心[10]。探究施用根际细菌对番茄生长的影响,具有推动番茄健康发展的重要意义。笔者采用Ashby无氮培养基从番茄根际土中筛选根际固氮菌,研究根际细菌对番茄幼苗根系及生长的影响,揭示根际细菌在番茄栽培中的应用潜力与风险。
1 材料与方法
1.1 试验材料
菌株筛选于番茄根际土壤,该土壤样品为2022年3月采集于山西农业大学东阳试验基地大棚内结果期番茄植株根际。
盆栽试验供试番茄品种为晋番茄四号;栽培基质采用蛭石;栽培花盆的规格为直径12.0 cm×高12.5 cm×底径10.0 cm。
1.2 培养基
LB液体培养基:胰蛋白胨10.0 g,酵母浸出粉5.0 g,NaCl 10.0 g,一次水定容至1 000 mL,pH 7.0~7.4。121 ℃高压蒸汽灭菌21 min备用。
LB固体培养基:胰蛋白胨10.0 g,酵母浸出粉5.0 g,NaCl 10.0 g,琼脂16.0 g,一次水定容至1 000 mL,pH 7.0~7.4。121 ℃高压蒸汽灭菌21 min备用。
阿须贝氏(Ashby)无氮培养基:甘露醇10.0 g,KH2PO4 0.2 g,NaCl 0.2 g,CaSO4·2H2O 0.1 g,CaCO3 5.0 g,MgSO4·7H2O 0.2 g,琼脂15.0 g,一次水定容至1 000 mL,pH 6.8~7.0。
1.3 菌株筛选与鉴定
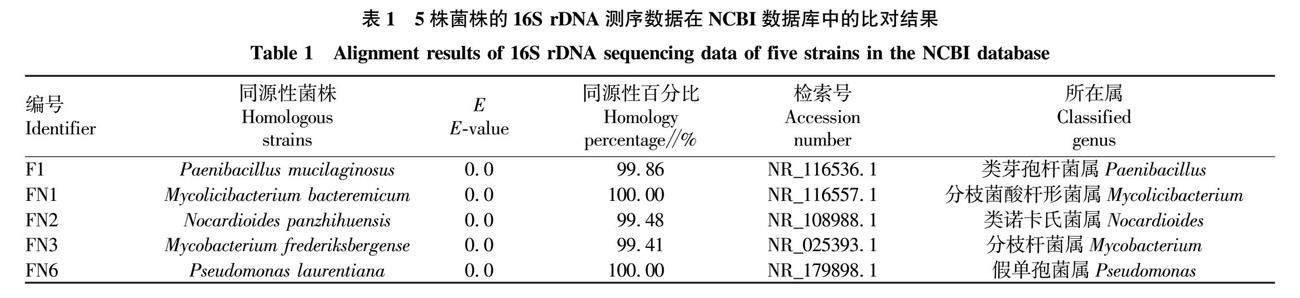
称量采集的番茄根际土1 g,将土样置于含有玻璃珠的锥形瓶中,添加99 mL无菌水,然后37 ℃、170 r/min振荡30 min,获得土壤悬浊液。取悬浊液1 mL,使用梯度稀释法,稀释为10-1、10-2、10-3、10-4、10-5、10-6浓度的悬浊液。然后每一浓度吸取200 μL涂布到Ashby无氮培养基平板上。上述过程重复3次。37 ℃恒温培养48 h,观察菌落的大小、颜色、边缘、光泽、透明度等。使用接种环挑取不同形态的菌落,分别在新的Ashby无氮培养基平板上反复纯化,挑取单菌落反复纯化至少7次。将纯化的菌株接种到LB固体培养基斜面和Ashby无氮培养基斜面上,置于4 ℃冰箱保存以供下一步使用。另添加20%甘油若滴,保存于-80 ℃冰箱内。该过程最终筛选获得5株菌株,分别命名为F1、FN1、FN2、FN3、FN6。
菌株鉴定采用16S rDNA的分子鉴定方法。收集1 mL OD600为1.0~1.5的细菌菌液,离心弃上清后加入含有酶RNase A的缓冲液,加入溶菌酶,室温静置5 min,反复离心、冲洗与水浴,提取细菌的基因组DNA。采用引物27F和1492R(5′-AGAGTTTGATCCTGGCTCAG-3′和5′-CTACGGCTACCTTGTTACGA-3′)进行PCR扩增。反应体系为基因组DNA 1.0 μL, 10×Buffer(含Mg2+)5.0 μL,Taq聚合酶1.0 μL,dNTP 1.0 μL,正反引物各1.5 μL,补充ddH2O至50.0 μL。程序为95 ℃预变性5 min,然后95 ℃变性30 s,58 ℃退火 30 s,72 ℃延伸1.5 min,进行35个循环,最终72 ℃延伸7 min。按照AxyPrep DNA凝胶回收试剂盒说明书进行PCR产物的回收。使用ABI3730-XL测序仪进行DNA测序,将测序结果与NCBI核酸数据库进行比对,获得物质序列相似性最大的物种信息,作为鉴定结果。
1.4 菌液的制备
使用接种环分别挑取在LB固体培养基平板上活化的5株菌株的单菌落,接种至250 mL LB液体培养基中,重复3次。30 ℃ 170 r/min恒温振荡培养3 d,获得菌液。将重复培养获得的菌液混合摇匀,用于盆栽试验。
1.5 盆栽试验
自2023年2月12日至3月28日,在山西农业大学玻璃温室内进行盆栽试验,以自然光为光照条件,温度维持在15~35 ℃,湿度维持在40%~65%。采用完全随机设计,以番茄作为供试植物,分别添加筛选到的菌株F1、FN1、FN2、FN3、FN6菌液作为处理,添加未接种菌株的培养液作为对照CK,设置6个重复,每盆保留2株植株,共36盆。
挑选外形大小一致且饱满的番茄种子,用75%乙醇溶液浸泡5 min进行消毒,然后使用蒸馏水冲洗3次,再将种子浸泡在含有无菌水的培养皿内。栽培基质选取蛭石,先采用高压蒸汽灭菌法121 ℃、90 min进行灭菌,然后晾干。花盆使用75%乙醇进行消毒。在每个花盆中装入灭菌的蛭石500 g,然后将番茄种子点播到蛭石表面2 cm以下,每盘点播3粒。采用称重法保持含水量为80%。10 d出苗后,保留长势一致的植株,每盆间苗为2株,每盆浇灌Hogland营养液20 mL。继续种植14 d后,进行施用菌剂处理。分别添加F1、FN1、FN2、FN3、FN6菌株制成的菌液和未接种菌株的培养液100 mL,24和34 d后,都再次施用相应的菌液100 mL。44 d后,测量番茄植株的株高、茎粗和SPAD值,然后收获植株。
1.6 指标测量
株高的测量使用精度为1 mm的直尺;茎粗的测量使用精度为0.01 mm的游标卡尺;SPAD值的测量使用叶绿素仪SPAD-502 Plus(Konnica Monlta,日本)。
鲜重的测量使用精度为0.01 g的电子天平称量植株的地上部和根系;干重的测量使用烘箱70 ℃对测完鲜重的植物样品烘干2 d,再使用精度为0.000 1 g的电子天平称量。
根直径、根总长、根总面积和根总体积的测量使用根系扫描仪Epson Twain Pro(Epson,日本)对平铺的植物根系进行扫描,然后使用根系形态学和结构分析软件WINRhizo分析计算;地上部投影面积的测量同样使用根系扫描仪Epson Twain Pro对平铺的植物地上部(包括叶片和茎)进行扫描,然后使用软件WINRhizo分析计算。
1.7 数据统计分析
分别将5种菌株处理的指标与对照的指标进行t检验分析,统计结果P<0.05标记*,P<0.01标记**。统计分析使用软件SPSS 16.0进行。
2 结果与分析
2.1 菌株的生物学鉴定
使用Ashby无氮培养基,从连作的番茄根际土中分离筛选到5株菌株,编号为F1、FN1、FN2、FN3和FN6。使用16S rDNA方法对5株菌株进行分子生物学鉴定。结果显示,F1、FN1、FN2、FN3和FN6分别与菌株Paenibacillus mucilaginosus、Mycolicibacterium smegmatis、Nocardioides panacihumi、Mycobacterium asiaticum和Pseudomonas laurentiana具有高度同源性,同源性百分比均大于99%(表1)。5株菌株F1、FN1、FN2、FN3和FN6分别属于类芽孢杆菌属(Paenibacillus),分枝菌酸杆形菌属(Mycolicibacterium),类诺卡氏菌属(Nocardioides),分枝杆菌属(Mycobacterium),假单孢菌属(Pseudomonas)。
2.2 根际细菌对番茄鲜重和干重的影响
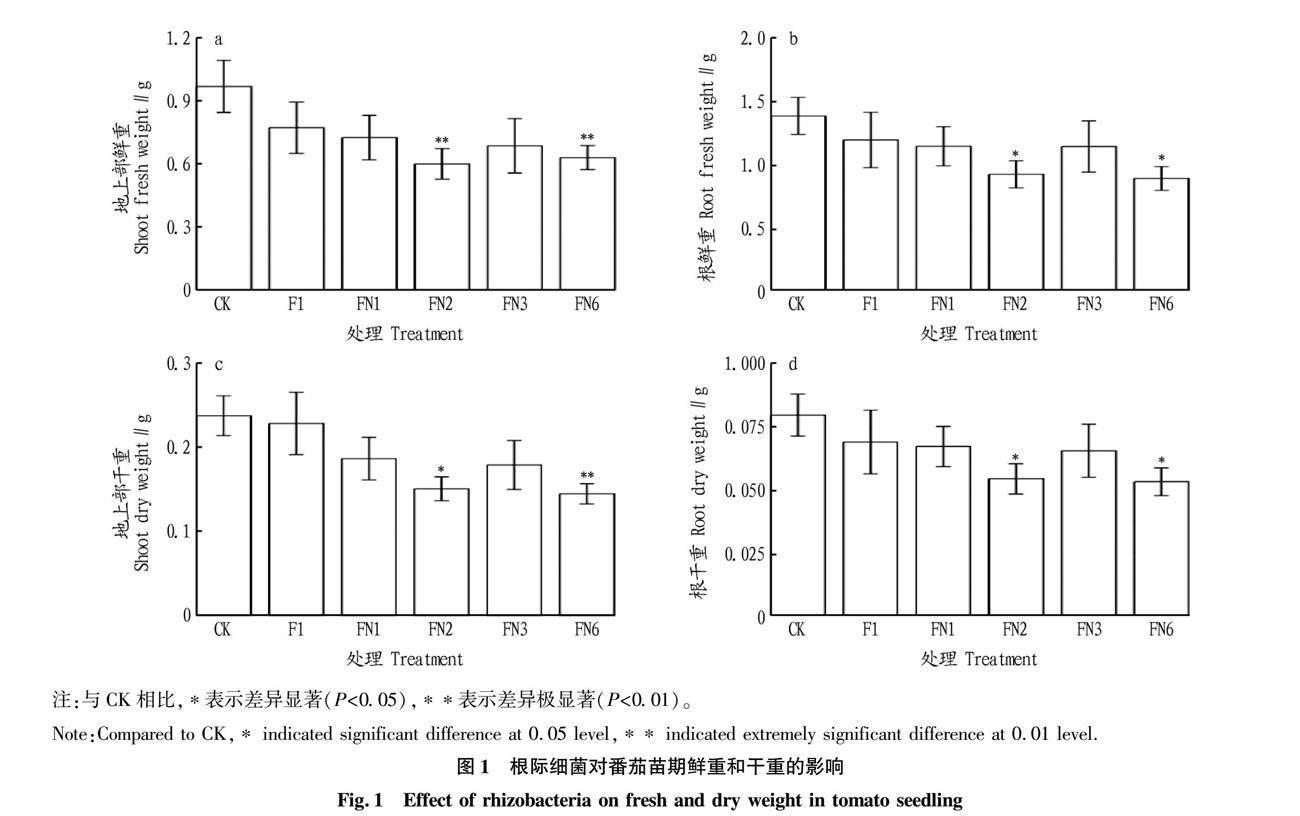
由图1可知,与CK相比,添加5种菌株都呈降低番茄植株生物量的趋势,FN2和FN6显著降低植株的地上部鲜重、干重和根系的鲜重和干重。FN2分别降低了36.5%和31.9%的地上部干重和根干重,FN6分别降低了39.1%和33.3%的地上部干重和根干重。
2.3 根际细菌对番茄苗期株高和茎粗的影响
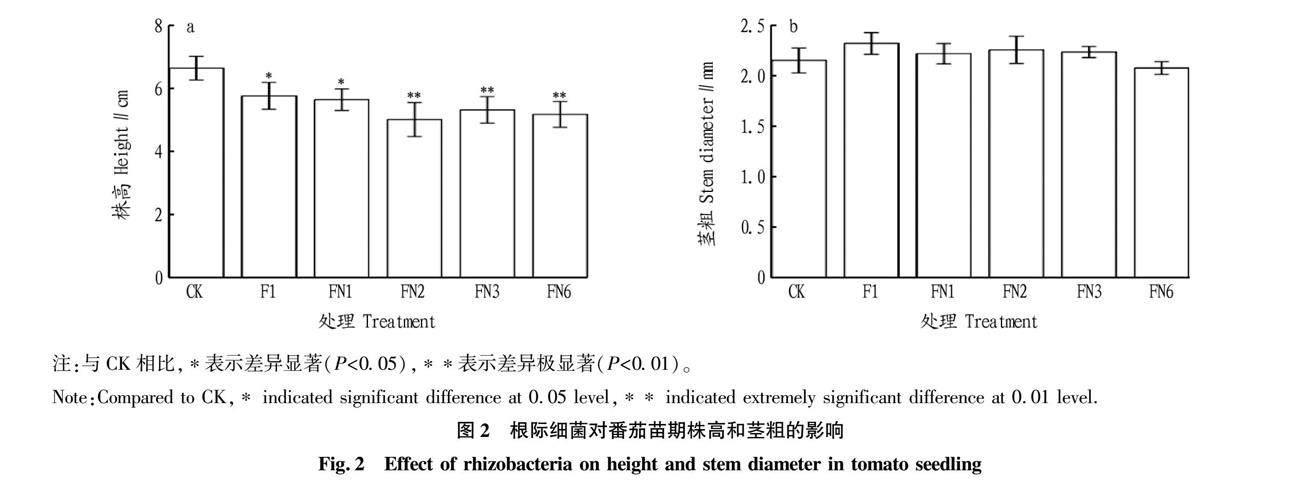
5种菌株都显著抑制了番茄植株的株高,与对照相比分别降低了13.2%、15.1%、24.6%、20.0%和22.1%,特别是FN2、FN3、FN6达极显著效果(图2a)。5种菌株都未显著影响植物的茎粗(图2b)。
2.4 根际细菌对番茄叶片SPAD值和地上部投影面积的影响
5种菌株都显著降低了番茄叶片的SPAD值,且F1、FN1、FN3和FN6达极显著水平,降幅分别为15.7%、22.7%、20.0%、15.8%和23.8%(图3a)。
FN2和FN6显著降低了番茄地上部的投影面积,降幅分别为37.0%和38.7%(图3b)。
2.5 根际细菌对番茄根系特性的影响
与CK相比,FN1和FN2显著降低了番茄根直径,降幅分别为11.7%和11.2%(图4a)。5种菌株都未显著影响番茄根总长(图4b)。与CK相比,FN6显著降低了根总表面积,降幅为28.9%(图4c)。与CK相比,FN2和FN6显著降低了根总体积,降幅分别为32.0%和33.4%(图4d)。
3 结论与讨论
植物根际促生菌(PGPR)凭借自身的固氮、解磷、解钾或分泌生长素等多种功能,通常促进植物的生长[12-14]。迄今为止,从自然界中已鉴定出的PGPR菌株有20多个属,包括假单孢菌属(Pseudomonas)、节杆菌属(Arthrobacter)、芽孢杆菌属(Bacillus)等[15]。其中根际固氮菌属于PGPR中的一类,因为他们能够固定空气中的氮气,从而增加土壤含氮量,进而促进植物的生长[16-18]。该研究利用Ashby无氮培养基选择性地筛选出具有固氮能力的根际细菌5株,分别隶属于5个不同的菌属,包括假单孢菌属(Pseudomonas)、类芽孢杆菌属(Paenibacillus)、分枝菌酸杆形菌属(Mycolicibacterium)、类诺卡氏菌属(Nocardioides)和分枝杆菌属(Mycobacterium)。
采用Ashby无氮培养基筛选出的细菌菌株,通常表现出促进植物生长的效果。王楠等[19]从植物根际土中筛选到5株根际固氮菌,用于番茄幼苗的促生研究,结果显示根际固氮菌增加了番茄幼苗的生物量。雷海英等[6]筛选到的根际固氮菌增加了苦参幼苗子叶的数目和株高的高度。薛智权等[7]筛选的根际固氮菌同样促进了黄芪植株的生长。程杰杰等[8]施用根际固氮菌促进了玉米和水稻的生长。然而,何建清等[20]筛选到10株根际固氮菌应用于青稞幼苗的生长中,结果显示, 5株菌株抑制了植物的生长,6株菌株显著降低了植物的干重,只有1株菌株促进了干物质的积累。该试验结果显示,筛选到的5株根际细菌都呈现出抑制番茄幼苗的生长,FN2和FN6还显著降低了番茄幼苗的地上部和根部干重和鲜重。FN6菌株的负效应还表现在影响根系的表型结构,FN6处理显著降低了幼苗的根总面积和根总体积。这种负向结果暗示,根际细菌有时与宿主植物未能保持良好的互利共生关系。可能细菌数量在一定阈值范围内或者共生关系建立在某些特定生境下,植物才可能在这种共生关系中受益且被促进生长[21-22]。该研究结果提示,在利用根际细菌时,应当警惕其引起的负面效益,不可盲目开发利用。
从番茄根际土中筛选获得的5株根际细菌,应用于番茄幼苗生长中时,都未呈现正效应。尤其是,FN2和FN6菌株显著降低了番茄的株高、地上投影面积,抑制了植物生物量的积累,干扰了叶绿素的合成。FN6菌株还对番茄根系生长呈现出抑制效应。这些结果提醒不能盲目地开发利用根际细菌,深入地探究根际细菌与植物之间的互作机制很有必要。
参考文献
[1]崔中利,叶现丰,张宇,等.根际微生物组组装与植物健康[J].微生物学杂志,2022,42(6):1-9.
[2] 郝志敏,钱欣雨,董金皋.植物微生物组的功能及应用研究进展[J].微生物学杂志,2021,41(3):1-7.
[3] TKACZ A,POOLE P.Role of root microbiota in plant productivity[J].Journal of experimental botany,2015,66(8):2167-2175.
[4] 张瑞福.根际微生物:农业绿色发展中大有作为的植物第二基因组[J].生物技术通报,2020,36(9):1-2.
[5] 杨忠妍.化肥施用过量对农作物的危害[J].现代农业科技,2020(21):203-204,212.
[6] 雷海英,赵青松,杨潇,等.苦参根际高效固氮菌的分离及复合菌肥对幼苗的促生效应[J].生物技术通报,2020,36(9):157-166.
[7] 薛智权,唐中伟,李浩,等.山西黄芪根际固氮菌的分离与应用[J].山西农业大学学报(自然科学版),2016,36(7):483-488.
[8] 程杰杰,殷超凡,萨尔山别克·热阿合曼,等.固氮菌 Kosakonia radicincitans GXGL-4A 对玉米和水稻的促生作用及其根际定殖动态[J].江苏农业科学,2018,46(2):33-37.
[9] TIEMAN D,ZHU G T,RESENDE M F R,JR,et al.A chemical genetic roadmap to improved tomato flavor[J].Science,2017,355(6323):391-394.
[10] 牛艳,王晓静,陈翔,等.中国番茄产业发展的现状问题和对策及宁夏番茄产业发展成效[J].黑龙江农业科学,2022(12):70-74.
[11] 霍建勇.中国番茄产业现状及安全防范[J].蔬菜,2016(6):1-4.
[12] 周益帆,白寅霜,岳童,等.植物根际促生菌促生特性研究进展[J].微生物学通报,2023,50(2):644-666.
[13] 何宏涛,王玉虎,周洪友,等.番茄根际产生长素菌株分离及其对番茄和马铃薯幼苗的促生作用[J].江苏农业科学,2022,50(19):219-225.
[14] 田婧,李邵,马宁,等.植物根际促生菌作用机理研究进展[J].安徽农业科学,2016,44(10):1-2,39.
[15] 韩学东,杜春梅,董锡文.植物根际促生菌研究综述[J].乡村科技,2023,14(5):87-90.
[16] 杜普旋,陈荣华,邓权清,等.花生根瘤菌的分离筛选及应用[J].南方农业学报,2023,54(1):102-109.
[17] COBAN O,DE DEYN G B,VAN DER PLOEG M.Soil microbiota as game-changers in restoration of degraded lands[J].Science,2022,375(6584):1-11.
[18] 靳海洋,王慧,张燕辉,等.基于基因组的一株土壤固氮菌分离菌株鉴定及其促生作用[J].微生物学报,2021,61(10):3249-3263.
[19] 王楠,李刚强,李云龙,等.固氮类芽孢杆菌的分离鉴定及其促生、抑菌活性的测定[J].中国农业科技导报,2019,21(5):95-103.
[20] 何建清,张格杰,赵伟进,等.青稞根际优良联合固氮菌的筛选及鉴定[J].干旱地区农业研究,2019,37(5):182-186,192.
[21] 曾青,熊超,尹梅,等.植物微生物组生态功能与群落构建过程研究进展[J].生物多样性,2023,31(4):182-198.
[22] CHERNOV T I,SEMENOV M V.Management of soil microbial communities:Opportunities and prospects (a review)[J].Eurasian soil science,2021,54(12):1888-1902.

