基于预后营养指数的分级营养支持对胃癌根治性手术患者营养状态、睡眠的影响
韦文华 王伟雄


摘要 目的:分析基于预后营养指数(PNI)的分级营养支持在胃癌根治术患者中的应用效果。方法:选取2022年3月至2023年10月霞浦县医院收治的行根治性手术的胃癌患者58例作为研究对象,随机分为观察组和对照组,每组29例。对照组围术期接受常规营养支持,观察组接受基于PNI的分级营养支持。比较2组患者术后营养状态、免疫状态、术后康复及睡眠质量。结果:观察组术后7 d PNI高于对照组,血清前白蛋白、转铁蛋白、IgG、IgM显著较高( P <0.05)。观察组术后肛门排气时间、恢复经口进食时间、住院时间短于对照组( P <0.05)。观察组术后阿森斯失眠量表评分低于对照组( P <0.05)。结论:基于PNI的分级营养支持可改善胃癌根治术患者免疫与营养状态,加快术后康复,减少睡眠障碍。
关键词 胃癌;预后营养指数;营养支持;免疫;睡眠;术后康复
Effect of Graded Nutritional Support Based on Prognostic Nutritional Index on the Nutritional Status and Sleep of Gastric Cancer Patients Undergoing Radical Surgery WEI Wenhua,WANG Weixiong
(The third Department of Xiapu County Hospital,Xiapu 355100,China)
Abstract Objective: To know the effect of graded nutritional support based on a prognostic nutritional index(PNI) in gastric cancer patients undergoing radical surgery. Methods: Fifty-eight gastric cancer patients who underwent radical surgery were enrolled and randomly divided into an observation group( n =29) and a control group( n =29).The control group received routine nutritional support,while the observation group received graded nutritional support based on PNI.The two groups′ postoperative nutritional status,immune status,recovery,and sleep quality were compared. Results: The PNI of the observation group was higher than that of the control group 7 d after surgery,and the serum albumin,transferrin,IgG,and IgM were significantly higher( P <0.05).The observation group had shorter postoperative exhaust time,oral feeding time,and hospital stay than the control group( P <0.05).The postoperative Asens insomnia scale score of the observation group was lower than that of the control group( P <0.05). Conclusion: Graded nutritional support based on PNI can improve the immune and nutritional status of gastric cancer patients undergoing radical surgery,accelerate postoperative recovery,and reduce sleep disorders.
Keywords Gastric cancer; Prognostic nutritional index; Nutritional support; Immunization; Sleep; Postoperative recovery
中图分类号:R473.5 文献标识码:A doi: 10.3969/j.issn.2095-7130.2024.03.067
胃癌是常见的消化系统恶性肿瘤。我国最新肿瘤登记数据显示,胃癌发病率与死亡率分别位居恶性肿瘤疾病谱第4位与第3位[1]。对于无法行内镜下治疗的胃癌患者,根治性手术为首选治疗方法。恶性肿瘤为消耗性疾病,营养不良发生风险显著高于普通人群[2]。胃癌所致的消化吸收障碍、幽门梗阻影响正常进食也会导致营养问题。胃癌根治术创伤重,患者术后早期多数无法正常进食,处于高分解状态,能量消耗大幅度增加,易出现负氮平衡,导致或加剧营养不良[3]。营养不良会影响患者对手术的耐受性,增加术后并发症,延长住院时间,也与远期预后关系密切,会增加复发、进展与死亡风险,缩短无疾病生存期与总生存期(Overall Survival,OS)[4]。创伤应激、炎症反应、疼痛、住院环境、负性情绪等因素均会对胃癌根治术患者睡眠产生影响,表现为入睡困难、睡眠时间减少等[5]。睡眠障碍会加重患者疼痛敏感,降低其活力,阻碍术后康复。研究显示,合理的营养支持不仅可改善胃癌患者营养状态,降低营养风险,减少术后并发症,也可减少睡眠障碍,促进术后康复[6]。本研究拟探讨预后营养指数(Prognostic Nutritional Index,PNI)的分级营养支持在胃癌根治术患者中的应用效果,现报道如下。
1 资料与方法
1.1 一般资料 选取2022年3月至2023年10月霞浦县医院收治的行根治性手术的胃癌患者58例作为研究对象,随机分为观察组和对照组,每组29例。观察组中男16例,女13例,年龄41~84岁,平均年龄(61.8±10.7)岁;平均体质量指数(Body Mass Index,BMI)(23.1±2.9)kg/m2;TNM分期:Ⅰ期9例,Ⅱ期13例,Ⅲ期8例;术式:全胃切除8例,近端胃切除3例,远端胃切除18例。对照组中男14例,女15例,年龄39~82岁,平均年龄(59.4±11.8)岁,平均BMI(22.9±2.7)kg/m2;TNM分期: Ⅰ期7例,Ⅱ期16例,Ⅲ期6例;术式:全胃切除10例,近端胃切除2例,远端胃切除17例。一般资料经统计学分析,差异无统计学意义( P >0.05),具有可比性。本研究经医院医学伦理委员会审核通过。
1.2 纳入标准 1)经组织病理学检查确诊胃癌;2)有根治性手术指征;3)术前未接受过放疗、化疗、免疫治疗等抗肿瘤治疗;4)对本研究知情同意,并签署知情同意书。
1.3 排除标准 1) 合并炎症性肠病、幽门梗阻等严重影响免疫与营养状态的疾病;2)近3个月使用过免疫调节药物者;3)合并严重心、肺、肝、肾疾病;4)合并其他恶性肿瘤;5)合并精神疾病或认知障碍;6)确诊胃癌前有慢性睡眠障碍;7)合并严重代谢性疾病,无法行肠外营养(Parenteral Nutrition,PN)。
1.4 干预方法 2组患者胃癌根治术由同一组医护人员完成。对照组接受常规营养支持:入院时评估患者营养状态与营养风险,提供营养支持相关健康宣教,依据评估结果实施营养支持方案。行深静脉置管,先给予全肠外营养(Total Parenteral Nutrition,TPN),热量20~25 kcal/(kg·d),主要为葡萄糖与脂肪乳。葡萄糖通过5%葡萄糖溶液补充,每日供给量150 g;脂肪乳以30%中长链脂肪乳为主,占总热量约40%;每日氮供给量0.15~0.20 g/(kg·d),通过复方氨基酸溶液补充;给予胰岛素,剂量为1U:5 g葡萄糖;另添加水溶性脂溶性维生素及微量元素。将上述制剂配置为PN营养液,静脉滴注,持续4~7 d,胃肠道功能恢复后逐步开始经口进食,循序渐进。观察组术后开展基于PNI的分级营养支持,主要内容如下:1)入院时进行营养筛查与营养支持宣教,计算PNI=血清白蛋白水平+外周血淋巴细胞总数×5,前者单位为g/L,后者单位为109/L,分值越高提示营养状况越好,≥50提示无营养风险(即营养状况正常),45~49分为轻度营养不良,40~44分为中度营养不良,<40分为重度营养不良。2)术前营养支持。a.营养状况正常:指导患者多摄入富含优质蛋白与高纤维素食物,避免刺激、生冷、油腻食物,持续4~7 d。b.轻度营养不良:依据饮食习惯、热量需求制定个体化的饮食方案,每日总热量约30 kcal/(kg·d),饮食遵循高优质蛋白、高纤维素、适量脂肪原则,三餐热量分3∶ 4∶ 3,早餐与午餐,午餐与晚餐的间隔时间<6 h。c.中度营养不良:在轻度营养不良患者术前营养支持方案的基础上增加口服营养补充(Oral Nutritional Supplements,ONS),参照中国抗癌协会肿瘤营养与支持治疗专业委员会推荐的“3+3”饮食法,及3顿正餐+3次ONS,每次ONS量为150~300 mL,每日总热量32~34 kcal/(kg·d)。d.重度营养不良:在中度营养不良患者术前营养支持方案的基础上增加PN,依据患者情况输注氨基酸(如复方氨基酸注射液18AAⅡ等)与脂肪乳(如中长链脂肪乳注射液C6~24等),或给予脂肪乳、氨基酸及葡萄糖的复合制剂补充,每日总热量35~38 kcal/(kg·d)。3)术后营养支持:术后1 d复查血常规与生化,重新评估PNI。先给予TPN(方法同对照组),肛门排气后给予肠内营养(Enteral Nutrition,EN),在EN制剂中添加肠道益生菌、ω-多不饱和脂肪酸等免疫调节制剂,逐步过渡为经口进食。依据PNI调整总热量、EN支持方案与经口进食方案,原则同术前。每3 d复查血常规与ALB,计算PNI并依据结果调整营养支持方案。
1.5 观察指标 1)营养状态:PNI、血清前白蛋白(Prealbumin,PA)与转铁蛋白(Transferrin,TRF)水平。2)术后恢复情况:记录肛门排气时间、恢复经口进食时间、住院时间。3)体液免疫指标:血清IgG、IgM与IgA水平。4)睡眠质量:采用阿森斯失眠量表(Athens Insomnia Scale,AIS)评价。该量表共8个条目,各条目采用4级评分法(0~3)分,总分0~24分,≤3分提示无睡眠障碍,4~6分提示可疑睡眠障碍,≥7分提示存在失眠。该量表Cronbach′α系数为0.85[7]。于术前1 d、术后7 d分别评估1次。
1.6 统计学方法 采用SPSS 26.0统计软件进行数据分析,计量数据用均数±标准差( ±s )表示,采用 t 检验;计数资料用百分率(%)表示,采用χ2检验,以 P <0.05为差异有统计学意义。
2 结果
2.1 2组患者营养状态比较 2组患者入院时PNI、血清PA与TRF比较,差异无统计学意义( P >0.05)。观察组术后7 d PNI、PA与TRF均显著高于入院时,且均高于对照组,差异有统计学意义( P <0.05)。见表1。
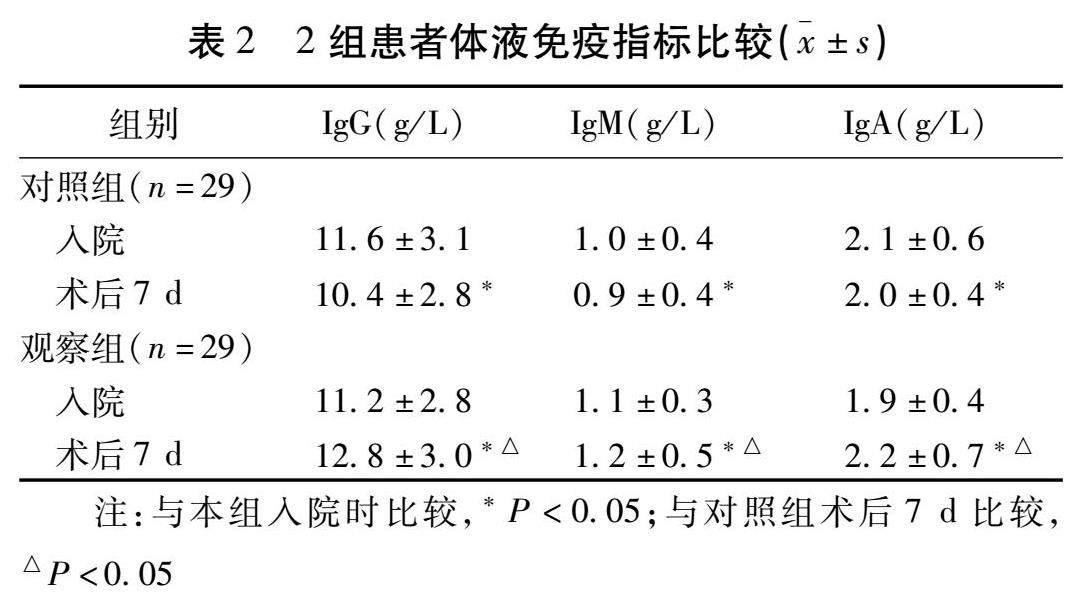
2.2 2组患者体液免疫指标比较 2组患者干预前血清IgG、IgM与IgA水平比较,差异均无统计学意义(均 P >0.05)。观察组术后7 d血清IgG、IgM高于对照组( P <0.05),IgA差异无统计学意义( P >0.05)。见表2。
2.3 2组患者术后康复比较 观察组术后肛门排气时间、恢复经口进食时间早于对照组( P <0.05),住院时间显著较短,差异有统计学意义( P <0.05)。见表3。
2.4 2组患者睡眠质量比较 2组患者术前AIS评分比较,差异无统计学意义( P >0.05),观察组术后住院期间AIS评分显著低于对照组,差异有统计学意义( P <0.05)。见表4。
3 讨论
营养不良是胃癌患者预后的重要影响因素。《加速康复外科中国专家共识暨路径管理指南(2018)》[8]在胃切除部分明确提出应在术前进行营养筛查,对于有营养风险者给予营养支持,首选经口补充与EN。早期临床多采用体BMI≤18.5 kg/m2、或(和)白蛋白<35 g/L进行筛选,营养不良检出率低,敏感度差。近年国内外指南多推荐采用营养筛查工具。PNI由日本学者小野寺提出,通过血白蛋白与淋巴细胞计数这两项指标判断患者营养状态,操作较营养风险筛查量表2002(Nutritional Risk Screening 2002,NRS 2002)与患者主观整体评估(Patient-Generated Subjective Globe Assessment,PG-SGA)更为简便,最初被用于接受胃肠道手术患者的免疫状况评估,近年研究发现其在消化道恶性肿瘤营养筛查中具备良好的敏感度,也可用于预后评估[9-10]。PNI在消化道恶性肿瘤围术期营养管理的应用也得到了研究肯定。郭峰杰等[11]的研究显示,PNI指导下的营养管理可有效降低食管癌根治吻合口瘘等并发症发生率,也可加快消化道功能恢复,提示PNI可作为消化道恶性肿瘤围术期营养管理评估工具。刘燕燕等[12]对进展期胃癌患者的研究显示,PNI是术后并发症、OS的独立影响因素,可作为围术期评估内容,临床可依据PNI进行营养干预。
营养不良不仅会影响患者对手术的耐受性,增加术后并发症发生风险,也可对免疫功能产生影响,导致肠黏膜损伤和肠道菌群失调,并降低患者对术后疼痛、康复的耐受力,导致康复延迟,甚至影响远期预后[4,13]。对于行胃癌根治术的患者,目前临床对术前营养支持关注不足,术前、术后营养管理也缺乏个体性,过度干预与干预不足均常见[14]。基于营养风险评估的个体化干预策略是解决上述问题的重要思路。陈晓燕等[15]的研究显示,相对于常规营养支持方案,基于NRS2002的标准化营养支持可有效提升胃癌患者术后PA与CD4+/CD8+,也可提前胃肠功能恢复时间与恢复正常饮食时间。张婉秋等[16]的研究显示,基于营养风险评估分级营养干预可改善胃癌根治术患者营养状态与免疫状态,降低切口愈合延迟、胃瘫、肠梗阻等并发症累计发生率,缩短住院时间。本研究得出了类似的结果,观察组在术后7 d时PNI、PA与TRF均显著高于对照组,体液免疫指标优于对照组,且消化道功能恢复时间及住院时间较短,提示基于PNI的分级营养支持可改善胃癌患者免疫、营养状态及近期预后,加快术后康复。
睡眠障碍是胃癌围术期常见并发症。睡眠不仅影响正常生理功能维持,也会影响机体发育、记忆形成、学习能力与免疫。胃癌患者围术期存在多种可导致睡眠障碍的危险因素,易发生入睡困难、睡眠结构紊乱、睡眠倒错[17]。睡眠障碍会对患者术后康复与近期预后产生影响。李辉等[18]对行根治性手术胃癌患者的研究显示,睡眠障碍与术后并发症关系密切,匹兹堡睡眠质量指数上升提示并发症发生风险增加。可能原因为睡眠障碍会导致个体免疫力下降、神经元损伤、术后康复的耐受力下降[19-20]。良好的营养状态是手术患者睡眠的保护因素[6]。本研究显示,尽管不同组术前AIS无显著差异,但观察组在术后AIS显著低于对照组,提示基于PNI的分级营养干预可改善胃癌根治术患者睡眠质量,该效应可能与提升了患者对手术与疼痛的耐受力,减少了并发症等有关[21]。
综上所述,基于PNI的分级营养支持可改善胃癌根治术患者营养状态与免疫功能,加快术后康复,减少睡眠障碍,在胃癌患者围术期营养管理中具备较高的推广价值。
利益冲突声明 :无。
参考文献
[1] ZHENG R,ZHANG S,ZENG H,et al.Cancer incidence and mortality in China,2016[J].J Natl Cancer Cent,2022,2(1):1-9.
[2]JIANG X H,CHEN X J,CHEN S,et al.Compliance with oral nutritional supplementation among gastric cancer patients at nutritional risk:A cross-sectional study[J].Nutrition and Cancer,2022,74(9):10-11.
[3]孙慧,徐慧,陆滢滢,等.营养风险筛查工具识别胃癌患者肌减少症的临床价值[J].实用临床医药杂志,2023,27(2):78-83.
[4]原陈珊,李高鹏,王伟刚.术前营养炎症指标对胃癌患者生存的预后价值分析[J].中国食物与营养,2023,29(5):85-88.
[5]王寅雪,尹毅青.地佐辛联合不同药物对腹腔镜胃癌根治术后睡眠质量和早期恢复的影响[J].中国肿瘤临床,2021,48(20):1036-1039.
[6]贾春萌.参与式饮食护理干预改善胃癌根治术后患者营养指标、睡眠质量的效果评估[J].世界睡眠医学杂志,2021,8(3):495-496.
[7]SOLDATOS C R,DIKEOS D G,PAPARRIGOPOULOS T J.Athens Insomnia Scale:validation of an instrument based on ICD-10 criteria[J].J Psychosom Res,2000,48(6):555-560.
[8]中华医学会外科学分会,中华医学会麻醉学分会.加速康复外科中国专家共识暨路径管理指南(2018)[J].中华麻醉学杂志,2018,38(1):8-13.
[9]HSUEH S W,LIU K H,HUNG C Y,et al.Predicting postoperative events in patients with gastric cancer:a comparison of five nutrition assessment tools[J].in vivo,2020,34(5):2803-2809.
[10] 王安琪,王子安.系统免疫炎性指数联合预后营养指数判断胃癌预后的价值分析[J].医学研究杂志,2023,52(7):113-118.
[11]郭峰杰,孙爱英,于丹丹.预后营养指数指导下的营养管理干预在食管癌根治术患者中的应用[J].齐鲁护理杂志,2023,29(4):29-33.
[12]刘燕燕,张明军.预后营养指数对进展期胃癌患者术后并发症及短期生存率的影响分析[J].临床输血与检验,2022,24(2):230-235.
[13]王璇,吴贤翠,张云霞,等.营养风险筛查评分与胃癌术后30 d内非计划再入院的关系[J].肿瘤代谢与营养(连续型电子期刊),2023,10(1):120-126.
[14]牛瑞红,武爱萍,吴雅芳,等.胃癌术后营养支持治疗研究进展[J].护理研究,2016,30(26):3212-3214.
[15]陈晓燕,俞远怀.营养风险筛查的标准营养支持治疗对胃癌术后患者PA及CD4/CD8表达水平的影响[J].中国食物与营养,2023,29(8):67-70.
[16]张婉秋,李海燕.基于预后营养指数的分级营养干预对胃癌根治性手术患者的应用效果[J].肿瘤综合治疗(连续型电子期刊),2023,9(2):146-150.
[17]赵艳生,李旭忠,靳金彪,等.放松训练对围术期胃癌患者应激反应、情绪及睡眠的影响[J].国际精神病学杂志,2022,49(3):534-536,544.
[18]李辉,张国庆.老年胃癌根治术患者术前睡眠障碍与术后并发症的相关性研究[J].保健医学研究与实践,2023,20(7):63-66.
[19]李仁华,陈娜,王锷,等.老年患者术前睡眠障碍与术后神经认知恢复延迟的相关性[J].中南大学学报:医学版,2021,46(11):1251-1259.
[20]MOGAVERO M P,DELROSSO L M,FANFULLA F,et al.Sleep disorders and cancer:State of the art and future perspectives[J].Sleep Med Rev,2021,56(1):101409.
[21]唐小丽,张婷,王国蓉,等.目标营养管理对胃癌患者营养状况及术后康复的影响研究[J].肿瘤代谢与营养(连续型电子期刊),2018,5(3):297-302.

