作物病害检测关键技术分析
侯海敏 沈梦姣 张艳


摘要:作物病害是影响和制约农业生产发展的重要因素之一,如何准确检测作物病因及病害程度,实现作物病害科学预警、精准防治尤为重要。通过对作物病害类型进行简介,从检测原理和机制对比分析作物病害常用的生化检测技术,如分子生物学、免疫学等技术及光学传感检测技术中的可见光图像、近红外光谱、红外热成像、高光谱成像等技术的优缺点。归纳总结发现生化检测技术的难点,主要包括对单一目标病原物检测、鉴定病原物工作量大、周期长;光学检测技术的难点主要包括易受环境影响、存在同谱异物现象等。针对光学传感技术在作物病害检测中存在的问题给出未来的发展方向,为相关研究提供更全面系统的参考。
关键词:作物病害;检测技术;生化检测;光学传感
中图分类号:S435; TP391.4
文献标识码:A
文章编号:2095-5553 (2024) 06-0090-08
收稿日期:2022年9月19日
修回日期:2023年4月6日
*基金项目:国家自然科学基金(62141501,62265003)
第一作者:侯海敏,男,1996年生,贵州铜仁人,硕士研究生;研究方向为作物早期疾病无损检测。E-mail: 1421058001@qq.com
通讯作者:张艳,女,1977年生,贵州遵义人,博士,教授;研究方向为生物信息无损检测、激光雷达。E-mail: Eileen_zy001@sohu.com
Analysis of key technologies for crop disease detection
Hou Haimin, Shen Mengjiao, Zhang Yan
(Engineering Research Center for Nondestructive Testing of Agricultural Products,
Guiyang University, Guiyang, 550005, China)
Abstract: Crop disease is one of the important factors that affect and restrict the development of agricultural production. How to accurately detect the cause and degree of crop disease, and realize scientific early warning and precise prevention of crop disease is particularly important. This paper firstly introduced the types of crop diseases, and then compared and analyzed the advantages and disadvantages of the biochemical detection technologies commonly used for crop diseases, such as molecular biology, immunology, and optical sensing detection technologies, and such as visible image, near infrared spectroscopy, infrared thermal imaging, hyperspectral imaging, etc. from the detection principle and mechanism. Through summing up, it was found that the difficulties of biochemical detection technology mainly included a large workload and a long cycle of detection and identification of a single target pathogen. The difficulty of optical detection technology included easy to be affected by the environment, the presence of foreign bodies in the same spectrum, etc. Finally, the future development direction of optical sensing technology in crop disease detection is given to provide a more comprehensive and systematic reference for related research.
Keywords: crop diseases; detection technology; biochemical detection; optical sensing
0 引言
作物在生长发育过程中会受到各种病害的影响,无法健康成长从而导致减产外,其质量还会大大降低。据联合国粮农组织数据统计,因作物病害导致农作物减产年均高达10%[1]。我国每年作物病害爆发的耕种面积均高于3.5×108km2,造成难以估量的经济损失[2]。
常规的作物病害检测是由植保专家等采用田间监测的方式确定病害的严重性,这种技术费时费力,不准确,而且受观测员主观因素影响很大[3]。目前,作物病害生化检测主要有分子、血清学和微生物学等实验室方法[4]。随着科学技术的提高,有更多的新病害检测技术在作物病害监测领域获得了广泛应用,尤其是感应器、光谱信号、物联网等高新技术的开发和完善,作物病害检测能力得到了很大提高[5]。
随着作物病害检测研究的加强,能够为农业生产进行指导,减少病害防治用药量,对确保农作物的生产与品质有着重大的作用与意义。基于此,本文主要对作物病害检测涉及的生化和光学传感检测等相关技术的原理及检测机制进行分析,同时根据光学传感技术在作物病害检测中存在的问题给出未来发展方向。
1 作物病害简介
根据致病因素,作物病害可分为侵染性和非侵染性两大类。通常,侵染性病害可分为细菌性、真菌性、病毒性和线虫病害等类型[6]。非侵染性疾病是由光照不平衡、营养素缺乏、水分不足或过量、肥料或农药使用不合理、环境变化、遗传因素等物理、化学、非生物环境因素引起的作物病害[7, 8]。
不同的病原物产生感染症状不同,这为作物病害检测奠定了基础。细菌性病害导致的病症主要表现为血管萎蔫、坏死、软腐和肿瘤;而病毒性病害主要症状表现为颜色改变、畸形、坏死、发育迟缓或矮小;真菌性病害主要症状为坏死、增生和萎蔫;线虫病害的常见症状包括发育迟缓、失绿、枯萎、缓慢衰退、萎蔫和腐烂。其中,真菌性病害占作物病害的80%~90%,是近年的研究热点。
2 作物病害常规生化检测技术概述
目前在作物病害检测中常用的生化检测技术主要为免疫学、分子生物学等相关技术[9]。由于不同病原物所具有的蛋白和核酸组成不完全相同,因此生化检测技术主要通过病原微生物的核酸进行扩增或蛋白抗原抗体的特异性反应,从而达到检测特定作物病害的目的。
2.1 分子生物学技术
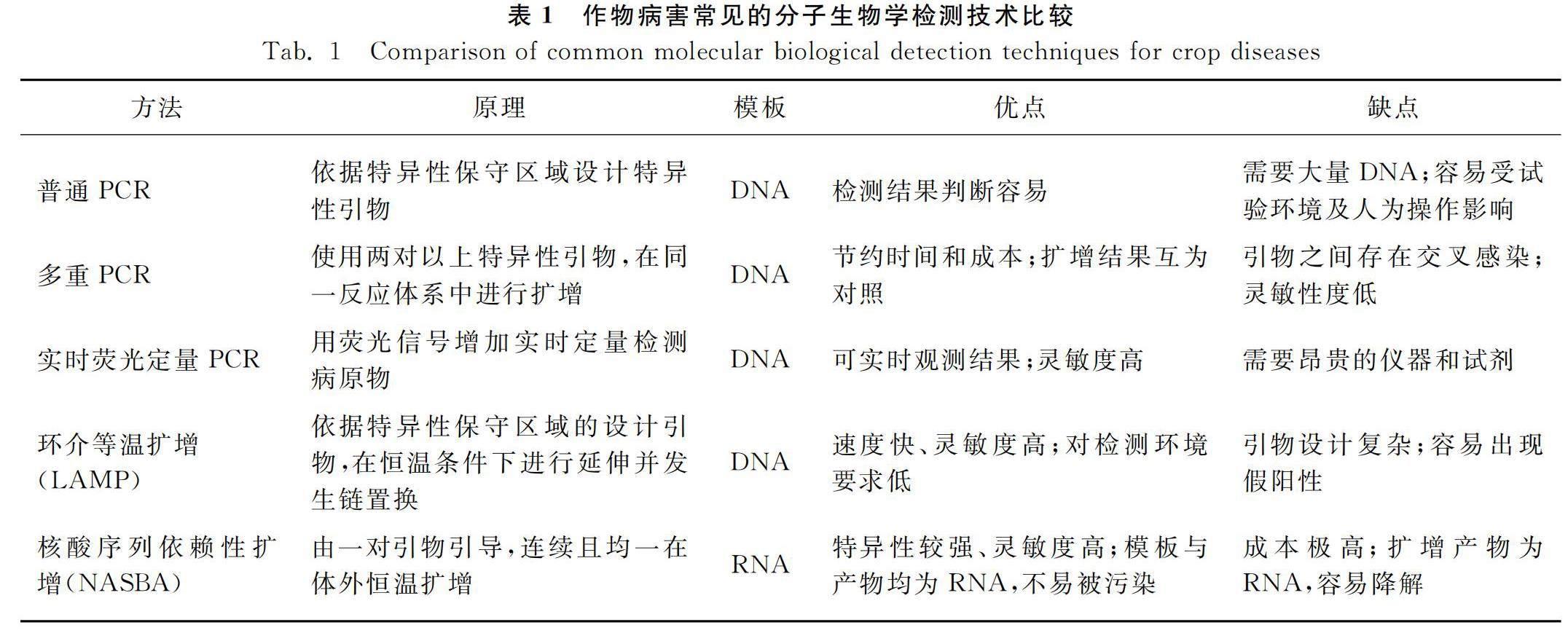
植物病害的产生,是在特定条件下植物和病原物二者之间一系列基因或基因副产物共同作用的结果[10]。分子生物学技术是通过检测病原物中DNA和RNA等遗传物质的特异性来直接检测病原物的存在。其中,核酸扩增技术是分子生物学领域主要的研究手段[11],具有特异性强、敏感度高、检验结果容易观察等优势,目前应用于对作物病毒、细菌和真菌等病原物的检测[12],该技术主要通过对病原物的微量核酸进行大量扩增,从而实现对作物病害的检测。核酸扩增技术对病害检测的机制是利用病原物引物的不同,其扩增产物也不同,选择某一特定病害的引物可以扩增到相应DNA或RNA片段。目前,运用于作物病害检测当中的分子生物学技术主要有普通PCR、实时荧光定性PCR、LAMP、NASBA等[13]。表1给出了分子生物学相关技术在作物病害检测中的特点分析。
可见,普通PCR、多重PCR和实时荧光定量PCR检测均属于变温扩增技术,都需要价格昂贵的仪器装置,且生产成本也较高;LAMP技术尽管敏感度较高,但由于引物设计复杂,并且其所使用的环引物在扩增过程中很容易发生非特异性配对,在测定过程中样本也容易产生气溶胶的散射污染,从而造成假阳性严重;而NASBA具有特异性强,但主要针对含RNA的病原物进行检测,其扩增产物易降解,不易保存。
2.2 免疫学技术
作物病害病原物主要是由核酸和蛋白质组成,是一种很好的抗原;而免疫学技术则是基于抗原与抗体的特异性反应的一种检测技术[14]。因此,可以通过病原物的蛋白来制备抗体并和相对应的抗体特异性结合,从而实现对作物病害的检测。目前,在作物病害检测中常见的免疫学技术有酶联免疫吸附测定(ELISA)、免疫荧光法(IF)、免疫胶体金等[15]。表2给出了常见免疫学检测技术在作物病害检测中的特点分析,其中免疫胶体金、酶联免疫吸附和免疫荧光虽然检测快速、灵敏度高,但是容易受载体干扰出现假阳性等问题[16]。
因此,在作物病害检测中,根据这些技术的特点以及应用场景需求,将不同技术结合使用,充分发挥各自的优点,这样能够使检测结果具有更高的精确度。
2.3 生化检测技术对比分析
由于生化检测技术具有敏感性高、特异性好、可对致病物直接检测等特性,目前已广泛应用在植物细菌、病毒、类病毒、真菌、线虫等方面的检测。作物病害生化检测技术对比分析如表3所示。
由表3可知,生化检测的难点:(1)对单一目标病原物检测。分子生物学相关技术大多只对已有的核酸序列进行扩增,其适用性与准确率在较大程度上依赖特殊基因组结构片断的选择及其相关特殊引物的设计;且不能同时对同种病原物的致病性、非致病性和有益菌株进行区分。(2)鉴定病原物工作量大、周期长。免疫学相关检测技术主要依赖于抗体与待测抗原分子的特异性结合,而抗原的处理过程复杂,需要花费大量的时间和成本,并且对结构复杂的病原抗体制备较为困难。
3 光学传感检测技术
染病作物与健康作物相比,其图像及光谱特征均存在不同程度的差异[17],从而导致在相应波段范围内,可见光、近红外、中红外和热红外等光谱特征发生变化。这也使得图像处理技术、光谱技术、高光谱成像技术在作物病害检测中的应用成为可能。
3.1 可见光图像技术
当植物遭受疾病的威胁时导致部分或全体植株变色、坏死、萎蔫甚至畸形、腐烂等外部形态改变和一些理化指标的变化[18]。一般情况下,患病作物会在叶片上出现与健康作物不同的视觉特征,因此大部分作物病害识别工作是针对作物叶片特征开展的[19]。可见光图像技术是模仿人眼在可见光波段R(红)、G(绿)、B(蓝)3个光谱段来获取病害作物的颜色、形状、质地和形态等特性,然后利用模式识别算法构建模型进行病害鉴定。
可见光图像技术主要通过提取并分析作物叶片颜色、形状和纹理等特征的变量来实现对病害检测。在作物出现病症后,对面积较大的病变或斑点以及不明显部位的图像进行处理。如图1所示[20]。图1(a)为马铃薯早疫病可见光图像,图1(b)白色部分表示病害区域,而黑色区域表示健康区域。由此可见,光图像技术在对作物病害检测时能够通过图像处理快速地识别出染病区域和健康区域。
可见光图像技术操作简单、成本低,作物的许多病害特征可以直接从可见光图像中获得。但只能对作物已显病症的部位进行检测,当病害侵染作物的过程中首先会对其内部生理结构造成损害,一段时间后才表现出外部表型的变化。因此仅通过可见光图像技术对作物纹理、颜色变化等病害特征检测,难以识别作物内在生理特性的改变,很难实现农作物病害的早期检测和诊断。
3.2 近红外光谱技术
作物在遭受病害胁迫时,其内部生理生化特征和外部形态的变化,均会导致光谱特性的改变[21],其光谱响应特性是由病害胁迫导致植物损伤所引起的色素、水分、形态、结构等变化的函数[22]。近红外光谱(near infrared spectroscopy,NIR)是介于可见光和中红外光之间的电磁波,波长范围为700~2 500 nm,一般有机物在该区域的光谱吸收主要是由含氢基团(—OH、—NH2、—CH等)的倍频和合频吸收[23]。当在近红外光谱波段区域内的光束照射到作物表层物质时,被照射到的作物内部物质会被光子激发,产生能级跃迁,由基态跃迁至受激态,从而产生了相应的光谱图[24]。
近红外光谱波长范围主要受类胡萝卜素、花青素、碳水化合物、脂肪和蛋白质等物质的影响[25]。其中,在700~1200 nm的光谱范围内,主要反映作物的生理状态及内部结构[26];在1 300~2 500 nm的光谱范围内,光谱反射率特性主要与植物水分和蛋白质含量有关[27]。由于近红外光谱技术具有快速、准确、无损、高效和无污染等优点,目前已广泛应用在农业、食品、医药、石油、化工等多个领域[28]。由于光谱采集仪具有较高的敏感度,在使用近红外光谱进行病害检测时数据采集会受环境和人为因素影响。当各种病害的胁迫现象出现于同一个作物上或是当各种作物同时受到同种病害威胁后,可能会产生相同的光谱曲线,因此加大了病害鉴定的难度。此外,近红外光谱技术必须与化学计量学相结合才能提取相关信息,其精确和稳健的模型也很难获得。
3.3 红外热成像技术
当作物受到病害威胁时,会在伤口处形成大量化学物质如水杨酸(SA)、脱落酸(ABA)等,并通过多种诱导因素对作物形成各种防御反应,使作物产生多种防御反应,形成许多防御反应产物,以抑制或杀伤病原[29]。同样,由于叶子的应激反应引起蒸腾功能反常,从而引起叶子温度的上升或下降,引起病变部位所发出的红外线光谱辐射引起改变[30]。所以,叶面温度可以作为作物主要生态特征和环境条件评价的基本参数进行检测植物病害。
红外热成像装置能够测量绝对零度以上的物质(-273.15℃),其在电磁光谱的红外范围内发射辐射[31]。在红外热成像检测中,叶片健康区域和病害区域之间的温差以及植物组织的最大温差是检测作物病害的有效参数,其等温线的可视化有助于强调当作物染病时由病原体感染引起的热点和冷点[32]。图2为葡萄冠层的可见光图像和红外热图像[33]。
与RGB(红光、绿光、蓝光)图像不同的是,在红外热图像中每个像素点都包含了直观的温度信号,其温度信号能迅速反应作物生理变化规律,更能够准确监测作物的生理信息与生态胁迫[34]。目前基于红外热成像技术的研究基本围绕温度的测量和分析展开,无论是生物或非生物胁迫,主要评价指标为叶片和植株平均温度(Average temperature,AT)及叶片的最大温差(Maximum temperature difference,MTD)等[35]。由于红外热成像技术能够对作物病害轻松自动化以进行实时测量,且不依赖光源、具有高灵敏度、高精度和宽测量范围等特点[36]。目前已广泛应用在土木工程、工业维修、航空航天、医学、制药和兽医等领域[37]。
虽然红外热成像技术能够反映出病害作物温度信息差异,但每张红外热图像包含了目标区域外的背景,提取目标区域的温度信息是红外热成像的一个难点。此外,其检测精度高度依赖环境条件(如温度、气流和湿度等),并且会受到周围物体和环境的强烈影响,温度测量的精确校准较为困难。尽管有大量的研究工作致力于利用红外热成像技术检测作物病害胁迫,但很少关注与作物病害相关温度变化的生理学特征变化。
3.4 高光谱成像技术
作物受到病害侵袭后,将改变其内部生理结构和生物化学特性,同时在外部形态上表现出一定程度的叶片发黄、枯萎、凋零等现象,其光谱特征也会随之改变,这种变化能够间接反映出作物在受到病害胁迫下的生理特性[38],因此可以使用高光谱成像技术来检测作物遭受病害感染状况。高光谱成像技术融入了光谱学、机器视觉、近红外光谱测量等多个学科,使图像技术与光谱技术实现了有机融合,从而具备清晰度较高、波段连续和图谱合一等特点[39]。可以用一个波长处的光学图像构成的三维数据立方块来表示高光谱图像。其中,二维是图像的横纵坐标信息,第三维则是光谱信息[40]。高光谱的图像信息能够直观地反映出作物的纹理、形状、颜色等外部特征,而第三维的光谱信息则可以充分反映作物的物理结构和化学成分等内部特征。高光谱数据分析常见步骤如图3所示。
首先,通过高光谱成像仪获取被测物的原始图像,然后对原始图像进行预处理,去除图像中不重要的信息,以提高图像质量。其次,进行图像处理和光谱处理。在图像处理过程中由于高光谱图像数据太大,无法直接获得有用信息,需要对图像降维,去除冗余信息。在光谱维度上具有高分辨率,波段连续。而波段连续可能导致在邻近波段间存在较高的共线性问题,会导致模型的准确率降低。所以,必须通过特征选取方法获得具有代表性的特征数据进行分析。最后,将光谱与图像数据整合进行模型的构建。利用模型的可视化能够直观地看到被检测作物化学成分及其分布,从而实现通过作物内部和外部特征达到精确检测病害的目的。
在高光谱图像上每个像素点包含数百个波段,因此能够在可见/见红外光谱范围内反映出作物的健康状况。图4比较了感染炭疽病茶叶的健康区域与染病区域的平均光谱变化[41]。由于400~700 nm作为肉眼可见的光谱波段,在这个波段范围内能够捕捉叶片色素沉着;而700~1 300 nm为近红外短波,其波长范围主要受叶肉细胞结构的影响[42]。其中,叶绿素a和叶绿素b主要吸收蓝光(400~495 nm)和红光(620~700 nm),对绿光波段(500~550 nm)吸收较少[43]。所以,叶片在蓝光波段、红光波段、绿光波段三者的反照率都存在着很大差异。健康叶片对红光和蓝色的反照率较低,对绿光的反照率较好。当叶片染病后其叶绿素浓度会明显下降,对红光和蓝色紫光的吸收减少,对绿光的吸收则增加。所以红光的蓝色波段反射量增加,而绿色波段反射量则减少。
高光谱成像技术具备实时无损、分辨率高,能获取频谱和图像数据等优点,目前已在作物营养素诊断、分类识别、品质鉴定、食品加工、病虫害监测等方面有大量研究和不同程度的应用[44]。由于高光谱图像数据量大,存在共线等问题,被检物所需的信息无法直接从三维立方体图像中获得,需要通过化学计量学模型来找出高光谱图像与作物病害之间的关联性。然而,目前对图谱有效信息提取方法不够成熟,导致数据处理难度加大;且基于高光谱成像技术构建的作物病害图谱数据库尚不完善,虽能进行初步提取,但是对分类判别研究较少。
3.5 光学传感检测技术对比分析
随着智能化农业的快速发展,光学传感技术在作物病害检测中已得到广泛应用。不同光学传感检测技术有优点同时也具有局限性,如表4所示。
由表4可知,使用光学传感技术检测作物病害的难点主要有:(1)已有的高准确率作物病害图像识别模型所用的数据集多为实验室拍摄的标准数据集(如AI Challenger和Plant Village等)[45]。实验室条件下采集的病害图像数据往往过于理想化或不够具有作物病害的代表性。在这些情形下构建的病害鉴定模型在实际使用中很难实现较好的鉴定效果,会影响到模型检验的准确性,造成漏检或鉴定有误。(2)受环境影响大。由于背景和光线温度不同、重叠或被遮蔽,尤其是检查对象的背景叶片色彩非常接近等,将对目标叶片的检测带来较大影响。(3)存在“同谱异物”的现象。不同的病害胁迫在对同一个作物或不同作物同时受同种病害威胁时,可能会产生相同的光谱曲线,因此对作物病害的鉴定造成了很大的难度。
4 存在问题与展望
4.1 存在问题
目前针对作物病害的生化检测技术已经取得较好积累,在遥感技术及智慧农业快速发展的前提下,基于非破坏性技术的作物病害检测越来越受重视。本文从检测原理对比分析作物病害的常用生化检测技术和光学传感技术的优缺点,详细介绍光学传感技术的检测机制,并归纳总结其难点。与生化检测技术相比,光学传感技术有其突出的优越性,具有高效、快捷、无损的特点。但是由于作物生长环境的复杂性和病害的多样性给利用光学传感技术对作物病害检测带来以下问题。
1) 作物生长环境复杂,不利于光学传感数据采集。现有的光学传感技术对作物的各项检测大多限于实验室光源环境,由于作物病害的多样性,不同种类的作物在不同生长环境下具有不同特征,在自然环境条件下,光学传感数据采集易受光照、温度和湿度等因素影响。
2) 对具有相似病症的不同病害准确识别较为困难。许多病原菌及其产生的毒素与寄主作物相互作用可能引起相似的病症,这将导致“异物同谱”现象的发生。此外,作物图像及光谱特征的变化不单单是由生物胁迫造成的,还受非生物胁迫等影响,这对作物病害精确识别带来挑战。
3) 缺少专门的作物病害检测算法数据库。由于作物病害光学传感数据的复杂性,在农业生产应用中传统经典的算法不能满足各种病害实际检测的要求,需要对算法不断改进以提高检测的效率和准确性。
4.2 展望
由于作物病害种类多,发病时间、部位及病害程度复杂多变,今后的研究可以从以下方面展开。
1) 多技术结合。以往的研究中,往往只针对某种单一光学传感或生化检测技术进行研究,忽略了其他技术的辅助和指导。通过多技术的结合应用,如:将光学传感与分子生物学、免疫学等相关技术结合能够使病害检测从宏观到微观取得更好的效果。
2) 研究新的图谱数据处理方法。通过研究光谱与作物生化组分之间的机理性关系,找到具有高专一性和代表性的病害特征,并寻找新的数据压缩和提取等方法来提高病害检测模型的精确度和普适性。
3) 构建完整图谱数据库。不同发病期的作物病害图像大小、颜色特征、区域分布并不一致,其光谱响应波段和分析方法也不同,很难采用一定范围内的某一个特征或多个特征来表述。因此,构建图谱数据库后可以对光谱数据、图像数据和相应病原物与病症进行关联,能够对具有相似表征的不同病害准确识别提供更高的可能性。
在实际作物病害检测过程中,及时发现病害发病初期特征至关重要,把病害控制在大规模发作之前,能够更好地控制病害的爆发。由于作病害的早期症状模糊,易受环境条件的影响等,在病害初期得不到精确识别,因此今后的研究将集中在作物病害的早期实时检测;同时随着图像处理技术、光谱分析技术、信息技术等快速发展和深度融合,光学传感技术在作物病害检测方面将会是未来的发展趋势。
参 考 文 献
[1]Ryan M R, Crews T E, Culman S W, et al. Managing for multifunctionality in perennial grain crops [J]. BioScience, 2018, 68(4): 294-304.
[2]白雪冰, 余建树, 傅泽田, 等. 光谱成像技术在作物病害检测中的应用进展与趋势[J]. 光谱学与光谱分析, 2020, 40(2): 350-355.
Bai Xuebing, Yu Jianshu, Fu Zetian, et al. Application of spectral imaging technology for detecting crop disease information:A review [J]. Spectroscopy and Spectral Analysis, 2020, 40(2): 350-355.
[3]竞霞. 基于多源多时相数据棉花黄萎病遥感监测研究[D]. 北京: 北京师范大学, 2009.
Jing Xia. Remote sensing monitoring of Verticillium wilt in cotton based on multi-source and multi-temporal data [D]. Beijing: Beijing Normal University, 2009.
[4]Bock C H, Poole G H, Parker P E, et al. Plant disease severity estimated visually, by digital photography and image analysis, and by hyperspectral imaging [J]. Critical Reviews in Plant Sciences, 2010, 29(2): 59-107.
[5]王翔宇, 温皓杰, 李鑫星, 等. 农业主要病害检测与预警技术研究进展分析[J]. 农业机械学报, 2016, 47(9): 266-277.
Wang Xiangyu, Wen Haojie, Li Xinxing, et al. Research progress analysis of mainly agricultural diseases detection and early warning technologies [J]. Transactions of the Chinese Society for Agricultural Machinery, 2016, 47(9): 266-277.
[6]阚春月, 王守法, 杨翠云. 植物种传病害检测技术的研究进展[J]. 安徽农业科学, 2010, 38(15): 7956-7959.
Kan Chunyue, Wang Shoufa, Yang Cuiyun. Progress of detecting plant seed-borne diseases [J]. Journal of Anhui Agricultural Sciences, 2010, 38(15): 7956-7959.
[7]Bock C H, Poole G H, Parker P E, et al. Plant disease severity estimated visually, by digital photography and image analysis, and by hyperspectral imaging [J]. Critical Reviews in Plant Sciences, 2010, 29(2): 59-107.
[8]Zhang N, Yang G, Pan Y, et al. A review of advanced technologies and development for hyperspectral-based plant disease detection in the past three decades [J]. Remote Sensing, 2020, 12(19): 3188.
[9]Shahrour W G, Shatnawi M A, Abubaker S, et al. Identification of Phytophthora infestans from infected potato and tomato plants using molecular techniques [J].Journal of Food, Agriculture & Environment, 2013, 11(3&4): 1216-1221.
[10]彭好文, 黎起秦, 蒙姣荣. PCR技术在植物病害研究中的应用[J]. 广西农业科学, 2006(6): 682-685.
Peng Haowen, Li Qiqin, Meng Jiaorong. Application of PCR technology in research of plant disease [J]. Guangxi Agricultural Sciences, 2006(6): 682-685.
[11]Parida M, Sannarangaiah S, Dash P K, et al.Loop mediated isothermal amplification (LAMP): A new generation of innovative gene amplification technique; perspectives in clinical diagnosis of infectious diseases [J]. Reviews in Medical Virology, 2008, 18(6): 407-421.
[12]彭丹丹, 张源明, 舒灿伟, 等. 植物病原真菌分子检测技术的研究进展[J]. 基因组学与应用生物学, 2017, 36(5): 2015-2022.
Peng Dandan, Zhang Yuanming, Shu Canwei, et al. Research progress on the molecular detection techniques of plant pathogenic fungi [J]. Genomics and Applied Biology, 2017, 36(5): 2015-2022.
[13]Khan M, Li B, Jiang Y, et al. Evaluation of different PCR-based assays and LAMP method for rapid detection of Phytophthora infestans by targeting the Ypt1 gene [J]. Frontiers in Microbiology, 2017, 8: 1920.
[14]陈长卿. 大豆疫霉的分子检测及游动孢子多样性研究[D]. 咸阳: 西北农林科技大学, 2005.
Chen Changqing. Molecular detection and zoospore diversity of Phytophthora soya [D]. Xianyang: Northwest A & F University, 2005.
[15]刘琼光. 植物病原细菌的血清学鉴定和分类[J]. 江西植保, 1995(4): 29-31.
[16]Ray M, Ray A, Dash S, et al. Fungal disease detection in plants: Traditional assays, novel diagnostic techniques and biosensors [J]. Biosensors and Bioelectronics, 2017, 87: 708-723.
[17]王彦翔, 张艳, 杨成娅, 等. 基于深度学习的农作物病害图像识别技术进展[J]. 浙江农业学报, 2019, 31(4): 669-676.
Wang Yanxiang, Zhang Yan, Yang Chengya, et al. Advances in new nondestructive detection and identification techniques of crop diseases based on deep learning [J]. Acta Agriculturae Zhejiangensis, 2019, 31(4): 669-676.
[18]洪霓, 高必达. 植物病害检疫学[M]. 北京: 科学出版社, 2005.
[19]Singh V, Sharma N, Singh S. A review of imaging techniques for plant disease detection [J]. Artificial Intelligence in Agriculture, 2020, 4: 229-242.
[20]Sai Reddy B, Neeraja S. Plant leaf disease classification and damage detection system using deep learning models [J]. Multimedia Tools and Applications, 2022, 81(17): 24021-24040.
[21]黄木易, 王纪华, 黄文江, 等. 冬小麦条锈病的光谱特征及遥感监测[J]. 农业工程学报, 2003(6): 154-158.
Huang Muyi, Wang Jihua, Huang Wenjiang, et al. Hyperspectral character of stripe rust on winter wheat and monitoring by remote sensing [J]. Transactions of the Chinese Society of Agricultural Engineering, 2003(6): 154-158.
[22]张竞成, 袁琳, 王纪华, 等. 作物病虫害遥感监测研究进展[J]. 农业工程学报, 2012, 28(20): 1-11.
Zhang Jingcheng, Yuan Lin, Wang Jihua, et al. Research progress of crop diseases and pests monitoring based on remote sensing [J]. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(20): 1-11.
[23]Qi W, Tian Y, Lu D, et al. Research progress of applying infrared spectroscopy technology for detection of toxic and harmful substances in food [J]. Foods, 2022, 11(7): 930.
[24]Fu X P, Ying Y B, Liu Y D, et al. Detection of pear firmness using near infrared diffuse reflectance spectroscopy [J]. Europe PMC, 2006, 26(6): 1038-1041.
[25]El-Mesery H S, Mao H, Abomohra A E F. Applications of non-destructive technologies for agricultural and food products quality inspection [J]. Sensors, 2019, 19(4): 846.
[26]Wang L, Jia M, Yin D, et al. A review of remote sensing for mangrove forests: 1956-2018 [J]. Remote Sensing of Environment, 2019, 231: 111223.
[27]Qu J H, Sun D W, Cheng J H, et al. Mapping moisture contents in grass carp (Ctenopharyngodon idella) slices under different freeze drying periods by Vis-NIR hyperspectral imaging [J]. LWT, 2017, 75: 529-536.
[28]李小龙, 秦丰, 赵龙莲, 等. 近红外光谱技术的小麦条锈病严重度分级识别[J]. 光谱学与光谱分析, 2015, 35(2): 367-371.
Li Xiaolong, Qin Feng, Zhao Longlian, et al. Identification and classification of disease severity of wheat stripe rust using near infrared spectroscopy technology [J]. Spectroscopy and Spectral Analysis, 2015, 35(2): 367-371.
[29]黄福贞. 植物感应性反应机制[J]. 生物学教学, 1999(10): 1-3.
[30]李真. 红外热成像技术在作物病害早期检测方面的应用研究[D]. 保定: 河北农业大学, 2015.
Li Zhen. Application of infrared thermal imaging technology in early detection of crop diseases [D]. Baoding: Hebei Agricultural University, 2015.
[31]Ishimwe R, Abutaleb K, Ahmed F. Applications of thermal imaging in agriculture—A review [J]. Advances in Remote Sensing, 2014, 3(3): 128.
[32]Mahlein A K, Oerke E C, SteinerU, et al. Recent advances in sensing plant diseases for precision crop protection [J]. European Journal of Plant Pathology, 2012, 133: 197-209.
[33]Zia-Khan S, Kleb M, Merkt N, et al. Application of infrared imaging for early detection of Downy Mildew (Plasmopara viticola) in grapevine [J]. Agriculture, 2022, 12(5): 617.
[34]郝松傲, 秦军. 热红外图像与可见光图像的配准与融合[J]. 四川测绘, 2008(3): 131-133.
Hao Songao, Qin Jun. The registration and fusion of infrared thermal image and visible light image [J]. Surveying and Mapping of Sichuan, 2008(3): 131-133.
[35]朱文静, 陈华, 李林, 等. 基于红外热成像边缘检测算法的小麦叶锈病分级研究[J]. 农业机械学报, 2019, 50(4): 36-41, 48.
Zhu Wenjing, Chen Hua, Li Lin, et al. Grading of wheat leaf rust based on edge detection of infrared thermal imaging [J]. Transactions of the Chinese Society for Agricultural Machinery, 2019, 50(4): 36-41, 48.
[36]Pineda M, Barón M, Pérez-Bueno M L. Thermal imaging for plant stress detection and phenotyping [J]. Remote Sensing, 2020, 13(1): 68.
[37]Vadivambal R, Jayas D S. Applications of thermal imaging in agriculture and food industry: A review [J]. Food and Bioprocess Technology, 2011, 4: 186-199.
[38]谢亚平, 陈丰农, 张竞成, 等. 基于高光谱技术的农作物常见病害监测研究[J]. 光谱学与光谱分析, 2018, 38(7): 2233-2240.
Xie Yaping, Chen Fengnong, Zhang Jingcheng, et al. Study on monitoring of common diseases of crops based on hyperspectral technology [J]. Spectroscopy and Spectral Analysis, 2018, 38(7): 2233-2240.
[39]Lowe A, Harrison N, French A P. Hyperspectral image analysis techniques for the detection and classification of the early onset of plant disease and stress [J]. Plant Methods, 2017, 13(1): 80.
[40]Ma J, Sun D W, Pu H, et al. Advanced techniques for hyperspectral imaging in the food industry: Principles and recent applications [J]. Annual Review of Food Science and Technology, 2019, 10: 197-220.
[41]Yuan L, Yan P, Han W, et al. Detection of anthracnose in tea plants based on hyperspectral imaging [J]. Computers and Electronics in Agriculture, 2019, 167: 105039.
[42]Peuelas J, Filella I. Visible and near-infrared reflectance techniques for diagnosing plant physiological status [J]. Trends in Plant Science, 1998, 3(4): 151-156.
[43]卢东昱, 崔新图, 黄镜荣, 等. 叶绿素吸收光谱的观测[J]. 大学物理, 2006, 25(1): 50-53, 63.
Lu Dongyu, Cui Xintu, Huang Jingrong, et al. Investigation on absorption spectrum of chlorophyⅡ [J]. College Physics, 2006, 25(1): 50-53, 63.
[44]马书英, 郭增长, 王双亭, 等. 高光谱技术监测植物病虫害方法研究进展[J]. 测绘地理信息, 2021, 46(5): 46-51.
Ma Shuying, Guo Zengzhang, Wang Shuangting, et al. Research progress in monitoring plant diseases and insect pests by hyperspectral technology [J]. Journal of Geomatics, 2021, 46(5): 46-51.
[45]周长建, 宋佳, 向文胜. 基于人工智能的作物病害识别研究进展[J]. 植物保护学报, 2022, 49(1): 316-324.
Zhou Changjian, Song Jia, Xiang Wensheng. Research progresses in artificial intelligence-Based crop disease identification [J]. Journal of Plant Protection, 2022, 49(1): 316-324.

