白乌鱼鱼肉多肽的酶解工艺优化
陈秋月 张佳怡 张鹏程 万欣 邹定燕 李玥颀 焦晓磊 张崟


摘要:白乌鱼是新培育的淡水鱼品种,其蛋白肽的功能性有待深入研究。为建立最优的制备白乌鱼鱼肉蛋白肽的水解工艺,为其功能性评价提供参考,以白乌鱼鱼肉为原料,在比较不同蛋白酶(碱性蛋白酶、胰蛋白酶、木瓜蛋白酶、中性蛋白酶、胃蛋白酶)对其水解度影响的基础上,通过单因素实验和响应面法对白乌鱼鱼肉的酶解工艺进行了优化,结果显示:碱性蛋白酶水解白乌鱼鱼肉的水解度最高(29.5%)。以该酶为催化剂,通过单因素实验(酶解温度、酶解时间、pH和酶浓度)和响应面法得出在酶解温度55 ℃、酶解时间4.65 h、pH 8.65、酶浓度1.0%时,白乌鱼鱼肉的水解度最高(39.62%)。以该酶解工艺为条件,验证实验的实测水解度为39.87%,与预测值39.62%的相对误差为0.63%。因此,所建立的白乌鱼鱼肉的酶解工艺具有可靠性。
关键词:白乌鱼;多肽;响应面法;优化;酶解工艺
中图分类号:TS254.1
文献标志码:A
文章编号:1000-9973(2024)06-0077-06
Optimization of Enzymatic Hydrolysis Process of Polypeptides from
Opniocepnalus argus var Kimnra
CHEN Qiu-yue1,2, ZHANG Jia-yi1,2, ZHANG Peng-cheng1,2, WAN Xin1,2,
ZOU Ding-yan1,2, LI Yue-qi1,2, JIAO Xiao-lei3, ZHANG Yin1,2*
(1.Key Laboratory of Meat Processing in Sichuan Province, Chengdu University, Chengdu 610106,
China; 2.College of Food and Bioengineering, Chengdu University, Chengdu 610106, China;
3.Neijiang Academy of Agricultural Sciences in Sichuan Province, Neijiang 641099, China)
Abstract: Opniocepnalus argus var Kimnra is a newly cultivated freshwater fish species, and the functionality of its protein peptides needs to be further explored. In order to establish the optimal hydrolysis process of preparing protein peptides from Opniocepnalus argus var Kimnra and provide references for the evaluation of their functionality, with Opniocepnalus argus var Kimnra as the raw material, on the basis of comparing the effects of different proteases (alkaline protease, trypsin, papain, neutral protease, pepsin) on the degree of hydrolysis (DH), single factor experiment and response surface method are used to optimize the enzymatic hydrolysis process of Opniocepnalus argus var Kimnra. The results show that alkaline protease has the highest degree of hydrolysis (29.5%). Using alkaline protease as the catalyst, through single factor experiment (enzymatic hydrolysis temperature, enzymatic hydrolysis time, pH and enzyme concentration) and response surface method, it is found that the degree of hydrolysis of Opniocepnalus argus var Kimnra is the highest (39.62%) when enzymatic hydrolysis temperature is 55 ℃, enzymatic hydrolysis time is 4.65 h, pH is 8.65 and enzyme concentration is 1.0%. Under the conditions of this enzymatic hydrolysis process, the measured degree of hydrolysis in the verification experiment is 39.87%, with the relative error of 0.63% compared to the predicted value of 39.62%. Therefore, the established enzymatic hydrolysis process of Opniocepnalus argus var Kimnra is reliable.
Key words: Opniocepnalus argus var Kimnra; polypeptides; response surface method; optimization; enzymatic hydrolysis process
收稿日期:2023-12-05
基金项目:四川省科技计划项目(2021YFN0033);国家现代农业产业技术体系四川创新团队项目(sccxtd-2023-15);四川省自然科学基金项目(2022NSFSC1764);内江市科技项目(2021KJJH008)
作者简介:陈秋月(1998—),女,硕士,研究方向:农产品加工与保藏。
*通信作者:张崟(1981—),男,教授,博士,研究方向:农产品加工与保藏。
白乌鱼是2022年被中国渔业协会认定的淡水鱼新品种[1],具有高蛋白、低脂肪等特点[2],其市场开发潜力巨大。自从白乌鱼新品种获得认定以来,国内外学者对其胴体黏液中耐热菌种类[3]、白乌鱼黏液中菌种的抗菌活性[4]、一氧化碳处理对白乌鱼鱼肉品质的影响[5]等进行了探索,建立了白乌鱼方便汤粉[6]、白乌鱼肉松[7]等产品的制作工艺。但是对白乌鱼鱼肉酶解液中功能性肽的酶解制备工艺研究较少。坊传白乌鱼鱼肉具有催乳、促进伤口愈合等功效[8],但是至今没有可靠的数据证明这些功效。
近年来,国内外研究人员从鱼肉酶解液中分离鉴定出多种功能性肽,马天新[9]从乌鱼鱼肉中发现了血管紧张素I转化酶(ACE)抑制肽,Zhang等[10]从乌鱼鱼肉中发现了抗氧化肽,Huang等[11]从鲢鱼鱼肉中提取了抗衰老肽,韩贵新等[12]从杂交鲟鱼龙筋中发现了具有抗肿瘤活性的功能性肽等。因此,白乌鱼鱼肉多肽可能是其具有催乳、促进伤口愈合等功效的主要原因。本文参照酶解肉类原料制备功能性肽的方法[13-14],采用响应面法对白乌鱼鱼肉的酶解工艺进行了优化,为评价白乌鱼鱼肉多肽的功能性奠定了基础。
1 材料与方法
1.1 材料与仪器
白乌鱼(1 000~1 500 g/条):十陵镇久贸农贸市场;胰蛋白酶(2 500 U/mg)、中性蛋白酶(100 U/mg)、木瓜蛋白酶(800 U/mg)、碱性蛋白酶(200 U/mg):上海源叶生物科技有限公司;胃蛋白酶(10 000 U/mg):山东拓普生物工程有限公司;硫酸铜:江苏诺泰澳赛诺生物制药股份有限公司;硫酸钾:江苏普乐司生物科技有限公司;浓硫酸、36%~38%甲醛溶液、浓盐酸:德国科隆公司;氢氧化钠、百里酚酞、碳酸钠、碳酸氢钠:成都市科隆化学品有限公司。
WP-UPT-20标准型超纯水机 四川沃特尔水处理设备有限公司;YP30002型电子天平 上海佑科仪器仪表有限公司;KDN-04C型消化炉、KDN-102C型凯氏定氮仪 上海昕瑞仪器仪表有限公司;Scientz-11无菌均质机 宁波新芝生物科技股份有限公司;PHS-3G型pH计 上海仪电科学仪器股份有限公司;HH-S6型六孔电热恒温水浴锅 北京科伟永兴仪器有限公司;TGL-1650型高速冷冻离心机 四川蜀科仪器有限公司。
1.2 实验方法
1.2.1 白乌鱼鱼肉蛋白质的测定
根据GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》方法测定白乌鱼鱼肉中蛋白质的含量。
1.2.2 白乌鱼鱼肉的酶解
将白乌鱼宰杀后去皮去骨,切成3 mm×3 mm×2 mm的小块,将鱼块混匀后称取20.0 g,加入料液比1∶4(肉∶水)的去离子水,用无菌均质机拍打180 s。将料液调节至适当pH后,加入适量的酶制剂酶解,反应结束后于90 ℃水浴加热10 min灭酶,待冷却到室温时,过滤除去残渣,将滤液在4 ℃、10 000 r/min条件下离心10 min,取上清液即为酶解液。
1.2.3 蛋白酶的筛选
选择5种不同种类的蛋白酶(中性蛋白酶、胃蛋白酶、胰蛋白酶、木瓜蛋白酶、碱性蛋白酶),参照各种酶的指导性水解条件对白乌鱼鱼肉进行酶解,具体酶解条件见表1。
1.2.4 单因素实验
在1.2.3的基础上,以碱性蛋白酶为酶制剂,在料液比为1∶4的条件下,分别对酶解温度、酶解时间、pH及酶浓度进行单因素实验,具体酶解条件如下。
1.2.4.1 酶解温度
根据碱性蛋白酶的指导性水解条件,在固定酶解时间为4 h、pH为8、酶浓度为0.6%的条件下,在45,50,55,60,65 ℃的酶解温度下,分析酶解温度对白乌鱼鱼肉水解度的影响。
1.2.4.2 酶解时间
以1.2.4.1确定的最佳酶解温度为条件,在固定pH为8、酶浓度为0.6%的条件下,在2,3,4,4.5,5,5.5,6 h的酶解时间下,分析酶解时间对白乌鱼鱼肉水解度的影响。
1.2.4.3 pH
以1.2.4.1和1.2.4.2确定的最佳酶解温度和酶解时间为条件,在固定酶浓度为0.6%的条件下,在6,7,8,9,10的pH下,分析pH对白乌鱼鱼肉水解度的影响。
1.2.4.4 酶浓度
以1.2.4.1、1.2.4.2和1.2.4.3确定的最佳酶解温度、酶解时间和pH为条件,在0.2%、0.3%、0.4%、0.5%、0.6%、0.8%、1.0%、1.2%、1.4%、1.6%的酶浓度下,分析酶浓度对白乌鱼鱼肉水解度的影响。
1.2.5 响应面实验设计
在单因素实验的基础上,以酶解温度(A)、酶解时间(B)、pH(C)、酶浓度(D)4个因素进行响应面实验设计,以水解度(DH)为响应值,采用1中心、4因素、5水平、30次实验的响应面实验方案,分析酶解条件对白乌鱼鱼肉水解度的影响。响应面实验因素水平表见表2。
1.2.6 水解度的测定
参考邹泽斌等[15]的方法,使用缓冲溶液将酶解待测液的pH调节至7.0,将待测溶液定容至100 mL,吸取待测溶液20 mL至250 mL的锥形瓶中,加入5 mL甲醛溶液及2~3滴0.5%的酚酞溶液,并在室温下放置5 min,然后用0.1 mol/L标准NaOH溶液滴定至终点。NaOH的体积用于计算游离氨基酸的量。水解度计算公式如下:
水解度(%)=游离氨基酸量(mg/g)总氮量(mg/g)×100%。
1.3 数据处理
采用SPSS 24.0、Excel 2016对实验数据进行统计分析和绘图;采用Design-Expert 12.0设计响应面实验方案,并分析数据的显著性和绘制响应面图。
2 结果与讨论
2.1 蛋白酶种类对水解度的影响对比
为了筛选对白乌鱼鱼肉具有较高酶解效率的蛋白酶,本实验选取碱性蛋白酶、木瓜蛋白酶、胃蛋白酶、胰蛋白酶、中性蛋白酶对白乌鱼鱼肉蛋白进行水解,所得水解度见图1。
由图1可知,这5种蛋白酶对白乌鱼鱼肉的水解效率差异显著(P<0.05),水解度从大到小的顺序为碱性蛋白酶>木瓜蛋白酶>中性蛋白酶>胰蛋白酶>胃蛋白酶。因此,根据水解度选择碱性蛋白酶为催化剂,用于水解白乌鱼鱼肉并制备多肽。
碱性蛋白酶是一种丝氨酸内切酶[16];胃蛋白酶有利于共价连接在丝氨酸上的磷酸基团[17];胰蛋白酶主要作用位点为赖氨酸和精氨酸的羧基侧[18];木瓜蛋白酶则是一种半胱氨酸内切酶[19]。白乌鱼鱼肉蛋白中丝氨酸含量较高,而碱性蛋白酶的活性中心为丝氨酸,因此碱性蛋白酶作用于白乌鱼鱼肉,能够更有效释放生物活性肽[16]。这些酶特性的差异可能是导致其对白乌鱼鱼肉水解度不同的主要原因。
2.2 单因素实验
2.2.1 酶解温度
由图2可知,白乌鱼鱼肉蛋白的水解度随着酶解温度的增加呈现先升高后降低的趋势。在55 ℃时,水解度最高,55 ℃后水解度显著下降(P<0.05),这可能是温度破坏了酶内部结构,酶活性下降,酶对白乌鱼鱼肉蛋白的酶解效果降低所致。酶解温度低于55 ℃时,碱性蛋白酶活性未达到最佳,这可能是导致白乌鱼鱼肉水解度较低的主要原因。
宁诗文等[20]在采用碱性蛋白酶对大黄花鱼肉进行水解时得出类似的实验结果。蛋白酶的活性受水解温度的影响很大,只有在一定的温度范围内,酶保持最佳活性,才能够达到最大酶解效率。55 ℃时碱性蛋白酶的活性最高,这可能是55 ℃时白乌鱼鱼肉水解度最高的主要原因。因此,选择45~65 ℃作为响应面设计时的温度限值。
2.2.2 酶解时间
在2.2.1中确定的最适酶解温度条件下,对酶解时间对白乌鱼鱼肉水解度的影响进行实验,所得结果见图3。
由图3可知,白乌鱼鱼肉的水解度随着酶解时间的增加呈现显著上升的趋势(P<0.05),在5 h时水解度达到峰值,之后水解度略有下降。碱性蛋白酶主要影响连接丝氨酸的肽键,当酶解达到一定程度时,碱性蛋白酶切割位点达到饱和[21],这可能是随着酶解时间的延长,白乌鱼鱼肉蛋白水解程度不再增加的主要原因。因此,选择3.35~5.95 h作为响应面设计时的时间限值。
2.2.3 pH
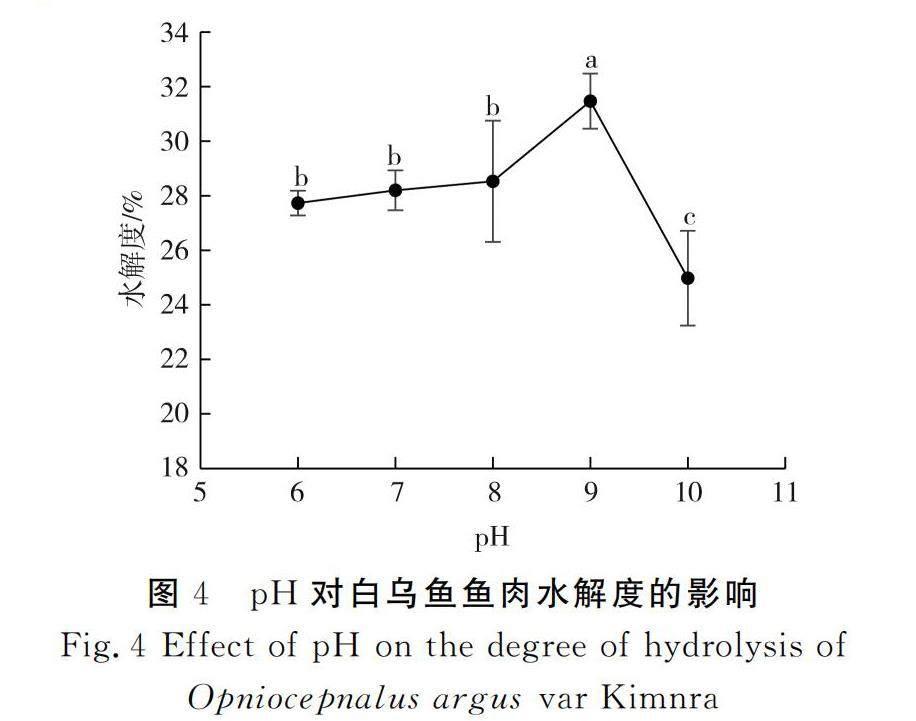
pH对白乌鱼鱼肉水解度的影响见图4。
由图4可知,随着pH从6增加到9,水解度从27.73%增加至31.47%,此时白乌鱼鱼肉的水解度最大,显著高于其他pH时的水解度(P<0.05)。当pH继续增加时,水解度显著下降(P<0.05)。碱性蛋白酶的最佳pH范围为8.5~9.5,在此pH范围时其酶活性较高。当pH超过9.5时,反应环境会抑制碱性蛋白酶的活性,水解度降低[22],这可能是pH为9时白乌鱼鱼肉的水解度最高的主要原因。因此,选择pH 7.35~9.95作为响应面设计时的pH限值。
2.2.4 酶浓度
酶浓度对白乌鱼鱼肉水解度的影响见图5。
由图5可知,随着酶浓度的增加,白乌鱼鱼肉的水解度逐渐增加,在酶浓度为1.0%时,白乌鱼鱼肉的水解度达到峰值。随着酶浓度的继续增加,白乌鱼鱼肉蛋白的水解度趋于稳定。底物浓度和酶浓度之间具有匹配性[23-24],在底物浓度确定的条件下(1.2.4.4),再高的酶浓度也不能催化底物更多地水解,这可能是当酶浓度超过1.0%时水解度趋于平缓的主要原因。因此,选择酶浓度0.6%~1.4%作为响应面设计时的酶浓度限值。
2.3 响应面实验结果
根据图2~图5的实验结果,以酶解温度(A)45~65 ℃、酶解时间(B)3.35~5.95 h、pH(C)7.35~9.95、酶浓度(D)0.6%~1.4%为响应限值,设计四因素五水平的响应面实验方案。响应面实验设计和结果、实测水解度(Y1实测)和预测水解度(Y1预测)以及实测水解度与预测水解度的相对误差见表3。
由表3可知预测水解度和实测水解度的相对误差值,有20组(67.7%)的相对误差小于5%,有25组(83.3%)的相对误差小于10%。由此可见,所建立的各酶解因素与水解度之间的拟合模型能够较准确地预测水解度。为了进一步分析所建立模型的可靠性,对拟合模型的显著性进行了分析。
2.4 拟合显著性分析
对各反应条件与水解度的拟合方差和显著性分析见表4。
由表4可知,模型的P<0.000 1,表明该拟合模型极显著,由失拟项的P>0.05可知,所建立的白乌鱼鱼肉的酶解条件与水解度间的拟合模型具有显著性。
由表4中一次项A、B、C、D的P值大小顺序D>B>A>C可知,对白乌鱼鱼肉酶解工艺的影响程度为pH(C)>酶解温度(A)>酶解时间(B)>酶浓度(D)。因此,在采用碱性蛋白酶水解白乌鱼鱼肉制备多肽时,应重点控制pH。
白乌鱼鱼肉蛋白水解度与各因素的响应面图见图6。比较图6中水解度与各因素的变化幅度可知,在其他条件确定的情况下,水解度随着pH的变化而变化的幅度最大,这也进一步证明了pH是影响白乌鱼鱼肉酶解制备多肽的关键因素,应重点控制。
2.5 拟合方程的可靠性验证
为了进一步验证所建立拟合模型的可靠性,以酶解温度55 ℃、酶解时间4.65 h、pH 8.65、酶浓度1.0%为水解条件,对白乌鱼鱼肉的水解度进行测定,所得结果为(39.87±0.63)%。该值与预测值39.62%的相对误差为0.63%(<5%)。因此,所建立的最优酶解工艺具有较好的可靠性。
3 结论
通过对比碱性蛋白酶、胰蛋白酶、木瓜蛋白酶、中性蛋白酶、胃蛋白酶对白乌鱼鱼肉水解度的影响,发现碱性蛋白酶对白乌鱼鱼肉蛋白的水解效果显著优于其他4种蛋白酶(P<0.05)。以碱性蛋白酶为催化剂,在单因素实验的基础上,通过响应面实验得出:当酶解温度为55 ℃、酶解时间为4.65 h、pH为8.65、酶浓度为1.0%时,白乌鱼鱼肉的水解度最高(39.62%)。验证实验结果显示:所得预测值39.62%与实测值的相对误差为0.63%(<5%)。因此,白乌鱼鱼肉的最优水解工艺为酶解温度55 ℃、酶解时间4.65 h、pH 8.65、酶浓度1.0%。
参考文献:
[1]肖尧,张如义,苏圣淞,等.紧扣现代农业特色优势,打造丘区农业种业强市——四川省内江市农业科学院加快推进种业振兴的实践与思考[J].农村经济与科技,2022,33(14):81-83.
[2]周爱国.白甲乌鳢种质分析、白化特征机理及其热休克蛋白基因的研究[D].广州:华南农业大学,2017.
[3]张龙翼,张崟,陈平平,等.白乌鱼胴体粘液中耐热菌的耐热性及特征菌种鉴定[J].现代食品科技,2018,34(11):77-82.
[4]张龙翼,陈平平,王林果,等.白乌鱼胴体黏液抗菌活性分析[J].成都大学学报(自然科学版),2018,37(2):155-158.
[5]张龙翼,张崟,张鹏程,等.冷藏过程中一氧化碳对白乌鱼肉品质的影响[J].现代食品科技,2019,35(3):95-100.
[6]焦晓磊,王林果,母运龙,等.白乌鱼方便汤粉的工业化鼓风干燥工艺[J].食品工业,2023,44(2):107-112.
[7]蒋丽施,舒春霞,徐远行,等.白乌鱼风味鱼肉松加工工艺研究[J].中国调味品,2022,47(7):109-113.
[8]韩旭,彭海川,白婷,等.蒸煮和油炸对鱼肉蛋白质营养和风味的影响[J].成都大学学报(自然科学版),2021,40(3):247-255.
[9]马天新.黑鱼鱼肉ACE抑制肽的制备及快速筛选[D].南昌:江西师范大学,2022.
[10]ZHANG J, LI M, ZHANG G N, et al. Identification of novel antioxidant peptides from snakehead (Channa argus) soup generated during gastrointestinal digestion and insights into the anti-oxidation mechanisms[J].Food Chemistry,2021,337:127921.
[11]HUANG J J, LI H L, XIONG G Q, et al. Extraction, identification and anti-photoaging activity evaluation of collagen peptides from silver carp (Hypophthalmichthys molitrix) skin[J].LWT-Food Science and Technology,2023,173:114384.
[12]韩贵新,汪金林,李钰金,等.杂交鲟鱼(Acipenseridae)龙筋中活性肽的分离、鉴定和抗癌机制[C]//中国食品科学技术学会第十九届年会论文摘要集,2022.
[13]ZHANG Y, ZHANG L Y, VENKITASAMY C, et al. Improving the flavor of microbone meal with flavourzyme by response surface method[J].Journal of Food Process Engineering,2019,42(4):13040-13041.
[14]ZHNAG Y, KE H, BAI T, et al. Characterization of umami compounds in bone meal hydrolysate[J].Journal of Food Science,2021,86(6):2264-2275.
[15]邹泽斌,赖玉健,梁杉,等.响应面优化黄鱼胶酶解工艺及其基本成分分析[J].食品科技,2022,47(4):152-160.
[16]TACIAS-PASCACIO V G, MORELLON-STERLING R, EL-HOCINE S, et al. Use of alcalase in the production of bioactive peptides: a review[J].International Journal of Biological Macromolecules,2020,165:2143-2196.
[17]DANIEL C, BERENGUER-MURCIA ?, FERNANDEZ-LAFUENTE R, et al. Biological activities of peptides obtained by pepsin hydrolysis of fishery products[J].Process Biochemistry,2022,120:53-63.
[18]MIKHAIL S, KASHINSKAYA E, GISBERT E. A meta-analysis for assessing the contributions of trypsin and chymotrypsin as the two major endoproteases in protein hydrolysis in fish intestine[J].Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology,2023,278:111372.
[19]TACIAS-PASCACIO V G, CASTA?EDA-VALBUENA D, MORELLON-STERLING R, et al. Bioactive peptides from fisheries residues: a review of use of papain in proteolysis reactions[J].International Journal of Biological Macromolecules,2021,184:415-428.
[20]宁诗文,崔珊珊,尚宏丽.响应面法优化大黄花鱼肉蛋白水解工艺及多肽抗氧化性研究[J].食品工业科技,2020,41(13):219-226.
[21]CAO M D, LI W H, LI H, et al. Antioxidant and ACE inhibitory activities of peptides prepared from adzuki bean by semi-solid enzymatic hydrolysis[J].Food Bioscience,2022,47(3):253-261.
[22]YANG L H, GUO Z L, WEI J Q, et al. Extraction of low molecular weight peptides from bovine bone using ultrasound-assisted double enzyme hydrolysis: impact on the antioxidant activities of the extracted peptides[J].LWT-Food Science and Technology,2021,146:111470.
[23]侯小桢,张伊敏,林群超,等.响应面法优化毛虾酶解工艺条件[J].韩山师范学院学报,2020,41(3):61-69.
[24]燕瑜翰,卢静静.响应面法优化克氏原螯虾虾头酶解工艺研究[J].农产品加工,2022(24):20-22.

