不同性别南方型黑杨无性系叶片对土壤短期间歇性干旱的生理响应
摘要:【目的】全球气候变化背景下南方型黑杨(Populus spp.)栽培区的干旱问题日渐严重,限制了人工林的生产力提升。研究南方型黑杨应对土壤短期间歇性干旱的性别生理响应差异,探讨不同性别黑杨的干旱适应能力及策略,为基于性别的黑杨造林无性系选择提供参考。【方法】以南方型黑杨栽培区重点推广的4种雌性和3种雄性黑杨无性系当年生扦插苗为研究对象,采用盆栽控水的方式进行土壤短期间歇性干旱(干旱—复水—干旱)处理,通过对比分析不同性别无性系在土壤短期间歇性干旱过程中叶片质膜稳定性、渗透调节、抗氧化系统,以及光合色素等生理指标的变化,分析南方型黑杨在叶片生理响应和干旱耐受性方面应对土壤短期间歇性干旱的性别差异。【结果】受土壤干旱影响,雌、雄黑杨叶片均出现电导率上升、丙二醛和游离脯氨酸含量以及抗氧化酶活性升高、叶绿素含量下降等现象,表明叶片膜和光合系统受到一定损伤,而复水(解除干旱)后均恢复至正常水平。但雌、雄黑杨在生理响应的水平和模式方面存在一定差异:雌性黑杨在干旱胁迫时叶片抗氧化酶活性波动较大,叶绿素和脯氨酸含量维持较高的水平,而复水后叶绿素含量可以快速恢复,但膜脂过氧化程度维持较高水平;雄性黑杨在干旱胁迫时通过保持较高的细胞膜稳定性和稳定的抗氧化酶活性以提高抗旱性,同时降低叶绿素含量以减少水分损耗。表明在干旱条件下,雌性黑杨继续维持一定的光合和生长能力,但抗旱能力较低,而雄性黑杨相应具有较强的干旱耐受能力。此外,雄性黑杨无性系在应对干旱胁迫时表现出较为一致的生理响应,而雌性黑杨在无性系间存在较大差异。【结论】雄性黑杨无性系整体上具有较高且稳定的抗旱能力,而雌性黑杨抗旱能力相对较弱,且无性系间差异较大,但复水后的干旱间歇期可以较快恢复至正常的叶片生理状态。
关键词:干旱胁迫;南方型黑杨;性别差异;抗旱策略;抗氧化酶系统
中图分类号:S722 文献标志码:A开放科学(资源服务)标识码(OSID):
文章编号:1000-2006(2024)03-0172-09
Sex-specific leaf physiological responses of southern-type poplar to short-term intermittent soil drought
MA Tan1, TIAN Ye1*, WANG Shujun2, LI Wenhao1, DUAN Qiying1, ZHANG Qingyuan1
(1.Co-Innovation Center for Sustainable Forestry in Southern China, College of Forestry and Grass, Nanjing Forestry University, Nanjing 210037, China; 2.Yuxing Nursery Farm, Baoying 225831, China)
Abstract:【Objective】Climate change-induced drought restricts the distribution, growth and productivity of southern poplar plantations in the south of China. To explore adaptability to drought and provide reference for future sex-based poplar clone selection, we studied physiological responses to short-term intermittent soil drought between different sexes. 【Method】 Based on pot experiments by setting short-term intermittent soil water deficiency, four female and three male clones of southern-type poplar were used to compare sex-specific changes in physiological traits, including leaf plasma membrane stability, osmotic regulation, antioxidant system, and photosynthetic pigments. 【Result】Short-term drought induced increases in electrical conductivity of leaves, malondialdehyde (MDA) and proline (Pro) contents, and antioxidant enzyme activities, but decreases in leaf chlorophyll content, for both male and female poplar clones, which indicated damage to leaf membranes and photosynthesis system with membrane lipid peroxidation. After drought relief by rewatering, these physiological traits all returned to substantially the same level as the (normal watering/non-drought) control treatment. Differences existed in the level and pattern of physiological responses to short-term soil drought between male and female clones. For female clones, the activity of antioxidant enzymes in leaves fluctuated greatly, and the contents of chlorophyll and proline remained at a high level under draught treatment; after drought relief by rewatering, chlorophyll content recovered rapidly, while membrane lipid peroxidation remained high. For male clones exposed to short-term drought, however, we detected stable POD activity and reduced chlorophyll content; this indicated higher drought resistance. Male clones, by maintaining membrane stability and reducing water loss. Therefore, female poplar clones showed relatively lower drought tolerance, but maintained a certain level of photosynthesis and growth, while male clones presented relatively higher drought tolerance. In addition, during short-term soil drought, three male clones showed relatively consistent physiological responses, while male clones had greater inter-clone variation. 【Conclusion】 Male poplar clones had relatively high and stable drought resistance, while female clones had generally weak but varied inter-clone drought resistance. However, female clones displayed rapid recovery of leaf physiological conditions after rewatering between short-term drought.
Keywords:drought stress; southern-type poplar; sexual difference; drought resistance strategy;antioxidant enzyme system
IPCC气候变化评估报告中指出,地球表面的平均温度在20个世纪升高了约0.6 ℃,且预计在未来还可能持续上升[1]。随着全球气候变化,不同地区的降水格局也会发生改变,水资源分布不均的情况日益加剧[2],全球更多区域会因此经历严重、频繁的干旱事件[3]。由于全球气候变化引起的温度上升,我国干旱区的范围以及干旱程度也有增加的趋势[4],雨量分布由过去的“南涝北旱”向“南旱北涝”转变,南方地区也出现了越来越严重的旱情[5]。干旱胁迫导致植物体内的生理和代谢过程易受到影响,严重时可导致植物死亡,因此,由全球变暖、干旱等气候变化导致限制林木生产力的气候因子逐渐由温度转向水分供应[6]。
杨树(Populus spp.)是中纬度平原地区最重要的人工用材林树种,对我国木材安全保障和生态环境保护有着巨大的意义[7]。自20世纪80年代黑杨派树种引入我国以来,已培育出了大量适合南方平原地区生长的速生型优良无性系,这些南方型黑杨无性系普遍对土壤水分条件要求较高,目前高生产力的林分主要种植在水、养条件较好的江河平原地区,甚至利用了部分基本农田[8]。目前,全球变暖、干旱频发等气候变化对杨树人工林高生产力的维持已产生了一定的冲击,此外,受耕地红线的限制,我国南方型黑杨人工林的发展将来更多需要面向条件较差、干旱贫瘠的山地。因此,无论是从气候变化,还是从杨树栽培用地的改变等角度考虑,寻找抗旱能力较强的杨树无性系是未来杨树人工林营造的核心之一。
大量研究表明,雌雄异株植物的不同性别个体具有不同的胁迫敏感性和耐受能力,雄性植株往往具有更强的应对包括干旱在内的外界胁迫的适应力[9-10]。如银杏(Ginkgo biloba)、葎草(Humulus scandens)等物种的雄株在干旱胁迫下能表现出更强的保水能力[11-12]。杨树对干旱胁迫的响应方面前人也有较多研究,但在性别差异方面的研究主要集中于青杨派树种[13-14],针对作为用材林培育最重要的黑杨派树种的相关研究较少[15-16],并且杨树为雌雄异株树种,以往在雌雄性别差异方面均只选用了单一无性系开展研究,研究结果的可靠性值得商榷。
因此,本研究以南方型黑杨栽培区先后重点推广的雌、雄黑杨无性系为对象,以盆栽控水的方式进行土壤短期间歇性干旱处理,从叶片质膜稳定性、渗透调节、抗氧化系统以及光合色素等方面对雌、雄性别黑杨无性系的生理响应进行对比分析,探讨其干旱耐受能力和响应策略的性别差异,以期为气候变化背景下基于性别的黑杨造林无性系选择提供参考,同时也为黑杨派无性系造林立地向山地拓展提供支撑。
1 材料与方法
1.1 供试无性系及育苗管理
本研究选择了自黑杨派(Sect. Aigeiros Duby)树种引入以来先后在长江中下游地区重点推广应用的7个南方型黑杨无性系作为试验材料,其中雌性无性系包括NL-95杨(P.×euramericana ‘Nanlin-95’)、NL-895杨(P.×euramericana ‘Nanlin-895’)、I-72杨(P. × euramericana ‘San Martino’)和I-69杨(P. deltoides ‘Lux’),雄性无性系包括NL-3804杨(P. deltoides ‘Nanlin-3804’)、NL-3412杨(P. deltoides ‘Nanlin-3412’)和35杨(P. deltoides ‘35/66’)。供试插穗取自于江苏省宿迁市泗洪县半城马浪湖林场的南方型杨树种质资源圃。
盆栽试验在南京林业大学白马教学科研基地的玻璃温室内进行。盆栽所用基质以山地黄棕壤、珍珠岩、河沙和有机肥按照体积比6∶2∶1∶1配置而成,其中山地黄棕壤取自南京林业大学白马教学科研基地的丘陵岗地,质地较为黏重。配置后的基质容重为1.1 g/cm3,最大体积持水量为35.8%,pH为6.9。采用上、下口径分别为23、16.5 cm,高22 cm的塑料容器进行扦插育苗,每盆的基质装填量约为7.0 kg。
于2019年3月将各无性系粗度和长度基本一致的插穗扦插于容器中,每个容器扦插1根插穗,容器下设置托盘,放置在架空苗床上进行育苗。扦插后充分灌溉,育苗期间进行正常的水分和杂草管理。
1.2 试验设计及调查取样
于2019年8月选择各无性系苗高、地径基本一致、健康的苗木开展试验,设计短期间歇性干旱(short-term intermittent drought treatment, DR)和对照(control, CK)2种处理,其中DR处理在试验开始时(0 d)浇1次透水,之后任其自然失水,并根据植株叶片的水势变化和萎蔫程度,同时结合土壤含水量的变化,于处理开始的第5天(因供试黑杨无性系植株较大,耗水快,此时供试无性系植株大部分叶片发生萎蔫)进行一次充分复水,之后开始第2次自然失水;CK处理采用称重的方式,每天补充1次水分,保持土壤含水量为最大持水量的70%~80%。试验设置3个小区重复,每个重复每种无性系各5盆,试验盆栽共计210盆,每个重复小区各无性系随机摆放。
针对短期间歇性干旱处理,根据干旱处理开始后叶片的萎蔫情况,于处理开始后的第1、3、4、5天监测土壤相对含水量(第5天复水后停止监测),并同步监测杨树叶片的黎明前和正午水势,用于判断植株的干旱胁迫情况。根据DR处理植株叶片形态的变化,并结合土壤含水量和叶片水势结果,于处理开始后的第5天在取样之后进行一次复水,之后进行第2次自然失水。叶片样品采集分别于处理开始后的第1、3、4、5、7、10天进行,其中第1天水分供应充分,叶片正常,第3~5天叶片由开始出现萎蔫至大部分叶片发生萎蔫,第7天为复水之后的第2天,第10天为复水后第5天,此时叶片再度大部分萎蔫。CK处理的取样时间安排与DR处理同步进行。
试验处理及采样时所有杨树无性系均已形成驻芽,植株叶片完全展开,充分成熟。每次取样时均在各无性系苗木顶端往下第3~8片成熟功能叶中随机选取,每个无性系每次在各重复中随机选取3株苗木进行混合采样。样品采集后置于4 ℃冰盒内保存,并尽快带回实验室后,取部分鲜样迅速采用液氮研磨后,置于-80 ℃下进行超低温保存,用于膜脂过氧化与抗氧化系统相关生理指标测定,另一部分样品于采样当天进行相对电导率和叶绿素含量测定。
1.3 指标测定方法
土壤相对含水量采用W.E.T土壤三参数仪(Delta-T,UK)进行测定,每个重复小区的每个无性系随机选取3盆,于测定日的上午10时进行测定,测定位置为盆栽容器的中部。
叶片水势采用植物水势压力室(SKPM 1400-80,UK)测定,其中黎明前水势在4:00—5:00时段测定,正午水势在12:00—14:00时段测定。每个重复小区的每个无性系随机选取3株苗木,采集植株中上部的成熟功能叶进行测定。
叶片相对电导率(REC)采用电导仪法测定,丙二醛(MDA)含量采用硫代巴比妥酸法测定,超氧化物歧化酶(SOD)活性采用氮蓝四唑光还原法测定,过氧化物酶(POD)活性采用愈创木酚法测定,总叶绿素含量采用丙酮-乙醇(体积比1∶1)混合液提取测定,游离脯氨酸(Pro)含量采用茚三酮染色法测定[17-18]。
1.4 数据处理
采用Excel 2016进行数据计算和处理。4个雌性无性系和3个雄性无性系分别作为性别群体,利用SPSS 24.0对各取样时间点的雌、雄性别以及处理与对照之间的差异性进行t检验,并对不同取样时间点之间进行单因素方差分析(One-way ANOVA)和Duncan多重比较,差异显著性水平定为Plt;0.05。采用SPSS 24.0和Origin 2021进行图表绘制。
2 结果与分析
2.1 短期间歇性干旱对土壤含水量及雌、雄黑杨叶片水分特征和叶绿素含量的影响
2.1.1 首次自然失水过程土壤含水量及雌、雄黑杨叶片水势变化
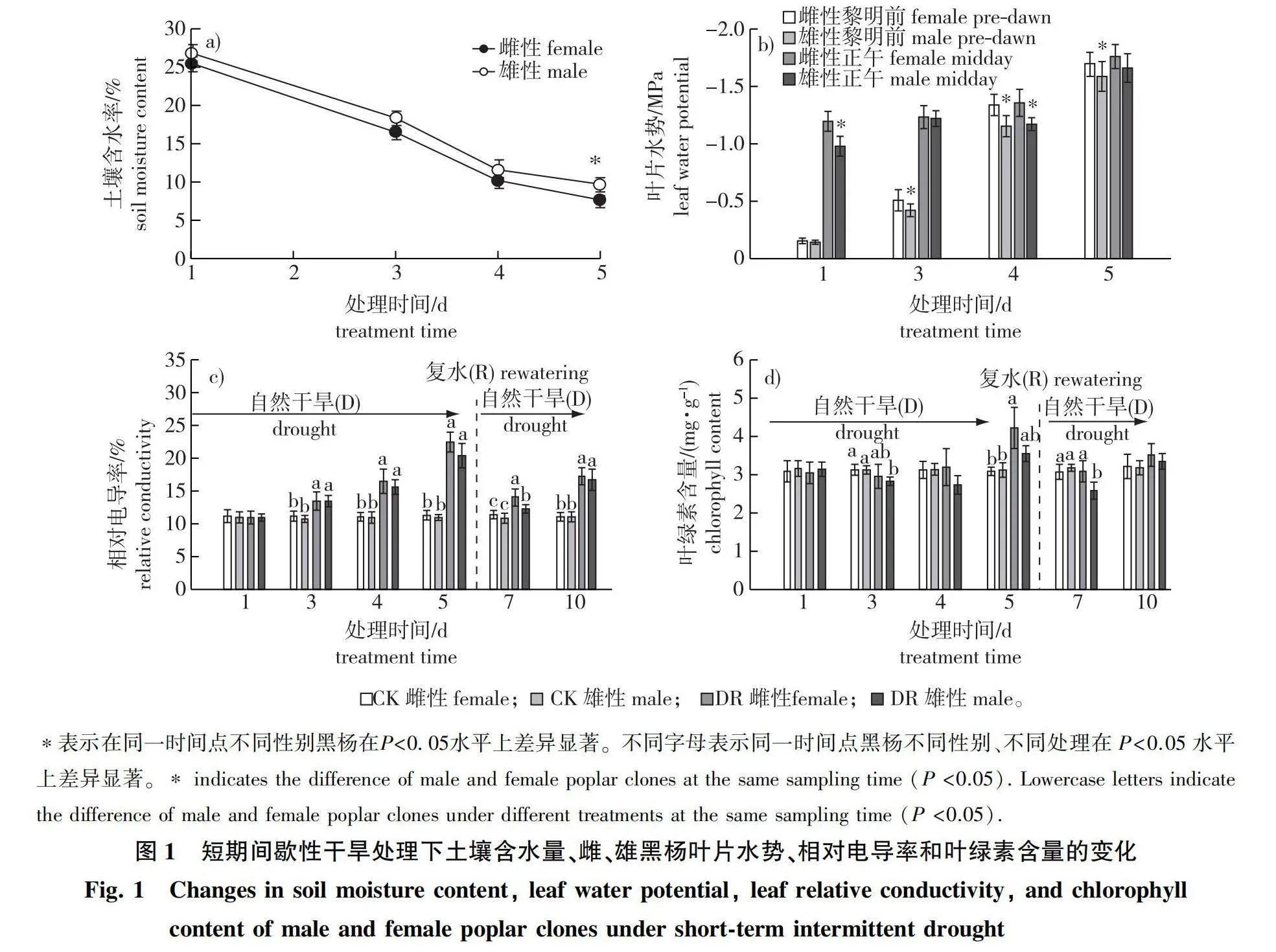
处理开始后的第1天,雌、雄无性系盆栽土壤的平均相对含水量分别为25.5%和26.8%,为盆栽土壤最大持水量(35.8%)的71%~75%,基本处于田间持水量水平,之后均快速下降,至处理开始第5天时,土壤相对含水量已降至10%以下;短期干旱过程中雌性无性系的盆栽土壤相对含水率整体上略低于雄性无性系,且在第5天时达到显著差异水平(图1a)。从雌、雄无性系叶片黎明前和正午水势的变化趋势(图1b)也可以看出,与土壤含水率相对应,雌、雄无性系的叶片黎明前和正午水势也均随着干旱时间延长而显著下降。干旱处理开始的第1天,雌性黑杨无性系的正午水势即已显著低于雄性黑杨,表明雌性黑杨具有相对更大的耗水量;至干旱处理开始后第4天,雌、雄黑杨无性系的黎明前叶片水势均已无法恢复,表明叶片已产生严重的水分亏缺,但无论黎明前水势还是正午水势,雌性黑杨整体上均显著低于雄性黑杨,表明雌性黑杨此时叶片的水分亏缺程度相对雄性黑杨更为严重。
2.1.2 叶片质膜透性和叶绿素含量变化
第1次干旱处理开始后的第3天,雌、雄黑杨叶片相对电导率开始显著上升,第4、5天时雌性黑杨叶片REC较对照分别上升了1.50和1.99倍,而雄性黑杨叶片REC较对照分别上升了1.42和1.86倍,雌性黑杨的上升幅度均高于雄性黑杨(图1c),表明短期干旱后雌性黑杨叶片细胞的膜脂过氧化程度相对更高。复水后雌、雄黑杨叶片REC均迅速恢复(下降),但仍显著高于对照,且雌性黑杨显著高于雄性黑杨(Plt;0.001),表明雌、雄复水后叶片受损的膜系统均有一定程度恢复,但相比较而言,雄性黑杨的恢复程度较好。至第10天时,雌、雄黑杨经历第2次干旱后,叶片相对电导率再度上升,但上升幅度低于第1次干旱(第5天),且雌、雄黑杨间的差异变得不显著。
短期间歇性干旱对雌、雄黑杨叶片叶绿素(Chl)含量均产生一定影响,第1次干旱后的第3天和第4天,雌、雄黑杨叶片Chl含量均有所下降,其中雄性黑杨的下降幅度高于雌性(图1d),表明干旱导致黑杨叶片叶绿素降解,其中雄性黑杨所受影响较大。至干旱处理后第5天,雌、雄黑杨的叶片叶绿素含量均出现显著的反向上升,但仍然以雌性黑杨的上升幅度高于雄性,与对照处理相比,雌、雄黑杨的叶片叶绿素含量分别上升了36.13%和13.46%;而复水之后,雌性黑杨叶片Chl含量迅速恢复至正常水平,而雄性黑杨显著低于正常浇水处理(P lt; 0.001),仅达到对照组的81.45%(图1d),表明干旱解除后,雌性黑杨的叶绿素含量可以快速恢复,而雄性黑杨的恢复程度较差。经历第2次干旱至第10天,雌、雄黑杨叶片叶绿素含量再次上升,重复出现了干旱胁迫响应。
2.2 短期间歇性干旱对雌、雄黑杨叶片渗透调节和抗氧化系统的影响
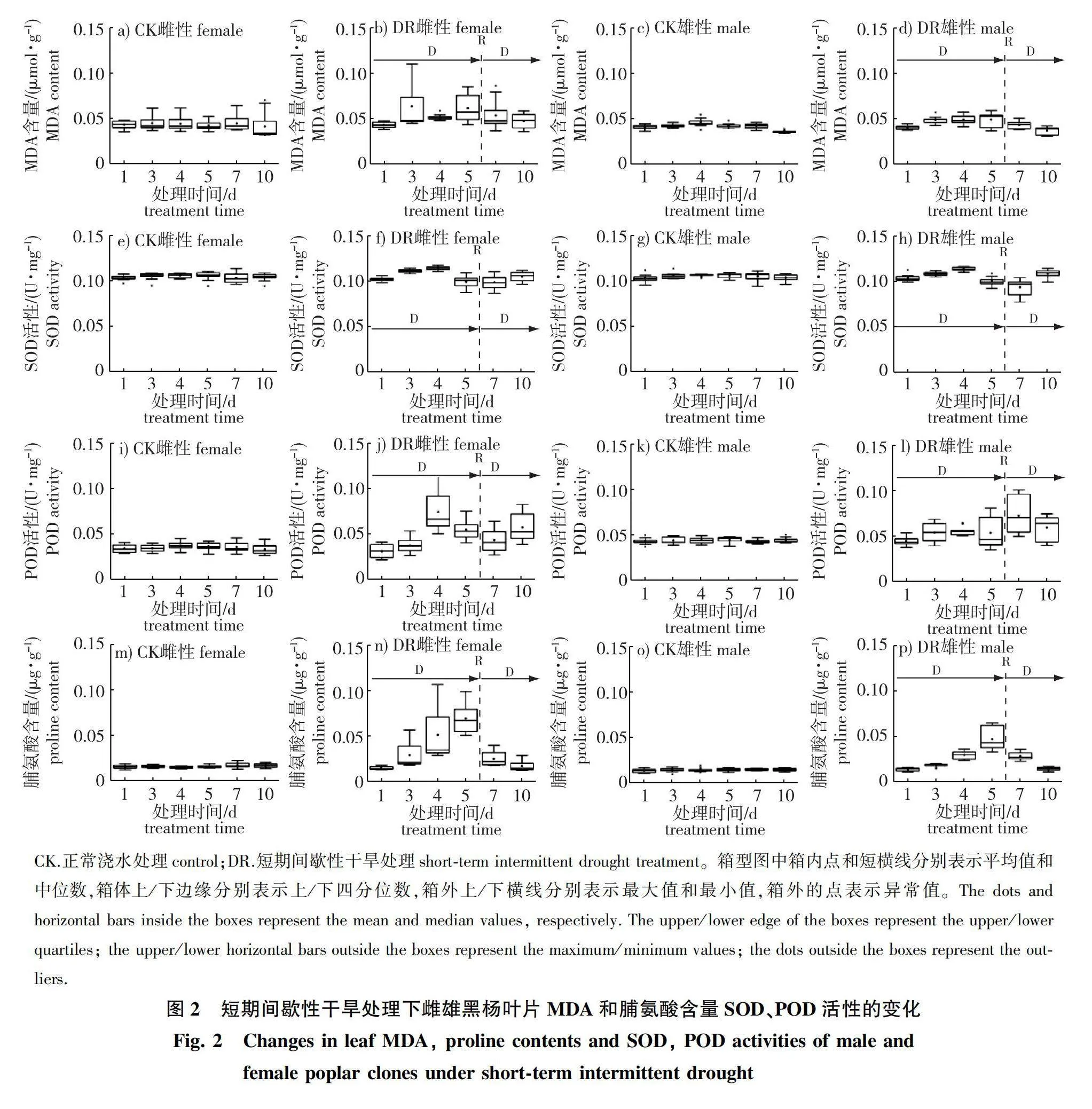
1)叶片丙二醛(MDA)含量。雌、雄黑杨叶片丙二醛(MDA)含量的变化趋势在短期间歇性干旱过程中大致相同(图2)。干旱处理后的第3天,雌、雄黑杨叶片MDA含量均明显上升,第5天时雌、雄黑杨叶片MDA含量分别比对照高46.3%和15.9%,而复水后第2次自然干旱过程开始后的第2天,雌、雄黑杨叶片MDA含量均基本恢复至正常水平。雌、雄性别比较,短期间歇性干旱过程中叶片MDA含量的变动幅度在不同性别间存在较大差异(图2b、2d),雌性黑杨叶片MDA含量的四分位距(inter-quartile range, IQR)整体上大于雄性,且多数时间点(如处理开始后第3、5天)的最大值均远高于雄性。此外,雌性黑杨叶片MDA含量的中位数多位于箱体下部,但平均值则多出现于较大值一侧,呈明显的右偏态分布,表明受干旱胁迫,雌性黑杨叶片MDA积累量总体上略高于雄性,但同时也存在较大的无性系间变异,而雄性黑杨则整体上表现较为稳定,无明显的无性系间变异。
2)叶片抗氧化系统。正常浇水的对照处理下,雌、雄黑杨叶片的超氧化物歧化酶(SOD)和过氧化物酶(POD)活性在处理期间基本保持稳定,其中SOD活性水平基本不存在性别差异,而POD活性水平整体上以雄性黑杨显著高于雌性黑杨(Plt;0.001)(图2e—2l)。
第1次短期干旱处理下,雌、雄黑杨无性系叶片SOD和POD活性均有所上升,但雌、雄黑杨的上升模式存在一定差异(图2f、2h、2j、2l)。干旱处理开始后,雌性黑杨无性系叶片SOD活性快速上升,处理第3天时即已极显著高于对照(P lt; 0.001),而雄性黑杨无性系的响应相对滞后,于处理后第4天达到最高值,并显著高于对照(P lt; 0.001)。雌性黑杨无性系叶片POD活性在干旱处理后第4天显著上升,并达到峰值,而雄性无性系在干旱初期期间上升幅度不明显。至干旱处理第5天时,雌、雄黑杨无性系叶片SOD活性迅速下降,并均显著低于对照(Plt;0.05),但性别间不存在差异;而对于POD活性,雌性黑杨有所下降,但仍保持较高水平,但雄性黑杨仍然变化不大。
复水后再度干旱的前期,雌性黑杨无性系叶片SOD活性基本维持与对照处理相同水平,而雄性黑杨SOD活性迅速下降至显著低于对照水平(P lt; 0.001);至再度干旱的第5天,雌、雄性黑杨SOD活性再次显著上升,呈现出干旱胁迫响应。而在POD活性方面,雌、雄黑杨无性系在第2次干旱过程中均保持较为稳定的但高于对照处理的POD活性水平,但同一性别的无性系间的变幅与第1次干旱处理时相比变得更大,表明经历1次短期干旱后,雌雄性别黑杨无性系均主动提高叶片的POD活性水平,并且同一性别的无性系间第2次干旱的响应产生了一定分异。
3)叶片脯氨酸积累。第1次干旱处理开始后,雌、雄黑杨叶片脯氨酸(Pro)含量均显著上升,但雌性黑杨的上升幅度整体高于雄性,干旱处理开始后的第3~5天,雌性黑杨叶片Pro积累量比雄性黑杨高48%~74%(图2m—2p),说明干旱胁迫下雌性黑杨较雄性黑杨更容易在叶片中积累较多的脯氨酸。从同一性别内的变化来看,雌性黑杨的4个无性系响应干旱胁迫时叶片Pro含量变化较大,且呈明显的右偏态,而雄性黑杨各无性系间变化较小,基本呈正态分布(图2n、2p),表明雌性黑杨的无性系之间在应对干旱时的响应差异程度明显高于雄性,而雄性无性系之间相对表现较为稳定。复水之后雌、性黑杨各无性系的叶片Pro水平均能快速恢复至正常水平,不存在显著的性别差异;同时在受到第2次干旱胁迫时(第10天)并没有发生如同第1次胁迫时的显著上升(图2n、2p),表明在经受一次胁迫以后,雌、雄黑杨各无性系均产生了一定的适应性,Pro的积累和调控响应不再敏感。
3 讨 论
干旱时产生的过量活性氧会造成氧化胁迫,破坏植物膜系统,引起膜脂过氧化,产生MDA[17]。相对电导率和MDA含量的变化通常可以用来衡量膜的完整性和膜质过氧化程度[18],从而反映出植株受胁迫程度。本研究发现在短期间歇性干旱的整个过程中,雌性黑杨的叶片REC和MDA含量整体上升高于雄性,主要体现在雌性表现出更高的平均值和远超雄性的最大值,即在干旱胁迫下,雌性黑杨的叶片膜系统比雄性更容易受损,这与雌、雄青杨(P. cathayana)在干旱胁迫下的表现类似[19]。另外雌性黑杨的MDA含量在干旱程度较重时存在明显的右偏态,表明雌性黑杨虽然在无性系间具有较大变动,但大多数更容易出现膜脂过氧化现象和MDA的积累,而雄性黑杨应对干旱的性状表现整体上相对更为稳定。
干旱胁迫下,植株体内SOD、POD等抗氧化酶活性的提高可以维持活性氧积累与清除之间的平衡,保护植株膜系统不受伤害[20-21]。本研究结果表明,在干旱初始阶段,雌、雄黑杨均能通过提高SOD活性来应对氧化胁迫,对膜系统进行有效保护,但当干旱胁迫严重时(处理第5天),生成的活性氧已无法清除,SOD活性相应下降。类似现象在欧美杨(P. deltoides × P. nigra)[21]和沙棘(Hippophae rhamnoides)[22]的相关研究中有过报道,其中针对欧美杨的研究结果发现,极端胁迫环境下,欧美杨雌、雄个体间表现出更明显的响应差异,其中雌株的SOD活性表现出更大幅度的下降[21]。本研究中雌、雄黑杨在较轻的干旱下SOD活性变化表现出高度的相似性,而在较为严重的干旱时酶活性的下降幅度并没有发现明显的性别差异,但在重度干旱胁迫以及复水之后的再度干旱阶段,性别间表现出更大的差异,且同一性别内的无性系间分化变得更为明显。这一现象在POD活性变化中同样有所体现,因此,在判断不同性别或者品种的抗旱能力时,仅以第1次胁迫时植株的生理响应作为指标有失偏颇,其复水后的恢复能力也应作为一项重要参考。
在间歇性干旱的整个过程中,雌、雄黑杨POD活性存在较明显的性别差异,雌性黑杨POD活性的波动幅度明显高于雄性,说明雌株相比雄株有更高的胁迫敏感性,即同样的干旱胁迫下雌性黑杨更易受到胁迫造成叶片损伤,需要迅速提高相关保护酶活性维持活性氧产生与清除的平衡,而雄性黑杨稳定的POD活性和更低的REC以及MDA含量说明其叶片受到的伤害更低,这一结果与前人对青杨的相关研究结果基本一致[13, 23]。另外雌、雄黑杨POD活性的变化趋势与MDA含量变化趋势相似度较高,说明黑杨POD活性上升对减少叶片MDA积累可能具有重要的作用。
作为渗透调节物质,游离脯氨酸对维持干旱胁迫下的植物叶片细胞功能极为重要[24]。前人针对雌雄异株树种应对干旱胁迫的渗透调节响应存在一定的分歧,在干旱胁迫下,有些树种,如滇杨(P. yunnanensis)的雄性植株具有更强的渗透调节能力[25],而另外一些树种(如中国沙棘)则表现为雌性具有更强的渗透调节能力[26]。本研究发现,随着干旱程度加重,雌、雄黑杨无性系叶片Pro含量均持续上升,但雌性黑杨的上升幅度整体上高于雄性,叶片中有更多的Pro积累,说明雌性黑杨更倾向于以脯氨酸的积累提高干旱耐受能力。此外,干旱时雌性黑杨Pro的大量积累或许与在干旱胁迫解除后Pro可以作为氮源被植株利用有关[27],干旱胁迫下,雌性黑杨维持高含量的Pro一方面可以保证细胞质基质与外界环境的渗透平衡,减少细胞水分散失,另外在胁迫结束后可以作为氮源保障植株迅速恢复叶绿素含量,以维持营养生长[28],在一定程度上可以作为以保障营养生长为前提的干旱适应策略。另外雌性黑杨不同无性系之间表现出较大差异性,而雄性不同无性系之间基本无差异,这是在进行性别选择时必须考虑到的因素。
干旱胁迫下植物叶绿素含量的变化影响光合作用,进而影响植株生长和抗旱能力[29-31]。本研究中,雌、雄黑杨在干旱前期叶片Chl含量均有所下降,但雌性黑杨Chl含量始终高于雄性,这与雌、雄性别康定柳(Salix paraplesia)在干旱胁迫下的研究结果[32]相似,相对于雄株,高山柳雌株在干旱胁迫下有较高的叶绿素含量,依靠光合作用提升干旱耐受能力。而本研究中雄性黑杨在干旱条件下降低Chl含量,通过限制植物生长和减少水分消耗来应对干旱,其耐旱能力在一定程度上相对较高。干旱间歇复水时雌性黑杨Chl含量迅速恢复至正常水平,但雄性黑杨显著低于正常浇水处理,进一步说明短期干旱导致了雄性黑杨叶片叶绿素部分降解,以至于复水后难以在短时间内恢复,而雌性黑杨在干旱阶段能减少Chl损失,并于复水后迅速恢复。雌性黑杨能迅速恢复叶绿素水平的能力与其大量积累Pro以应对干旱的策略相吻合,在干旱阶段积累的大量Pro能够在其复水后合成Chl时被直接利用。雌性黑杨采取保证光合作用的干旱响应策略,从而为营养生长的维持奠定基础,但这也意味着对水分更高的需求。与雄性黑杨相比,雌性黑杨更倾向于生长在水分和养分更为充足的立地[33],表明雌性黑杨更倾向于提升营养生长,而雄性黑杨更倾向于提升干旱耐受性。本研究结果表明,在干旱胁迫程度最高时,雌、雄黑杨Chl含量均明显上升,这一结果与本研究在测定叶绿素含量时采用的叶片鲜质量有关,短期内受到严重干旱时导致叶片快速失水,从而出现叶绿素“浓缩”现象[34-35],其中雌性黑杨的浓缩现象更明显,尤其最大值(第5天)明显高于雄性,体现出了一定的性别间差异。当然,如果需要对不同性别杨树无性系在经历干旱过程时叶绿素以及其他生理参数的绝对变化进行探讨,则需要结合叶片含水量的变化,采用生物量为基础进行计算,可以更加科学地表征不同性别杨树无性系应对间歇性干旱的生理响应。
综上所述,雌、雄黑杨在应对短期间歇性干旱时采取了不同的响应策略,雌株通过维持较高的脯氨酸和叶绿素含量以保证更高的光合能力,维持和促进植株生长;而雄株则采取了更为保守的应对策略,通过降低光合作用以节省水分,再以相关保护酶、渗透调节物质保护叶片减少伤害。另外,本研究结果表明,雌性黑杨应对干旱胁迫时,其生理响应表现出较大的无性系间变异,但雄性黑杨各无性系间则表现出较高的一致性。虽然本研究选择的雌、雄无性系数量相对偏少,但在一定程度上仍然可以反映不同性别无性系应对土壤干旱的生理响应特征,因此,将来在进行无性系选择时还需要充分考虑同一性别内的稳定性。综合来看,雌性黑杨有更强的生长能力,而雄性黑杨有更高且更稳定的抗逆性。当然,由于南方型黑杨植株大,生长阶段耗水快,而本研究采用的盆栽控水法受容器大小和植株根系生长空间受限的影响,在较短的时间内即产生了明显的干旱胁迫现象,对有效探讨雌雄黑杨应对干旱和复水的性别生理差异产生了一定的干扰和限制,后续需要适当增大根系生长空间,或者在田间进一步开展相关试验研究,以明确南方型黑杨应对间歇性干旱的性别差异,为适地适无性系的造林品种选择提供有效支撑。
参考文献(reference):
[1]LEE J Y, MAROTZKE J, BALA G, et al. IPCC (The Intergovernmental Panel on Climate Change). Climate change 2021: the physical science basis. Future global climate: scenario-42 based projections and near-term information[M]. Cambridge: Cambridge University Press, 2021.
[2]常兆丰,韩福贵,仲生年.甘肃民勤荒漠区18种乔木物候与气温变化的关系[J].植物生态学报,2009,33(2):311-319.CHANG Z F,HAN F G,ZHONG S N.Relationships between phenology of 18 tree species and air temperature change in the Minqin Desert area of China[J].J Plant Ecol (Chin Version),2009,33(2):311-319.DOI: 10.3773/j.issn.1005-264x.2009.02.008.
[3]SOLOMON S.Climate change 2007:the physical science basis:contribution of working group I to the fourth assessment report of the Intergovernmental Panel on Climate Change[M].Cambridge:Cambridge University Press,2007.
[4]徐建文,居辉,刘勤,等.黄淮海地区干旱变化特征及其对气候变化的响应[J].生态学报,2014,34(2): 460-470. XU J W,JU H,LIU Q,et al.Variation of drought and regional response to climate change in Huang-Huai-Hai Plain[J].Acta Ecol Sin,2014,34(2): 460-470.DOI: 10.5846/stxb201301240148.
[5]蔡运龙,SMIT B.全球气候变化下中国农业的脆弱性与适应对策[J].地理学报,1996,51(3):202-212.CAI Y L,SMIT B.Sensitivity and adaptation of Chinese agriculture under global climate change[J].Acta Geogr Sin,1996,51(3):202-212.DOI: 10.1053/jhep.2003.50458.
[6]CHAVES M M,MAROCO J P,PEREIRA J S.Understanding plant responses to drought: from genes to the whole plant[J].Funct Plant Biol,2003,30(3):239.DOI: 10.1071/fp02076.
[7]方升佐.中国杨树人工林培育技术研究进展[J].应用生态学报,2008,19(10):2308-2316.FANG S Z.Silviculture of poplar plantation in China:a review[J].Chin J Appl Ecol,2008,19(10):2308-2316.DOI: 10.3321/j.issn:1001-7488.2007.08.009.
[8]苏晓华,黄秦军,张冰玉,等.中国杨树良种选育成就及发展对策[J].世界林业研究,2004,17(1):46-49.SU X H,HUANG Q J,ZHANG B Y,et al.The achievement and developing strategy on variety selection and breeding of poplar in China[J].World For Res,2004,17(1):46-49.DOI: 10.3969/j.issn.1001-4241.2004.01.010.
[9]胥晓,杨帆,尹春英,等.雌雄异株植物对环境胁迫响应的性别差异研究进展[J].应用生态学报,2007,18(11):2626-2631.XU X,YANG F,YIN C Y,et al.Research advances in sex-specific responses of dioecious plants to environmental stresses[J].Chin J Appl Ecol,2007,18(11):2626-2631.DOI: 10.3969/j.issn.1003-5710.2013.01.012.
[10]陈小梅,危晖,林媚珍.气候变化对雌雄异株植物影响的研究进展[J].生态学杂志,2014,33(11):3144-3149.CHEN X M,WEI H,LIN M Z.Responses of dioecious plants to climate change:a review on the potential mechanisms[J].Chin J Ecol,2014,33(11):3144-3149.DOI: 10.3321/j.issn:1006-687X.2007.03.028.
[11]何梅,施大伟,胡玉安,等.干旱胁迫下银杏雌雄植株的生长及内源激素含量的差异[J].江西农业大学学报,2017,39(6):1154-1162.HE M,SHI D W,HU Y A,et al.Gender differences in the growth and endogenous hormone contents of male and female Ginkgo biloba under drought stress[J].Acta Agric Univ Jiangxiensis (Nat Sci Ed),2017,39(6):1154-1162.DOI: 10.13836/j.jjau.2017150.
[12]刘金平,段婧.营养生长期雌雄葎草表观性状对水分胁迫响应的性别差异[J].草业学报,2013,22(2):243-249.LIU J P,DUAN J.Humulus scandens gender differences in response to water stress in the vegetative growth stage[J].Acta Prataculturae Sin,2013,22(2):243-249.DOI: 10.3969/j.issn.1001-4829.2010.03.056.
[13]XU X,PENG G Q,WU C C,et al.Drought inhibits photosynthetic capacity more in females than in males of Populus cathayana[J].Tree Physiol,2008,28(11):1751-1759.DOI: 10.1093/treephys/28.11.1751.
[14]ZHANG S,JIANG H,PENG S M,et al.Sex-related differences in morphological,physiological,and ultrastructural responses of Populus cathayana to chilling[J].J Exp Bot,2011,62(2):675-686.DOI: 10.1093/jxb/erq306.
[15]段启英,田野,鄂晓伟,等.南方型黑杨生长和生理特性对持续干旱和复水响应的性别差异[J].生态学杂志,2020,39(7):2140-2150.DUAN Q Y,TIAN Y,E X W,et al.Sexual differences in growth and physiological properties of southern-type poplar clones in response to continuous drought and re-watering[J].Chin J Ecol,2020,39(7):2140-2150.DOI: 10.13292/j.1000-4890.202007.024.
[16]李斌.不同性别美洲黑杨幼苗生理生态特征对干旱胁迫的响应[D].杭州:浙江农林大学,2021.LI B.Responses of physiological and ecological characteristics of Populus deltoides seedlings of different sexes to drought stress[D].Hangzhou:Zhejiang A amp; F University,2021.
[17]杨淑红,宋德才,刘艳萍,等.土壤干旱胁迫和复水后3个杨树品种叶片部分生理指标变化及抗旱性评价[J].植物资源与环境学报,2014,23(3):65-73.YANG S H,SONG D C,LIU Y P,et al.Changes of some physiological indexes in leaf of three cultivars of Populus after drought stress in soil and rewatering and evaluation on their drought resistance[J].J Plant Resour Environ,2014,23(3):65-73.DOI: 10.3969/j.issn.1674-7895.2014.03.09.
[18]张江涛,杨亚峰,刘艳,等.杨树品种2025及其2个芽变彩叶品种对土壤持续干旱胁迫的生理响应 [J].东北林业大学学报,2014,42(11):1-6.ZHANG J T,YANG Y F,LIU Y,et al.Physiological response of poplar 2025 and two bud mutation colored-leaf varieties to soil continuous drought stress[J].J Northeast For Univ,2014,42(11):1-6.DOI: 10.3969/j.issn.1000-5382.2014.11.001.
[19]ZHANG S,CHEN L H,DUAN B L,et al.Populus cathayana males exhibit more efficient protective mechanisms than females under drought stress[J].For Ecol Manag,2012,275:68-78.DOI: 10.1016/j.foreco.2012.03.014.
[20]杨舒贻,陈晓阳,惠文凯,等.逆境胁迫下植物抗氧化酶系统响应研究进展[J].福建农林大学学报(自然科学版),2016,45(5):481-489.YANG S Y,CHEN X Y, HUI W K,et al.Progress in responses of antioxidant enzyme systems in plant to environmental stresses[J].J Fujian Agric For Univ (Nat Sci Ed),2016,45(5):481-489.DOI: 10.13323/j.cnki.j.fafu(nat.sci.).2016.05.001.
[21]沈燕.欧美杂交杨(Populus deltoides × Populus nigra)雌雄植株对盐和干旱胁迫的生理生态响应[D].杭州:浙江农林大学,2018.SHEN Y.Physiological and ecological responses of male and female Populus deltoides × Populus nigra to salt and drought stress[D].Hangzhou:Zhejiang A amp; F University,2018.
[22]裴斌,张光灿,张淑勇,等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J].生态学报,2013,33(5):1386-1396.PEI B,ZHANG G C,ZHANG S Y,et al.Effects of soil drought stress on photosynthetic characteristics and antioxidant enzyme activities in Hippophae rhamnoides Linn.seedlings[J].Acta Ecol Sin,2013,33(5):1386-1396.DOI: 10.5846/stxb201209281358.
[23]张琳敏,陈坚,沈文涛,等.雌雄组合模式下青杨形态和生理特征对干旱的响应差异[J].西华师范大学学报(自然科学版),2019,40(4):325-331.ZHANG L M,CHEN J,SHEN W T,et al.Different morphological and physiological responses of Populus cathayana to drought under male and female combination mode[J].J China West Norm Univ (Nat Sci),2019,40(4):325-331.DOI: 10.16246/j.issn.1673-5072.2019.04.001.
[24]PER T S,KHAN N A,REDDY P S,et al.Approaches in modulating proline metabolism in plants for salt and drought stress tolerance:phytohormones,mineral nutrients and transgenics[J].Plant Physiol Biochem,2017,115:126-140.DOI: 10.1016/j.plaphy.2017.03.018.
[25]CHEN L H,ZHANG S,ZHAO H X,et al.Sex-related adaptive responses to interaction of drought and salinity in Populus yunnanensis[J].Plant Cell Environ,2010,33(10):1767-1778.DOI: 10.1111/j.1365-3040.2010.02182.x.
[26]刘瑞香,杨劼,高丽.中国沙棘和俄罗斯沙棘叶片在不同土壤水分条件下脯氨酸、可溶性糖及内源激素含量的变化[J].水土保持学报,2005,19(3):148-151,169.LIU R X,YANG J,GAO L.Changes in contents of proline,soluble saccharin and endogenous hormone in leaves of Chinese seabuckthorn and Russian seabuckthorn under different soil water content[J].J Soil Water Conserv,2005,19(3):148-151,169.DOI: 10.3321/j.issn:1009-2242.2005.03.036.
[27]张净,王锦霞,郭萌萌,等.甜菜幼苗对干旱胁迫的适应机制[J].中国农学通报,2020,36(32):1-7.ZHANG J,WANG J X,GUO M M,et al.Beta vulgaris seedlings:adaptive mechanism to drought stress[J].Chin Agric Sci Bull,2020,36(32):1-7.DOI: 10.1007/s11738-019-2815-z.
[28]唐学玺.环境胁迫下雌雄异株植物的差异响应特征及研究进展[J].中国海洋大学学报(自然科学版),2020,50(7):74-81.TANG X X.Characteristics and research progress of sex-specific responses to environmental stresses of dioecious plants[J].Period Ocean Univ China,2020,50(7):74-81.DOI: 10.16441/j.cnki.hdxb.20190162.
[29]韩瑞宏,卢欣石,高桂娟,等.紫花苜蓿(Medicago sativa)对干旱胁迫的光合生理响应[J].生态学报,2007,27(12):5229-5237.HAN R H,LU X S,GAO G J,et al.Photosynthetic physiological response of alfalfa (Medicago sativa) to drought stress[J].Acta Ecol Sin,2007,27(12):5229-5237.DOI: 10.3321/j.issn:1000-0933.2007.12.033.
[30]LAL A,EDWARDS G E.Analysis of inhibition of photosynthesis under water stress in the C4 species Amaranthus cruentus and Zea mays:electron transport,CO2 fixation and carboxylation capacity[J].Funct Plant Biol,1996,23(4):403.DOI: 10.1071/pp9960403.
[31]MOHSENZADEH S,MALBOOBI M A,RAZAVI K,et al.Physiological and molecular responses of Aeluropus lagopoides (Poaceae) to water deficit[J].Environ Exp Bot,2006,56(3):314-322.DOI: 10.1016/j.envexpbot.2005.03.008.
[32]LIAO J,SONG H F,TANG D T,et al.Sexually differential tolerance to water deficiency of Salix paraplesia: a female-biased alpine willow[J].Ecol Evol,2019,9(15):8450-8464.DOI: 10.1002/ece3.5175.
[33]HUGHES F M R,BARSOUM N,RICHARDS K S,et al.The response of male and female black poplar [Populus nigra L.subspecies betulifolia (Pursh.) W.Wettst.] cuttings to different water table depths and sediment types:implications for flow ma-nagement and river corridor biodiversity[J].Hydrol Process,2000,14(16/17):3075-3098.DOI: 10.1002/1099-1085(200011/12)14:16/17lt;3075::aid-hyp135gt;3.0.co;2-l.
[34]常青山,张利霞,王建章,等.干旱和复水对4个芍药品种生理指标的影响及品种抗旱性评价[J].南京林业大学学报(自然科学版),2018,42(6):44-50.CHANG Q S,ZHANG L X,WANG J Z,et al.Effects of drought stress and rewatering on physiological indexes of four Paeonia lactiflora cultivars and evaluation of their drought resistance[J].J Nanjing For Univ (Nat Sci Ed),2018,42(6):44-50.DOI: 10.3969/j.issn.1000-2006.201803030.
[35]COSTA M A,PINHEIRO H A,SANTOS C S E,et al.Lipid peroxidation,chloroplastic pigments and antioxidant strategies in Carapa guianensis (Aubl.) subjected to water-deficit and short-term rewetting[J].Trees,2010,24(2):275-283.DOI: 10.1007/s00468-009-0397-x.
(责任编辑 孟苗婧 郑琰燚)

