液泡氨肽酶Y编码基因PoAPE3在稻瘟病菌中的生物学功能研究
杨子锋 黄琳婉 翁书凝 徐虎啸 王聪勐 赵爱玉 汤蔚
摘要
氨肽酶是一類可以选择性剪切氨基酸残基的蛋白酶,液泡氨肽酶Y能够调控碱性氨基酸残基的剪切以及液泡的活性。本研究通过同源性比对获得酵母液泡氨肽酶Y在稻瘟病菌中的同源基因PoAPE3,利用基因敲除法获得 PoAPE3基因敲除突变体(ΔPoAPE3),并构建回补体菌株进行生物学功能分析。表型测定结果表明,PoAPE3基因敲除突变体在产孢量、孢子萌发率、致病性、侵染过程等方面与野生型均无明显差异。突变体在完全培养基(CM)和稻秆培养基(SDC)上生长速率下降,且在应对胁迫剂H2O2时表现为更耐受,应对刚果红时表现为更敏感。以上结果表明PoAPE3参与调控稻瘟病菌的营养生长和对外界环境胁迫的应答过程。
关键词
稻瘟病菌; 氨肽酶Y; 基因敲除; 功能分析
中图分类号:
S 43511141
文献标识码: A
DOI: 10.16688/j.zwbh.2023178
Functional analysis of vacuolar aminopeptidase Y gene PoAPE3 in Pyricularia oryzae
YANG Zifeng1, HUANG Linwan1, WENG Shuning1, XU Huxiao1, WANG Congmeng2,ZHAO Aiyu3, TANG Wei1*
(1. College of Plant Protection, Fujian Agriculture and Forestry University, Fuzhou 350002, China;
2. Agricultural and Rural Bureau of Yongchun County, Quanzhou City, Fujian Province,
Quanzhou 362600, China; 3. Yongchun Xingmao Tea, Fruit and Vegetable Professional
Cooperative, Quanzhou City, Fujian Province, Quanzhou 362600, China)
Abstract
Aminopeptidases belong to a class of proteases capable of selectively cleaving amino acid residues. Acting as an aminopeptidase, vacuolar aminopeptidase Y regulates the cleavage of basic amino acid residues and influences vacuolar activity. In this study, the homologous gene PoAPE3, highly consistent with vacuolar aminopeptidase Y of Saccharomyces cerevisiae, was obtained from Pyricularia oryzae. Through gene knockout techniques, the ΔPoAPE3 was obtained, and a complementary strain was constructed for functional analysis. Phenotypic determination results showed that the ΔPoAPE3 exhibited no significant differences from the wildtype strain in terms of spore production, spore germination, pathogenicity, and infection process. However, ΔPoAPE3 displayed slower growth on CM and SDC media, increased tolerance to H2O2, and heightened sensitivity to Congo Red. These results indicate that PoAPE3 plays a role in vegetative growth and the response to external environmental stressors.
Key words
Pyricularia oryzae; aminopeptidase Y; gene knockout; functional analysis
稻瘟病菌Pyricularia oryzae 引起的稻瘟病是水稻的重要病害之一,每年由于稻瘟病引起的水稻产量损失巨大[1]。除水稻外,稻瘟病菌还可以侵染大麦等多种重要经济作物[2],同时稻瘟病菌简便的遗传操作体系,使其成为研究病原真菌较为理想的模式生物[3]。
液泡是由单层膜与其内部的细胞液组成的细胞器,主要存在于植物细胞中。真菌中也存在液泡,并与植物中的液泡有着相似的功能。蛋白酶是水解蛋白质肽链的一类酶的总称,在液泡中主要存在有PEP4(与哺乳动物组织蛋白酶D相关的天冬酰胺内肽酶)[4]和Prb1(丝氨酸内肽酶)两种蛋白酶[5],液泡中的许多水解酶在其成熟过程中需要经过这两种酶的加工[6]。根据蛋白酶降解多肽的方式可以将蛋白酶分成内肽酶和端肽酶,其中端肽酶又可分为羧肽酶和氨肽酶。氨肽酶是一类可以从蛋白质和多肽的N端选择性切除氨基酸残基的蛋白酶,其广泛存在于动植物体内[7]。目前已知在液泡中有3种氨肽酶,分别为APE1(液泡氨肽酶Ⅰ)、APE4(天冬酰胺氨肽酶)和APE3(液泡氨肽酶Y)。APE1能在谷胱甘肽代谢中发挥作用[89];APE4可能帮助自噬蛋白的转运[1011];APE3是一种特异性液泡蛋白酶,能特异性切割N末端的碱性氨基酸。目前已有研究表明,APE3在成熟过程中受到Prb1的调控,形成70 kD和75 kD两种分子[12]。在酵母中过表达ScAPE3后液泡活性增强,且ScAPE3在30℃时形成包涵体从而不进入液泡[13]。
APE3基因编码的液泡氨肽酶能对碱性末端的氨基酸进行剪切从而参与到液泡的活动中。为探究稻瘟病菌中APE3同源基因是否也有相似的功能,本研究对稻瘟病菌PoAPE3进行生物学功能分析,以期对PoAPE3在稻瘟病菌中的功能有更深入的了解,同时为其他病原真菌中氨肽酶的研究提供一定参考。
1 材料与方法
1.1 供试材料
稻瘟病菌野生型菌株Guy11、大肠杆菌Escherichia coli菌株DH5α、载体pCX62, pKNTmCherry均由本实验保存。水稻品种为‘CO39,大麦品种为‘Golden Promise。
1.2 PoAPE3蛋白序列的获得
在酵母数据库(https:∥www.yeastgenome.org/)中查找APE3并获得酿酒酵母Saccharomyces cerevisiae ScAPE3的氨基酸序列,然后于NCBI网站(https:∥www.ncbi.nlm.nih.gov/)中使用Blastp搜索工具比对得到一个与ScAPE3高度同源的稻瘟病菌的氨基酸序列(MGG_09692),命名为PoAPE3。
1.3 PoAPE3敲除突变体的获取
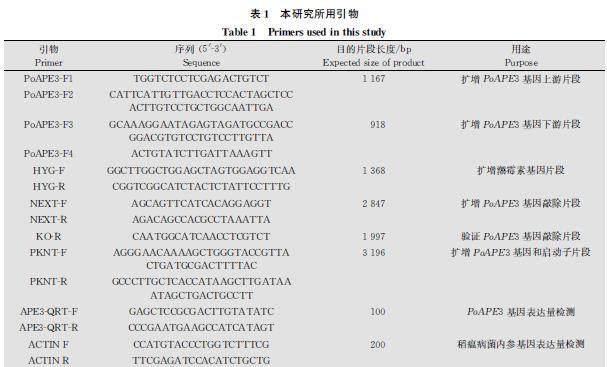
以野生型菌株Guy11 的DNA为模板,用引物PoAPE3F1/PoAPE3F2扩增PoAPE3基因上游1 167 bp 的DNA片段,用引物PoAPE3F3/PoAPE3F4扩增该基因下游918 bp的DNA片段,同时以质粒pCX62为模板,用引物HYGF/HYGR扩增潮霉素基因全长。通过融合PCR将PoAPE3基因上游片段、潮霉素基因和PoAPE3基因下游片段融合成长度约为3 453 bp的片段,用引物NEXTF/NEXTR扩增融合片段,并转化到稻瘟病菌野生型菌株Guy11的原生质体中[14],用潮霉素(600 μg/mL)对转化子进行筛选,阳性转化子用PoAPE3F1/KOR验证PoAPE3基因是否被HYG基因替换;用PoAPE3F1/HYGR验证潮霉素基因是否被转入[15]。试验所用引物(表1)均为自行设计,并由生工生物工程(上海)股份有限公司合成。
1.4 PoAPE3回补体菌株的获取
以野生型菌株Guy11的DNA为模板,用PKNTF/PKNTR引物扩增包括PoAPE3基因及启动子的片段,将其连接至pKNTmCherry載体上并转入大肠杆菌DH5α,构建回补载体。用原生质体转化的方式将回补载体转入突变体菌株中,用600 μg/mL G418(遗传霉素)对转化子进行筛选。采用PoAPE3F1/KOR验证PoAPE3基因是否回补,PoAPE3F1/HYGR验证潮霉素基因是否还保留。试验所用引物(表1)由生工生物工程(上海)股份有限公司合成。
1.5 PoAPE3敲除突变体的表型分析
1.5.1 菌株生长状况观察及生长速率测定
从野生型、敲除突变体和回补体菌株菌落边缘切取直径2 mm的圆形菌块,分别接种于完全培养基CM(complete medium)、基本培养基MM(minimal medium)、稻秆培养基SDC(rice decoction & corn medium)上[16],28℃培养7 d后测量菌落直径并拍照。
完全培养基(CM):每升培养基中含有50 mL硝酸盐,1 mL 微量元素, 1 mL维生素,10 g葡萄糖,1 g酸水解酪蛋白,1 g酵母提取物,固体培养基加入20 g琼脂粉。
微量元素: 每100 mL 蒸馏水中含有22 g七水硫酸锌,11 g硼酸,05 g四水氯化锰,05 g七水硫酸铁,017 g六水氯化钴,016 g五水硫酸铜,015 g五水钼酸钠,5 g乙二酸四乙酸二钠。
维生素:每100 mL 蒸馏水中含有001 g生物素,001 g维生素B,001 g硫胺素,001 g 核黄素,001 g对氨基苯甲酸,001 g烟酸。
基本培养基(MM):每升培养基中含有6 g硝酸钠,052 g氯化钾,0312 g七水硫酸镁,152 g磷酸二氢钾,001 g硫胺素,1 mL微量元素,10 g葡萄糖,固体培养基加入20 g琼脂粉。
稻秆培养基(SDC):每升培养基中含有25 g玉米粉, 100 g稻秆,20 g琼脂粉。
1.5.2 产孢量与孢子萌发测定
在野生型、敲除突变体和回补体菌株菌落边缘切取直径2 mm的圆形菌块接种于SDC培养基上,28℃黑暗条件下培养5 d后刮去菌丝,置于黑光灯下28℃诱导产孢3 d,测量菌落直径。用2 mL无菌水洗平板,单层miracloth过滤,定容至2 mL,用血球计数板统计孢子数,计算单位面积的产孢量。产孢量=孢子液浓度×孢子液体积/菌落生长面积。取10 μL孢子液滴于疏水盖玻片上,放置于保湿盒内28℃条件下培养,于0、2、4、8、12 h观察孢子形态并拍照,统计孢子萌发率及附着胞形成率,以50个孢子为1组,统计5组。孢子萌发率=已萌发孢子数/总孢子数×100%;附着胞形成率=形成附着胞结构的孢子数/总孢子数×100%。
1.5.3 敲除突变体对大麦和水稻的致病情况分析与侵染观察
调整野生型、敲除突变体和回补体菌株孢子悬浮液浓度为1×105个/mL,并加入2%明胶(50 μL/mL),采用点滴法对出苗后7 d的大麦叶片进行离体接种,在叶片正面点3滴(20 μL/滴),每处理3个重复,将接种的大麦叶片放置在28℃黑暗保湿1 d后转移至28℃,L∥D=12 h∥12 h的培养箱中继续保湿培养6 d,培养完成后观察大麦叶片上病斑扩展直径分析致病情况;同时,选用2~3周龄的水稻,利用喷壶将孢子悬浮液均匀喷洒于活体水稻叶片上,28℃黑暗,相对湿度为80%的培养箱中培养24 h后放置于28℃恒温,L∥D=12 h∥12 h的接种室,7 d后观察水稻发病情况并拍照和进行病斑分级统计[17]。
孢子悬浮液中加入2%明胶(50 μL/mL)备用。剪取生长7 d的大麦叶片,在叶片背面沿着叶脉两侧采用点滴法(2 μL/滴)接种孢子悬浮液,在28℃黑暗条件下保湿培养12、24、40 h及48 h后撕取大麦叶背表皮,于光学显微镜下观察侵染情况并拍照。
1.5.4 外界环境胁迫对菌株的生长抑制测定
在野生型、敲除突变体和回补体菌株菌落边缘切取直径2 mm的圆形菌块接种于含有3 mmol/L 过氧化氢(H2O2)、2 mmol/L 二硫苏糖醇(DTT)、02 g/L 刚果红(CR)以及未添加胁迫剂的CM培养基中,28℃黑暗培养7 d后测量菌落直径并拍照,计算生长抑制率。生长抑制率=(CM培养基上菌落直径-胁迫处理下菌落直径)/CM培养基上菌落生长直径×100%。
1.6 实时荧光定量PCR检测PoAPE3基因的表达情况
在野生型菌株菌落边缘切取直径为2 mm的菌块于添加了3 mmol/L 过氧化氢(H2O2)、02 g/L 刚果红(CR)以及未添加胁迫剂的50 mL CM培养液中,28℃,150 r/min培养2 d,使用总RNA提取试剂盒(Promega)提取不同处理的菌株总RNA。使用SYBR試剂盒(诺唯赞)并用特异性引物APE3QRTF/APE3QRTR(表1)进行定量PCR。以肌动蛋白基因作为内源性内参基因。基因相对表达水平通过2-ΔΔCt方法进行评估[18],每个样本的所有试验均独立重复3次。
1.7 数据统计与分析
孢子萌发率、附着胞形成率、生长抑制率和基因相对表达量在Excel 2019中运算,运用DPS数据处理系统进行统计分析,采用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
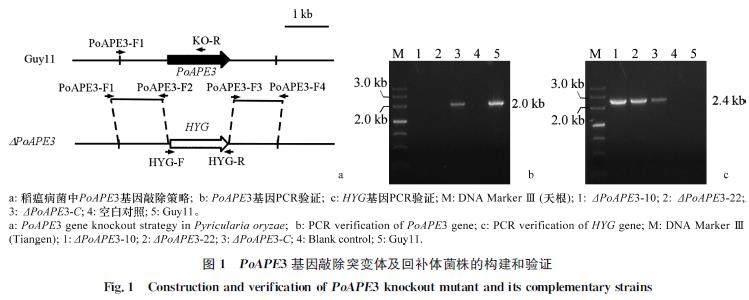
2.1 基因敲除与回补体菌株的获得
为探究PoAPE3在稻瘟病菌中的功能,通过扩增PoAPE3的上、下游片段,与潮霉素基因连接,采用原生质体转化的方式进行基因敲除(图1a),获得具有潮霉素抗性的转化子。以清水为空白对照,野生型Guy11基因组DNA为阳性对照,通过上臂引物PoAPE3F1和基因内部引物KOR进行PCR验证,共获得两个敲除突变体ΔPoAPE310和ΔPoAPE322(图1b)。通过上臂引物PoAPE3F1和潮霉素内部引物HYGR确定ΔPoAPE310和ΔPoAPE322均携带潮霉素基因(图1c),随机选用ΔPoAPE310进行后续试验。获得的回补体菌株命名为ΔPoAPE3C,并以相同的方式验证确定回补体菌株携带PoAPE3基因和潮霉素基因。
2.2 敲除突变体ΔPoAPE3的表型分析
2.2.1 ΔPoAPE3的营养生长情况
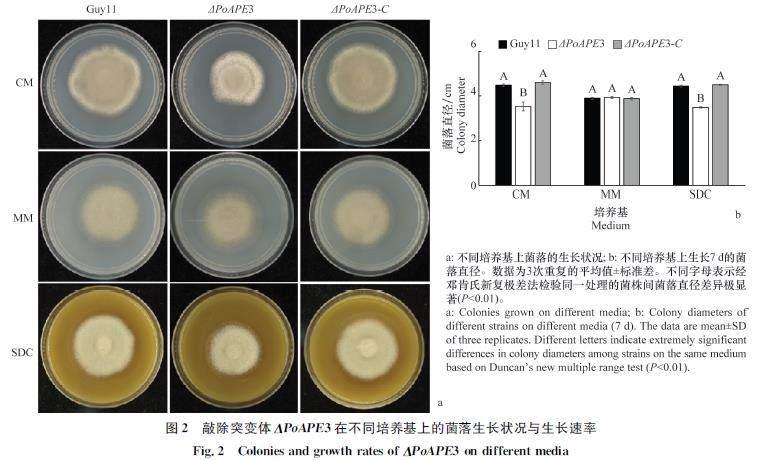
为探究PoAPE3对稻瘟病菌生长的影响,将野生型菌株Guy11、突变体菌株ΔPoAPE310、回补体菌株ΔPoAPE3C接种于CM、MM、SDC平板上,结果表明,ΔPoAPE310在MM平板上生长速率与Guy11无显著差异(图2a),而在CM、SDC平板上的生长速率有所下降,分别比野生型下降了213%和215%(图2b),说明PoAPE3参与了稻瘟病菌的营养生长。
2.2.2 ΔPoAPE3对孢子萌发、附着胞形成和产孢量的影响
为明确PoAPE3是否参与稻瘟病菌附著胞发育过程,收集野生型菌株Guy11、突变体菌株ΔPoAPE310及回补体菌株ΔPoAPE3C的分生孢子,调好孢子液浓度后滴于疏水盖玻片上,置于盒中保湿培养。结果表明,野生型与突变体的孢子形态和产孢量均没有显著差异,产孢量均约为4×104个/cm2(F2,2=1104,P=0951)(图3a, 3b);在2 h时,突变体萌发率约为90% (F2,2=2192, P=0087),4 h时孢子均已萌发,至8 h时附着胞的形成率约为93%(F2,2=5548, P=0305),均与野生型菌株没有明显差异(图3c, 3d),说明PoAPE3不参与调控稻瘟病菌的分生孢子产生以及附着胞的形成过程。
2.2.3 ΔPoAPE3的致病性分析
配制浓度为1×105个/mL的野生型菌株Guy11、敲除突变体ΔPoAPE3以及回补体菌株ΔPoAPE3C的孢子悬浮液,点滴法接种于离体大麦叶片正面,喷雾法接种于2周龄水稻苗上。结果表明,野生型菌株和ΔPoAPE3接种大麦后,大麦叶片上均产生约15 cm宽病斑,接种水稻后病斑形态也没有明显差异,均可观察到典型病斑(图4a,4b)。对侵染水稻后的病斑分级统计结果也表明,野生型菌株与突变体菌株导致的各级病斑数目无显著差异(F4,4=1300, P=0806)(图4c),说明PoAPE3不参与调控稻瘟病菌的致病过程。
2.2.4 ΔPoAPE3对稻瘟菌侵染过程的影响
在大麦叶片背面接种孢子悬浮液后于28℃保湿培养,分别于培养12、24、40 h和48 h时撕取大麦叶背表皮观察侵染情况。结果表明,ΔPoAPE3与野生型菌株Guy11的孢子在培养12 h时均可以正常形成侵染结构,并在24 h时可以正常侵入,且在40 h和48 h时能穿透邻近细胞(图5),说明PoAPE3不影响稻瘟病菌的侵染过程。
2.2.5 ΔPoAPE3对胁迫因子的敏感性分析
为探究PoAPE3应对不同胁迫因子的能力,本研究将野生型菌株Guy11、敲除突变体ΔPoAPE3和回补体菌株ΔPoAPE3C分别接种于含有不同胁迫剂(氧化压力胁迫剂H2O2、内质网压力胁迫剂DTT、细胞壁胁迫剂CR)的CM培养基中。结果表明,突变体菌株在含有H2O2的平板上生长直径大于野生型,表现出更耐受,而在含有CR的平板上生长直径小于野生型,表现为更敏感(图6a)。统计分析表明,H2O2对突变体菌株的抑制率较野生型菌株下降5%;CR对突变体菌株的抑制率显著高于野生型和回补体菌株(P<001)(图6b),说明敲除PoAPE3基因可以影响胁迫因子对菌株生长的抑制作用。由于ΔPoAPE3在胁迫处理下的生长抑制率与Guy11和ΔPoAPE3C有显著差异,我们推测PoAPE3基因的表达可能受到胁迫因子的诱导,因此通过实时荧光定量PCR检测野生型菌株的PoAPE3基因在不同胁迫处理下的表达情况,结果表明,在胁迫处理下,PoAPE3基因的表达水平均显著上升(P<001)(图6c),说明PoAPE3基因受环境胁迫因子的诱导参与调控应对氧化压力和细胞壁胁迫的应答。
3 结论与讨论
氨肽酶作为一种蛋白酶广泛存在于不同的动植物体内,是生物体内重要的切割氨基酸残基的蛋白酶[7]。目前液泡氨肽酶Y在丝状真菌中的报道较少,仅在酵母中有报道[1920]。在酵母中,氨肽酶APE3的成熟受到Prb1蛋白酶的调控[12],有研究表明,稻瘟病菌中Prb1的同源蛋白PoSPM1参与调控稻瘟病菌的致病性[21],而PoSPM1在稻瘟病菌中如何调控PoAPE3尚不明确。本研究从稻瘟病菌中鉴定到一个与酿酒酵母液泡氨肽酶Y同源的基因PoAPE3,并研究了其在稻瘟病菌中的生物学功能。
通过对PoAPE3在稻瘟病菌中的生物学表型分析发现,由于突变体在MM培养基中并没有生长缺陷且MM培养基主要由无机物组成,说明PoAPE3不参与稻瘟病菌利用无机物进行营养生长的过程。而ΔPoAPE3在CM和SDC培养基上的生长速率减慢,分别减少213%和215%。相比于MM培养基,CM或SDC培养基增加了有机物或植物元素,表明PoAPE3参与稻瘟病菌对部分营养物质的吸收过程。此外,与野生型菌株相比突变体菌株对细胞壁胁迫剂以及氧化压力胁迫剂的敏感性发生了改变,说明PoAPE3可能在胁迫处理下加速对氨基酸的切割,但是加速处理的过程会损害液泡功能使稻瘟病菌对氧化压力的耐受性降低,同时产生的氨基酸可以用于稳定细胞壁从而增加对细胞壁胁迫的耐受性。根据胁迫试验结果推测,PoAPE3基因缺失后,稻瘟病菌的细胞壁组分或结构可能发生了改变,细胞的新陈代谢可能发生了变化,且这些变化或许使细胞壁的渗透能力和对营养物质的吸收能力受到影响,从而影响了稻瘟病菌的营养生长,进而导致突变体的生长速率减慢。但是致病性以及侵染试验中突变体与野生型菌株相比并没有明显的变化,这说明缺失突变体在细胞壁组分以及细胞新陈代谢中的改变较为轻微,不足以影响稻瘟病菌的致病能力。与酵母ScAPE3功能进行比较,稻瘟病菌中PoAPE3降低菌株营养生长的速率,对细胞壁胁迫剂更敏感方面与其表现较为一致,但是稻瘟病菌PoAPE3在应对氧化压力胁迫时耐受性更好,说明PoAPE3与ScAPE3的功能存在一定的差异, 推测稻瘟病菌可能存在与酵母不同的通过PoAPE3基因所介导的营养物质的利用的机制。
綜上所述,PoAPE3不参与调控稻瘟病菌的附着胞形成及致病过程,但其调控稻瘟病菌的营养生长过程和外界环境应答过程。对于PoAPE3如何影响稻瘟病菌对营养物质的利用的机制还有待进一步研究。
参考文献
[1] TALBOT N J. On the trail of a cereal killer: Exploring the biology of Magnaporthe grisea [J]. Annual Review of Microbiology, 2003, 57(1): 177202.
[2] SKAMNIOTI P, GURR S J. Against the grain: safeguarding rice from rice blast disease [J]. Trends in Biotechnology, 2009, 27(3): 141150.
[3] LIU Jinling, WANG Xuejun, MITCHELL T, et al. Recent progress and understanding of the molecular mechanisms of the riceMagnaporthe oryzae interaction [J]. Molecular Plant Pathology, 2010, 11(3): 419427.
[4] AMMERER G, HUNTER C P, ROTHMAN J H, et al. PEP4 gene of Saccharomyces cerevisiae encodes proteinase A, a vacuolar enzyme required for processing of vacuolar precursors [J]. Molecular and Cellular Biology, 1986, 6(7): 24902499.
[5] MOEHLE C M, TIZARD R, LEMMON S K, et al. Protease B of the lysosomelike vacuole of the yeast Saccharomyces cerevisiae is homologous to the subtilisin family of serine proteases [J]. Molecular and Cellular Biology, 1987, 7(12): 43904399.
[6] HECHT K A, ODONNELL A F, BRODSKY J L. The proteolytic landscape of the yeast vacuole [J/OL]. Cellular Logistics, 2014, 4(1): e28023. DOI:104161/cl28023.
[7] TAYLOR A. Aminopeptidases: structure and function [J]. The FASEB Journal, 1993, 7(2): 290298.
[8] ADAMIS P D B, MANNARINO S C, RIGER C J, et al. Lap4, a vacuolar aminopeptidase I, is involved in cadmiumglutathione metabolism [J]. BioMetals, 2008, 22(2): 243249.
[9] TRUMBLY R J, BRADLEY G. Isolation and characterization of aminopeptidase mutants of Saccharomyces cerevisiae [J]. Journal of Bacteriology, 1983, 156(1): 3648.
[10]WILK S, WILK E, MAGNUSSON R P. Purification, characterization, and cloning of a cytosolic aspartyl aminopeptidase [J]. Journal of Biological Chemistry, 1998, 273(26): 1596115970.
[11]YOKOYAMA R, KAWASAKI H, HIRANO H. Identification of yeast aspartyl aminopeptidase gene by purifying and characterizing its product from yeast cells [J]. The FEBS Journal, 2006, 273(1): 192198.
[12]YASUHARA T, NAKAI T, OHASHI A. Aminopeptidase Y, a new aminopeptidase from Saccharomyces cerevisiae. Purification, properties, localization, and processing by protease B [J]. Journal of Biological Chemistry, 1994, 269(18): 1364413650.
[13]YOON J, SEKHON S S, KIM Y H, et al. Enhanced lysosomal activity by overexpressed aminopeptidase Y in Saccharomyces cerevisiae [J]. Molecular and Cell Biochemistry, 2016, 417(1/2): 181189.
[14]TALBOT N J, EBBOLE D J, HAMER J E. Identification and characterization of MPG1, a gene involved in pathogenicity from the rice blast fungus Magnaporthe grisea [J]. The Plant Cell, 1993, 5(11): 15751590.
[15]湯蔚. 非折叠蛋白反应相关基因MoHAC1和MoIRE1在稻瘟病菌生长发育和致病过程中的功能分析[D]. 南京: 南京农业大学, 2015.
[16]ZHANG Haifeng, ZHAO Qian, LIU Kaiyue, et al. MgCRZ1, a transcription factor of Magnaporthe grisea, controls growth, development and is involved in full virulence [J]. FEMS Microbiology Letters, 2009, 293(2): 160169.
[17]VALENT B, FARRALL L, CHUMLEY F G. Magnaporthe grisea genes for pathogenicity and virulence identified through a series of backcrosses [J]. Genetics, 1991, 127(1): 87101.
[18]ZHENG Huawei, LI Lingping, MIAO Pengfei, et al. FgSec2A, a guanine nucleotide exchange factor of FgRab8, is important for polarized growth, pathogenicity and deoxynivalenol production in Fusarium graminearum [J]. Environmental Microbiology, 2018, 20(9): 33783392.
[19]TADI D, HASAN R N, BUSSEREAU F, et al. Selection of genes repressed by cAMP that are induced by nutritional limitation in Saccharomyces cerevisiae [J]. Yeast, 1999, 15(16): 17331745.
[20]NISHIZAWA M, YASUHARA T, NAKAI T, et al. Molecular cloning of the aminopeptidase Y gene of Saccharomyces cerevisiae. Sequence analysis and gene disruption of a new aminopeptidase [J]. Journal of Biological Chemistry, 1994, 269(18): 1365113655.
[21]SAITOH H, FUJISAWA S, ITO A, et al. SPM1 encoding a vacuolelocalized protease is required for infectionrelated autophagy of the rice blast fungus Magnaporthe oryzae [J]. FEMS Microbiology Letters, 2009, 300(1): 115121.
(責任编辑:杨明丽)

