糖尿病肾病中与铁死亡相关中枢基因的识别
赵升 李文川 董兰 连容 李玥娇 何凤


【摘要】目的 通过生物信息学分析,识别在糖尿病肾病(DN)进展中发挥重要作用的铁死亡相关基因,为DN的治疗提供新见解。方法 对RNA测序数据集GSE142025进行DN差异表达基因(DEGs)的分析和筛选,并进行了基因本体论(GO)功能注释和基因集富集分析(GSEA)。随后,构建加权基因共表达网络分析(WGCNA)来识别关键基因。通过韦恩图将DEGs和关键基因所共有的铁死亡相关基因(FRGs)确立为中枢(hub)基因。应用受试者操作特征(ROC)曲線验证hub基因的临床诊断价值,并采用免疫组织化学染色(IHC)法检测 hub 基因在3例 DN 患者及3例正常肾组织中的表达量。结果 在DN组和对照组(NC组)筛选出1 916个DEGs。GO功能富集分析显示,DEGs主要参与炎症相关的生物过程,GSEA分析提示DEGs在铁离子结合的生物过程中显著富集。WGCNA构建的12个共表达模块中,grey60、turquoise和grey模块与DN的相关性最高。根据筛选标准从3个模块中挑选出188个关键基因,其中与DEGs共有的FRGs有2个,分别为铜蓝蛋白(CP)基因和脂质运载蛋白-2(LCN2)基因。ROC曲线验证二者皆具有良好的临床诊断价值。IHC结果显示,2个基因在DN患者组织样本中表达均上调(P均< 0.05),与生物信息学的分析结果相一致。结论 CP和LCN2可能通过抑制肾组织中的铁死亡参与DN疾病的发展,可作为DN潜在的生物标志物和治疗的新靶点。
【关键词】糖尿病肾病;加权基因共表达网络分析;铁死亡;铜蓝蛋白;脂质运载蛋白-2
Characterization of hub genes associated with ferroptosis in diabetic nephropathy
ZHAO Sheng, LI Wenchuan, DONG Lan, LIAN Rong, LI Yuejiao, HE Feng
(Department of Nephrology, the Second Affiliated Hospital, School of Medicine, South China University of Technology,
Guangzhou 510180, China)
Corresponding author: HE Feng, E-mail: eyhefeng@scut.edu.cn
【Abstract】Objective To identify hub genes associated with ferroptosis in the progression of diabetic nephropathy (DN) through bioinformatics analysis, offering novel insights into DN treatment. Methods Differentially expressed genes (DEGs) in DN were screened using RNA sequencing dataset GSE142025, and Gene Ontology (GO) and Gene Set Enrichment Analysis (GSEA) were utilized for functional annotation. Subsequently, the Weighted Gene Co-expression Network Analysis (WGCNA)was conducted to pinpoint key genes. Venn diagrams aided in identifying hub genes among ferroptosis-related genes (FRGs) common to DEGs and key genes. ROC curves were employed to assess the clinical diagnostic potential of these hub genes. Immunohistochemistry (IHC)was conducted to detect the expression levels of hub genes in DN patients and normal kidney tissues. Results 1 916 DEGs were identified between the DN and control (NC) groups. GO enrichment analysis revealed that DEGs were mainly involved in inflammation-related biological processes. GSEA analysis found significant enrichment in processes related to iron ion binding. Among 12 co-expression modules constructed by WGCNA, grey60, turquoise, and grey modules showed the highest correlation with DN. 188 key genes were selected from 3 modules based on the screening criteria, among which 2 were FRGs shared by DEGs, namely ceruloplasmin (CP) gene and lipocalin-2 (LCN2) gene. ROC curves confirmed high clinical diagnostic value of these two genes. IHC results showed upregulated expression of both two genes in DN patient samples (both P < 0.05), consistent with the findings of bioinformatics analysis. Conclusion CP and LCN2 could be involved in the progression of DN by inhibiting ferroptosis, serving as promising biomarkers and treatment targets for DN.
【Key words】Diabetic nephropathy; WGCNA; Ferroptosis; Ceruloplasmin; Lipocalin-2
糖尿病肾病(DN)是糖尿病的微血管并发症之一,也是终末期肾病(ESRD)的主要原因[1-2]。尽管对糖尿病患者已有全面的医疗健康管理策略,但DN发病率仍呈逐年上升的趋势[3]。DN发病的机制涉及血流动力学的变化、代谢失衡以及炎症免疫等多重因素[4-7]。目前尚无有效延缓DN进展的特效药物,因此需要研究新的生物标志物来提高DN的早期诊断准确性,从而及时干预,延缓ESRD的发生。DN与细胞程序性死亡如自噬、细胞凋亡和坏死相关[7-8]。铁死亡作为一种由氧化应激损伤引发的细胞程序性死亡形式,引发脂质氧化产物过度堆积以及谷胱甘肽过氧化物酶4(GPX4)活性降低,可导致肾脏组织受到严重的活性氧(ROS)损
害[9-10]。近年来,越来越多的科学研究证明,铁死亡可能在DN的进展中发挥重要作用[11]。因此,深入研究DN发生、发展过程中铁死亡的相关病理机制成为目前研究的焦点。随着高通量测序技术的持续发展,利用基因数据库和生物信息学技术对海量的数据分析可深入挖掘疾病进展过程中的分子功能及变化联系,为揭示疾病的起因和发展机制提供了更多的可能性。
本课题拟通过从DN中筛选出有差异表达的、与铁死亡相关的基因(FRGs),同时从加权基因共表达网络分析(WGCNA)高度相关的基因模块中识别并鉴定具有潜在价值的FRGs作为DN的潜在生物标志物,为DN的早期诊断和治疗提供了新方向,现报道如下。
1 材料与方法
1.1 标本来源
本课题收集来自华南理工大学附属第二医院收治的3例经活组织检查(活检)确诊的DN(尿白蛋白与肌酐质量比>30 mg/g)肾组织样本,以及3例肾切除术后未受影响的正常(NC)肾组织作为对照。本研究经医院伦理委员会批准(批件号:S-2021-065),所有参与者均已签署知情同意书。
1.2 获取数据集及筛选差异基因
从GEO数据库下载糖尿病肾组织活检样本的RNA测序数据集GSE142025,包含正常对照组(NC组)9例和DN组27例。使用R软件中的“limma”包对NC组和DN组进行差异表达基因(DEGs)的分析和筛选,筛选标准为P < 0.05且|Log2FC| > 1。随后使用“ggplot2”包绘制火山图以可视化DEGs。
1.3 基因功能富集分析
為了探索DEGs的生物功能和参与的生物过程,使用R软件的“clusterProfiler”包对DEGs进行基因本体论(GO)功能分析和基因集富集分析(GSEA)。
1.4 获取与铁死亡相关的基因集
在FerrDb网站(http: //www.zhounan.org/ferrdb)上获得经证实在人体组织中表达的与铁死亡相关的基因集,包括265个Driver基因、280个Suppressor基因和3个Marker基因。排除重复的基因,最终筛选出396个FRGs。
1.5 WGCNA的构建
使用 R 软件的“WGCNA”包,根据方差排名,在数据集中选取17 182个在前25%的基因构建共表达网络。通过“pickSoftThreshold”函数确定适当的软阈值,使构建的基因网络更符合无标度网络特征。然后根据基因加权的相关系数,将基因按照表达模式分类,得到基因树状聚类图。再计算基因表达谱和给定模型的相关性,对相关性较高的模块进行合并后得到12个模块。最后计算基因模块和临床状态之间的相关性及统计学P值,r的绝对值越接近1,说明相关性越大;P < 0.05为具有统计学意义。
1.6 关键模块和中枢基因的识别
将与临床特征关联度最高的模块确立为关键模块,将Gene Significance(GS)>0.2和Module Membership(MM)>0.8的基因定为关键基因。对DEGs、WGCNA和FRGs取交集,确定交集处的基因为中枢(hub)基因。
1.7 免疫组织化学染色(IHC)
将所收集的3例DN肾组织和3例NC肾组织样本进行常规石蜡包埋,切片后使用特异性抗体进行IHC。使用的抗体为:铜蓝蛋白基因(CP,21131-1-AP),脂质运载蛋白-2(LCN2,26991-1-AP)。然后应用Image J软件的IHC-Toolbox软件对400倍视野的IHC结果进行定量分析。
1.8 统计学处理
使用SPSS 26.0和GraphPad Prism 8.0进行统计分析和绘制统计图。所有计量资料均符合正态分布,以表示,组间比较采用独立样本t检验。P < 0.05为差异具有统计学意义。
2 结 果
2.1 DN组与NC组的DEGs筛选
使用R软件分析并筛选数据集GSE142025中的DEGs,得到1 916个DEGs,火山图见图1A,其中上调的基因为1 071个,下调的基因为845个。
2.2 GO功能分析和GSEA
DEGs的GO功能分析见图1B。与NC组相比,DN组的DEGs主要富集于与炎症相关的生物过程,涉及炎性细胞的激活、分化和增殖。GSEA结果提示,DEGs的分子功能富集于铁离子结合的生物过程(图1C)。因铁离子的结合过程可能与DN疾病进展中的铁死亡过程相关,故从FerrDb网站获取396个已被证实在人体组织表达的FRGs,其中32个FRGs为与DEGs共有的基因(图1D)。热图展示了FRGs在数据集GSE142025中的表达和差异情况(图1E)。
2.3 构建WGCNA并筛选关键基因
使用数据集GSE142025中的36个样本构建WGCNA(图2A),选取最佳的软阈值20(图2B),代入模型构建无标度网络,获得拟合指数R2=0.97(图2C)。利用基因树状图进行层次聚类以生成模块,合并具有相似特征基因的模块,最终得到12个共表达模块(图2D)。评估基因模块与临床状态之间的相关性(图2E),结果显示grey60(r=-0.53)、turquoise(r=-0.48)和grey模块(r=0.46)与DN的相关性最高且具有统计学意
义(P均< 0.05)。绘制这3个模块的散点图(图2F~H),选取GS>0.2和MM>0.8的基因,共获得188个关键基因。
2.4 Hub基因的筛选和验证
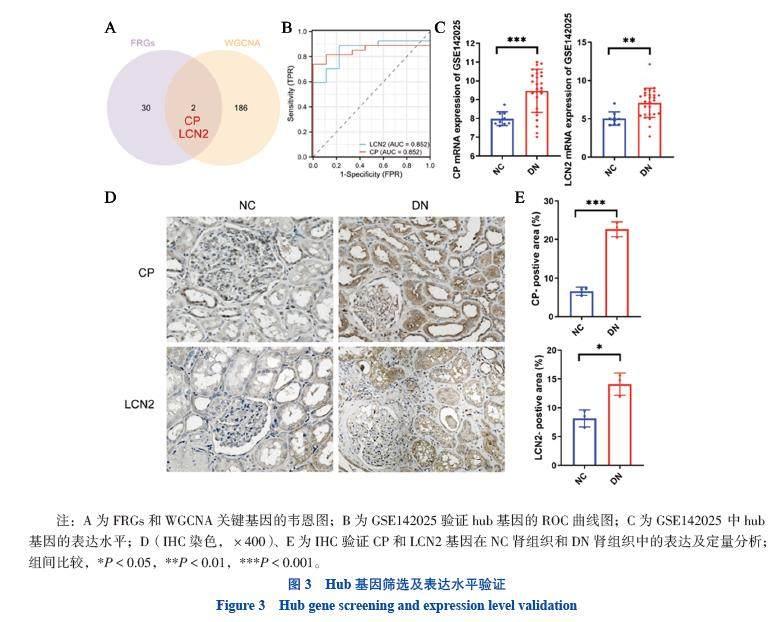
将通过WGCNA获得的关键基因与32个FRGs绘制韦恩图(图3A),取交集为hub基因,即铜蓝蛋白基因(CP)和脂质运载蛋白-2(LCN2)。ROC曲线验证了hub基因,结果显示CP和LCN2的AUC均为0.852,均>0.80的标准(图3B)。绘制散点图可视化hub基因在数据集GSE142025中的表达情况(图3C),用IHC交叉验证(图3D、E),检测hub基因的蛋白表达量,结果显示2个基因在DN肾组织中的表达均上调,与生物信息学分析的结果一致。
3 讨 论
DN因其逐年升高的发病率和致死率以及昂贵的医疗费用,正在成为世界性的公共卫生问题[12]。由于DN的发病机制尚不明确,目前尚无有效的药物或方法预防ESRD。铁死亡是一种由氧化应激损伤引发的铁依赖性细胞程序性死亡的形式,已有研究证实其参与多种疾病的炎症和氧化的病理過程[13-16]。鉴于炎症和氧化在DN的疾病进展中扮演的重要角色,探究DN发生、发展过程中与铁死亡相关的分子机制成为近年研究的热点。早期研究揭示,铁在肾脏中的过度累积会加速糖尿病大鼠的肾损伤[17]。在此基础上,Feng等[18]的研究发现,在高糖环境的刺激下,肾脏组织细胞显现出明显的铁死亡特征,包括膜密度的增加、线粒体的体积缩小、线粒体嵴的减少甚至消失,以及脂质过氧化产物丙二醛和4-羟基壬烯醛等相关分子的过表达。Kim等[11]进一步的研究表明,铁死亡抑制剂Fer-1能够显著改善TGF-β1诱导的肾小管细胞死亡以及脂质过氧化物的累积。Feng等[19]指出,铁死亡可能通过激活低氧诱导因子/血红素氧合酶1途径促进DN进展,从而损害肾小管。Chen等[20]的研究则显示,通过抑制糖尿病小鼠足细胞中GPX4的泛素化,可以保护肾脏免受铁浓缩和氧化应激损伤,进而改善DN。此外,Lu等[21]的研究表明,恩格列净可能通过促进AMP活化蛋白激酶介导的核转录因子红系2相关因子2激活途径减轻DN小鼠以及HK-2细胞高糖模型的铁死亡损伤,从而改善DN肾脏组织的病变。上述研究均表明,铁死亡在DN的进展中发挥着重要的促进作用,探索铁死亡相关调控途径中新的生物标志物有望为减缓DN进展的治疗提供新的研究方向。
本研究利用生物信息学的方法在DN组和NC组鉴定出1 916个DEGs,其中上调的基因有1 071个、下调的基因有845个。GO功能分析显示,DEGs主要参与炎症相关的生物过程,而GSEA结果提示DEGs的分子功能显著富集在铁离子结合的生物过程上,表明在DN的发生发展中铁死亡可能与DN的炎症过程相关。本研究通过韦恩图获得DN组与NC组间差异表达的32个FRGs,随后使用WGCNA获得存在差异性和与临床状态相关性最高的3个模块中的188个关键基因,联合关键基因和FRGs鉴定出2个hub基因即CP和LCN2。
CP是一种携带铜的金属酶,其主要作用是通过将二价铜离子还原成一价,从而充当促氧化剂,把亚铁转化为可以与转铁蛋白结合的三价形态[22]。早期研究发现,糖尿病患者血清CP水平升高[23-24]。Yamazaki等[25]的研究表明,血清CP水平升高是DN进展的危险因素,对患者不良预后有一定的预测价值。Tsai等[26]的研究指出,尿液中CP水平与近端肾小管细胞的损伤呈正相关,提示CP可能通过铁死亡在早期DN中发挥病理生理作用。另外,Shang等[27]的研究表明,CP的过表达可抑制铁死亡诱导剂在细胞内诱导的铁、丙二醛和脂质ROS的沉积,从而减少肝癌细胞中的铁死亡。本研究ROC曲线分析结果显示,CP的AUC>0.80,对临床DN具有一定的诊断效能,且IHC结果显示DN组中CP的表达量明显上调。
LCN2在大多数组织的上皮细胞和中性粒细胞中产生,也被称中性粒细胞明胶酶相关脂质运载蛋白(NGAL),是免疫调节蛋白亚家族的一部分,在炎症环境中已成为一种关键的铁调节蛋白。LCN2的表达上调可以募集炎症细胞和诱导促炎细胞因子的释放[28-29]。已有研究显示,在急性肾损伤和慢性肾脏病中,血清及尿液中LCN2的含量会随着估计肾小球滤过率的下降和白蛋白尿的增加而升高,其可作为肾小管损伤的标志物[30-32]。Jaberi等[33]的研究表明,高血糖刺激下LCN2的合成增加。Tang等[34]的研究发现,尿液中NGAL水平与DN的肾损伤分期相关。Song等[35]的体外实验研究表明,NGAL促进HK-2细胞的增殖以及减少细胞铁死亡的发生。本研究LCN2的ROC曲线分析结果表明,LCN2对DN进展的诊断有一定临床价值(AUC为0.825)。
另外,本研究中IHC结果显示,DN组织的CP和LCN2的表达水平升高,提示其可能是机体对DN氧化和免疫环境失衡的一种稳态反应。这种上调可能是机体的一种代偿机制,旨在通过负调控铁死亡以延缓DN的疾病进展,但发挥该作用的具体机制尚需进一步利用体外细胞实验和动物模型实验研究阐明,以期为DN治疗靶向的药物研发提供新的见解和方向。
参 考 文 献
[1] ZHANG L, LONG J, JIANG W, et al. Trends in chronic kidney disease in China[J]. N Engl J Med, 2016, 375(9): 905-906. DOI: 10.1056/NEJMc1602469.
[2] KOYE D N, MAGLIANO D J, NELSON R G, et al. The global epidemiology of diabetes and kidney disease[J]. Adv Chronic Kidney Dis, 2018, 25(2): 121-132. DOI: 10.1053/j.ackd.2017.10.011.
[3] JIANG S, DI D, JIAO Y, et al. Complement deposition predicts worsening kidney function and underlines the clinical significance of the 2010 renal pathology society classification of diabetic nephropathy[J]. Front Immunol, 2022, 13: 868127. DOI: 10.3389/fimmu.2022.868127.
[4] NAAMAN S C, BAKRIS G L. Diabetic nephropathy: update on Pillars of therapy slowing progression[J]. Diabetes Care, 2023, 46(9): 1574-1586. DOI: 10.2337/dci23-0030.
[5] RICCIARDI C A, GNUDI L. Kidney disease in diabetes: From mechanisms to clinical presentation and treatment strategies[J]. Metabolism, 2021, 124: 154890. DOI: 10.1016/j.metabol.2021.154890.
[6] AMATRUDA M, GEMBILLO G, GIUFFRIDA A E, et al. The aggressive diabetic kidney disease in youth-onset type 2 diabetes: pathogenetic mechanisms and potential therapies[J]. Medicina, 2021, 57(9): 868. DOI: 10.3390/medicina57090868.
[7] 趙悦, 王俭勤. 炎症在糖尿病肾病中的研究进展[J]. 新医学, 2021, 52(7): 477-481. DOI: 10.3969/j.issn.0253-9802.2021.07.002.
ZHAO Y, WANG J Q. Research progress on inflammation in diabetic nephropathy[J]. J New Med, 2021, 52(7): 477-481. DOI: 10.3969/j.issn.0253-9802.2021.07.002.
[8] JIN J, SHI Y, GONG J, et al. Exosome secreted from adipose-derived stem cells attenuates diabetic nephropathy by promoting autophagy flux and inhibiting apoptosis in podocyte[J]. Stem Cell Res Ther, 2019, 10(1): 95. DOI: 10.1186/s13287-019-1177-1.
[9] JIANG W J, XU C T, DU C L, et al. Tubular epithelial cell-to-macrophage communication forms a negative feedback loop via extracellular vesicle transfer to promote renal inflammation and apoptosis in diabetic nephropathy[J]. Theranostics, 2022, 12(1): 324-339. DOI: 10.7150/thno.63735.
[10] KAJARABILLE N, LATUNDE-DADA G O. Programmed cell-death by ferroptosis: antioxidants as mitigators[J]. Int J Mol Sci, 2019, 20(19): 4968. DOI: 10.3390/ijms20194968.
[11] KIM S, KANG S W, JOO J, et al. Characterization of ferroptosis in kidney tubular cell death under diabetic conditions[J]. Cell Death Dis, 2021, 12(2): 160. DOI: 10.1038/s41419-021-03452-x.
[12] ANDERS H J, HUBER T B, ISERMANN B, et al. CKD in diabetes: diabetic kidney disease versus nondiabetic kidney disease[J]. Nat Rev Nephrol, 2018, 14(6): 361-377. DOI: 10.1038/s41581-018-0001-y.
[13] CHEN X, KANG R, KROEMER G, et al. Ferroptosis in infection, inflammation, and immunity[J]. J Exp Med, 2021, 218(6): e20210518. DOI: 10.1084/jem.20210518.
[14] CHEN X, KANG R, KROEMER G, et al. Broadening horizons: the role of ferroptosis in cancer[J]. Nat Rev Clin Oncol, 2021, 18(5): 280-296. DOI: 10.1038/s41571-020-00462-0.
[15] JIANG X, STOCKWELL B R, CONRAD M. Ferroptosis: mechanisms, biology and role in disease[J]. Nat Rev Mol Cell Biol, 2021, 22(4): 266-282. DOI: 10.1038/s41580-020-00324-8.
[16] 楊晓玲, 何宗源, 章琦鑫, 等. 小胶质细胞PTGS2/Hepcidin炎症通路在神经元铁死亡中的作用机制[J]. 西南医
科大学学报, 2024, 47(1): 39-44. DOI: 10.3969/j.issn.2096-
3351.2024.01.009.
YANG X L, HE Z Y, ZHANG Q X, et al. Microglia PTGS2/Hepcidin inflammatory pathway mediates ferroptosis of neurons[J]. J Southwest Med Univ, 2024, 47(1): 39-44. DOI: 10.3969/j.issn.2096-3351.2024.01.009.
[17] LI J, ZHENG S, FAN Y, et al. Emerging significance and therapeutic targets of ferroptosis: a potential avenue for human kidney diseases[J]. Cell Death Dis, 2023, 14(9): 628. DOI: 10.1038/s41419-023-06144-w.
[18] FENG Q, YANG Y, QIAO Y, et al. Quercetin ameliorates diabetic kidney injury by inhibiting ferroptosis via activating Nrf2/HO-1 signaling pathway[J]. Am J Chin Med, 2023, 51(4): 997-1018. DOI: 10.1142/S0192415X23500465.
[19] FENG X, WANG S, SUN Z, et al. Ferroptosis enhanced diabetic renal tubular injury via HIF-1α/HO-1 pathway in db/db mice[J]. Front Endocrinol, 2021, 12: 626390. DOI: 10.3389/fendo.2021.626390.
[20] CHEN J, OU Z, GAO T, et al. Ginkgolide B alleviates oxidative stress and ferroptosis by inhibiting GPX4 ubiquitination to improve diabetic nephropathy[J]. Biomedecine Pharmacother, 2022, 156: 113953. DOI: 10.1016/j.biopha.2022.113953.
[21] LU Q, YANG L, XIAO J J, et al. Empagliflozin attenuates the renal tubular ferroptosis in diabetic kidney disease through AMPK/NRF2 pathway[J]. Free Radic Biol Med, 2023, 195: 89-102. DOI: 10.1016/j.freeradbiomed.2022.12.088.
[22] VROEGINDEWEIJ L H P, BOON A J W, PAUL WILSON J H P, et al. Effects of iron chelation therapy on the clinical course of aceruloplasminemia: an analysis of aggregated case reports[J]. Orphanet J Rare Dis, 2020, 15(1): 105. DOI: 10.1186/s13023-020-01385-w.
[23] LATHIYA N, AZIZ Q, FAWWAD A, et al. Change in pulmonary function tests and their relation to the serum levels of ceruloplasmin, copper and superoxide dismutase in patients suffering from Type-1 and Type-2 diabetes[J]. Pak J Med Sci, 2023, 39(3): 880-884. DOI: 10.12669/pjms.39.3.6485.
[24] Ceruloplasmin replacement therapy ameliorates neurological symptoms in a preclinical model of aceruloplasminemia-PubMed[EB/OL]. [2024-03-06]. (2024-03-15). https://pubmed.ncbi.nlm.nih.gov/29183916/.
[25] YAMAZAKI M, ITO S, USAMI A, et al. Urinary excretion rate of ceruloplasmin in non-insulin-dependent diabetic patients with different stages of nephropathy[J]. Eur J Endocrinol, 1995, 132(6): 681-687. DOI: 10.1530/eje.0.1320681.
[26] TSAI Y C, KUO M C, HUANG J C, et al. Single-cell transcriptomic profiles in the pathophysiology within the microenvironment of early diabetic kidney disease[J]. Cell Death Dis, 2023, 14(7): 442. DOI: 10.1038/s41419-023-05947-1.
[27] SHANG Y, LUO M, YAO F, et al. Ceruloplasmin suppresses ferroptosis by regulating iron homeostasis in hepatocellular carcinoma cells[J]. Cell Signal, 2020, 72: 109633. DOI: 10.1016/j.cellsig.2020.109633.
[28] MOSCHEN A R, ADOLPH T E, GERNER R R, et al. Lipocalin-2: a master mediator of intestinal and metabolic inflammation[J]. Trends Endocrinol Metab, 2017, 28(5): 388-397. DOI: 10.1016/j.tem.2017.01.003.
[29] XIAO X, YEOH B S, VIJAY-KUMAR M. Lipocalin 2: an emerging player in iron homeostasis and inflammation[J]. Annu Rev Nutr, 2017, 37: 103-130. DOI: 10.1146/annurev-nutr-071816-064559.
[30] SCHREIBER A, ROUSSELLE A, KLOCKE J, et al. Neutrophil gelatinase-associated lipocalin protects from ANCA-induced GN by inhibiting TH17 immunity[J]. J Am Soc Nephrol, 2020, 31(7): 1569-1584. DOI: 10.1681/ASN.2019090879.
[31] MARAKALA V. Neutrophil gelatinase-associated lipocalin (NGAL) in kidney injury-A systematic review[J]. Clin Chim Acta, 2022, 536: 135-141. DOI: 10.1016/j.cca.2022.08.029.
[32] ALBERT C, ZAPF A, HAASE M, et al. Neutrophil gelatinase-associated lipocalin measured on clinical laboratory platforms for the prediction of acute kidney injury and the associated need for dialysis therapy: a systematic review and meta-analysis[J]. Am J Kidney Dis, 2020, 76(6): 826-841.e1. DOI: 10.1053/j.ajkd.2020.05.015.
[33] JABERI S A, COHEN A, DSOUZA C, et al. Lipocalin-2: Structure, function, distribution and role in metabolic disorders[J]. Biomedecine Pharmacother, 2021, 142: 112002. DOI: 10.1016/j.biopha.2021.112002.
[34] TANG X Y, ZHOU J B, LUO F Q, et al. Urine NGAL as an early biomarker for diabetic kidney disease: accumulated evidence from observational studies[J]. Ren Fail, 2019, 41(1): 446-454. DOI: 10.1080/0886022X.2019.1617736.
[35] SONG Y J, ZHANG Q Y, WANG L J, et al. Preliminary study on 24p3/neutrophil gelatinase-associated lipocalin (NGAL) ferroptosis inhibition in renal tubular epithelial cells[J]. Bioengineered, 2022, 13(5): 12169-12181. DOI: 10.1080/21655979.2022.2073144.
(責任编辑:林燕薇)

