我国沿海5个地区冬季养殖仿刺参体表微生物多样性比较分析
潘美利 党慧凤 黄宇希 王晓航 黎睿君 丁君
摘 要:为探究仿刺参(Apostichopus japonicus)体表微生物在仿刺参疾病发生与环境交互中的作用,采用Illumina HiSeq高通量测序技术对来自大连、营口、唐山、威海、宁德等5个沿海地区的养殖仿刺参体表微生物进行了多样性分析。结果显示,地域差异对仿刺参体表微生物组成影响明显,其中福建省宁德市霞浦县(ND)养殖仿刺参的体表微生物组成与其他4个地区差异最明显。在门水平上,各地区的最优势菌门均为变形菌门(Proteobacteria),其中ND组相对丰富度(76.16%)最低;在目和科水平上,ND组的最优势微生物分别属于柄杆菌目(Caulobacterales)和生丝单胞菌科(Hyphomonadaceae),所占比例分别为14.48%、14.34%;在属水平上,ND组仿刺参体表微生物中不动杆菌属(Acinetobacter)、副球菌属(Paracoccus)、毛螺菌属(Lachnospira)等所占的比例与其他各组存在显著差异(P<0.05);山东省威海市乳山市(WH)养殖仿刺参体表微生物多样性在属水平上的相对丰富度最高,该组副球菌属所占比例与其他地区均存在显著差异(P<0.05)。研究结果可为进一步开展仿刺参体表微生物多样性与环境适应进化研究以及养殖仿刺参病害防治提供参考。
关键词:仿刺参;冬季;体表微生物;多样性差异
仿刺参(Apostichopus japonicus)又称刺参,隶属于棘皮动物门(Echinodermata)、海参纲(Holothuroidea)、刺参科(Stichopodidae)、仿刺参属(Apostichopus),是我国海参的代表物种之一,也是我国重要的棘皮动物养殖品种,其产地从北部的渤海湾和辽东半岛到南部的南沙群岛均有分布[1-2]。仿刺参富含7种必需氨基酸和大量抗衰老的酸性黏多糖,被认为是最好的海参品种之一[3-4]。为满足人们的消费需求,我国自20世纪50年代开始开展刺参增养殖技术研究[5],其养殖在20世纪80年代迅速发展,仿刺参也逐渐成为我国最重要的水产养殖品种之一[6]。我国仿刺参的大规模养殖地区以辽东半岛和山东半岛为主,其次是河北和福建的沿海地区。根据农业农村部的数据统计,2022年中国仿刺参养殖产量达到248 508 t[7]。
随着仿刺参养殖规模和范围的不断扩大,仿刺参养殖过程中病害頻频发生,对其养殖业造成了严重经济损失,其中以腐皮综合征、幼参烂胃病、体泡综合征(BVS)等疾病尤为严重[8-9]。Becker等[10]发现,引起仿刺参表皮溃烂病的病原有弧菌属(Vibrio sp.)、拟杆菌属(Bacteroides sp.)和α-变形菌门(α-Proteobacterium)等。王印庚等[11]认为,引起养殖刺参腐皮综合征的主要病原菌为弧菌和假单胞菌。张春云等[12]利用形态学、生理生化实验和16s rRNA分子生物学鉴定方法,发现养殖刺参腐皮综合征的致病菌是灿烂弧菌(Vibrio splendidus)。这些疾病的发病部位大多在仿刺参体表,因此,研究仿刺参体表微生物的多样性对于预防和控制养殖仿刺参疾病至关重要。
本研究对来自中国沿海5个养殖地区的冬季养殖仿刺参体表的微生物多样性进行了分析,以期为进一步开展仿刺参体表微生物多样性与环境适应进化研究以及仿刺参疾病防治提供参考。
1 材料和方法
1.1 取样
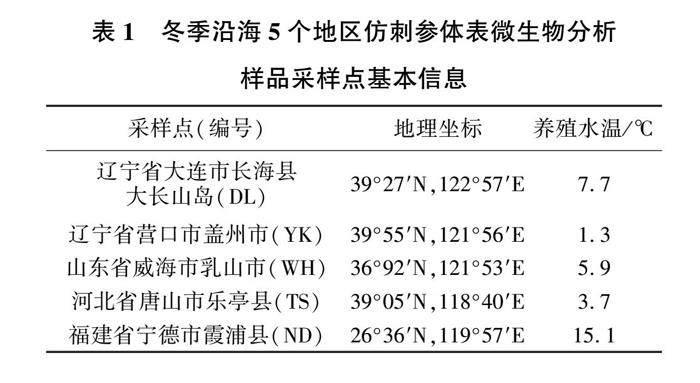
2021年11月—2022年1月,分别在我国沿海5个大型半开放仿刺参养殖基地采集仿刺参样品,采样点具体信息见表1。各基地单个养殖池塘面积约为6.67 hm2,水深2~3 m,养殖水来自近海海域利用纳潮纳入的海水。全年不投喂饲料,不投放益生菌,保证仿刺参自然生长。
从5个地区的养殖基地各随机采集10头仿刺参样品,样品平均湿体质量在55~60 g/头(排水后体质量为35~40 g/头)。将仿刺参从养殖基地的养殖池中捞起后立即放入加有养殖海水的无菌密封袋中,采用冰袋低温运输,24 h内空运至大连市海珍品疾病防控重点实验室。
1.2 仿刺参样品准备
从各采样点的仿刺参样品中分别随机选取3头作为3个平行样。在超净工作台上,使用灭菌的手术刀取仿刺参背部中间的表皮0.2 g放入灭菌的小烧杯中,用无菌海水濯洗2~3次,装入灭菌的2 mL离心管中;在无菌条件下,使用匀浆器将离心管中的仿刺参表皮充分研磨成匀浆,将装有匀浆的2 mL离心管放入液氮中速冻;使用干冰送交北京诺禾致源科技股份有限公司进行扩增子高通量测序分析。
1.3 仿刺参体表微生物基因组提取及检测
采用CTAB法提取仿刺参体表细菌基因组DNA[13]。取适量样本DNA于离心管中,用无菌水将样本稀释至1 ng/μL,利用琼脂糖凝胶电泳检测DNA的纯度和浓度。
1.4 PCR扩增与纯化
分别以DL、YK、WH、TS、ND 5个地区的仿刺参体表DNA为模版,用16s rDNA-V4通用引物(上游序列为515F:5-GTGCCAGCMGCCGCGGTAA-3,下游序列为806R:5-GGACTACHVGGGTWTCTAAT-3)[14]对16s rDNA-V4的基因进行PCR扩増。取5 μL的PCR产物于2%的琼脂糖凝胶中电泳检测,检测条件为5 V/cm,25 min,并用Qiagen Gel Extraction Kit(QIAGEN,Germany)凝胶回收试剂盒回收16S rDNA-V4区的片段。
1.5 文库构建和上机测序
测序所得的原始数据经过FLASH 1.2.7软件拼接[15],拼接得到的原始序列数据(raw tags)利用Qiime V1.9.1进行质量过滤[16],得到高质量的标签数据(clean tags),通过UCHIME Algorithm去除嵌合体[17],得到最终的有效数据(effective tags)。利用Uparse 7.0.1001软件[18]对所有样本的全部有效数据进行聚类,以97%的一致性(identity)将序列聚类成为操作分类单元(operational taxonomic units,OTUs),同时选取OTUs中出现频次最高的序列作为代表序列。用Mothur软件和SILVA[19]的SSUrRNA数据库[18]对OTUs代表序列进行物种注释分析(设定阈值为0.8~1.0)。此过程委托北京诺禾致源科技股份有限公司完成。
2 结果和分析
2.1 序列拼接组装与OTU聚类分析
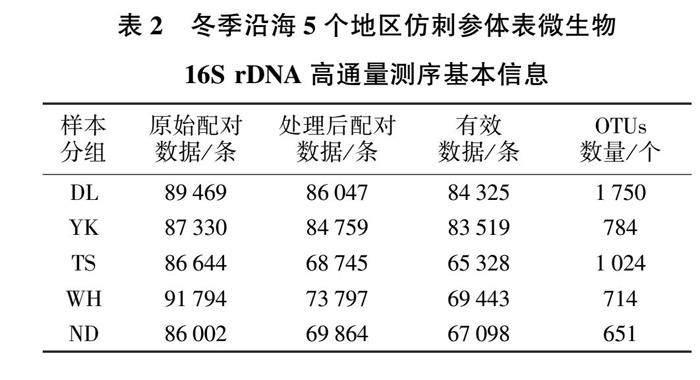
基于Illumina HiSeq测序平台测序构建PCR-free文库,然后进行双末端(paired-end)测序。通过对读长(reads)拼接,平均每个样品测得88 391条tags,经过质控,平均得到81 547条有效数据,质控有效数据75 292条,质控有效率达85.12%。以97%的一致性将序列聚类成为OTUs,共得到6 319个OTUs,然后对OTUs序列与Silva 132数据库进行物种注释。其中能够注释到数据库的OTUs数目为6 300,分类为41个门、63个纲、158个目、315个科、865个属、606个种。每个组别分析后的详细数据见表2。
2.2 仿刺参体表微生物Alpha多样性分析
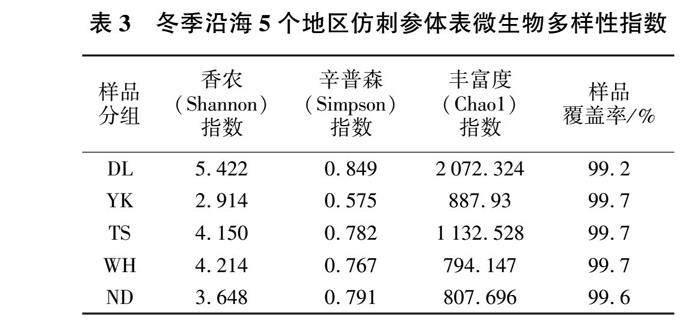
Alpha多样性分析可反映样本内的微生物群落多样性。冬季沿海5个地区仿刺参体表微生物多样性指数见表3。由表3可见,5个地区养殖仿刺参体表的微生物多样性存在差异。5组样品的覆盖率(goods_coverage)均达到99%以上,说明样品中序列检测率很高,测序结果符合样品中体表微生物的真实情况。对比样品中香农(Shannon)指数,辛普森(Simpson)指数,DL组的物种多样性最高;同时,DL组的丰富度(Chao1)指数最大,表明DL组物种丰富度最大。
2.3 仿刺参体表微生物Beta多样性分析
Beta多样性可以反映不同地区冬季仿刺参体表微生物物种的组成差异。采用非度量多维尺度分析(NMDS)方法对不同组间样本物种差异进行分析,结果见图1。样品间距离越近,表示二者物种差异程度越小;样品间距离越远,表示二者物种差异越大。结果显示,DL组和YK组的仿刺参体表微生物物种组成与其他3个地区仿刺参体表微生物物种组成差异较大;TS、WH以及ND组这3个地区的仿刺参体表微生物物种组成差异较小。
2.4 仿刺参体表微生物组成分析
在门水平上(见图2-a),5个地区养殖仿刺参体表微生物的第一优势菌门均为变形菌门(Proteobacteria),其中TS组相对丰度占比最高,达87.44%;ND组相对丰度占比最低,为76.16%。YK、WH、TS组这3个地区养殖仿刺参体表微生物的次优势菌门均为厚壁菌门(Firmicutes),相对丰度占比分别为5.67%、8.94%、5.90%。
在纲水平上(见图2-b),α-变形菌纲(Alphaproteobacteria)是5个地区养殖仿刺参体表微生物的第一优势菌纲,其中YK组相对丰度占比最高,达83.05%;DL组相对丰度占比最低,为52.16%。DL、WH、TS和ND组这4个地区养殖仿刺参体表微生物的次优势菌纲均为γ-变形菌纲(Gammaproteobacteria),相对丰度占比分别为22.82%、17.12%、9.42%和20.25%;而YK组养殖仿刺参体表微生物的次优势菌纲为拟杆菌纲(Bacteroidia)。
在目水平上(见图2-c),DL、YK、WH和TS组养殖仿刺参体表微生物的第一优势菌目均为红螺菌目(Rhodobacterales),相对丰度占比分别为15.58%、38.03%、22.72%和22.09%;而ND组的第一优势菌目为柄杆菌目(Caulobacterales),相对丰度占比为14.48%。在目水平上的第一优势菌目呈现出明显的南北地区差异。DL、ND组养殖仿刺参体表微生物的次优势菌目为纤维弧菌目(Cellvibrionales),其相对丰度占比分别为14.58%和12.93%。
在科水平上(见图2-d),DL、YK、WH和TS组养殖仿刺参体表微生物的第一优势菌科均为红螺菌科(Rhodobacteraceae),相对丰度占比分别为15.58%、38.03%、22.72%和22.09%,而ND组的第一优势菌科为生丝单胞菌科(Hyphomonadaceae),相对丰度占比为14.34%。在目、科分类水平上的第一优势菌均呈现出明显的南北地区差异。DL、TS组两地养殖仿刺参体表微生物的次优势菌科为生丝单胞菌科,其相对丰度占比分别为11.17%和12.48%。
在属水平上(见图2-e),鉴定到的细菌总体水平偏低,常见病原菌弧菌属并不在排名前30的优势菌内,辅证了近年来由弧菌引起的仿刺参发病率逐年降低,同年度采集的仿刺参病例同样较少。
由图3可见,在属水平上,沿海5个地区仿刺参体表微生物物种的相对丰度依次为WH>TS>DL>ND>YK,其中,WH和TS组乳杆菌属(Lactobacillus)相对丰度占比较高,分别为2.70%和2.62%;WH组双歧杆菌属(Bifidobacterium)相对丰度占比较高,为2.26%。
由图4可见,位于南部的宁德地区与其他4个地区在属水平上具有显著差异的微生物有嗜冷菌属(Colwellia)、不動杆菌属(Acinetobacter)、溶杆菌属(Lysobacter)、副球菌属(Paracoccus)、鞘氨醇单胞菌(Sphingomonas)、亚硝化螺菌属(Nitrosospira)、独岛杆菌属(Dokdonella)、热单胞菌属(Thermomonas)等。威海地区在属水平上的微生物多样性最为丰富,该地区与其他4个地区存在差异的微生物有不动杆菌属(Acinetobacter)、副球菌属(Paracoccus)等,其中副球菌属(Paracoccus)与其他4地均有显著差异。
3 讨论
3.1 仿刺参体表微生物的结构特征
本研究发现,沿海5个地区的仿刺参体表微生物主要由变形菌门(76%~88%)和厚壁菌门(2%~10%)组成,其中变形菌门为第一优势菌,这与主要鱼类体表微生物结构分析的结果一致[20-21]。有研究发现,在门水平上,虹鳟(Oncorhynchus mykiss)[20]皮肤微生物以变形菌门和厚壁菌门为主,小头裸裂尻鱼(Herzensteinia microcephalus)[21]皮肤微生物的主要优势菌为放线菌门(Actinobacteria)和变形菌门。仿刺参属于底栖生物,其生活的沉积泥中的最优势菌也是变形菌门[22]。变形菌门是细菌中最大的一个门,有着最庞大的微生物类群,在各种复杂的环境中都能存活,这类微生物可以参与环境中的碳循环,为宿主积累能量,与宿主的生理特性关系紧密相连[23-24]。仿刺参体表微生物在纲、目水平上的优势菌分别为α-变形菌纲以及红螺菌目,均归属于变形菌门,其中红螺菌目是α-变形菌纲中的主要目,这类微生物可以通过光合作用进行生长,还可参与海洋中的碳、氮循环[25]。厚壁菌门多数为革兰氏阳性细菌,其分布于近海和前海的沉积物中[26],与刺参活动范围相符[27]。
3.2 仿刺参体表微生物的潜在致病菌
本研究对5个不同沿海地区的仿刺参体表微生物进行分析,发现仿刺参体表微生物存在不动杆菌属,该属微生物可能会导致水质污染和水生动物疾病的发生。不动杆菌属是一类非发酵革兰氏阴性杆菌,在自然环境的水体和土壤中广泛存在,是一类毒力较低的条件致病菌[28]。本研究发现,ND与YK、DL、TS等组的显著差异菌在属水平上均有不动杆菌。王轶南等[29]发现,在化皮参苗(Apostichopus japonicus)病灶组织微生物群落结构中存在不动杆菌属,且其属于第二优势菌。不动杆菌属作为重要的病原菌可致使鱼类发生疾病,如鲍曼不动杆菌对美洲鳗鲡(Anguilla rostrata)[30]、鳜(Sinipercachuatsi)[31]、异育银鲫(Carassius auratus gibelio)[32]、斑点叉尾鱼回(Ictalurus punctatus)[33]、线鳢(Channastriata)[34]、露斯塔野鲮(Labeo rohita)[35]均具有致病性;琼氏不动杆菌可引起石鲽(Kareius bicoloratus)[36]、锦鲤(Cyprinus carpio)[37]发生疾病。有研究表明,不动杆菌在水生动物处于健康状态时不具有致病性[38],但该菌的一个重要的感染途径是在水生动物体表损伤时进行感染[[39]。不动杆菌属的一些菌种可以分解有机质,产生氨、亚硝酸盐和硝酸盐等营养物质,为水生动物生长提供养分,但在水生动物养殖密度过高时则会导致水质污染,引起动物疾病的发生[40-41]。
弧菌作为条件致病菌,只有当宿主抵抗力降低或环境极度恶化时在养殖动物体表大量分离。李晓宇等[42]某次在大连地区发现仿刺参腐皮综合征的致病菌为溶藻弧菌(Vibrio alginolyticus),人工回归感染试验结果显示,浸浴感染没有出现病症,而腹部注射和体壁创伤浸浴感染则出现病症并伴有死亡,证实仿刺参体表黏膜层可抵御外来病原弧菌的侵袭,且溶藻弧菌是一种机会致病弧菌。张春云等[12]从患有腐皮综合征仿刺参的病灶处分离得到优势菌株——灿烂弧菌,人工回归感染试验发现,该菌株引发的症状与自然发病的症状相同,并且对健康仿刺参有很强的致病及致死作用。在本研究中,在属水平上被注释为前30位的优势属中并未见到弧菌属,推测这与采集的样本均为健康仿刺参有关。
3.3 仿刺参体表微生物的有益生物
在本研究中,WH组的优势菌为乳杆菌属,此外该组的副球菌属与其他地区仿刺参体表微生物均存在显著差异,以上菌属都是益生菌,推测威海地区的仿刺参疾病发生较少。乳杆菌属中的乳酸菌(Lactic acid bacteria)、嗜酸乳杆菌(Lactobacillus acidophilus)等作为水产动物的肠道益生菌可改善肠道内环境,增强机体的免疫力[43],其中,乳酸菌可作为一种生物屏障抑制病原弧菌的感染;嗜酸乳酸杆菌可分泌抑制物质,与病原弧菌竞争营养从而抑制病原菌的生长,也可降低病原弧菌的黏附率[44];乳酸杆菌作为益生菌可以促进刺参肠道中益生菌的生长,增强其免疫能力,降低刺参感染疾病的风险[45]。仿刺参腐皮综合征等皮肤病是由弧菌引起的,周海平等[46]研究表明,乳酸杆菌对病原弧菌有很好的抑制作用;双歧杆菌属次之,其属中的两歧双歧杆菌(Bifdobacterium bidfium)是水产养殖中常用的益生菌[47]。
副球菌属隶属于变形菌门中的红螺菌目、红螺菌科,与本研究中在目水平上和科水平上注释到的微生物相呼应。副球菌属的存在可提高刺参的免疫能力。有研究表明,副球菌属中的马氏副球菌(Paracoccus marcusii)作为刺参饲料的添加剂可以有效提高刺参体腔细胞的呼吸爆发活力,上调刺参体腔细胞非特异性免疫基因的表达量,增强刺参的非特异性免疫力[48],还可促进其生长,提高刺参肠道和体腔细胞的免疫能力。在体外试验中发现,马氏副球菌对引起刺参腐皮综合征的病原菌灿烂弧菌具有抑制作用[49]。
3.4 不同海域仿刺参体表微生物的异同及其影响因素
本研究发现,不同海域仿刺参体表微生物的群落结构存在差异,推测其与仿刺参生存海域环境的微生物组成有关。在物种组成上,采自黄海海域(DL和WH)仿刺参体表微生物的多样性和丰富度总和均高于采自渤海海域(YK和TS)以及東海海域(ND)仿刺参体表微生物的多样性和丰富度总和。据报道,仿刺参肠道微生物与其生活的环境密切相关,黄海海域的仿刺参肠道微生物多样性显著高于渤海的[50]。这与本研究仿刺参体表微生物多样性的研究结果一致。
不同海域仿刺参体表微生物的物种多样性可能与海域间的水温有关。本研究样品采集时,黄海海域水温高于渤海海域水温,其微生物多样性也高于后者,然而,东海海域水温高于黄海海域水温,其微生物多样性却低于黄海海域。有研究指出,温度是影响环境中微生物结构重要的物理因子,温度能够加快微生物的生长和繁殖速度,同样也可以抑制菌群的生长和繁殖速度,从而通过这种促进或抑制作用改变环境中的菌群结构[51-52]。
4 结论
仿刺参体表微生物多样性分析发现,仿刺参的体表存在益生菌属,也存在条件致病菌属。健康仿刺参的体表微生物处于相对平衡状态,养殖环境恶化会导致一些有害微生物大量增加进而诱发疾病,甚至导致养殖生物体死亡。仿刺参与其共生微生物的关系还需进一步探索。本研究分析了仿刺参体表微生物与自身环境的关联性,可为进一步开展仿刺参体表微生物多样性与环境适应进化以及仿刺参疾病的防治提供参考。
参考文献
[1]夏海峰,杜宗军,陈冠军.刺参肠道及养殖池塘底泥微生物多样性的比较研究[J].海洋湖沼通报,2015(4):105-110.
[2]张启宇,刘峰,陈英义,等.海参病害防治诊断专家系统的研究[J].江苏农业科学,2017,45(18):226-229.
[3]樊绘曾.海参:海中人参——关于海参及其成分保健医疗功能的研究与开发[J].中国海洋药物,2001,20(4):37-44.
[4]常亚青,隋锡林,李俊.刺参增养殖业现状、存在问题与展望[J].水产科学,2006,25(4):198-201.
[5]黄华伟,王印庚.海参养殖的现状、存在问题与前景展望[J].中国水产,2007(10):50-53.
[6]ZHAO Z L,JIANG J W,PAN Y J,et al.Proteomic analysis reveals the important roles of alpha-5-collagen and ATP5β during skin ulceration syndrome progression of sea cucumber Apostichopus japonicus[J].Journal of Proteomics,2018,175:136-143.
[7]农业农村部渔业渔政管理局,全国水产技术推广站,中国水产学会.中国渔业统计年鉴[M].北京:中国农业出版社,2023.
[8]姜森颢,任贻超,唐伯平,等.我国刺参养殖产业发展现状与对策研究[J].中国农业科技导报,2017,19(9):15-23.
[9]ZHAO Z L,ZHOU Z C,DONG Y,et al.Association of intestinal fungal communities with the body vesicular syndrome:an emerging disease of sea cucumber(Apostichopus japonicus)[J].Aquaculture,2021,530:735758.
[10]BECKER P,GILLAN D,LANTERBECQ D,et al.The skin ulceration disease in cultivated juveniles of Holothuria scabra (Holothuroidea,Echinodermata)[J].Aquaculture,2004,242(1/2/3/4):13-30.
[11]王印庚,荣小军,张春云,等.养殖刺参暴发性疾病——“腐皮综合症”的初步研究与防治[J].齐鲁渔业,2004,21(5):44-47.
[12]张春云,王印庚,荣小军.养殖刺参腐皮综合征病原菌的分离与鉴定[J].水产学报,2006,30(1):118-123.
[13]LUTZ K A,WANG W Q,ZDEPSKI A,et al.Isolation and analysis of high quality nuclear DNA with reduced organellar DNA for plant genome sequencing and resequencing[J].BMC Biotechnology,2011,11:54.
[14]WU L Y,WEN C Q,QIN Y J,et al.Phasing amplicon sequencing on Illumina Miseq for robust environmental microbial community analysis[J].BMC Microbiology,2015,15(1):125.
[15]MAGOC T,SALZBERG S L.FLASH:fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics,2011,27(21):2957-2963.
[16]CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods,2010,7(5):335-336.
[17]EDGAR R C,HAAS B J,CLEMENTE J C,et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16):2194-2200.
[18]HAAS B J,GEVERS D,EARL A M,et al.Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J].Genome Research,2011,21(3):494-504.
[19]EDGAR R C.UPARSE:highly accurate OTU sequences from microbial amplicon reads[J].Nature Methods,2013,10(10):996-998.
[20]CHO K,USHIKI T,ISHIGURO H,et al.Altered microbiota by a high-fat diet accelerates lethal myeloid hematopoiesis associated with systemic SOCS3 deficiency[J].iScience,2021,24(10):103117.
[21]郝佳慧,蔡偉杰,李柯懋,等.高通量测序分析小头裸裂尻鱼皮肤和肠道的微生物多样性[J].微生物学报,2023,63(1):233-250.
[22]李晓龙.正常和发病刺参养殖池塘沉积环境中细菌群落变化的研究[D].保定:河北农业大学,2014.
[23]程庆,江超,陈苏芳,等.高通量测序分析湖南汝城县热水圩热泉微生物多样性[J].湘南学院学报,2021,42(5):22-27.
[24]LU H P,WANG Y B,HUANG S W,et al.Metagenomic analysis reveals a functional signature for biomass degradation by cecal microbiota in the leaf-eating flying squirrel(Petaurista alborufus Lena)[J].BMC Genomics,2012,13:466.
[25]白洁,李海艳,赵阳国.黄海北部不同站位海洋细菌群落分布特征[J].微生物学报,2009,49(3):343-350.
[26]RAVENSCHLAG K,SAHM K,PERNTHALER J,et al.High bacterial diversity in permanently cold marine sediments[J].Applied and Environmental Microbiology,1999,65(9):3982-3989.
[27]LIU S L,SUN J C,RU X S,et al.Differences in feeding,intestinal mass and metabolites between a thermotolerant strain and common Apostichopus japonicus under high summer temperature[J].Aquaculture Research,2018,49(5):1957-1966.
[28]ELIOPOULOS G M,MARAGAKIS L L,PERL T M.Acinetobacter baumannii:epidemiology,antimicrobial resistance,and treatment options[J].Clinical Infectious Diseases,2008,46(8):1254-1263.
[29]王轶南,王俊杰,王姣姣,等.用16S rDNA克隆文库法分析患病刺参幼苗的菌群结构[J].大连海洋大学学报,2014,29(3):205-211.
[30]孙云,何明旺,张盼盼,等.美洲鳗鲡致病性鲍曼不动杆菌的分离、鉴定及致病性分析[J].水产学报,2020,44(9):1561-1571.
[31]顾天钊,陆承平,陈怀青.鲍氏不动杆菌──鳜鱼暴发性死亡的新病原[J].微生物学通报,1997,24(2):104-106.
[32]陆文浩,陈辉,王习达,等.异育银鲫致病性鲍曼不动杆菌的鉴定和系统发育分析[J].中国兽医科学,2009,39(4):303-309.
[33]MARTOJA R,MARTOJA-PIERSON M.Initiation aux techniques de lhistologie animale[R].Masson,1967.
[34]RAUTA P R,KUMAR K,SAHOO P K.Emerging new multi-drug resistant bacterial pathogen,Acinetobacter baumannii associated with snakehead Channa striatus eye infection[J].Current Science,2011,101(4):548-553.
[35]BEHERA B K,PARIA P,DAS A,et al.Molecular characterization and pathogenicity of a virulent Acinetobacter baumannii associated with mortality of farmed Indian Major Carp Labeo rohita(Hamilton 1822)[J].Aquaculture,2017,471:157-162.
[36]陈翠珍,房海,张晓君.石鲽病原琼氏不动杆菌形态型Ⅰ的鉴定[J].微生物学通报,2005,32(3):34-39.
[37]陈翠珍,张晓君,房海,等.锦鲤中琼氏不动杆菌的分离与鉴定[J].水生态学杂志,2009,30(1):86-90.
[38]张涵,周涛,王岩.综合养殖池塘中三角帆蚌和鱼类肠道细菌的组成[J].水生生物学报,2013,37(5):824-835.
[39]吴春艳,任思宇,汪开毓,等.一株虹鳟源乌尔新不动杆菌的分离鉴定与其感染的病理损伤[J].水产科学,2019,38(6):797-803.
[40]罗国芝,陈家捷,于文杰,等.一株新型异养硝化细菌处理养殖水的效果[J].环境工程学报,2016,10(8):4206-4212.
[41]张喜昌,薛明洋,戚晓舟,等.从海泥中分离的約氏不动杆菌聚磷特性研究[J].家畜生态学报,2022,43(5):60-64.
[42]李晓宇,冯丽娟,徐乐,等.刺参腐皮综合征病原菌的分离鉴定及特性分析[J].水产科学,2022,41(5):759-768.
[43]孔祎頔,田佳鑫,陈秀梅,等.水产动物益生菌及其对肠道菌群影响的研究进展[J].中国畜牧杂志,2019,55(1):29-33.
[44]李建光.刺參菌群结构的分析及益生菌对刺参的影响[D].大连:大连理工大学,2014.
[45]张涛,白岚,李蕾,等.不同添加量的益生菌组合对仿刺参消化和免疫指标的影响[J].大连水产学院学报,2009,24(Sup 1):64-68.
[46]周海平,李卓佳,杨莺莺,等.乳酸杆菌LH对几种水产养殖病原弧菌的抑制作用[J].台湾海峡,2006,25(3):388-395.
[47]刘广,赵阳,李元莉,等.益生菌在水产无脊椎动物养殖中的研究与应用[J].饲料与畜牧,2013(4):46-49.
[48]阳钢,田相利,董双林,等.四种不同添加物对仿刺参非特异性免疫力和肠道免疫基因Aj-p105、Aj-p50、Aj-rel和Aj-lys mRNA表达的影响[J].水产学报,2015,39(5):638-647.
[49]YAN F J,TIAN X L,DONG S L,et al.Growth performance,immune response,and disease resistance against Vibrio splendidus infection in juvenile sea cucumber Apostichopus japonicus fed a supplementary diet of the potential probiotic Paracoccus marcusii DB11[J].Aquaculture,2014,420/421:105-111.
[50]柴英辉,高菲,王金锋,等.仿刺参(Apostichopus japonicus)肠道菌群的地域性差异与共性研究[J].海洋与湖沼,2019,50(5):1127-1137.
[51]李彬,荣小军,廖梅杰,等.冬季刺参养殖环境与肠道内细菌菌群的研究[J].海洋科学,2010,34(4):64-69.
[52]李佳霖,汪光义,秦松.秦皇岛近海养殖对潮间带微生物群落多样性的影响[J].生态环境学报,2011,20(5):920-926.
Comparative analysis of microbial diversity on the skin of Apostichopus japonicus located at five coastal areas of China in winter
PAN Meili, DANG Huifeng, HUANG Yuxi, WANG Xiaohang, LI Ruijun, DING Jun
(College of Fisheries and Life Sciences,Dalian Ocean University,Dalian 116023,China)
Abstract: Apostichopus japonicus was an important aquatic echinoderm in China,and its surface microorganisms played an important role in the occurrence of diseases of A. japonicus and the interaction with the environment.In this study,Illumina HiSeq high-throughput sequencing technology was used to analyze the diversity of microorganisms on the skin of sea cucumbers in five different coastal areas of China(Dalian,Yingkou,Tangshan,Weihai and Ningde).The results showed that the regional differences had a significant impact on the surface microbial composition of A. japonicus.The skin microorganisms of A. japonicus collected from Ningde(ND) had the most significant difference compared with the other 4 groups.At the phylum level,Proteobacteria was the most dominant phylum in all groups,with the lowest relative richness in ND group(76.16%).At the order and family level,the most dominant microorganisms of ND group belonged to Caulobacterales and Hyphomonadaceae respectively,accounting for 14.48% and 14.34% respectively.At the genus level,the percentage of some microorganisms in ND group were significantly different from other 4 groups(P<0.05),in terms of Acinetobacter,Paracoccus,Lachnospira,etc.In addition,Weihai(WH) group had the highest relative richness at the genus level,with significant difference in Paracoccus percentage(P<0.05).The results of four research would provide a reference for the further study on microbial diversity and environmental adaptation of sea cucumbers,as well as the prevention and treatment of diseases of sea cucumbers.
Key words: Apostichopus japonicus; winter; skin microorganisms; diversity difference

