下调ODC1对人SCLC细胞H82、H69增殖、凋亡及铂类药物敏感性的影响


DOI:10.3969/j.issn.10001565.2024.02.008
摘" 要:为探索下调鸟氨酸脱羧酶1(ornithine decarboxylase1, ODC1)对人小细胞肺癌(small cell lung cancer,SCLC)细胞H82、H69增殖、凋亡及铂类药物敏感性的影响,检测了人SCLC细胞系ODC1的表达水平,并利用LV-NC/ODC1-RNAi慢病毒感染H82、H69细胞后,通过实时荧光定量PCR(qPCR)和免疫印迹实验(West1ern blot)检测ODC1在mRNA和蛋白水平的表达.CCK-8法、软琼脂克隆形成实验、流式细胞术、Western blot等检测下调ODC1后细胞增殖、凋亡及对铂类药物敏感性的变化.结果显示,ODC1在人SCLC细胞系中多数高表达,且下调ODC1后人SCLC细胞H82、H69增殖减慢,凋亡明显增加,药物敏感性增强.说明下调ODC1抑制H82、H69细胞增殖,促进细胞凋亡,增强细胞对铂类药物的敏感性.
关键词:鸟氨酸脱羧酶1(ODC1);小细胞肺癌(SCLC);增殖;凋亡;药物敏感性
中图分类号:R73-3""" 文献标志码:A""" 文章编号:10001565(2024)02017309
Effects of ODC1 downregulation on the proliferation, apoptosis, and sensitivity to platinum drugs of human SCLC cells H82 and H69
GAO Xiangpeng1,2, WANG Xiaofang1, HE Wenyi1,2, LI Yumiao1, SONG Jin1, JIA Youchao1
(1. Hebei Key Laboratory of Cancer Radiotherapy and Chemotherapy, Department of Medical Oncology, Affiliated Hospital of Hebei University, Baoding 071000,China;2. School of Clinical Medicine, Hebei University, Baoding 071000, China)
Abstract: To explore the effect of the downregulation of ornithine decarboxylase1 (ODC1) on the proliferation, apoptosis and platinum drugs sensitivity of human small cell lung cancer(SCLC) cells H82 and H69, the expression levels of ODC1 of the human SCLC cell lines were examined. H82 and H69 cells were infected with the LV-NC/ODC1-RNAi lentivirus, then the expression of ODC1 at the mRNA and protein levels was determined by real-time fluorescent quantitative PCR(q-PCR) and immunoblot assay(Western blot). CCK-8 assay, colony formation assay, flow cytometry and Western blot were used to detect
收稿日期:20221116;修回日期:20230421
基金项目:
河北大学研究生创新项目(HBU2022ss002);2021年政府资助省级医学优秀人才项目——小细胞肺癌基础及转化创新团队
第一作者:高翔鹏(1987—),男,河北大学硕士研究生,主要从事淋巴瘤、实体瘤的临床诊治及基础研究.E-mail:821408156@qq.com
通信作者:贾友超(1981—),男,满族,河北大学附属医院主任医师,主要从事淋巴瘤、实体瘤的临床诊治及基础研究.E-mail:youchaojia@163.com
宋瑾(1982—),女,河北大学附属医院主管护师,主要从事肿瘤护理研究.E-mail:2705251562@qq.com
the changes of cell proliferation,apoptosis and sensitivity to platinum drugs after downregulation of ODC1. As a result, ODC1 was mostly highly expressed in human SCLC cell lines; the proliferation of human SCLC cells H82 and H69 slowed down; their apoptosis significantly increased and drugs sensitivity was enhanced. In summary, downregulation of ODC1 can inhibits the proliferation of human SCLC cells H82 and H69, promotes cell apoptosis, and enhances cell sensitivity to platinum drugs.
Key words: ornithine decarboxylase1(ODC1); small cell lung cancer(SCLC); proliferation; apoptosis; drugs sensitivity
小细胞肺癌(small cell lung cancer,SCLC)是侵袭性最高的肺癌病理类型,占所有类型的10%~15%,具有恶性程度高、生长迅速、容易耐药、易早期转移等特点,目前主要治疗手段仍为传统的化疗和放疗,预后极差,亟待高效的治疗方案改善其临床预后[1].
鸟氨酸脱羧酶1(ornithine decarboxylase1,ODC1)是生物体内多胺合成的第1个限速酶,其可以介导鸟氨酸生成腐胺,从而调控体内多胺的合成,该酶持续高活性可引起多胺的异常累积[2].多胺是生物体内的一种有机小分子,生物学作用极为广泛,参与包括人在内的几乎所有动植物的基因表达调控、细胞增殖与凋亡、细胞周期等[3],相关研究证实,多种肿瘤的发生发展与细胞内多胺的异常累积密切相关[4-6].ODC1在肿瘤的发生发展中至关重要,是一个极具价值的潜在的肿瘤诊断与预后标志物和治疗靶点.然而,ODC1在SCLC中的潜在作用机制鲜见报道,有待进一步探索.本研究旨在探讨ODC1在SCLC中的分子功能及其对铂类药物敏感性的影响,为靶向治疗SCLC寻找新的途径.
1" 材料与方法
1.1" 材料
1.1.1" 细胞系
人SCLC细胞系H82细胞购自ATCC,人小细胞肺癌细胞系H69购自中国科学院上海生命科学研究院细胞资源中心.
1.1.2" 试剂与抗体
1640细胞培养基和胎牛血清(Gibico公司);RNAi-慢病毒(上海吉凯基因科技有限公司);Anti-ODC-1 antibody(Abcam);GAPDH Mouse monoclonal antibody(Proteintech);Trizol(AcrylCarrier);抗青霉素链霉素、HEPES溶液和PBS缓冲液(Solarbio);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);反转录试剂盒和q-PCR试剂盒(南京诺唯赞生物科技股份公司);BCL-2、BAX、Cytochrome3、Caspase3、cleaved-Caspase3、PARP,cleaved-PARP、Cyclin B1、Cyclin A2、Cyclin D1、Cyclin E1、CDK2、GAPDH抗体均购自CST公司.
1.2" 方法
1.2.1" ODC1低表达人SCLC细胞模型的构建与验证
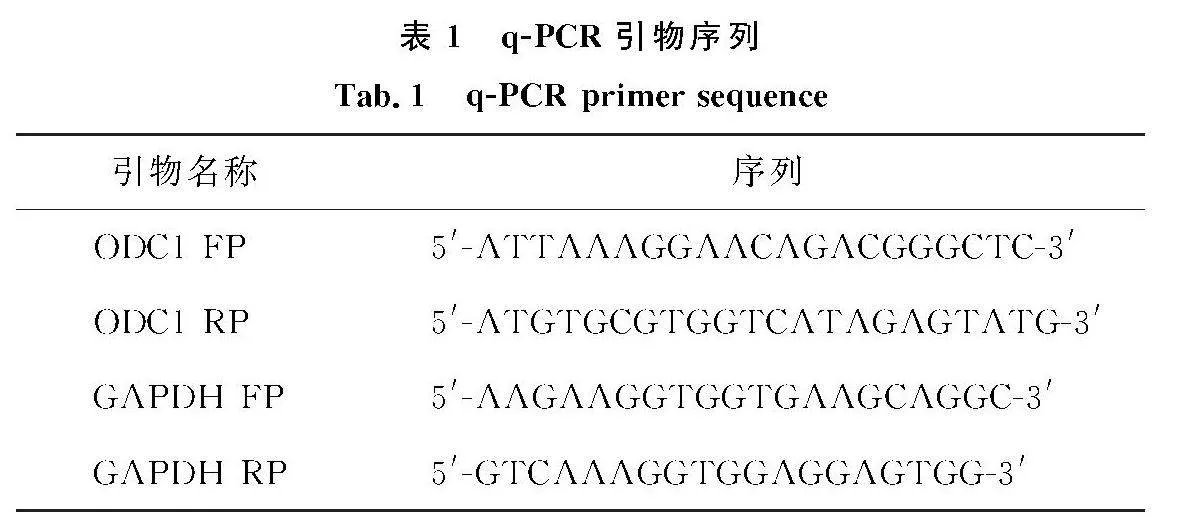
取对数生长期的人SCLC细胞,计数,按照慢病毒感染手册将LV-NC/ODC1-RNAi分别感染细胞;取感染后处于对数生长期的细胞提取RNA,并用oligo(dT)18作引物将其中的mRNA反转录为第1链,再以cDNA为模板,PCR扩增目标基因ODC1(以GAPDH作为内参).PCR扩增参数如下:在94 ℃ 预变性5 min后,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,25个循环后,72 ℃延伸5 min结束扩增.PCR引物设计见表1.用RAPI裂解液提取对数生长期细胞蛋白,BCA法测定总蛋白含量.蛋白质样品经SDS-PAGE分离后,电转移至PVDF膜.TBST室温封闭1 h,一抗(体积比1∶1 000)孵育过夜,二抗(体积比1∶5 000)室温孵育1 h,最后用ECL化学发光剂显色3 min,化学发光仪检测目的蛋白表达.
1.2.2" 细胞增殖实验
收集处于对数生长期的H82、H69对照组和实验组细胞,离心计数,以每孔1×104 个细胞平铺于96孔板中,37 ℃培养.分别于24、48、72、96、120 h加入CCK-8溶液(10 μL/孔),孵育4 h后用酶标仪测定波长450 nm处OD值.
1.2.3" 软琼脂克隆实验
制备质量分数1.2%与0.7%的琼脂糖凝胶,高压灭菌后置于55 ℃水浴锅中,1.2%琼脂糖凝胶与2×1 640培养基1∶1(体积比)混合,加入至6孔细胞培养板,1.5 mL/孔;收集对数生长期的H82/H69对照组及实验组细胞,离心计数,0.7%琼脂糖凝胶与2×1 640培养基1∶1(体积比)混匀,加入适量细胞悬液(含5×103 个细胞)充分混匀,每孔加入1 mL,37 ℃,体积分数5% CO2培养箱培养,每隔3 d补加适量培养基,约2~3周后终止培养,拍照计数.
1.2.4" 流式细胞术检测细胞凋亡
收集对数生长期的H82、H69对照组和实验组细胞各(1~10)×105 个,用预冷PBS离心洗涤.用双蒸水稀释5×Binding Buffer为1×Binding Buffer工作液,取500 μL 1×Binding Buffer重悬细胞.每管加入5 μL的Annexin V-APC和10 μL 7-AAD.轻柔涡旋混匀后,室温避光孵育5 min.最后上机进行分析.
1.2.5" CCK-8检测药物敏感性
收集对数生长期的H82、H69对照组和实验组细胞,离心计数,将细胞重悬于顺铂浓度为0、1、2、4、8、16、32、64 nmol/mL的培养基中,以1×104 个/孔的密度接种于96孔板中培养,分别于24、48、72、96、120 h加入CCK-8溶液(10 μL/孔),孵育4 h后用酶标仪测定波长450 nm处OD值,计算顺铂抑制率.
1.3" 统计学分析
采用SPSS 22.0软件、GraphPad Prism 8.0软件进行数据分析与绘图,实验计量数据以均值±标准差(x±s)表示;对于多组实验结果比较,采用单因素方差分析.以P<0.05为差异具有统计学意义.
2" 结果
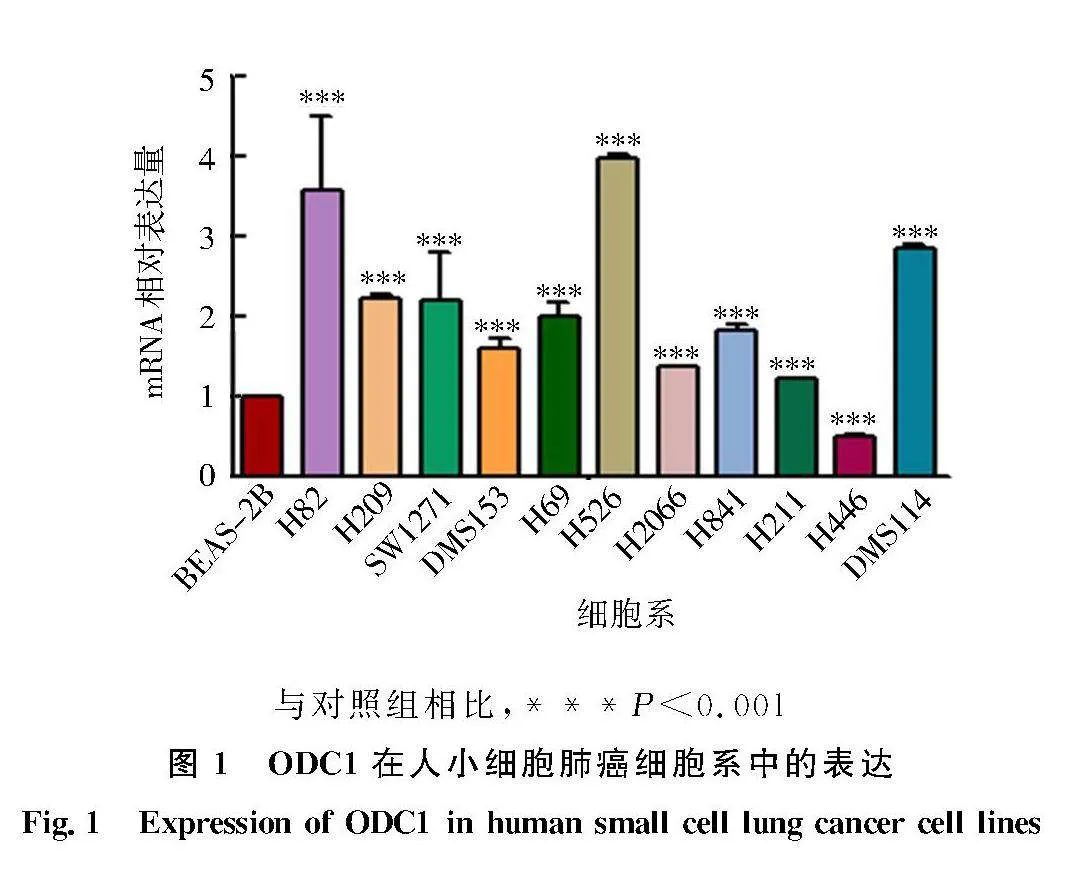
2.1" ODC1在人SCLC细胞系中的表达
分别提取人正常肺上皮细胞BEAS-2B及SCLC细胞系H69、H209、DMS153、H446、H82、H2066、H841、DMS114、SW1271、H526、H211的RNA,q-PCR检测ODC1在正常肺上皮及SCLC细胞系中的表达情况(以GAPDH作为内参),结果如图1,ODC1在SCLC细胞系H82、H69、H526等10种细胞系中表达高于正常肺上皮细胞,在H446细胞系中的表达低于正常肺上皮细胞.
与对照组相比,***P<0.001
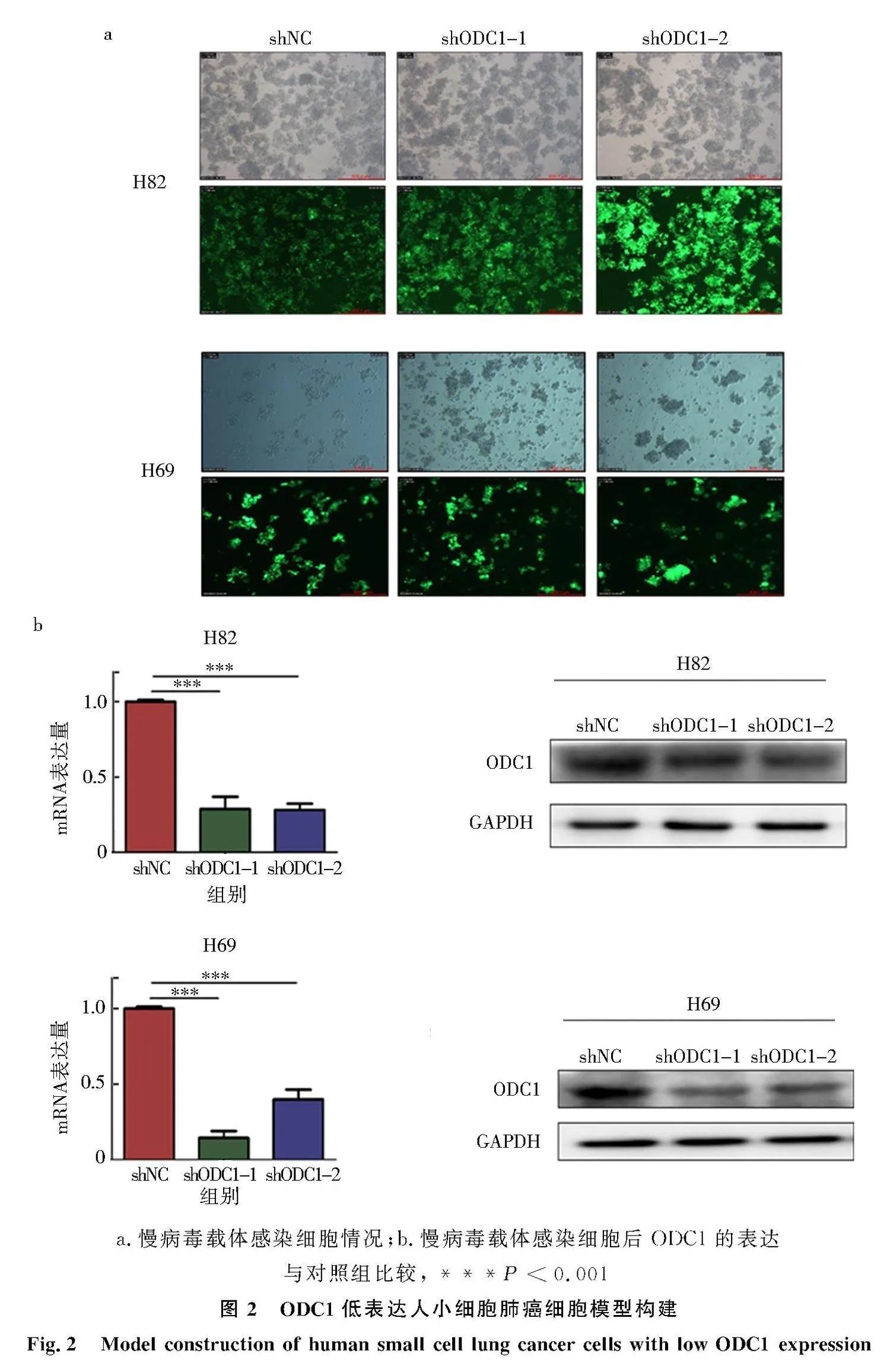
2.2" shODC1慢病毒载体感染人SCLC细胞H82、H69
shODC1慢病毒载体感染人SCLC H82、H69细胞72 h后在荧光显微镜下观察可见对照组及实验组细胞均产生绿色荧光,表明慢病毒感染成功.利用q-PCR和Western blot分别检测各细胞ODC1 mRNA和蛋白表达水平,与对照组相比,H82-shODC1-1、H82-shODC1-2、H69-shODC1-1、H69-shODC1-2组ODC1 mRNA及蛋白表达量明显降低(Plt;0.001,图2),结果表明ODC1低表达人SCLC细胞模型构建成功.
2.3" 下调ODC1对H82、H69细胞增殖的影响
CCK-8法检测下调ODC1对人SCLC细胞增殖的影响.结果显示,24、48、72、96、120 h实验组H82-shODC1-1、H82-shODC1-2、H69-shODC1-1、H69-shODC1-2细胞的OD值明显低于对照组(Plt;0.001,图3),且随着培养时间的增加抑制率明显增高,表明下调ODC1抑制了人SCLC细胞H82、H69的增殖.
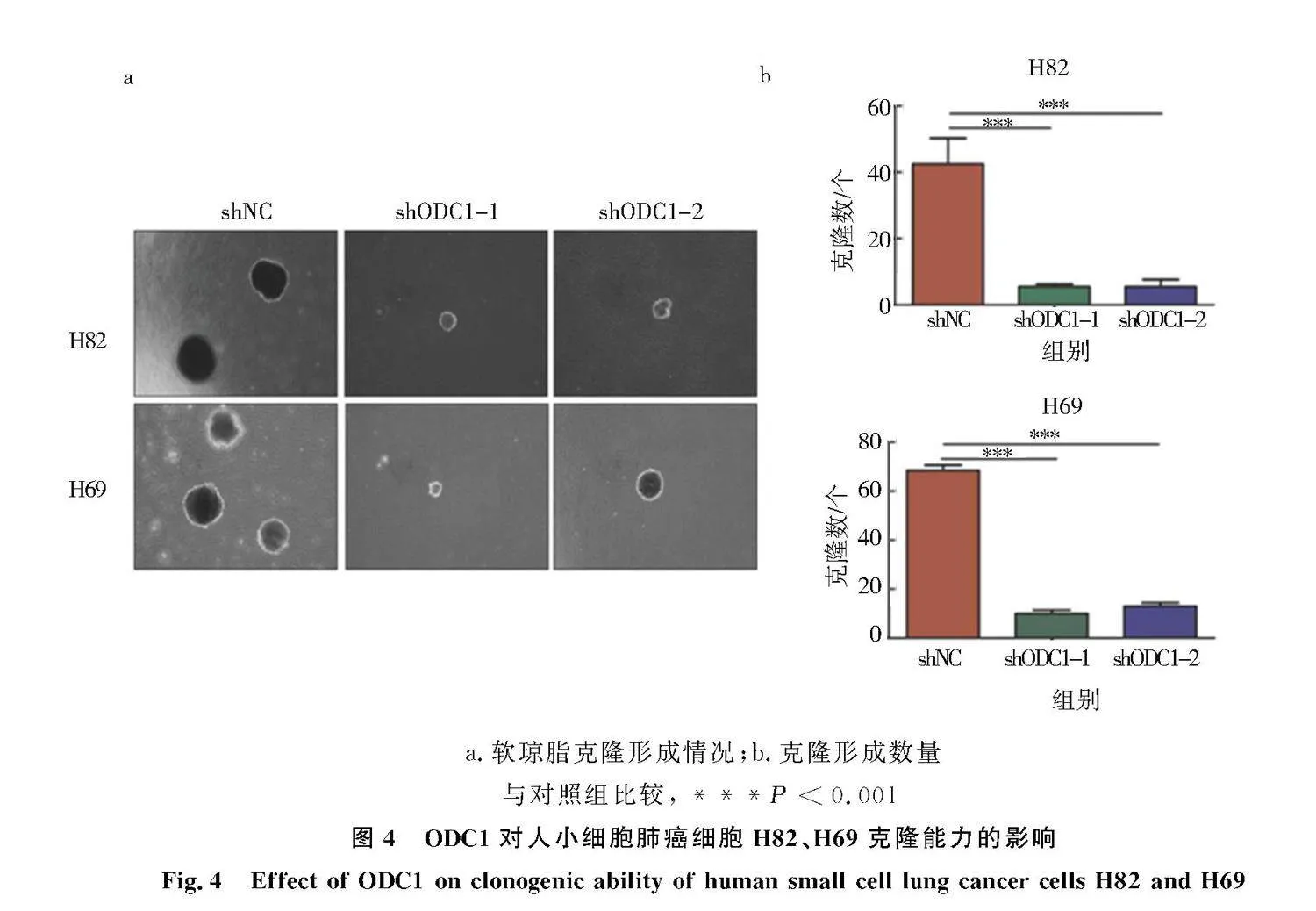
2.4" 下调ODC1对H82、H69细胞克隆能力的影响
软琼脂克隆实验检测下调ODC1对人SCLC细胞克隆能力的影响.结果显示,与对照组相比,实验组H82-shODC1-1、H82-shODC1-2、H69-shODC1-1、H69-shODC1-2细胞形成的克隆数量明显减少(P<0.001,图4),且细胞克隆团体积明显减小.表明下调ODC1抑制了人SCLC细胞H82、H69的克隆能力.
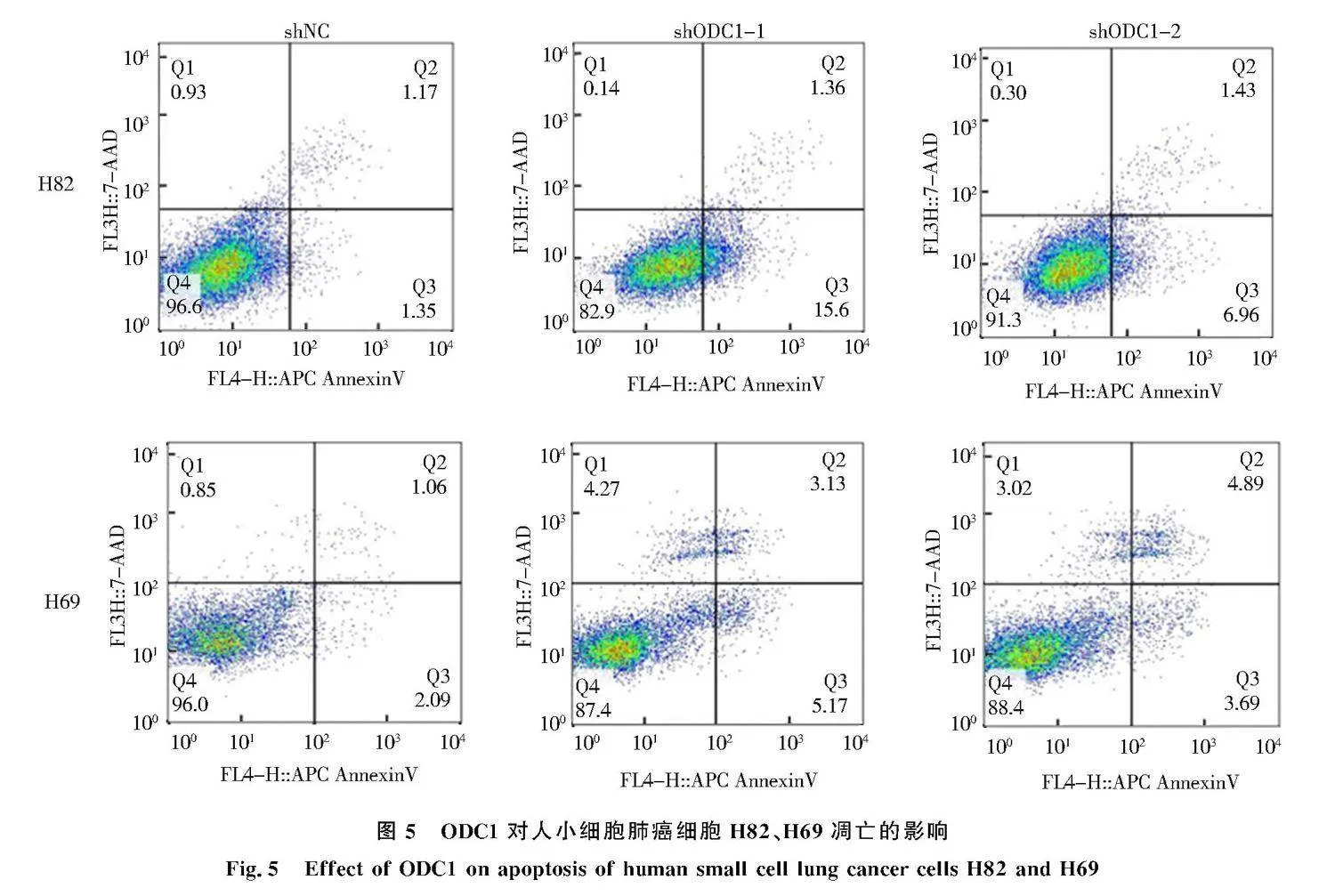
2.5" 下调ODC1对H82、H69细胞凋亡的影响
流式细胞术检测细胞凋亡.结果显示,与对照组相比,实验组H82-shODC1-1、H82-shODC1-2、H69-shODC1-1、H69-shODC1-2的凋亡细胞显著增加(P<0.001,图5),表明下调ODC1促进人SCLC细胞H82、H69凋亡.
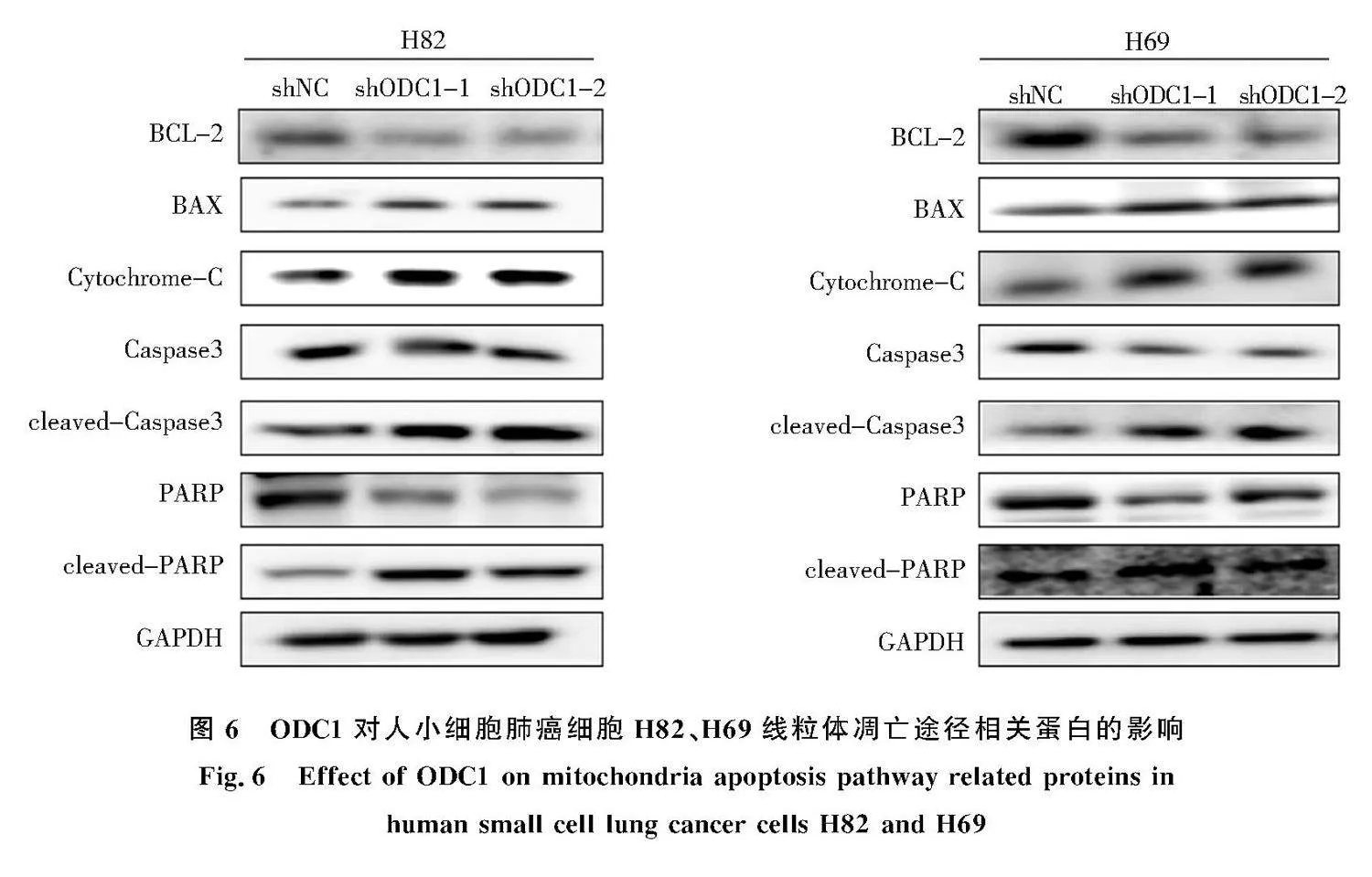
2.6" 下调ODC1对H82、H69细胞凋亡途径的影响
Western blot结果显示:下调ODC1后线粒体凋亡途径Caspase通路相关的抗凋亡蛋白BCL-2、Caspase、PARP表达下调,促凋亡蛋白BAX表达上调,Cytochrome-C,cleaved-Caspase3,cleaved-PARP
也显著上调(图6),表明下调ODC1通过激活线粒体介导的Caspase凋亡途径诱导人小细胞肺癌细胞H82、H69凋亡.
2.7" 下调ODC1对H82、H69细胞分裂周期的影响
Western blot结果显示:下调ODC1后,与对照组相比,实验组H82-shODC1-1、H82-shODC1-2细胞Cyclin B1表达上调,Cyclin A2、CDK2表达下调,表明细胞阻滞于G2/M期;与对照组相比,实验组H69-shODC1-1、H69-shODC1-2细胞Cyclin D1、CDK2表达上调,Cyclin E1表达下调,表明细胞阻滞于G1期(图7).
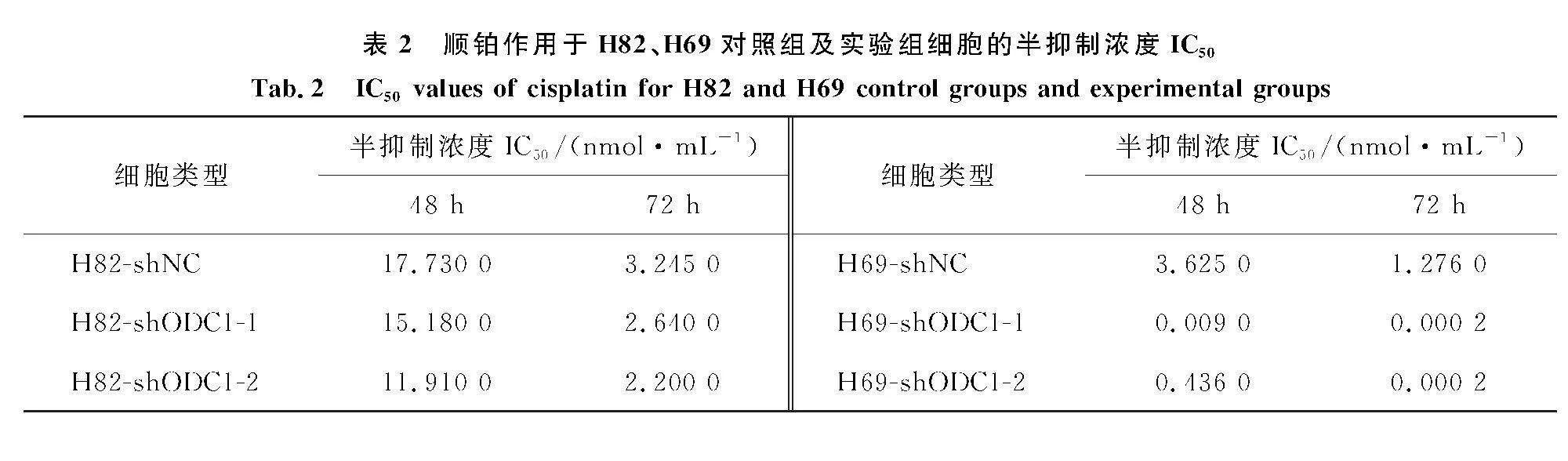
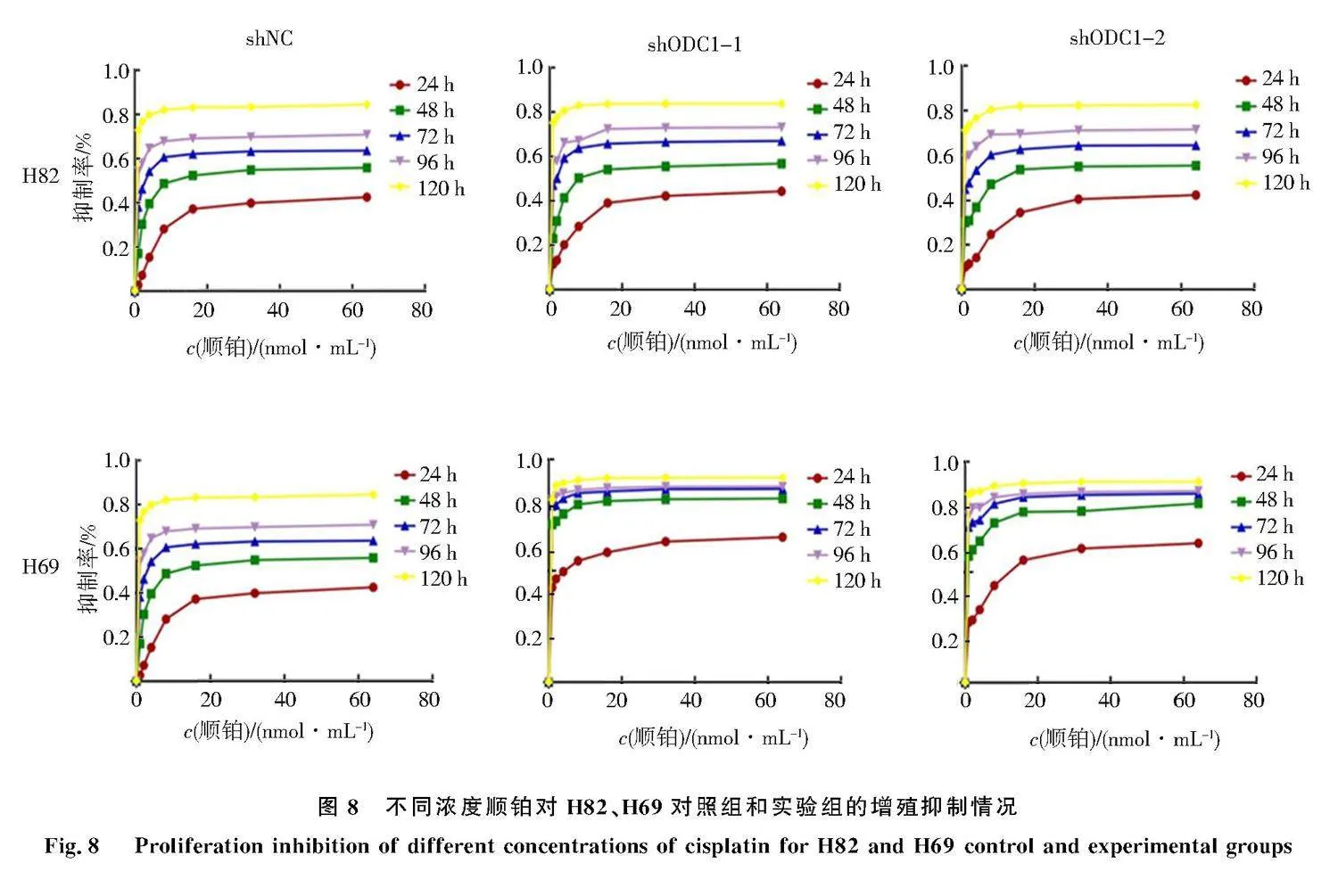
2.8" 下调ODC1对H82、H69细胞铂类药物敏感性的影响
使用不同浓度顺铂处理慢病毒感染的人SCLC细胞,结果如图8和表2.与对照相比,实验组H82-shODC1-1、H82-shODC1-2、H69-shODC1-1、H69-shODC1-2经不同浓度顺铂处理后细胞的药物敏感性增强,且呈现明显的时间依赖性,尤其是H69细胞,表明下调ODC1增强了人SCLC细胞H82、H69对铂类药物的敏感性.
3" 讨论
正常生理状态下,多胺通过静电作用与细胞内含有多价阴离子的大分子化合物结合,从而促进生物体复制、转录和翻译等生物过程,为细胞的存活与增殖提供物质基础[2].大量研究表明,肿瘤的发生发展与多胺代谢异常密切相关[7].ODC基因包括ODC1和ODC2,ODC1定位于2p25.1,普遍存在于生物体内,是多胺生物合成过程中的关键酶之一.据报道,ODC1的高表达与多种肿瘤的发生发展密切相关:Hogarty等[8]研究表明,在神经母细胞瘤细胞系中敲低ODC1基因的表达可抑制癌细胞增殖;此外多胺拮抗剂疗法可抑制神经母细胞瘤的发生和进展[9];在一项60例子宫内膜癌患者的队列研究中使用定量实时聚合酶链反应(qRT-PCR)证实,ODC1表达升高可导致子宫内膜癌PFS(无进展生存期)缩短[10];ODC1可作为前列腺癌组织诊断的上皮特异性生物标记物[11],另有相关文献报道[12],ODC1可用于评估人类前列腺癌的侵袭性.本研究发现,ODC1在SCLC细胞系中多数高表达,下调ODC1后抑制SCLC细胞增殖,引发细胞周期阻滞,诱导细胞凋亡,增加细胞的药物敏感性.
Ye等[13]发现ODC1在人肝细胞癌(HCC)组织和细胞系中表达上调,体外降低ODC1的表达可抑制HCC细胞的增殖、迁移、侵袭,诱导细胞周期阻滞,并且可通过调控AKT/GSK3β/β-catenin通路及其相关下游蛋白,逆转肿瘤酸性微环境导致的不良影响;此外敲低ODC1也可通过降低HCC细胞中的脂质代谢而抑制肿瘤生长[14].本研究中发现,下调ODC1的表达后,人SCLC细胞H82、H69增殖能力和单细胞克隆能力明显下降,说明ODC1高表达促进了人SCLC细胞H82、H69的增殖,进而影响肿瘤的发生发展.ODC1过度表达可引起细胞内腐胺水平升高,从而抑制甲基汞诱导的线粒体功能障碍相关性细胞凋亡[15];ODC1可减弱巨噬细胞参与的炎症反应,并抑制ROS诱导的巨噬细胞的凋亡[16],这使得ODC1成为潜在治疗靶点.本研究中下调ODC1后,人SCLC细胞H82、H69凋亡明显增加,又进一步检测了细胞凋亡的内部线粒体介导的Caspase信号通路相关蛋白,结果显示,实验组细胞抗凋亡蛋白BCL-2表达下调,促凋亡蛋白BAX及Cytochrome C、cleaved-Caspase3、cleaved-PARP表达上调,说明下调ODC1可以依赖内源性线粒体途径诱导SCLC细胞H82、H69凋亡.本研究进一步检测了下调ODC1后人SCLC细胞周期的变化,结果显示H82实验组细胞Cyclin B1表达上调,Cyclin A2表达下调,H69实验组细胞Cyclin D1表达上调,Cyclin E1表达下调,表明H82、H69细胞分别阻滞于G2/M期与G1期.另外,三阴性乳腺癌(TNBC)患者样本中ODC1表达水平升高,使用ODC1抑制剂二氟甲基鸟氨酸(DFMO)治疗可使TNBC对化疗的敏感性增强,提示ODC1可能是TNBC患者的一种靶向治疗敏感点[17],本研究使用不同浓度顺铂处理对照组及实验组细胞,发现下调ODC1增强了SCLC细胞H82、H69对铂类药物的敏感性,表明靶向ODC1可能提高小细胞肺癌的化疗效果.
ODC1是生物体内多胺代谢过程中的关键酶,而肿瘤的发生发展与多胺代谢异常密切相关,本研究内容还需进一步地深入探讨,旨在为今后SCLC的诊断、预后及靶向治疗提供新的研究思路和方向.
参" 考" 文" 献:
[1]" SUNG H, FERLAY J, SIEGEL R L,et al.Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA A Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660.
[2]" 刘贤锡.多胺代谢与肿瘤治疗[J].山东大学学报(医学版),2011,49(10):67-72.
[3]" MILLER-FLEMING L,OLIN-SANDOVAL V, CAMPBELL K,et al. Remaining mysteries of molecular biology: the role of polyamines in the cell[J]. J Mol Biol, 2015, 427(21): 3389-3406. DOI:10.1016/j.jmb.2015.06.020.
[4]" KARLSSON A, HELOU K, WALENTINSSON A, et al. Amplification of Mycn, Ddx1, Rrm2, and Odc1 in rat uterine endometrial carcinomas[J]. Genes Chromosomes Cancer, 2001,31(4):345-356. DOI:10.1002/gcc.1153.
[5]" NILSSON J A, KELLER U B, BAUDINO T A,et al. Targeting ornithine decarboxylase in Myc-induced lymphomagenesis prevents tumor formation[J]. Cancer Cell, 2005,7(5): 433-444. DOI:10.1016/j.ccr.2005.03.036.
[6]" LAM SK, U KP, L YY,et al. Inhibition of ornithine decarboxylase 1 facilitates pegylated arginase treatment in lung adenocarcinoma xenograft models[J]. Oncol Rep,2018,40(4):1994-2004. DOI:10.3892/or.2018.6598.
[7]" HOLBERT C E, CULLEN M T, CASERO R A,et al. Polyamines in cancer: integrating organismal metabolism and antitumour immunity[J]. Nat Rev Cancer, 2022, 22(8): 467-480. DOI:10.1038/s41568-022-00473-2.
[8]" HOGARTY D, NORRIS, DAVIS,et al. ODC1 is a critical determinant of MYCN oncogenesis and a therapeutic target in neuroblastoma[J]. Cancer Res, 2008, 68(23): 9735-9745. DOI:10.1158/0008-5472.can-07-6866.
[9]" EVAGELIOU N F, HABER M, VU A,et al. Polyamine antagonist therapies inhibit neuroblastoma initiation and progression[J]. Clin Cancer Res, 2016, 22(17):4391-4404. DOI: 10.1158/1078-0432.ccr-15-2539.
[10]" KIM H I, SCHULTZ C R, BURAS A L,et al. Ornithine decarboxylase as a therapeutic target for endometrial cancer[J]. PLoS One,2017,12(12): e0189044. DOI:10.1371/journal.pone.0189044.
[11]" SYMES A J,EILERTSEN M,MILLAR M,et al. Quantitative analysis of BTF3, HINT1, NDRG1 and ODC1 protein over-expression in human prostate cancer tissue[J]. PLoS One, 2013,8(12): e84295. DOI:10.1371/journal.pone.0084295.
[12]" KAUL D, WU C L, ADKINS C B,et al.Assessing prostate cancer growth with mRNA of spermine metabolic enzymes[J]. Cancer Biol Ther, 2010,9(9):736-742. DOI:10.4161/cbt.9.9.11549.
[13]" YE Z, ZENG Z, SHEN Y,et al. ODC1 promotes proliferation and mobility via the AKT/GSK3β/β-catenin pathway and modulation of acidotic microenvironment in human hepatocellular carcinoma[J]. Onco Targets Ther," 2019,12: 4081-4092. DOI:10.2147/ott.s198341.
[14]" CHOI Y, OH S T, WON M A,et al. Targeting ODC1 inhibits tumor growth through reduction of lipid metabolism in human hepatocellular carcinoma[J]. Biochem Biophys Res Commun, 2016, 478(4): 1674-1681. DOI: 10.1016/j.bbrc.2016.09.002.
[15]" SATO M,TOYAMA T, KIM M S,et al. Increased putrescine levels due to ODC1 overexpression prevents mitochondrial dysfunction-related apoptosis induced by methylmercury[J]. Life Sci, 2020, 256: 118031. DOI:10.1016/j.lfs.2020.118031.
[16]" JIANG F, GAO Y, DONG C,et al. ODC1 inhibits the inflammatory response and ROS-induced apoptosis in macrophages[J]. Biochem Biophys Res Commun, 2018, 504(4): 734-741. DOI:10.1016/j.bbrc.2018.09.023.
[17]" GECK R C, FOLEY J R, MURRAY STEWART T,et al. Inhibition of the polyamine synthesis enzyme ornithine decarboxylase sensitizes triple-negative breast cancer cells to cytotoxic chemotherapy[J]. J Biol Chem, 2020,295(19):6269-6277. DOI:10.1074/jbc.RA119.012376.
(责任编辑:赵藏赏)

