敌草胺对油菜抗氧化酶活性及相关基因表达的影响
周敏 王富豪 张明浩 刘子琪 郭靖华 郝培培 程有普


摘 要 除草剂药害严重影响油菜产量,研究筛选预防药害发生的生物标记物,结合植物生长调节剂的药害缓解机制,可有效解决油菜田敌草胺的药害问题。以盆栽油菜为材料,研究敌草胺处理后抗氧化酶活性及相关基因表达的变化规律,探究赤·吲乙·芸苔的药害缓解机制。结果显示过氧化物酶(POD)反应最灵敏, 1.2 g/L敌草胺处理12 h酶活达到最高值;2.4 g/L敌草胺能够显著诱导油菜GST基因较对照6.4倍的高表达。4.8 g/L和6.0 g/L敌草胺处理48 h,叶片内SOD、POD、CAT活性和相关基因表达量显著低于对照,氧化损伤严重。喷施0.1 mg/L赤·吲乙·芸苔,能激活低浓度(1.2 g/L、2.4 g/L)敌草胺胁迫的油菜抗氧化系统,解除药害影响。综上,敌草胺对油菜抗氧化酶活性和相关基因表达整体呈低浓度促进高浓度抑制,先升高后降低的趋势。2.4 g/L敌草胺接近油菜受害的临界浓度,POD可用于药害发生的早期预警。喷施 0.1 mg/L赤·吲乙·芸苔可较好的缓解敌草胺产生的轻度药害。
关键词 敌草胺;油菜;抗氧化酶;基因表达
油菜(Brassica napus L.)是中国第一大油料作物,用途广,具有重要的经济价值。在栽植过程中,油菜受杂草危害严重。人们为了克服杂草抗药性往往加大农药用量,导致油菜药害事件频发,严重危害油菜的产量和质量[1]。敌草胺(napropamide)是一类酰胺类除草剂,杀草活性高,广泛应用于油菜田1 a生单子叶杂草和部分阔叶杂草的防除[2]。研究敌草胺对油菜产生的药害及其缓解机制对油菜安全生產意义重大。
常规剂量下喷施除草剂,作物表面一般不会显现明显的药害症状,但其生理生化指标,如抗氧化酶活性,往往会发生显著变化[3]。研究发现,植物在受到农药胁迫后,体内会产生大量的活性氧(reactive oxygen species,ROS),引发生理生化和相关基因表达量的各种变化以获得适应性[4]。但当活性氧积累达到一定阈值,将导致膜脂过氧化作用加剧,造成植物体的氧化损伤[5]。植物体内有一套负责清除活性氧产生的抗氧化系统,其中超氧化物歧化酶(SOD)负责催化O2-发生歧化反应形成H2O2和O2-;过氧化物酶(POD)不但可以利用NAPDH等电子供体,生成H2O2,还能直接参与H2O2的清除;过氧化氢酶(CAT)则是进一步将H2O2转化为H2O[6]。SOD、CAT基因是一类“抗氧化保护基因”,由多种基因编码组成,可通过改变抗氧化酶活性来调节氧化应激损伤[7],研究抗氧化酶基因的表达量变化更有助于揭示农药对作物本身的毒性机制。Wu等[8]研究发现敏感品种的甜玉米SOD、CAT、 POD活性随着除草剂烟嘧磺隆的暴露时间延长而显著降低,而抗性品种的SOD和CAT基因在烟嘧磺隆诱导下显著上调。魏婧等[9]认为原初逆境造成细胞ROS积累,其通过信号传导途径调节抗氧化基因的表达,从而增强了植物对次生逆境的抗逆性。植物抗氧化系统应激能力可以在组织中调控谷胱甘肽解毒酶(GST)基因的表达[10]。GST是一类具有抗氧化和解毒等多重功能的超家族蛋白酶,其催化的谷胱甘肽(GSH)轭和反应在植物的解毒过程中起着至关重要的作用[11-12]。谷胱甘肽还原酶(GR)通过参与ASA-GSH循环,催化GSSG还原为GSH,使植物细胞重要的两种非酶抗氧化剂抗坏血酸和谷胱甘肽再生,进一步参与植物应对氧化胁迫的响应[13]。生物标记物被广泛应用于医学和动物学领域[14-15],在植物上少见报道。实际上,当作物遭受农药胁迫时,也可以通过测定其体内抗氧化酶活性的变化,选择反应较为灵敏的酶,将其作为植物出现药害前的敏感标记物[16-17],指导农药安全使用。植物生长调节剂具有增强植物抗逆性,缓解药害的作用。Wang等[18]研究发现油菜素内脂通过诱导GST和GR的活力,提高解毒酶相关基因的表达,加速了农药在番茄体内的降解。赤·吲乙·芸苔是一种新型植物生长调节剂,含有30多种天然植物内源激素和活性物质,被广泛应用于大田、油菜等,以改善作物品质增加产量,解除药害,然而其作用机制仍不清楚[19-21]。
以白菜型油菜‘三月黄为试验材料,通过盆栽试验并模拟田间飘移药害,观察、记录油菜出现药害前后的浓度及症状,同时比较喷施赤·吲 乙·芸苔后的植株生长情况和生理指标变化,深入研究不同浓度敌草胺对油菜苗期的抗氧化酶活性和相关基因表达的影响。筛选出油菜体内对敌草胺反应较灵敏的酶,作为敌草胺药害的生物标记物,为敌草胺的安全使用及药害解除提供数据 支持。
1 材料与方法
1.1 试验材料
油菜供试品种为‘三月黄,由河南郑州金阳光种子有限公司提供。供试农药为50%敌草胺WP,由江苏快达农化股份有限公司生产; 0.136%赤·吲乙·芸苔WP,由德国阿格福莱农林环境生物技术股份有限公司生产。
1.2 试验设计
油菜种植采用穴盆育苗,盆直径15 cm,培养箱内常规管理,培养箱周期设置:光照12 h,光照度600 lx,温度25 ℃,相对湿度50%;黑暗12 h,温度20 ℃,相对湿度65%。待油菜长到二叶一心时移栽至苗盆,为模拟农业生产中油菜出现明显飘移药害的症状,在油菜移栽成活后用手提式喷雾器茎叶喷施不同质量浓度[0、0.6、1.2(推荐剂量)、2.4、4.8、6.0 g/L]敌草胺。1 d后喷施 0.1 mg/L(根据预试验结果确定该浓度下缓解效果较好)赤·吲乙·芸苔。分别于单独喷施敌草胺和同时处理了敌草胺和赤·吲乙·芸苔后 12 h、24 h、48 h、3 d、5 d、7 d取样,液氮预冻后置于-80 ℃冰箱保存待测。试验每个处理(含空白对照)设3次重复。
1.3测定项目及方法
1.3.1 安全性观察 按照药害程度,可将油菜药害分为轻度、中度、重度,轻度药害主要表现为局部颜色变化,经过一段时间可自行恢复,产量损失少;中度药害则会阻碍植株正常生长,叶片有畸形,植株矮小等;重度药害可严重抑制植株生长,叶片枯萎,死苗等[22]。喷施敌草胺后定时观察油菜叶片的药害症状,是否出现死苗,叶片畸形等,并观察喷施赤·吲乙·芸苔后油菜的药害缓解症状,做好相关记录。
1.3.2 酶活性测定 称取油菜叶片0.5 g放入研钵中,加入2 mL预冷的pH为7.4(0.05 mol/L)的磷酸缓冲液,冰浴研磨,4 ℃下冷冻离心 (3 500 r/min)15 min,取上清液用于酶活力测定。使用试剂盒(南京建成)和酶标仪(Epoch,美国)进行酶活性测定。丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法,测定532 nm下OD值。超氧化物歧化酶(SOD)以每克组织在1 mL反应液中SOD抑制率达50%时所对应的量为1个活力单位(U)。过氧化物酶(POD)在37 ℃条件下,每克组织每分钟催化1 μg底物的酶量定义为1个酶活力单位(U)。过氧化氢酶(CAT)以每毫克组织每秒钟分解1 μmol的H2O2为1个活力单位(U)。谷胱甘肽解毒酶(GST)规定每毫克组织在37 ℃反应1 min(扣除非酶促反应),使反应体系中GSH浓度降低1 μmol/L为1个酶活力单位(U)。谷胱甘肽还原酶(GR)规定每克组织每分钟使反应体系中底物NADPH的浓度改变 1 mmol所需的酶量为1个酶活力单位(U)。
1.3.3 基因表达量测定 称取0.5 g油菜叶片放置在提前预冷的研钵中,加入1 mL RNAiso Plus(TaKaRa,日本)研磨至粉末状,提取RNA,并用微量分析仪测定RNA的浓度。采用PrimeScriptTM RT reagent Kit试剂盒(TaKaRa,日本)进行反转录合成cDNA。反转录反应条件如下:37 ℃孵育15 min,85 ℃孵育5 s,最后4 ℃孵育10 min后放入-20 ℃冰箱保存,备用。qPCR采用TB GreenTM Premix Ex TaqTM II 荧光定量试剂盒(TaKaRa,日本)测定,反应条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,40个循环。使用实时荧光定量PCR仪(qTOWER-2.2,德国)进行荧光定量分析,基因相对表达量采用2-△△Ct相对定量法。试验均为3次重复的结果。用于基因扩展的特异引物来自于莫江楠[23]和吴静雪[24],以油菜actin为内参基因,引物序列如表1所示。
1.4 数据统计与分析
使用Excel 2016软件处理数据制图,用SPSS 26.0软件对数据进行方差分析。
2 结果与分析
2.1 敌草胺对油菜幼苗的安全性分析
药害观察结果如图1所示,不同质量浓度敌草胺对油菜的药害程度不同,浓度越高,药害症状越明显。0.6 g/L和1.2 g/L敌草胺处理7 d内,油菜安全,未出现任何药害症状。喷施2.4 g/L敌草胺后24 h,油菜会产生症状不明显的轻微药害,如叶片稍卷曲。4.8 g/L敌草胺处理植株生长矮小,叶片卷曲黄化严重;6.0 g/L处理组的油菜植株药害严重,心叶皱缩、株型松散矮化,部分植株凋萎。
2.2 敌草胺对油菜抗氧化酶活性的影响
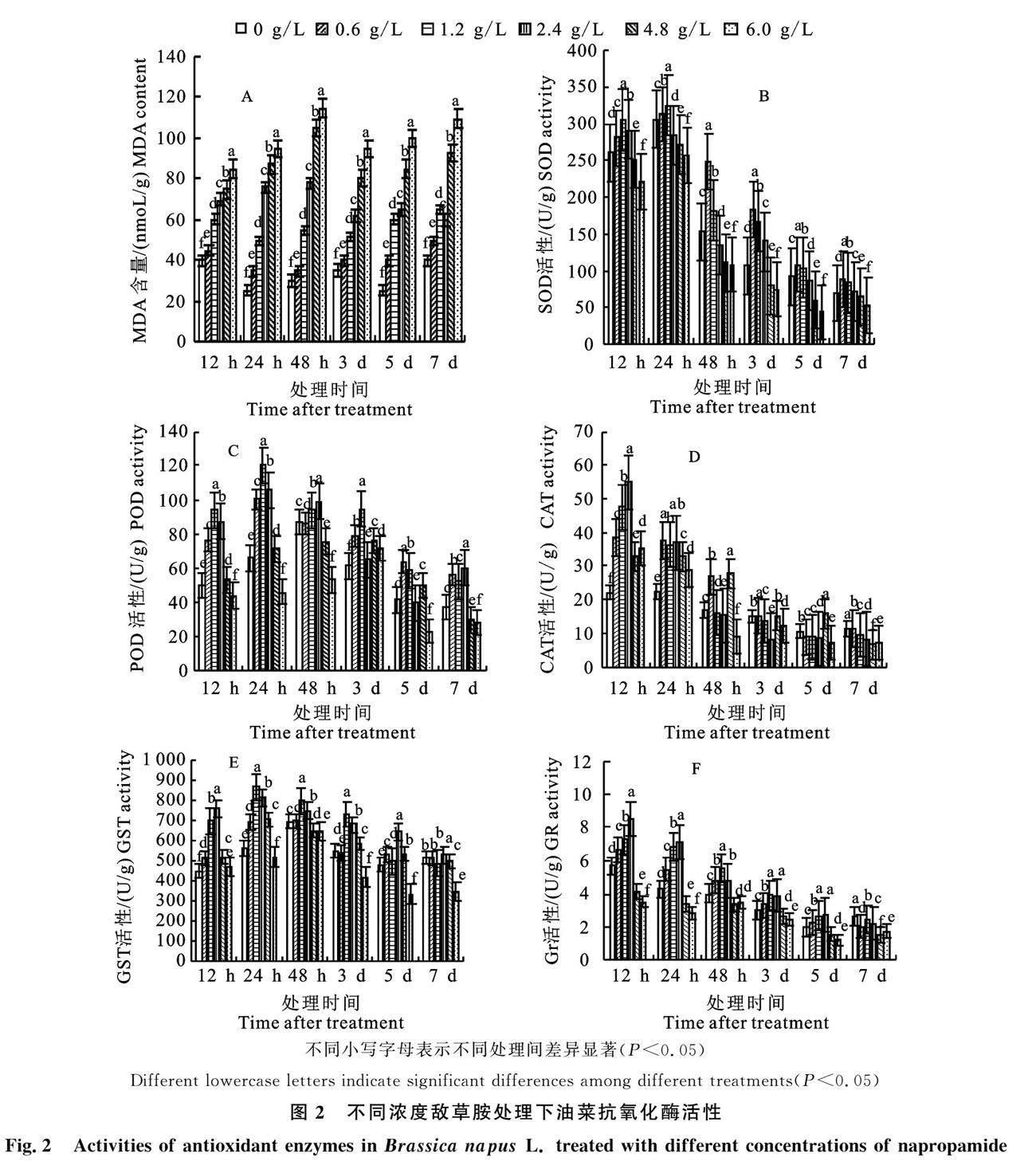
丙二醛(MDA)含量可以反应细胞受自由基危害的的严重程度,MDA含量越高,表示细胞膜脂过氧化损伤越严重。如图2-A所示,药后 12 h,不同浓度敌草胺处理的油菜叶片MDA含量均高于对照水平;药后48 h,6 g/L处理达到最高值,比对照组高出2.8倍;药后3 d,0.6、1.2和 2.4 g/L敌草胺处理MDA含量开始下降;药后 7 d,4.8和6.0 g/L处理MDA含量仍明显高于对照水平,分别是对照的2.33倍和2.75倍。
由图2-B可知,药后12 h,1.2和2.4 g/L敌草胺处理SOD活性分别较对照高出17.29%和11.96%,药后24 h达到最高值,说明此时油菜应激反应最强烈。药后48 h,不同浓度敌草胺处理SOD活性均開始下降。图2-C所示,1.2 g/L敌草胺处理的油菜POD活性在喷药当天显著高于其他浓度处理组,且在药后24 h达到最大值,比对照高出88.26%,说明此时POD被显著激活。药后48 h,0.6和1.2 g/L浓度处理组POD活性接近对照,而4.8和6.0 g/L处理明显低于对照,分别比对照低13.19%和38.97%,说明此时油菜POD活性受到抑制。不同浓度敌草胺处理12 h后,油菜叶片CAT活性均明显高于对照,2.4 g/L处理组达到最高值,为对照2.5倍。药后 24 h,CAT开始下降。药后48 h,0.6和4.8 g/L处理仍明显高于对照,而6.0 g/L敌草胺处理组CAT活性明显低于对照水平(图2-D)。
图2-E显示1.2和2.4 g/L敌草胺处理12 h后,显著激活了油菜叶片的GST活性,药后24 h达到最大值。4.8 g/L浓度处理下,GST活性呈先增高后下降的趋势,7 d后趋于对照。药后 12 h,2.4 g/L敌草胺处理的油菜叶片GR活力达到最高值,而4.8和6.0 g/L处理明显低于对照,分别减少了27.64%和38.69%,说明高浓度敌草胺胁迫抑制了油菜体内的GR活性(图2-F)。
2.3 敌草胺对油菜抗氧化酶基因表达量的影响
为进一步研究油菜响应敌草胺胁迫的分子机制,探究抗氧化酶基因和酶活性之间的关系,对3个抗氧化酶(braSOD、braPOD、braCAT)基因和1个解毒酶(GST)基因进行基因表达量分析,结果如图3所示。喷施敌草胺后12 h,0.6、1.2和2.4 g/L浓度处理的油菜叶片的不同抗氧化酶基因表达量均明显上调。2.4 g/L处理的braSOD和braPOD基因表达量分别在药后24 h和3 d达到最高值,分别是对照的2.7倍和5.4倍。7 d内,6.0 g/L处理的braSOD和braPOD基因表达量均明显低于对照,说明高浓度敌草胺抑制了油菜的基因表达。如图3-D所示,不同浓度敌草胺胁迫12 h后就强烈地诱导了油菜叶片GST基因的表达,0.6 g/L处理GST基因表达量是对照的2.7倍;药后24 h,2.4 g/L敌草胺胁迫的油菜GST基因表达量达到最高值,是对照的6.4倍。药后48 h,不同浓度处理的GST基因表达量仍明显高于对照。
2.4 赤·吲乙·芸苔对油菜的药害缓解效果
如图4所示,喷施赤·吲乙·芸苔后24 h, 2.4 g/L敌草胺处理组药害症状消失,植株长势良好。4.8 g/L处理的部分植株药害症状减轻;而药害发生严重的6.0 g/L敌草胺处理油菜不能恢复正常生长状态,仍有部分植株死亡。
如图5-A所示,喷施赤·吲乙·芸苔后,对不同浓度敌草胺处理的油菜膜脂过氧化缓解作用不同,0.6、1.2和2.4 g/L浓度敌草胺处理的MDA含量与喷施清水的对照组相近,但低于单独喷施敌草胺的处理组,且敌草胺浓度越高,下降幅度越明显;4.8和6.0 g/L处理的MDA含量仍高于对照水平,这表明赤·吲乙·芸苔对1.2和2.4 g/L敌草胺胁迫下油菜的膜脂过氧化缓解效果良好。
图5-B显示,喷施赤·吲乙·芸苔后12 h, 0.6和1.2 g/L敌草胺处理的SOD活性接近于对照,而2.4和4.8 g/L处理明显高于对照,分别比对照高出77.67%和42.75%。药后48 h,各处理组SOD活性接近于对照,而6.0 g/L处理仍低于对照,说明赤·吲乙·芸苔的加入降低了0.6和1.2 g/L敌草胺处理下油菜叶片的SOD活性,激活了2.4和4.8 g/L浓度处理组的SOD活性,而对6.0 g/L浓度处理的影响不大。喷施赤·吲乙·芸苔后12 h,各处理组的POD活性均高于对照,其中2.4 g/L处理比对照高94.61%。药后3 d,4.8 g/L敌草胺处理POD活性达到最高值,比对照高出1.4倍(图5-C)。4.8和6.0 g/L敌草胺处理在喷施赤·吲乙·芸苔后12 h分别是对照的3倍和4倍,药后48 h,6.0 g/L敌草胺处理的CAT活性开始下降,直到第5天始终低于对照(图5-D)。
喷施赤·吲乙·芸苔后12 h,油菜叶片的GST和GR活性均明显被激活,6.0 g/L敌草胺处理的GST和GR活性分别是对照的3.4倍和4.7倍。药后24 h,4.8 g/L敌草胺处理GST活性达到最高,是对照的2.7倍(图5-E)。药后 3 d,6.0 g/L处理组GR活性仍明显高于对照值(图5-F)。
如图6所示,喷施赤·吲乙·芸苔后7 d内,2.4 g/L等浓度处理的braSOD、braPOD、braCAT基因表达量继续上调;而6.0 g/L敌草胺的braSOD基因表达量始终低于对照值,braPOD基因表达量则在药后24 h达到最大值,是对照的4.7倍。喷施赤·吲乙·芸苔后48 h(图4-D), 2.4和4.8 g/L处理的GST基因表达量达到最高值,分别是对照的7.7倍和10.9倍。药后3 d,不同浓度敌草胺处理的GST基因表達量仍明显高于对照。
3 讨论与结论
植物在应对外界污染物胁迫的过程中,自身产生了一套复杂的解毒机制,当生物体内存在大量由于毒性胁迫造成的ROS时,为了防止受损严重的细胞复制,抗氧化酶基因的表达会受到刺激而维持在很低的水平[25]。本试验结果显示,braSOD基因和braCAT基因在较低浓度(0.6和 1.2 g/L)敌草胺处理下明显上调,表明油菜受到氧化胁迫诱导抗氧化酶基因表达,激活了抗氧化防御系统。但在高浓度(6.0 g/L)敌草胺处理7 d内,油菜叶片braSOD基因表达量始终低于对照,这可能是因为油菜发生了严重的药害,抑制了SOD的酶活性,导致braSOD基因表达受到抑制。Cui等[26]研究发现,在敌草胺胁迫下,外源水杨酸的加入显著降低SOD、CAT活性,激活POD、GST、GR等活性。但本研究结果显示,喷施赤·吲乙·芸苔后,中高浓度(2.4、4.8 g/L)敌草胺处理的SOD、POD和CAT活性明显升高,同时braSOD、braCAT和braPOD基因均不同程度继续上调,说明赤·吲乙·芸苔可以通过诱导油菜相关抗氧化酶基因的表达来调控抗氧化酶活性,在一定程度上激活油菜的保护酶系统。但6.0 g/L敌草胺高浓度处理后,油菜药害严重,活性氧积累超出了植株本身的抗氧化系统清除能力,酶活性受到抑制,细胞受损,无法恢复到正常状态。相比之下,施用赤·吲乙·芸苔后,0.6和1.2 g/L敌草胺处理的抗氧化酶活性和对照组差异很小,这说明施用赤·吲乙·芸苔能够在一定程度上缓解敌草胺对油菜的胁迫,这对敌草胺在生产中的科学使用有重要指导意义:使用敌草胺除草时可以考虑混用适量赤·吲乙·芸苔,以提高作物的安全性。
另外,本研究显示,5种浓度处理下,2.4 g/L处理酶活变化趋势最明显。2.4 g/L敌草胺处理下加入赤·吲乙·芸苔,油菜GST基因表达量和对照接近,表明赤·吲乙·芸苔的加入在一定程度上中和了敌草胺的氧化胁迫;而4.8 g/L敌草胺胁迫下,赤·吲乙·芸苔的加入表现为促进了油菜GST基因的表达。本研究结果表明,该浓度处理下,油菜发生了强烈的应激反应,预示着2.4 g/L敌草胺对油菜具有潜在毒害,因此当敌草胺的施用浓度超过2.4 g/L时,必须考虑对油菜的安全性。
本试验中,高浓度(4.8、6.0 g/L)敌草胺胁迫导致油菜细胞受损;赤·吲乙·芸苔通过降低MDA含量,调节油菜的膜脂过氧化作用,减轻敌草胺对油菜的细胞损伤,使植株恢复正常生长状况。低浓度(0.6、1.2 g/L)敌草胺处理下,油菜的SOD、POD、CAT均被显著激活。其中,POD反应最灵敏,1.2 g/L处理12 h酶活就达到最高值;而SOD虽然也达到最高值,但趋势不如POD明显;而相同时间内,CAT酶活性升到最高值所需的浓度更高(2.4 g/L)。综合比较,POD最适合作为油菜出现敌草胺药害前的生物标记物。
综上所述,不同浓度敌草胺对油菜的抗氧化酶活性和相关基因表达整体呈现低浓度促进高浓度抑制的趋势,2.4 g/L是临界浓度,对油菜具有潜在药害,生产中需格外重视。POD酶反应最灵敏,可以作为敌草胺药害发生前的敏感生物标记物。喷施赤·吲乙·芸苔对2.4 g/L敌草胺胁迫的药害缓解效果最佳。
参考文献 Reference:
[1] 李香菊. 近年我国农田杂草防控中的突出问题与治理对策[J].植物保护,2018,44(5):77-84.
LI X J. Main problems and management strategies of weeds in agricultural fields in China in recent years[J].Plant Protection,2018,44(5):77-84.
[2] 罗 跃,黄文源,刘旭东,等.除草剂敌草胺的环境毒理学研究进展[J].现代农药,2021,20(2):1-6.
LUO Y,HUANG W Y,LIU X D,et al. Advances in environmental toxicology of herbicide napropamid[J]. Modern Agrochemicals,2021,20(2):1-6.
[3] 李海峰,王瑞华,韩 琛.农药胁迫对植物抗氧化系统的研究现状[J].农产品加工,2018(2):59-62.
LI H F,WANG R H,HAN CH. The research status of pesticide stress to antioxidant system in plants[J].Farm Products Processing,2018(2):59-62.
[4] GAAFAR R M,OSMAN M E-A H,ABO-SHADY A M, et al. Role of antioxidant enzymes and glutathione S-transferase in bromoxynil herbicide stress tolerance in wheat plants[J].Plants, 2022,11:2679.
[5] BOWLER C,MONTAGU M V,INZE D. Superoxide dismutase and stress tolerance[J].Annual Review of Plant Physiology and Plant Molecular Biology,1992,43(1):83-116.
[6] MITTLER R,VANDERAUWERA S,GOLLERY M, et al. Reactive oxygen gene network of plants[J]. Trends Plant Science,2004,9(10):490-498.
[7] CHEN C,ZHOU Q,LIU S,et al. Acute toxicity,biochemical and gene expression responses of the earthworm Eisenia fetida exposed to polycyclic musks[J]. Chemosphere,2011,83(8):1147-1154.
[8] WU Z X,XU N W,YANG M,et al. Responses of photosynthesis,antioxidant enzymes,and related gene expression to nicosulfuron stress in sweet maize(Zea mays L.) [J]. Environmental Science and Pollution Research,2022,29:37248-37265.
[9] 魏 婧,徐 暢,李可欣,等.超氧化物歧化酶的研究进展与植物抗逆性[J].植物生理学报,2020,56(12):2571-2584.
WEI J,XU CH,LI K X,et al. Progress on superoxide dismutase and plant stress resistance[J]. Plant Physiology Journal,2020,56(12):2571-2584.
[10] HAYES J D,STRANGE R C. Invited commentary potential contribution of the glutathione S-transferase supergene family to resistance to oxidative stress[J].Free Radical Research,1995,22(3):193-207.
[11] DIXON D P,LAPTHORN A,EDWARDS R. Plant glutathione transferases[J].Gluthione Transferases and Gamma-glutamy Transpeptidases,2005,400:169-186.
[12] ROUHIER N,LEMAIRE S D,JACQUOT J P. The role of glutathione in photosynthetic organisms:emerging functions for glutaredoxins and glutathionylation[J].Annual Review Plant Biology,2008,59(1):143-166.
[13] FOYER C H,LOPEZ-DELGADO H,DAT J F,et al. Hydrogen peroxide-and glutathione-associated mechanisms of acclimatory stress tolerance and signalling[J].Physiology Plant,1997,100(2):241-254.
[14] ARONSON J K,FERNER R E. Biomarkers-A general review[J].Current Protocols in Pharmacology,2017,76:17.https://doi.org/10.10021cpph.19
[15] MOLLENHAUER B,VON ARNIM C A F.Toward preventing Parkinsons disease[J].Science, 2022,377(6608):818-819.
[16] 王 艷,陈雁君,公茂礼,等.噻虫胺农药胁迫对小白菜过氧化物酶活性的影响[J].中国卫生检验杂志,2008, 18(12):2535-2536.
WANG Y,CHEN Y J,GONG M L,et al. Effect of clothianidin stress on activity of peroxydase of brassica chinensis[J]. Chinese Joumal of Health Laboratory Technology,2008,18(12):2535-2536.
[17] 张清智,陈振德,王文娇,等.毒死蜱胁迫对小白菜抗氧化酶活性和相关生理指标的影响[J].生态学报,2008, 28(9):4524-4530.
ZHANG Q ZH,CHEN ZH D,WANG W J,et al. Effects of chlorpyrifos stress on antioxidant enzyme activities and some related compound contents in pakchoi[J]. Acta Ecologica Sinica,2008,28(9):4524-4530.
[18] WANG J T,JIANG Y P,CHEN S C,et al. The different responses of glutathione-dependent detoxification pathway to fungicide chlorothalonil and carbendazim in tomato leaves[J]. Chemosphere,2010,79:958-965.
[19] THOMAS H. Growth and yield response of selected crops to treatment with Com Cat [D]. Republic of South Africa:University of the Free State,2011.
[20] 颜 刚.碧护植物生长调节剂在花生上的应用[J].辽宁农业科学,2018(3):82-83.
YAN G.Application of the plant growth regulator Bihu on the peanut[J]. Liaoning Agricultural Sciences,2018(3):82-83.
[21] 张 萌,武婷婷,崔 娟,等.碧护对几种常用大豆苗前除草剂药害的解除效果[J].大豆科技,2015(2):44-48.
ZHANG M,WU T T,CUI J,et al. Mitigation effect of VitCat on phytotoxicity to some soybean preemergent herbicides[J]. Soybean Science&Technology,2015(2):44-48.
[22] 俞满根.作物药害及其预防技术[J].江西植保,2001(4):134-135.
YU M G.Crop drug damage and its prevention techniques[J].Jiangxi Plant Protection,2001(4):134-135.
[23] 莫江楠. MeJA对低温下油菜幼苗生长及生理的影响[D]. 兰州:西北师范大学,2020.
MO J N. Effect of MeJA on Brassica rapa L. seedling growth and physiology under low temperature stress [D]. Lanzhou:Northwest Normal University,2020.
[24] 吴静雪.白菜对毒死蜱的生理和分子响应及缓解机制[D].杭州:浙江大学,2010.
WU J X. Physiological and molecular responses of Chinese cabbage to chlorpyrifos and its mitigation mechanism[D]. Hangzhou:Zhejiang University,2010.
[25] VAN EERD L L,HOAGLAND R E,ZABLOTOWICZ R M,et al. Pesticide metabolism in plants and microorganisms[J]. Weed Science,2003,51(4):472-495.
[26] CUI J,ZHANG R,WU G L,et al. Salicylic acid reduces napropamide toxicity by preventing oxidative damage to rapeseed(Brassica napus L.)[J]. Archives of Environmental Contamination and Toxicology,2010,59:100-108.
Effect of Napropamide on Activities of Antioxidant Enzymes and
Expression of Related Genes in Brassica napus L
ZHOU Min1,WANG Fuhao1,ZHANG Minghao1,LIU Ziqi1,
GUO Jinghua1,HAO Peipei2 and CHENG Youpu1
(1.College of Horticulture and Landscape,Tianjin Agricultural University,Tianjin 300392,China;
2.China Academy of Luheng Chemical Co.,Ltd.,Tianjin 300270,China)
Abstract Herbicide injury seriously affects the yield of rapeseed. The screening of early biomarkers for pesticide damage,combined with the application of plant growth regulators,can effectively mitigate pesticide injuries in rapeseed fields. In this study,potted rapeseed was chosen as experimental material,the patterns of antioxidant enzyme activity and related gene expression after napropamide treatment was investigated,and the mitigation mechanism of gibberellic acid·indol-3-ylacetic acid·brassinolide in response to pesticide injury was explored. The results showed that POD was the most sensitive parameter,with the highest enzyme activity at 12 h after 1.2 g/L treatment,88.26% higher than the control; 2.4 g/L napropamide significantly induced the GST gene expression of rapeseed,6.4-fold higher than the control. After 48 hours of treatment with 4.8 g/L and 6.0 g/L napropamide,the activities of SOD,POD,and CAT,as well as the expression of related genes,were significantly lower than those in the control group. However,oxidative damage was observed to be severe.Spraying 0.1 mg/L gibberellic acid·indol-3-ylacetic acid·brassinolide activated the antioxidant system of rapeseed stressed by napropamide at low concentrations(1.2,2.4 g/L) and alleviated the effects of the phytotoxicity. In conclusion,an generally low concentration of napropamide promots inhibitition of high concentration in the antioxidant enzyme activity and related gene expression in rapeseed,exhibiting an first increase followd by a subsequent decrease. The concentration of 2.4 g/L napropamide approaches the critical concentration for causing damage to rapeseed,and POD levels can be an early warning indicator for pesticide injuries. The spraying of 0.1 mg/L gibberellic acid·indol-3-ylacetic acid·brassinolide more effectively alleviates the mild damage caused by napropamdie.
Key words Napropamide; Brassica napus L; Antioxidant enzymes; Gene expression
Received 2023-02-24 Returned 2023-05-15
Foundation item The National Natural Science Foundation of China(No. 31572034);Tianjin Municipal Enterprise Science and Technology Special Envoy Project(No.19JCTPJC59000).
First author ZHOU Min,female,master student. Research area: agricultural pharmacology. E-mail: zhoumin_0915@163.com
Corresponding author CHENG Youpu,male,professor. Research area: agricultural pharmacology. E-mail: chengyoupu@tjau.edu.cn
(責任编辑:史亚歌 Responsible editor:SHI Yage)

