H2SO4-Fe2(SO4)3浸出铜精矿过程中铁形态转化研究
张明峂 罗仙平 李晓东 沈楼燕 赵红波

〔摘 要〕 H2SO4-Fe2(SO4)3浸出体系因其具有成本低、腐蚀性较低等特点,被广泛应用于铜精矿的浸出。由于溶液中Fe的形态变化决定着浸出工艺的经济效益,因此针对浸出液中不同条件下的铁形态进行了研究。研究表明,Fe3+与Fe2+之间的转化主要涉及电子转移,不会改变H+ 浓度;当浸出液pH值达到2时,会产生大量黄钾铁矾沉淀,并夹杂着质量分数为1.0%的Cu和质量分数为0.5%的Zn;当浸出液中Fe2+质量浓度超过46.5 g/L时,在常温下会产生FeSO4·7H2O结晶,并夹杂着质量分数为1.9%的Cu和质量分数为1.0%的Zn。
〔关键词〕铜精矿;H2SO4-Fe2(SO4)3浸出体系;浸出条件;硫酸铁;氧化
中图分类号:TF811;TF803.21 文献标志码:A 文章编号:1004-4345(2024)02-0001-04
Study on Iron Species Transformation in the Leaching of Copper Concentrate by H2SO4-Fe2(SO4)3
ZHANG Mingtong1, LUO Xianping2, LI Xiaodong3, SHEN Louyan4, ZHAO Hongbo1
(1. Central South University, Changsha, Hunan 410083, China; 2. Jiangxi University of Science and Technology, Ganzhou, Jiangxi 341099, China; 3. Hunan Research Institute for Nonferrous Metals, Changsha, Hunan 410100, China;
4. China Nerin Engineering Co., Ltd., Nanchang, Jiangxi 330038, China)
Abstract The H2SO4-Fe2(SO4)3 leaching system is widely used for the leaching of copper concentrate due to its low cost and low corrosivity. The species change of iron in solution determine the economic benefits of the leaching process. This study investigates the iron species in the leach solution under different conditions on a basis of the process. It has been shown that the conversion between Fe3+ and Fe2+ mainly involves electron transfer and does not alter the H+ concentration. When the pH value of the leach solution rises to 2, a large amount of jarosite will be generated, with Cu of a mass fraction of 1.0% and Zn of a mass fraction of 0.5%. When the concentration of Fe2+ in the leach solution exceeds 46.5 g/L, heptahydrated ferrous sulphate crystals will be generated at room temperature, with Cu of a mass fraction of 1.9% and Zn of a mass fraction of 1.0%.
Keywords copper concentrate; H2SO4-Fe2(SO4)3 leaching system; leaching conditions; iron sulfate; oxidation
銅是一种重要的工业金属原料,具有优异的导热性、导电性和延展性,被广泛应用于电力、建筑、国防工业等领域[1]。中国的铜资源约占世界铜储量的3%,具有人均占有量少、资源品质差、分布广、开采难度大等特点[2-3]。黄铜矿是主要的铜矿资源,世界上70%以上的铜以黄铜矿的形式存在。由于持续开采,国内的黄铜矿呈现出“贫、细、杂”的特点[4-5],且黄铜矿与闪锌矿、方铅矿、黄铁矿等的伴生关系复杂,在浮选过程中受到“表面活化”的影响难以实现深度分离,导致铜精矿中含闪锌矿、方铅矿等其他硫化矿[6]。因此,近年来复杂铜精矿的综合利用问题越来越受到关注。
目前,从铜精矿中提取铜的方式仍然以火法冶炼为主,而铜精矿中夹杂的其他硫化矿不仅会降低铜产品的品位,还会造成熔炉堵塞等问题[7]。此外,铜精矿的火法冶炼过程中会产生大量SO2烟气,吸收、处理这些SO2增加了火法冶炼工艺的成本[8]。相比之下,湿法工艺能够避免产生SO2,对矿物的品位要求也低,因此更适合用于从复杂铜精矿中提取金属铜。
湿法工艺浸出铜的方式有很多,其中H2SO4-Fe2(SO4)3浸出体系因成本低、腐蚀性小,受到了广泛的关注[9]。但截至目前,研究工作集中在铜锌精矿在该体系中的溶解机理、溶解动力学、钝化现象和产物等内容上[10-11],关于浸出液中铁形态变化的研究还比较少。实际上,H2SO4-Fe2(SO4)3浸出体系中含有高浓度的铁离子,矿物的浸出反应以铁离子的氧化还原反应为主,且溶液中的铁离子会发生络合、沉淀、结晶等形态变化[12]。浸出液中铁离子的不同形态不但会对矿物浸出效果造成影响,还会对浸出液中有价金属的存在形态产生影响,从而影响复杂铜精矿在H2SO4-Fe2(SO4)3体系中溶解浸出的经济效益。因此,对H2SO4-Fe2(SO4)3浸出铜精矿工艺中铁形态进行分析具有重要意义。
经过前期浸出实验条件的探索和优化,得到铜精矿在H2SO4-Fe2(SO4)3体系中的最优浸出条件为:Fe2(SO4)3浓度为1 mol/L、H2SO4质量浓度为10 g/L,t=95 ℃。本文拟对Fe浓度为2 mol/L、S浓度为3 mol/L的Fe-S-H2O体系浸出液在25 ℃和95 ℃条件下,不同形态的铁的分布情况进行研究,探讨溶液氧化还原电位、pH值以及FeSO4浓度对铁形态的影响。
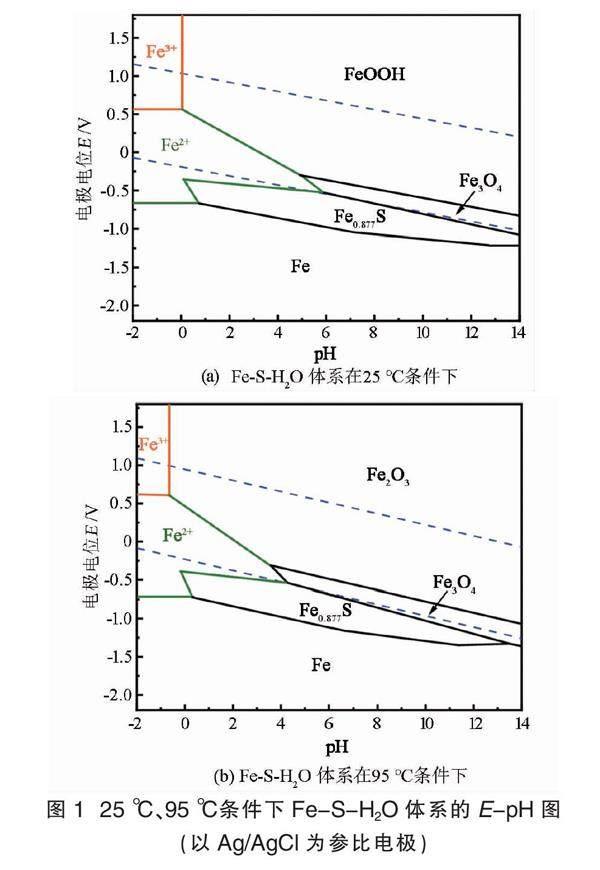
通过热力学分析软件HSC Chemistry分析得到的在25 ℃和95 ℃条件下,Fe浓度为2 mol/L、S浓度为3 mol/L的Fe-S-H2O体系浸出液中不同形态的铁的分布优势区间如图1所示。
1 溶液氧化還原电位的影响
由图1可以看到,溶解态的Fe3+位于E-pH图的左上角,说明Fe3+更容易存在于酸性高电位的环境中。在该体系中,当氧化还原电位低于0.6 V(vs. Ag/AgCl)时,Fe3+ 会得到电子生成Fe2+。该过程不涉及H+ 浓度的变化,所以Fe3+ 与Fe2+ 优势区间的分隔线为水平线。随着氧化还原电位继续降低,Fe2+会与硫生成Fe0.877S,然后再被还原生成铁单质。但是,Fe0.877S优势区间的氧化还原电位已经低于氢线,即在该条件下,H2O会被还原产生H2。因此,在H2SO4-Fe2(SO4)3浸出工艺中考虑的氧化还原电位主要包括Fe3+与Fe2+ 优势区间和水稳定区域。H2SO4-Fe2(SO4)3浸出液保持在酸性高氧化还原电位状态,加入硫化铜精矿以后,由于硫化矿表面电位较低,接触到矿物的Fe3+ 会得到电子生成Fe2+。所以,浸出结束后,大量的Fe2(SO4)3被还原成了FeSO4。同样,在酸性条件下,随着氧化还原电位的升高,Fe2+ 又会失去电子生成Fe3+。该过程也不涉及H+ 浓度的变化。
2 pH的影响
为研究pH值升高后铁的形态变化及其影响,实验反应液由FeSO4和Fe2(SO4)3以4∶1的摩尔比配成,用于模拟浸出液。反应液总铁浓度为1.6 mol/L,含Cu2+、Zn2+离子各10 g/L。采用3 mol/L的KOH溶液调节pH值,反应装置为锥形瓶。实验时,将锥形瓶被放置于恒温水浴摇床中,控制温度和搅拌速率。
由图1可知,Fe3+ 在pH升高过程中会产生羟基氧化铁(FeOOH)。在自然界中,FeOOH存在4种晶型,分别为α-FeOOH、β-FeOOH、γ-FeOOH、δ-FeOOH,其中最稳定的是α-FeOOH(针铁矿)。作为一种水合铁氧化矿,α-FeOOH加热失水后会生成Fe2O3 [13]。
酸性反应液的初始pH值为0.8,在滴加KOH溶液的同时,通过pH计监测溶液酸度变化。在pH值低于1.4时,溶液中几乎无沉淀产生;当pH值升至1.6时,溶液中有较多沉淀产生;当pH值升至2时,溶液中有大量沉淀产生。
此外,温度对沉淀的形成也具有重要影响。实验表明,当温度由室温上升到60 ℃ 时,沉淀速度明显加快;当升至95 ℃ 时,沉淀不仅生成迅速,而且颗粒已堆积在锥形瓶底部,见图2。将沉淀分离、冲洗、烘干、研磨后,用于XRD检测和XRF分析。黄色沉淀XRD图谱见图3,XRF分析结果见表1。
图3中几乎只有KFe3(SO4)2(OH)6的衍射峰,再结合表1的分析结果,可以判定黄色沉淀的物相主要为KFe3(SO4)2(OH)6。
由表1可知,黄钾铁矾沉淀中含有质量分数为1.1%的铜和质量分数为0.5%的锌,表明生成黄钾铁矾的过程中会造成Cu2+和Zn2+的共沉淀,这势必会影响含锌铜精矿在H2SO4-Fe2(SO4)3体系中浸出的经济效益。
Bigham、Schwertmann等[14]对28个矿区水环境中的沉淀物进行分析:当pH≥6.5时,沉淀物主要为水铁矿(Fe5HO8·4H2O)或与针铁矿(α-FeOOH)的混合物;当pH在2.8~4.5范围内时,沉淀物主要为施威特曼石[理想化学式为Fe8O8(OH)6SO4]和极少量的针铁矿;当pH=2.6时,形成了大量的含钠黄钾铁矾,即(H, K, Na) Fe3(SO4)2(OH)6。Pina、Frenay等[15]提到黄钾铁矾生成速率随温度升高而明显加快。当温度低于60 ℃时,沉淀生长较慢;在pH=2时,沉淀形成最快;pH小于1或大于3时,沉淀形成明显被抑制。Graf [16]提出溶液中SO42-/K+ 浓度越高,黄钾铁矾的稳定性越好。Majzlan则提出Fe3+与SO42- 之间存在较强络合作用[12],而H+ 或OH- 浓度过高时会抑制这种作用。
根据上述研究成果,本研究第3章中浸出液的pH值为1,且SO42-浓度极高,需要警惕黄钾铁矾的产生,其可能会抑制矿物浸出,造成溶液中Cu2+、Zn2+的损失。
3 硫酸亚铁浓度的影响
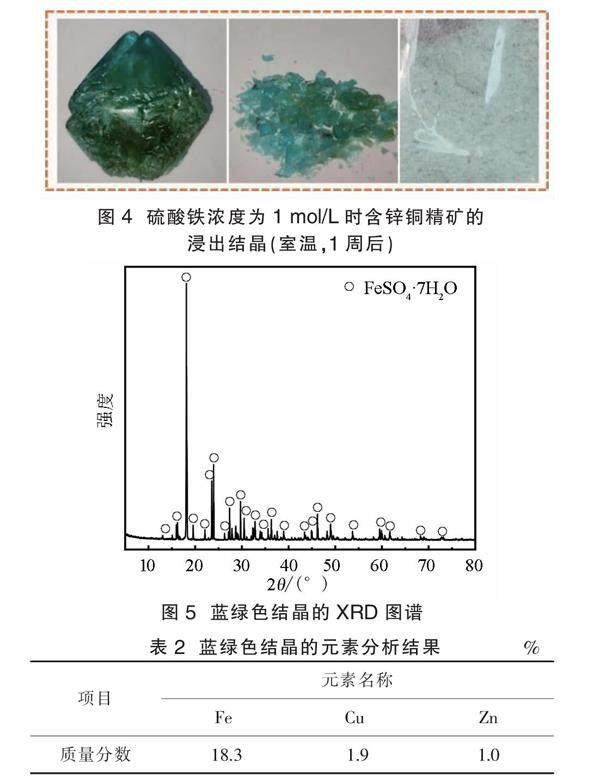
在之前的工作中,研究了不同硫酸铁浓度(0.2 mol/L、0.4 mol/L、0.6 mol/L、0.8 mol/L和1.0 mol/L)中含锌铜精矿的浸出情况。浸出结束后,不同溶液中Fe2+ 离子浓度分别为9.0 g/L、18.1 g/L、25.3 g/L、38.7 g/L和46.5 g/L。这些浸出液在室温中静置1周后,在含46.5 g/L Fe2+ 离子的浸出液中发现了蓝绿色结晶,如图4所示。将该结晶取出,经去离子水冲洗、常温晾干、研磨后进行XRD检测和元素分析。XRD图谱见图5,元素分析结果见表2。
图5中几乎只有七水合硫酸亚铁(FeSO4·7H2O)的衍射峰,这表明是高浓度硫酸亚铁发生了结晶。
Bullough、Canning等[17]研究发现FeSO4结合水数量随温度升高而减少,FeSO4·7H2O存在于较低温度下(低于45 ℃)。FeSO4在H2SO4溶液中的溶解度随温度的降低、硫酸浓度的升高而降低。在25 ℃时,质量分数为0.6 %的硫酸溶液中,FeSO4的溶解度仅为22.5%。含锌铜精矿浸出液中FeSO4产生结晶会夹杂Cu2+、Zn2+,由表2可知,该结晶中含有1.9 %的Cu和1.0 %的Zn。因此,以H2SO4-Fe2(SO4)3浸出含锌铜精矿需要关注溶液中Fe2+的浓度,并预测在所有工艺的温度和酸度中是否会产生结晶,以免影响浸出效益。
4 结论
本研究采用H2SO4-Fe2(SO4)3体系浸出含锌铜精矿,对浸出液中Fe的形态进行研究,得到以下结论:1)Fe3+更容易稳定存在于酸性、氧化还原电位高的溶液中(以Ag/AgCl为参比电极时,E>0.6 V),Fe2+更容易稳定存在于酸性、氧化还原电位较低的溶液中(以Ag/AgCl为参比电极时,E<0.6 V,高于氢线),Fe2+和Fe3+之间的转化主要涉及电子得失,不涉及H+ 浓度变化。2)用3 mol/L KOH溶液调节硫酸铁溶液的pH值到2,会有大量黄钾铁矾沉淀生成,且生成速度随温度升高而加快。沉淀中含有质量分数为1.0%的Cu和质量分数为0.5%的Zn。3)常温下,铜精矿在
1 mol/L硫酸铁中浸出得到的浸出液会发生结晶,结晶成分主要为FeSO4·7H2O,结晶中含有质量分数为1.9%的Cu和质量分數为1.0%的Zn。
参考文献
[1] 张楠.2023年中国铜工业供需形势分析 [J].中国矿业,2024,33(2): 20.
[2] 孙传尧, 宋振国, 朱阳戈, 等. 中国铜铝铅锌矿产资源开发利用现状及安全供应战略研究 [J]. 中国工程科学, 2019, 21(1): 133.
[3] BERNHARDT D R I J. Mineral commodity summaries 2020 [R]. Reston, VA, 2020.
[4] LI X, MONNENS W, LI Z, et al. Solvometallurgical process for extraction of copper from chalcopyrite and other sulfidic ore minerals[J]. Green Chemistry, 2019, 22(2):417.DOI:10.1039/c9gc02983d.
[5] ZHAO H, ZHANG Y, ZHANG X, et al. The dissolution and passivation mechanism of chalcopyrite in bioleaching: An overview [J]. Minerals Engineering, 2019,136-140.
[6] EJTEMAEI M, NGUYEN A V. Characterisation of sphalerite and pyrite surfaces activated by copper sulphate [J].Minerals Enginee-ring, 2017, 100: 223.
[7] BELLEMANS I, DE WILDE E, MOELANS N, et al. Metal losses in pyrometallurgical operations-a review [J]. Adv Colloid Interfac, 2018, 255: 47-63.
[8] KARPPINEN A,SEISKO S, LUNDSTR M M. Atmospheric leaching of Ni, Co, Cu, and Zn from sulfide tailings using various oxidants [J]. Minerals Engineering, 2024, 207: 108576.
[9] LI Y, KAWASHIMA N, LI J, et al. A review of the structure, and fundamental mechanisms and kinetics of the leaching of chalcopy-rite [J]. Adv Colloid Interfac, 2013, 197: 32.
[10] MARTíNEZ-GóMEZ V J, FUENTES-ACEITUNO J C, PéREZ-GARIBAY R, et al. A phenomenological study of the electro-assisted reductive leaching of chalcopyrite [J]. Hydrometallurgy, 2016, 164: 54-63.
[11] WINARKO R, DREISINGER D B, MIURA A, et al. Characteriz-ation of the solid leach residues from the iodine-assisted chalco-pyrite leaching in ferric sulfate media[J].Hydrometallurgy,2024: 106302.
[12] MAJZLAN J, MYNENI S C B. Speciation of iron and sulfate in acid waters: aqueous clusters to mineral precipitates [J]. Environmental Science & Technology, 2005, 39(1): 188.
[13] 蔺祖弘. 改性羟基氧化铁用于含砷毒剂污染场地修复的性能评价及机理研究 [D].北京:北京化工大学,2021.
[14] BIGHAM J M, SCHWERTMANN U, TRAINA S J, et al. Schwertmannite and the chemical modeling of iron in acid sulfate waters [J].Geochimica et Cosmochimica Acta, 1996, 60(12): 2111.
[15] PINA P D S, FRENAY J, LE O V A, et al. A critical review of the chemical leaching of sphalerite in ferric sulfate and chloride solution[J/OL].Chemistry, Environmental Science,2003[2023-10-23]. https://www.semanticscholar.org/paper/A-critical-review-of-the-chemical-leaching-of-in-Pina-Frenay/be6ee645ec76ba19fc
22d7f1072cdf809a3c2253.
[16] GRAF D L. Chemical equilibria in soils [J]. Clays and Clay Minerals, 1979, 28(4): 319.
[17] BULLOUGH W S, CANNING T A, STRAWBRIDGE M. The solubility of ferrous sulphate in aqueous solutions of sulphuric acid [J]. Journal of Chemical Technology & Biotechnology, 2010, 2(12):703-707.
收稿日期:2023-10-29
作者简介:张明峂(1997—),男,主要研究方向为复杂硫化矿常压湿法浸出。

