氮氧化SODm/COm的设计与合成及其体外活性
宋明 王维 李智慧 康祎璠 黄文欢

文章编号:2096-398X2024)03-0106-06
(陕西科技大学 化学与化工学院, 陕西 西安 710021)
摘 要:基于对天然Cun-SOD酶的分析,本文选取功能氮氧化异烟酸HINO)配体与过渡金属CuII)通过混合溶剂热法合成了一例兼具双酶活性的配合物1,[Cu4Hino)4OH)2SO4H2O)4]n.通过单晶X-射线衍射仪SC-XRD)、粉末X-射线衍射仪PXRD)和傅里叶红外光谱仪FTIR)等对其进行系统的表征.NBT光还原法(NBT,氯化硝基四氮唑蓝)测试显示,配合物1的IC50值为0.43 μmol/L,表明其具有优良的抗氧化性能.同时,体外儿茶酚酶模拟測试,配合物1的kcat值为3.166×103 h-1,可作为中等强度的酶催化剂.
关键词:氮氧化物; 配位聚合物; SOD; 儿茶酚酶活性
中图分类号:O614.24+1 文献标志码: A
Design and synthesis of N-oxide SODm/COm and its vitro activity
SONG Ming, WANG Wei, LI hi-hui, ANG Yi-fan, HUANG Wen-huan*
College of Chemistry and Chemical Engineering, Shaanxi University of Science & Techology, Xi′an 710021, China)
Abstract:Based on the analysis of the natural Cun-SOD enzyme,a double enzyme complex 1,[Cu4Hino)4OH)2SO4H2O)4]n,was synthesized by mixing the Hino ligand with the transition metal CuII).It was systematically characterized by SC-XRD,PXRD and FTIR.NBT photoreduction assay NBT) showed that the IC50 value of complex 1 was 0.43μmol/L,indicating that complex 1 had excellent antioxidant properties.In vitro simulation of catecholase,the kcat value of complex 1 was 3.166×103 h-1,which can be used as a medium strength enzyme catalyst.
Key words:nitrogen oxides; coordination polymer; superoxide dismutase; catecholase activity
0 引言
在需氧生命体的新陈代谢过程中,大约有5%以上吸入的氧在生命体内通过单电子还原产生化学性质活泼的物质——活性氧(Reactive oxygen species,ROS)[1,2].ROS具有高度的活性与极强的氧化反应能力,适量的ROS可作为细胞信号转导和基因表达调控分子,调控细胞的生长、生存和凋亡;但过多的ROS就会有破坏作用,大量的自由基通过氧化作用来攻击所遇到的任何分子,使机体内大分子物质产生过氧化变性、交联或断裂,从而引起细胞结构和功能的破坏,导致机体组织损害的器官退行性变化(衰老)或者癌变[3-5].在生命系统中,SOD可以专一地清除耗氧过程中产生的超氧离子自由基,同时也协同谷胱甘肽过氧化物酶或过氧化氢酶一起彻底清除超氧离子自由基和H2O2等有害物种,因此在生命活动中扮演着极其重要的角色,常用于癌症、炎症、自身免疫性疾病及心肌缺血与缺血再灌注综合症等多种疾病的临床治疗[6-8].因此,SOD被医学界誉为“人体清道夫”.
近几十年,SOD一直是国内外学者研究的热点.但其研究大多集中于从动物血液或脏器中提取SOD,易受原料来源、产品得率、稳定性及安全性等方面的限制.同时天然SOD因相对分子质量大,稳定性差,在血液中半衰期短,且长期注射使用可诱发免疫和过敏反应等问题,在临床应用上受到极大的限制[9,10].因此,人工合成的活性小分子模拟天然SOD的催化功能及相关改性研究具有非常重要的研究意义.结合配位聚合物的特点,通过大量文献的调研分析,我们发现通过活性基团的引入来产生特殊的相互作用等方法合成具有优异SOD活性的功能化配合聚合物是非常有效的一种做法.在本文中,作者利用氮氧化功能有机配体异烟酸成功合成出了一例铜基模拟酶,并探究了其在体外的超氧化物歧化酶活性和儿茶酚酶活性.
1 实验部分
1.1 仪器和材料
1.1.1 主要材料
异烟酸,分析纯,上海麦克林生化科技有限公司;核黄素,分析纯,上海蓝季科技发展有限公司;氯化硝基四氮唑蓝NBT),分析纯,上海易恩化学技术有限公司;DL-甲硫氨酸,分析纯,上海新铂化学技术有限公司;3,5-二叔丁基邻苯二酚3,5-DTBC),分析纯,上海笛柏生物科技有限公司;磷酸二氢钠,分析纯,磷酸二氢钠,分析纯,甲醇,分析纯,冰醋酸,分析纯,天津市河东区红岩试剂厂.
1.1.2 主要仪器
单晶X-射线衍射仪(Bruker D8 Quest),傅里叶红外光谱仪(VECTOR-22),德国Bruker公司;粉末X-射线衍射仪(Rigaku RU 200),日本Rigaku公司;热重分析仪(BETSCH STA449C),德国Netzsch公司;紫外可见分光光度计(Cary100 UV-Vis),美国Agilent公司;手提式紫外分析仪(F-5),上海力辰邦西仪器科技有限公司.
1.2 配合物1 [Cu4Hino)4OH)2SO4H2O)4]n的制备
在25 mL聚四氟乙烯反应釜中加入五水合硫酸铜0.074 9 g,0.3 mmol)和氮氧化异烟酸配体0.041 7 g,0.3 mmol),加入甲醇∶水=2∶1的混合溶剂,调节混合溶剂pH值为7~8.室温搅拌30 min后,将反应釜在100 ℃条件下反应24 h,自然冷却至室温,得到绿色块状晶体,产率:44 %(基于HINO).分子式为C24H26Cu4N4O22S11 008.72),元素分析%),理论计算值:C:28.58; H:2.60; N:5.55;实测值:C:28.94; H,2.88; N:5.21.
1.3 配合物1的晶體结构测定
将所合成的晶体挑选出大小适中、表面无裂纹的单晶置于Bruker D8 Quest单晶X-射线衍射仪上,以ω-2θ扫描方式,收集衍射数据,全部强度数据经Lp校正和吸收校正SADABS).配合物的晶体结构采用程序SHELXL-14由直接法解得.全部非氢原子经Fourier合成及差值电子密度函数修正,全部氢原子坐标从差值电子密度函数并结合几何分析获得.全部非氢原子坐标以及各向异性温度因子和氢原子坐标以及各向同性温度因子经最小二乘法修正至收敛.全部解析均采用SHELXS-14和SHELXL-14解析程序包完成.配合物的晶体学数据如表1所示.
2 结果与讨论
2.1 配合物1的晶体结构
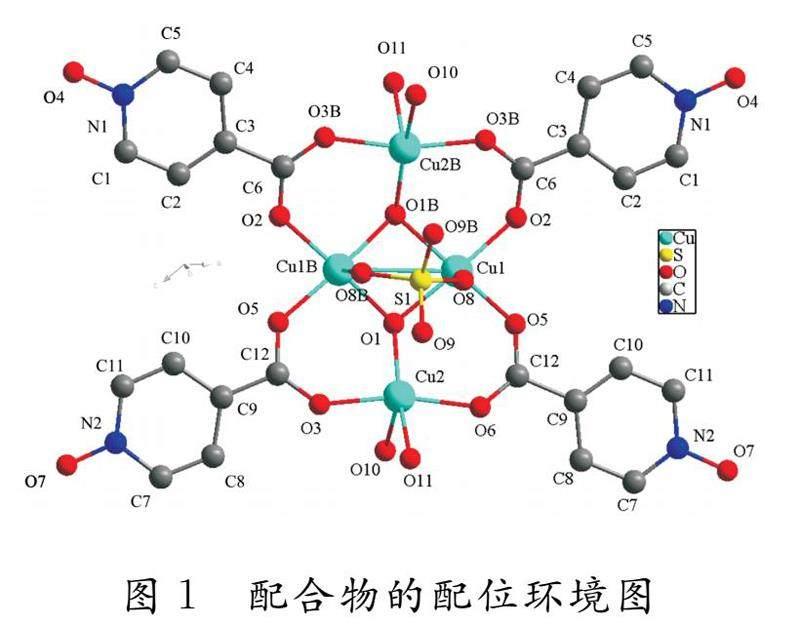
通过X-射线单晶衍射分析可知,该配合物为单斜晶系,属于C2/c空间群.配合物1的分子堆积如图1所示,单体四核结构单元为船式结构,其顶部是硫酸盐基团,两侧是吡啶环.所有铜原子均呈现出金字塔形的四方锥构型,Cul与氮氧化异烟酸羧基氧O2和O5以及在基底平面上μ3-OH氧配位,键长范围为1.92~1.99 ,轴向Cul-O8键长为1.98 ,基底平面上Cul-O1的键长为2.15 .Cu2的配位构型中含有μ3-OH中的O1,羧基氧O6和O3和两个参与配位的水分子O10和O11,键长范围为1.94~1.99 ,与基底平面上的Cul-O键长相对应.两个μ3-OH基团以特殊的桥连方式将结构单元中的两个未配位的半部结构连接在一起.Cu-μ3-OH的键长范围为1.94~1.99 ,Cul-O1-CulB键角为92.2 °,Cu2-O1-Cul键角为117.1 °.在结构单元的分子中心有一个Cu-O组成的四元环.OlB-Cul-O1和CulB-O1-Cul的键角分别为82.3 °和92.2 °.该环被折叠,使O1在Cul,O5和O2的最小二乘平面下方为0.53 ,Cul-Cu1B距离较短,键长为2.86[11-13].
氮氧化异烟酸充当桥连配体,通过羧基氧原子O5和O6双齿配位分别桥接两个铜原子Cul和Cu2.N-O基团中的O原子不参与CuII)原子配位,但和参与配位的水分子形成氢键.硫酸基团中的S原子位于空间结构的特殊位置,在铜原子Cul和CulB之间起双齿桥的作用.四个五配位的铜原子通过四个HINO的羧基、两个μ3-OH和一个桥连的双齿硫酸基团连接在一起,在结构单元的中心可以看到Cu2O4S组成的笼状结构.
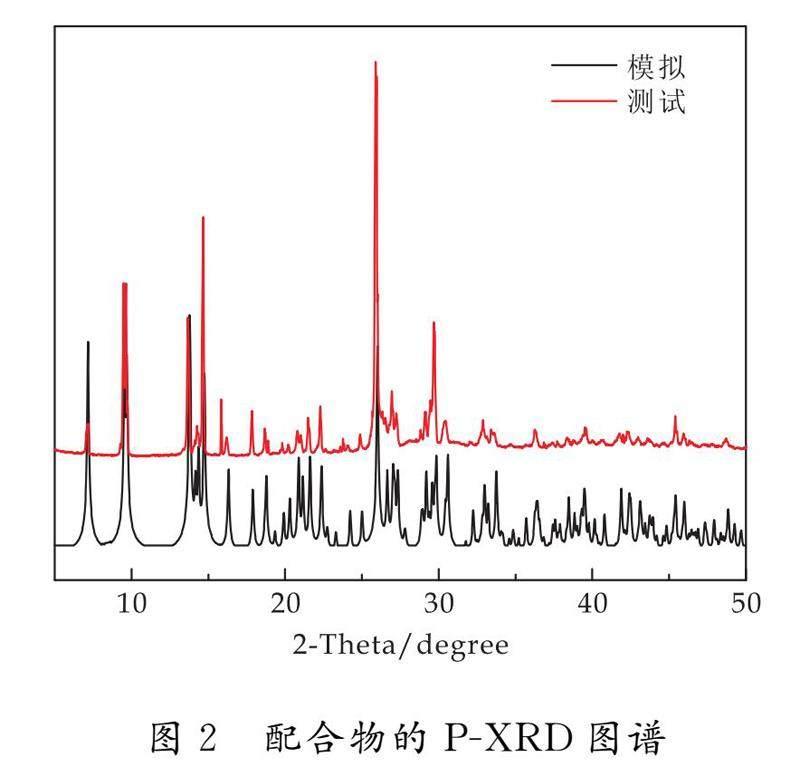
2.2 配合物1的P-XRD分析
在2θ为5 °~50 °范围内,配合物的PXRD图谱与单晶结构模拟的图谱如图2所示.两者的主要出峰位置和强度基本吻合,说明所合成配位物均为纯相,可以满足后续的性质表征及SOD活性测试.
2.3 配合物1的热稳定性分析
配合物在N2条件、10 ℃/min升温速率下的热重曲线如图3所示.从室温到126 ℃的质量损失为1.60 %,与1个溶剂水分子的理论损失1.75 %相对应.从126 ℃到200 ℃的质量损失为3.16 %与2个配位水分子的理论损失3.51%相对应.该配合物稳定在220 ℃,随着温度的继续上升,配体分解,配合物骨架坍塌.
2.4 配合物1的红外光谱分析
以Br为基质,在4 000~500 cm-1范围内测定了配合物的FTIR光谱,如图4所示.配合物红外光谱的主要数据为:3 320w),3 100w),1 626vs),1 554w),1 408vs),1 225s),1 075m),870w),780w),653m).其中,在3 320和3 100 cm-1处的吸收峰为配位水分子中O-H的伸缩振动;在1 626 cm-1处的吸收峰为羧基中C=O的伸缩振动;在1 554 cm-1和1 408 cm-1处的吸收峰为吡啶环上C=C和C=N伸缩振动;在1 225 cm-1处的吸收峰为N→O基团的伸缩振动;在1 075 cm-1处的吸收峰为为μ3-OH上O-H的伸缩振动;在870 cm-1、780 cm-1和653 cm-1处的吸收峰为吡啶环上C-H的伸缩振动.
2.5 配合物1的紫外光谱分析
室温下,配合物溶液的UV-Vis光谱如图5所示.配合物溶液的紫外吸收波长范围为278~330 nm,不同溶解时间下的紫外吸收强度基本一致,表明该配合物在溶液中具有较好的稳定性.
2.6 配合物1作为SODm的活性研究
本文通过NBT光还原法对配合物1作为超氧化物歧化酶模拟物的抗氧化活性进行研究.用NaH2PO4·2H2O-Na2HPO4·12H2O配置pH=7.8、0.05 mol/L缓冲溶液.用缓冲液分别配制浓度为3.4×10-6 mol/L的核黄素溶液,0.01 mol/L的MET和4.7×10-5 mol/L的NBT溶液及含不同浓度的O·-2清除剂溶液.测试时,依次取3 mL溶液于恒定光强度下光照,测定在560 nm处不同光照时间后溶液的吸光度值Abs560 nm光照时间为20 s),每组测量100 s.用相同的方法测定不同浓度下配合物溶液的吸光度值Abs560 nm,每组读数3次,取平均值.
用不同光照时间下配合物溶液的吸光度值Abs560 nm对光照时间t作图,如图6所示.直线的斜率=ΔAbs/Δt,表示配合物的浓度对NBT还原的抑制作用.0=0.009 05,1=0.005 14,2=0.004 15,3=0.003 34,4=0.002 28,5=0.001 6,6=0.001 05,其中,0为空白对照组.随着配合物浓度的增加,直线的斜率逐渐变小,对NBT还原的抑制作用增强.
根据公式η=1-k/k0)*100%,η表示配合物溶液的浓度对NBT还原的抑制率.以配合物溶液的浓度作为横坐标,抑制率作为纵坐标作图,如图7所示.其NBT还原的抑制率为50%的配合物溶液浓度为0.43 μmol/L.
模拟物对NBT还原的抑制率为50%的浓度(IC50值)代表了SOD模拟物抗氧化活性的强弱,IC50值的数值越小,表明SOD模拟物的抗氧化活性越好.配合物1与目前已报道的具有SOD活性的配合物相比,比显出较好的抗氧化性能[14-17].我们推测主要原因是配合物1中CuII)的配位构型与天然Cun-SOD中CuII)的配位构型相一致,均为五配位的四方锥构型.同时,天然Cun-SOD酶一个结构单元(亚基)中只含有1个CuII)配位构型,配合物1一个结构单元中同时含有四个CuII)配位构型,能够更快速地清除O·-2,更大程度地抑制O·-2对NBT的还原.其次,配体氮氧化异烟酸中N-O基团虽未参与CuII)配位,但N-O基团中的负电荷O-在O·-2的清除过程中通过电荷作用促进质子H+与O·-2的反应,增强配合物对O·-2的清除作用.
2.7 配合物1作为COm的活性研究
由于3,5-二叔丁基邻苯二酚(3,5-DTBC)的苯环上连接了两个叔丁基取代基,导致苯醌还原成邻苯二酚的电位较低[18].因此,很容易被氧化成性质非常稳定的邻醌,即3,5-二叔丁基邻苯二醌(3,5-DTBQ).因此,以3,5-DTBC为底物,将1×10-4 mol L-1的配合物1加入到不同浓度的3,5-DTBC溶液中,在甲醇和水v/v=1∶1)均匀混合的介质中评价了配合物1的类儿茶酚酶活性,并用紫外分光光度计监测反应的过程.
固定模拟物1的浓度为1×10-4 M,改变3,5-DTBC的浓度后的紫外光谱图如图8所示.从图8(a)~(c)可以看出,随着3,5-DTBC的浓度的提高,400 nm处的醌带随即增加,紫外吸收强度呈现浓度的依赖性.然而,从图8(c)~(f)得到,3,5-DTBC的浓度的提高,对400 nm处的醌带涨幅不大,说明3,5-DTBC的浓度高于4×10-3 M后,吸收强度几乎不受浓度得影响.
3,5-DTBC和配合物混合后,从图9中可以看到400 nm处的醌带增加,紫外吸收强度呈现时间依赖式增强,直到它们的强度达到饱和,并且无色溶液逐渐变成深棕色,表明模拟物1催化3,5-DTBC轉化为3,5-DTBQ.由Lineweaver-Burk图10计算可得配合物1的kcat值为:3.166×103 h-1,与文献已报道的配合物相比,属于中等效率的催化剂[19-22].
3 结论
本文基于天然Cun-SOD模型,选取氮氧化功能有机配体异烟酸HINO)与五水合硫酸铜通过溶剂热法合成了一例CuII)配位物,对其进行进行了系统的结构分析与表征,并探究了其在体外的超氧化物歧化酶活性和儿茶酚酶活性.实验结果表明,该配合物同时兼具优良的抗氧化活性(IC50值达0.43 μmol/L)和儿茶酚酶活性(kcat值为:3.166×103 h-1).通过系统的构效关系分析,以期通过上述研究为后续定向合成高效类酶模拟物提供一定的理论研究基础.
参考文献[HJ1.6mm]
[1] S J Dixon,B R Stockwell.The role of iron and reactive oxygen species in cell death.Nature Chemical biology,2014,10:9-17.
[2] P T Schumacke.Reactive oxygen species in cancer:A dance with the devil.Cancer Cell,2015,272):156-157.
[3] A.L.Sverdlov,A.Elezaby,F..Qin,et al.Mitochondrial reactive oxygen species mediate cardiac structural,functional,and mitochondrial consequences of diet-induced metabolic heart disease.Journal of the American Heart Association,2016,5:e002 555.
[4] C.R.Friese,C.McArdle,T.hau,et al.Antineoplastic drug exposure in an ambulatory setting:A pilot study.Cancer Nurs,2015,38:111.
[5] Clares M P,Blasco S,Inclán Mario,et al.ManganeseII) complexes of scorpiand-like azamacrocycles as MnSOD mimics.Chemical Communications,2011,4721):5 988-5 990.
[6] M.Fanelli,M.Formica,V.Fusi,et al.New trends in platinum and palladium complexes as antineoplastic agents.Coordination Chemistry Reviews,2016,310:41-79.
[7] A.Nakhaee,M.A.Mashhadi,M.ademir,et al.Lack of association between superoxide dismutase gene polymorphism and malignant lymphoproliferative disorders.Gene,Cell and Tissue,2016,33):e37 768.
[8] D.ang,.M.Lee,S..Park,et al.Functional variant of manganese superoxide dismutase SOD2 V16A) polymorphism is sssociated with prostate cancer risk in the prostate,lung,colorectal,and ovarian cancer study.Cancer Epidemiol,Biomarkers & Prevention,2007,168):1 581-1 586.
[9] R.ramer.The pharmaceutical potential of manganese-based superoxide dismutase mimics.Angewandte Chemie International Edition,2000,3924):4 469-4 470.
[10] A Tovmasyan,S Carballal,R Ghazaryan,et al.Rational design of superoxide dismutase SOD) mimics:The evaluation of the therapeutic potential of new cationic Mn porphyrins with linear and cyclic substituents.Inorganic Chemistry,2014,5321):11 467-11 483.
[11] C Y Gao,H R Tian,J Ai,et al.A microporous Cu-MOF with optimized open metal sites and pore spaces for high gas storage and active chemical fixation of CO2.Chemical Communications,2016,5274):11 147-11 150.
[12] W Q hang,R D Wang, B Wu,et al.Comparative study on temperature-dependent CO2 sorption behaviors of two isostructural N-Oxide-Functionalized 3D dynamic microporous MOFs.Inorganic Chemistry,2018,573):1 455-1 463.
[13] ang Y F,Liang X Q,Wang X,et al.CopperII) complex derived from axial chiral heterocyclic spiro ligand:Crystal structure,characterization and SOD activity .Inorganic Chemistry Communications,2017,86:218-222.
[14] Ceolin J,Siqueira J D,Martins F M,et al.Oxazolidine copper complexes:Synthesis,characterization and superoxide dismutase activity of copperII) complexes with oxazolidine ligands derived from hydroxyquinoline carboxaldehyde .Applied Organometallic Chemistry,2018,324):e4 218.
[15] Csire G,Timári S,Asztalos J,et al.Coordination,redox properties and SOD activity of CuII) complexes of multihistidine peptides .Journal of Inorganic Biochemistry,2017,177:198-210.
[16] 殷晓春,李 刚,王荣民,等.金属卟啉白蛋白结合体模拟SOD酶性能研究.中国科学:化学,2013,432):171-177.
[17] 栾锋平,向爱华,李庆祥.双核铜配合物的结构和SOD活性及电化学性质.武汉工程大学学报,2011,339):12-15.
[18] Sheoran M,Bhar ,Jain S,et al.Phenoxo-bridged dicopper complexes:Syntheses,characterizations,crystal structures and catecholase activity .Polyhedron,2019,161:169-178.
[19] Malis G,Geromichalou E,Geromichalos G D,et al.CopperII) complexes with non-steroidal anti-inflammatory drugs:Structural characterization,in vitro and in silico biological profile .Journal of Inorganic Biochemistry,2021,224:111 563.
[20] Squarcina A,Santoro A,Hickey N,et al.Neutralization of reactive oxygen species at dinuclear CuII)-cores:Tuning the antioxidant manifold in water by ligand design .ACS Catalysis,2020,1013):7 295-7 306.
[21] Székács I,Tokarz P,Horvath R,et al.In vitro SOD-like activity of mono- and di-copper complexes with a phosphonate substituted SALAN-type ligand .Chemico-Biological Interactions,2019,306:78-88.
[22] Mantasha I,Shahid M,umar M,et al.Exploring solvent dependent catecholase activity in transition metal complexes:An experimental and theoretical approach .New Journal of Chemistry,2020,444):1 371-1 388.
【責任编辑:蒋亚儒】
基金项目:国家自然科学基金项目(21801161); 中国博士后科学基金面上项目(2019M653524); 陕西科技大学博士科研启动基金项目(BJ15-35); 西北大学合成与天然功能分子化学教育部重点实验室开放基金项目(3380500672018-003))
作者简介:宋 明(1997—),男,四川南充人,在读硕士研究生,研究方向:电磁波吸收屏蔽的应用
通讯作者:黄文欢(1987—),女,福建福州人,副教授,博士,研究方向:能源存贮及转化、电磁波吸收屏蔽、固态电池关键材料的应用,huangwenhuan@sust.edu.cn

