茉莉酸甲酯调控水稻幼苗镉吸收与分布的机制
魏婷 马秀莲 张春平 吴广放 朱刚 李红 高菡

文章编号:2096-398X2024)03-0020-07
(1.陕西科技大学 环境科学与工程学院, 陕西 西安 710021; 2.中国建筑材料工业建设西安工程有限公司, 陕西 西安 710000)
摘 要:茉莉酸甲酯Methyl jasmonate,MeJA)是高等植物体内普遍存在的植物激素,在植物生物与非生物胁迫的生理响应及抗逆中发挥着重要的作用.本研究通过水培实验,探讨了外源茉莉酸甲酯对镉(Cadmium,Cd)胁迫下水稻幼苗生长及Cd吸收、分布的影响.结果显示,MeJA可有效缓解Cd胁迫引起的植物生长抑制,并使得水稻根部和地上部Cd含量分别下降14.42%和11.63%.非损伤微测显示,MeJA可以有效减少Cd2+离子内流,降低植物对Cd的吸收.此外,MeJA改变了细胞壁结构和多糖组分含量,使得水稻根部和地上部的细胞壁厚度分别增加了27.02%和39.96%,细胞壁多糖(果胶、纤维素和半纤维素)中的Cd含量也相应增加.有效阻控了Cd进入细胞质和细胞器,降低了Cd的生物毒性.水稻Cd吸收与转运能力的降低与吸收转运相关基因OsNramp1、OsNramp5、OsHMA2表达量降低有直接关系.研究结果为降低水稻Cd累积提供了一条有效的途径.
关键词:茉莉酸甲酯; 细胞壁; 亚细胞定位; Cd2+离子流; 基因表达
中图分类号:X173; S511 文献标志码: A
Mechanism of methyl jasmonate in regulating cadmium uptake and distribution in rice seedlings
WEI Ting1, MA Xiu-lian1, HANG Chun-ping2, WU Guang-fang2, HU Gang2, LI Hong1, GAO Han1
1.School of Environmental Science and Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China; 2.China Building Materials Industrial Construction Xi′an Engineering Co., Ltd., Xi′an 710000, China)
Abstract:Methyl jasmonate MeJA) is a plant hormone in higher plants and plays an important role in physiological response and stress resistance of plants under various biotic and abiotic stresses.In this study,the effects of exogenous MeJA on the growth of rice seedlings under cadmium Cd) stress were studied via hydroponics experiment.The results showed that MeJA could effectively relieve plant growth inhibition caused by Cd stress,and reduce Cd content in root and shoot parts of rice by 14.42% and 11.63%,respectively.Non-invasive micro-test analysis indicated that MeJA effectively reduced net Cd2+influx.Moreover,MeJA changed the cell wall structure and increased root and shoot cell wall thickness by 27.02% and 39.96%,respectively.The Cd content in pectin,cellulose and hemicellulose increased,thus Cd was effectively prevented from entering cytoplasm and organelles,and the biotoxicity of Cd to plant cells was reduced.Gene expression analysis showed that the decrease of Cd absorption and transportation in rice plants was directly related to the decreased expression of OsNramp1、OsNramp5 and OsHMA2 genes.Overall,this study provides a feasible way for decreasing Cd content in rice plants.
Key words:methyl jasmonate; cell wall; subcellular localization; Cd2+ flux; gene expression
0 引言
鎘(Cadmium,Cd)是生物毒性最强的重金属元素之一,也是一种植物非必要的重金属元素,具有毒性大、易转移、难降解等特点.Cd胁迫会影响植物的种子萌发,生长发育,气孔开合,营养物质吸收,导致光合作用下降,植物代谢紊乱,激素失衡,诱导氧化应激[1,2].此外,由于Cd在土壤中迁移性较强,极易被农作物吸收并富集在作物体内,从而导致作物的产量和品质低下,作物中的Cd通过食物链进入人体.Cd是公认的致癌、致畸、致突变物质,人体摄入过量的Cd会导致严重的功能性障碍疾病,威胁人类健康[3].因此,减少农作物中Cd累积,并提高植物Cd抗性已成为农业生产中亟待解决的问题.
茉莉酸甲酯Methyl jasmonate,MeJA)作为植物应答生物与非生物胁迫的重要信号物质,对植物抵御重金属胁迫和调控重金属累积起着非常重要的作用,且具有生理活性高和环境友好的特点[4,5].Singh等[6]研究发现,外源MeJA可降低水稻Cd吸收、累积并减轻Cd对生物膜的氧化损伤.MeJA也可有效抑制Cd从秋茄根部向地上部的转运,提高秋茄叶绿素含量以及内源茉莉酸含量,降低MDA含量及地上部Cd含量[7].Yan等[8]通过外源施用MeJA的方法提高了Cd胁迫下观赏辣椒各组织的干重、叶绿素含量、叶中的过氧化氢酶(CAT)以及抗坏血酸过氧化氢酶(ASA-POD)的活性,从而为受重金属胁迫的植物提供保护作用.此外,MeJA也可提高甘蓝型油菜抗坏血酸-谷胱甘肽循环相关酶的活性而显著缓解砷胁迫引起的氧化损伤,并降低植物体内砷的累积[9-11].尽管国内外已经在MeJA调节植物重金属抗性方面做了一定的基础研究,且证实了MeJA能够缓解植物重金属胁迫,然而,MeJA調控植物重金属吸收、转运的作用机制尚不明确.
水稻是中国第一大粮食作物,也是世界范围内主要的粮食作物之一,全球约有一半人口以大米为主食.据统计,中国水稻种植面积约占世界水稻种植总面积的1/4,稻谷产量约为世界总产量的37%,土壤中的Cd容易被水稻吸收,使得Cd污染而引起的Cd米事件层出不穷,对人类健康造成了严重的威胁.
本研究以水稻为实验材料,探讨外源MeJA对水稻生长、Cd吸收、累积和转运的影响,在此基础上,进一步研究MeJA对水稻根系Cd内流、细胞壁厚度、细胞壁Cd固定及重金属吸收转运相关基因表达的影响,深入阐明MeJA调控水稻Cd吸收、累积的作用机制,为利用MeJA提高作物重金属胁迫、降低植物重金属累积提供理论依据和实践指导.
1 实验部分
1.1 水稻幼苗的培养
以扬稻6号为供试植物材料.用3%的NaClO消毒后于蛭石中进行萌发.待幼苗长到两叶一心时,将幼苗移至含有1/4 Hoagland营养液的水培箱中,并放置于温室中进行培养,温度为白天/夜晚26 ℃/20 ℃,光照/黑暗时间为14 h/10 h,相对湿度60%~70%.待幼苗长至三叶一心时,选取健壮且大小一致的幼苗在1/2 Hoagland营养液中适应性培养一周,之后于1/2 Hoagland营养液中培养六周并进行处理.处理组包括:(1)C(空白对照);(2)Cd(3 mg L-1 Cd);(3)MeJA(1 mmol L-1 MeJA);(4)MeJA+Cd(1 mmol L-1 MeJA+3 mg L-1 Cd).MeJA均匀喷洒至水稻地上部分,有液滴滴落时为止.Cd以CdCl2·2.5H2O的形式加入营养液中.植物样品于处理一周后收样.
1.2 水稻生长指标的测定
将植株用去离子水小心冲洗,去除根部残留的营养液,用滤纸吸干根部表面水分,将其平铺在桌面上,用刻度尺测量地上部及根部的长度.用分析天平称取植株鲜重并记录,再将其放置在105 ℃烘箱中杀青半小时后,于80 ℃烘箱烘干至恒重并称重记录.
1.3 水稻幼苗Cd含量的测定
样品于110 ℃杀青后,在70 ℃烘箱烘干至恒重.将植物样品称取0.1 g于消解管中,加入10 mL HNO3浸泡10 h后进行消解,消解条件为:80 ℃消解1.5 h,120 ℃消解1.5 h,150 ℃消解3 h,升至175 ℃时开盖赶酸至1 mL时,用2% HNO3定容至10 mL,过滤,然后使用原子吸收光谱仪进行Cd含量的测定.
1.4 水稻根系Cd2+离子流测定
采用非损伤微测技术(NMT)对水稻根系Cd离子流进行测定[12].每株样品测定15 min,共4个生物学重复.正负表示Cd2+的运动方向,负值表示Cd2+内流,正值表示.
2 结果与讨论
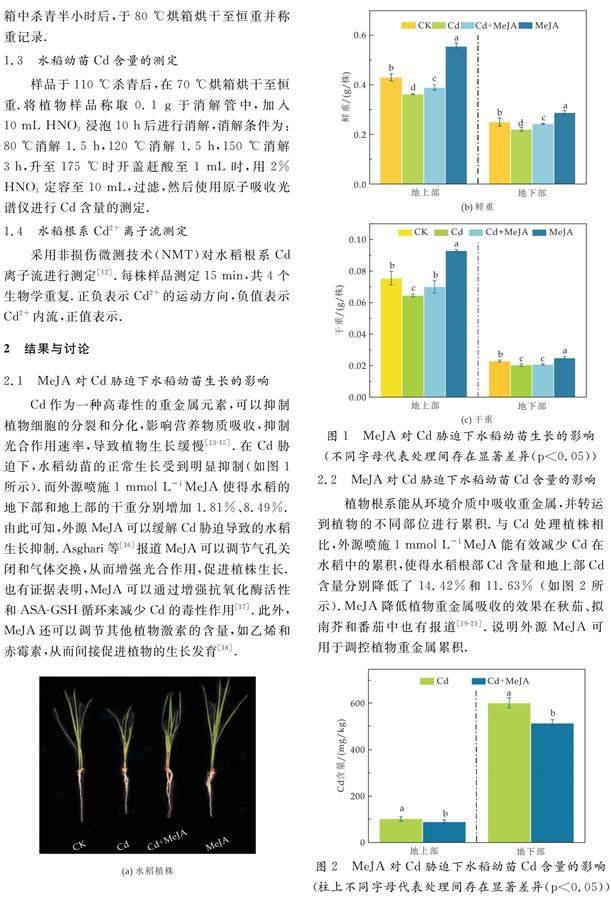
2.1 MeJA对Cd胁迫下水稻幼苗生长的影响
Cd作为一种高毒性的重金属元素,可以抑制植物细胞的分裂和分化,影响营养物质吸收,抑制光合作用速率,导致植物生长缓慢[13-15].在Cd胁迫下,水稻幼苗的正常生长受到明显抑制(如图1所示).而外源喷施1 mmol L-1MeJA使得水稻的地下部和地上部的干重分别增加1.81%、8.49%.由此可知,外源MeJA可以缓解Cd胁迫导致的水稻生长抑制.Asghari等[16]报道MeJA可以调节气孔关闭和气体交换,从而增强光合作用,促进植株生长.也有证据表明,MeJA可以通过增强抗氧化酶活性和ASA-GSH循环来减少Cd的毒性作用[17].此外,MeJA还可以调节其他植物激素的含量,如乙烯和赤霉素,从而间接促进植物的生长发育[18].
2.2 MeJA对Cd胁迫下水稻幼苗Cd含量的影响
植物根系能从环境介质中吸收重金属,并转运到植物的不同部位进行累积.与Cd处理植株相比,外源喷施1 mmol L-1MeJA能有效减少Cd在水稻中的累积,使得水稻根部Cd含量和地上部Cd含量分别降低了14.42%和11.63% 如图2所示).MeJA降低植物重金属吸收的效果在秋茄、拟南芥和番茄中也有报道[19-21].说明外源MeJA可用于调控植物重金属累积.
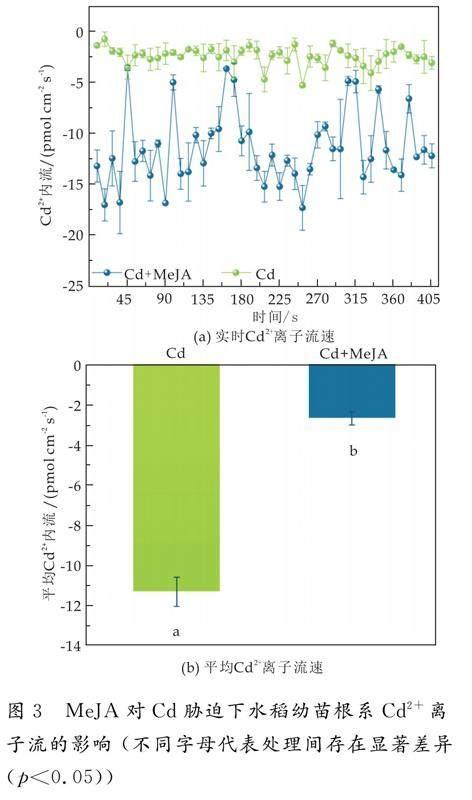
2.3 MeJA对Cd胁迫下水稻幼苗根系Cd2+离子流的影响
植物组织中的Cd含量与根表皮细胞对Cd跨膜摄取直接相关[12].因此,为了进一步阐明水稻根系对Cd的吸收特性,通过非损伤微测系统(NMT)检测了MeJA对水稻根系Cd2+离子流的影响.Cd胁迫下Cd2+大量流入水稻根系,平均流速率为11.61 pmol cm-2 s-1,喷施MeJA后,Cd2+内流现象明显被抑制,平均流速率为2.59 pmol cm-2 s-1,降低了77.69%(p<0.05)(如图3所示).说明外源喷施MeJA可以抑制Cd2+内流,减少水稻根系对Cd2+的吸收.研究表明,Cd2+可以与Ca2+竞争Ca2+通道,外源激素可以诱导Ca2+大量内流,而抑制Cd2+的吸收,说明Cd2+转运受植物信号分子或激素的调控[22-24].重金属以质膜上的阳离子转运蛋白为通道(OsNramp1、OsNramp5、OsIRT1)进入植物根系细胞,因此,Cd离子内流速率的降低可能与MeJA处理后转运蛋白基因的表达被抑制有关[25,26].
2.4 MeJA对水稻幼苗Cd亚细胞分布的影响
不同处理组Cd的亚细胞分布均表现为细胞壁>细胞质>细胞器,表明水稻累积Cd的主要部位为细胞壁,细胞质次之,累积最少的部位为细胞器.外源喷施MeJA使得Cd在根部细胞壁中的分布由58%增长到了76%,在地上部细胞壁中的分布由62%增长到了72%(如图4所示).细胞壁是阻碍重金属进入细胞的屏障[27,28].细胞壁上的多糖果胶、纤维素、半纤维素)含有带负电荷的官能团,能与重金属离子结合并将其固定在细胞壁上,从而减少Cd进入细胞的跨膜转运,减轻Cd对细胞器和细胞质的毒性,有助于维持植物细胞的正常代谢[28].
2.5 MeJA对Cd胁迫下水稻幼苗细胞壁厚度的影响
细胞壁对Cd固定能力的增强可能与细胞壁厚度的增加有关.Cd处理诱导植物细胞壁厚度的增加已在多项研究中被发现[29,30].而造成植物细胞壁增厚的主要原因是细胞壁多糖组分含量增加,提供給Cd2+的吸附位点增多[31,32].与Cd处理组相比,喷施MeJA后,地上部和地下部细胞壁厚度分别增加了39.96%和27.02%(如图5(a)、(b)所示).说明植物可以通过增加细胞壁厚度从而增强细胞壁固定Cd的能力,降低其对细胞壁和细胞质的毒害作用,有利于细胞正常生命活动的维持.同时,细胞壁厚度增加为植物细胞提供了较强的机械支持,使得Cd向原生质体转移过程中的渗透性降低[31],从而增强了植物对Cd的抗性.
2.6 MeJA对Cd胁迫下水稻根系细胞壁多糖含量及多糖中Cd含量的的影响
植物通过一系列适应机制重塑细胞壁成分和功能以应对重金属胁迫,增加细胞壁厚度,改变细胞壁与重金属离子结合的能力[33],本研究显示,MeJA处理使得Cd胁迫下水稻根系的纤维素含量增加了16.72%(如图6所示).对半纤维素和果胶的影响并不显著.细胞壁中较高水平的多糖能够增强细胞与Cd的结合.此外,细胞壁结构和组成的改变可能导致细胞壁孔隙率的改变[34],较高含量的果胶和纤维素会导致细胞壁增厚,从而降低其孔隙率,降低其对重金属的通透性[35].
细胞壁多糖中具有大量带负电的离子基团,如:羟基、氨基、羧基、醛基和巯基等,可提供较多的Cd2+结合位点,在固定Cd2+中起着重要的作用[12].对根系果胶、纤维素和半纤维素中Cd含量的分析表明,MeJA处理使得细胞壁中果胶中Cd含量增加37.81%,半纤维素中Cd含量增加了68.20%,纤维素中Cd含量增加了16.72%.
2.7 MeJA对重金属吸收转运相关基因表达的影响
Cd在植物体内的积累和分布与根表皮细胞对Cd的跨膜吸收直接相关[12].重金属跨膜运输需要借助细胞膜上的二价阳离子转运蛋白进行.OsNramp1和OsNramp5基因编码的转运蛋白是重金属进入植物细胞膜质膜的主要通道[36],OsHMA2是Cd从根部到地上部的主要转运蛋白基因[36,37].因此,本研究显示,Cd+MeJA处理6 h、9 h和12 h时,OsNramp1和OsNramp5基因的表达显著低于Cd处理植株.处理3 h、9 h和12 h时,OsHMA2基因的表达也显著低于Cd处理植株(如图7所示).说明外源MeJA可以抑制重金属吸收转运相关基因的表达,从而降低水稻根系对Cd的吸收速率及向地上部的转运速率,调控Cd在水稻中的累积分布并降低Cd对植物的毒性.
3 结论
MeJA减轻了Cd诱导的生长抑制,降低了水稻组织中Cd的含量.并通过抑制吸收转运相关基因的表达从而降低根系表皮细胞对Cd的吸收.同时,亚细胞分布显示水稻中的Cd主要位于细胞壁中,且MeJA可通过增加根细胞壁厚度和调节细胞壁中果胶、半纤维素、纤维素的含量来重建根细胞壁,从而增加了这些细胞壁组分中Cd的含量,增强了根细胞壁对Cd的固定,降低了Cd对细胞质和细胞器的生物毒性.本研究为利用MeJA调控植物重金属累积,缓解重金属胁迫提供了一定的理论基础.
参考文献
[1] 张星雨,叶志彪,张余洋.植物响应镉胁迫的生理与分子机制研究进展.植物生理学报,2021,577):1 437-1 450.
[2] 史广宇,余志强,施维林.植物修复土壤重金属污染中外源物质的影响机制和应用研究进展.生态环境学报,2021,303):655-666.
[3] 方 波,肖腾伟,苏娜娜,等.水稻镉吸收及其在各器官间转运积累的研究进展.中国水稻科学,2021,353):255-237.
[4] 刘宇婧,冯艺玫,刘欣悦,等.镉对波斯菊种子发芽的影响及外源MeJA的缓解作用.草业学报,2017,261):122-130.
[5] Ulloa-Inostroza E M,Alberdi M,Merio-Gergichevich C,et al.Low doses of exogenous methyl jasmonate applied simultaneously with toxic aluminum improve the antioxidant performance of vaccinium corymbosum.Plant and Soil,2016,4121):81-96.
[6] Singh I,Shah .Exogenous application of methyl jasmonate lowers the effect of cadmium-induced oxidative injury in rice seedlings.Phytochemistry,2014,108:57-66.
[7] Chen J,Yan ,Li X.Effect of methyl jasmonate on cadmium uptake and antioxidative capacity in kandelia obovata seedlings under cadmium stress.Ecotoxicology &Environmental Safety,2014,1041):349-356.
[8] Yan ,Chen J,Li X.Methyl jasmonate as modulator of Cd toxicity in capsicum frutescens var.fasciculatum seedlings.Ecotoxicology and Environmental Safety,2013,983):203-209.
[9] Farooq M A,Gill R A,Islam F,et al.Methyl jasmonate regulates antioxidant defense and suppresses arsenic uptake in Brassica napus L.Frontiers in Plant Science,2016 7):1-16.
[10] Farooq M A,Islam F,Yang C,et al.Methyl jasmonate alleviates arsenic-induced oxidative damage and modulates the ascorbate-glutathione cycle in oilseed rape roots.Plant Growth Regulation,2017,841):135-148.
[11] Wei T,Li X,Li H,et al.The potential effectiveness of mixed bacteria-loaded biochar/activated carbon to remediate Cd,Pb co-contaminated soil and improve the performance of pakchoi plants.Journal of Hazardous Materials,2022,435:129 006.
[12] Jia H,Wang X,Shi C,et al.Hydrogen sulfide decreases Cd translocation from root to shoot through increasing Cd accumulation in cell wall and decreasing Cd2+ influx in Isatis indigotica.Plant Physiology and Biochemistry,2020,155:605-612.
[13] Wu X,Song H,Guan C,et al.Boron alleviates cadmium toxicity in Brassica napus by promoting the chelation of cadmium onto the root cell wall components.Science of the Total Environment,2020,728:138 833.
[14] Pilaisangsuree V,Anuwan P,Supdensong ,et al.Enhancement of adaptive response in peanut hairy root by exogenous signalling molecules under cadmium stress.Journal of Plant Physiology,2020,2542):153 278.
[15] Yan ,Chen J,Li X.Methyl jasmonate as modulator of Cd toxicity in capsicum frutescens var.fasciculatum seedlings.Ecotoxicology and Environmental Safety,2013,98:203-209.
[16] Asghari M,Merrikhi M,avoosi B,et al.Methyl jasmonate foliar spray substantially enhances the productivity,quality and phytochemical contents of pomegranate fruit.Journal of Plant Growth Regulation,2020,39:1 153-1 161.
[17] Farooq M A,Islam F,Yang C,et al.Methyl jasmonate alleviates arsenic-induced oxidative damage and modulates the ascorbate-glutathione cycle in oilseed rape roots.Plant Growth Regulation,2018,84:135-148.
[18] Fahad S,Hussain S,Saud S,et al.Exogenously applied plant growth regulators enhance the morpho-physiological growth and yield of rice under high temperature.Frontiers in Plant Science,2016,7:1 250.
[19] Wei T,Sun Y,Li H,et al.Methyl jasmonate triggers cadmium detoxification in tomato plants via depressing Cd2+influx,altering the subcellular distribution,and chemical forms of cadmium.Water,Air,and Soil Pollution,2022,23311):2-16.
[20] 冯文静,高 巍,刘红恩,等.植物生长调节剂促进小麦幼苗生长及降低镉吸收转运的研究.河南农业大学学报,2021,556):1 036-1 044.
[21] Lu Q,Weng Y,You Y,et al.Inoculation with abscisic acid ABA)-catabolizing bacteria can improve phytoextraction of heavy metal in contaminated soil.Environmental Pollution,2020,257:113 497.
[22] Chen S,Jia H,Wang X,et al.Hydrogen sulfide positively regulates abscisic acid signaling through persulfidation of SnR2.6 in guard cells.Molecular Plant,2020,135):732-744.
[23] Li L ,Liu X L,Peijnenburg W J,et al.Pathways of cadmium fluxes in the root of the halophyte suaeda salsa.Ecotoxicology and Environmental Safety,2012,75:1-7.
[24] 张 硕.根际阴离子背景、pH值以及钙、钾离子浓度对水稻根系镉吸收和转运的效应分析[D].杭州:浙江大学,2020.
[25] Song Y,Jin L,Wang X.Cadmium absorption and transportation pathways in plants.International Journal of Phytoremediation,2017,192):133-141.
[26] 杨 猛.水稻NRAMP家族基因在Mn和Cd转运中的功能研究[D].武汉:华中农业大学,2014.
[27] 王学华,戴 力.作物根系镉滞留作用及其生理生化机制.中国农业科学,2016,4922):4 323-4 341.
[28] Gao M Y,Chen X W,Huang W X,et al.Cell wall modification induced by an arbuscular mycorrhizal fungus enhanced cadmium fixation in rice root .Journal of Hazardous Materials,2021,416:125 894.
[29] Fan J L,Wei X ,Wan L C,et al.Disarrangement of actin filaments and Ca2+ gradient by CdCl2 alters cell wall construction in arabidopsis thaliana root hairs by inhibiting vesicular trafficking.Journal of Plant Physiology,2011,16811):1 157-1 167.
[30] rzesowska M,Rabda I,Basińska A,et al.Pectinous cell wall thickenings formation:A common defense strategy of plants to cope with Pb.Environmental Pollution,2016,214:354-361.
[31] Aleamotua M,Mccurdy D W,Collings D A.Phi thickenings in roots:Novel secondary wall structures responsive to biotic and abiotic stresses.Journal of Experimental Botany,2019,7018):4 631-4 642.
[32] 刘清泉,陈亚华,沈振国,等.细胞壁在植物重金属耐性中的作用.植物生理学报,2014,505):605-611.
[33] Yang B,Eticha D,Rao I M,et al.Alteration of cell-wall porosity is involved in osmotic stress-induced enhancement of aluminium resistance in common bean Phaseolus vulgaris L.) .Journal of Experimental Botany,2010,6112):3 245-3 258.
[34] Schmohl N,Horst W.Cell wall pectin content modulates aluminium sensitivity of ea mays L.) cells grown in suspension culture.Plant Cell Environ,2000,23:735-742.
[35] Wu X,Song H,Guan C,et al.Boron alleviates cadmium toxicity in Brassica napus by promoting the chelation of cadmium onto the root cell wall components.Science of the Total Environment,2020,728:138 833.
[36] 杨耀帅,梅秀芹,李取生,等.缺氧和充氧栽培對水稻Cd积累及OsHMA2基因表达的影响.华南农业大学学报,2017,385):24-29.
[37] Akagi H.Mutations in rice Oryza sativa) heavy metal ATPase 2 OsHMA2) restrict the translocation of zinc and cadmium.Plant and Cell Physiology,2012,531):213-224.
【责任编辑:陈 佳】
基金项目:陕西省科技厅自然科学基础研究计划项目(2023-JC-YB-265)
作者简介:魏 婷(1983—),女,陕西眉县人,讲师,博士,研究方向:植物重金属抗性

