益气固表丸对慢性阻塞性肺疾病细胞模型线粒体中SIRT5表达的影响
蒙 婷,徐 丹,米叶斯尔·买买提艾力,荆 晶,李风森1,
(1. 新疆医科大学中医学院,新疆 乌鲁木齐 830011;2. 新疆维吾尔自治区第八人民医院,新疆 乌鲁木齐 830000;3. 新疆医科大学第四附属医院/国家中医临床研究基地,新疆 乌鲁木齐 830000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)发病机制复杂,近年来大量研究发现线粒体功能异常也是导致COPD的机制之一,调控线粒体功能成为研究COPD的一个重要方向[1]。SIRT5主要位于线粒体中,是通过去乙酰化抗氧化剂、线粒体维持和能量代谢蛋白来调节细胞应激反应的关键介质,有较明显的去琥珀酰化作用[2-3]。而SIRT5调控的琥珀酰化与线粒体功能密切相关,琥珀酰化参与线粒体功能障碍是许多疾病的一个共同因素[4-6]。益气固表丸是在六君子汤的基础上加减化裁而来,具有健脾益肺、化痰止咳的功效,是治疗COPD的有效药物,起效机制与氧化还原过程、细胞能量凋亡过程的负向调节等生物学过程、细胞成分组成有关[7]。但益气固表丸是否可以影响线粒体发生琥珀酰化从而改善COPD线粒体功能障碍尚不明确,故本研究通过SIRT5调控COPD细胞模型发生琥珀酰化,探究了益气固表丸对COPD细胞线粒体琥珀酰化的影响,进一步从分子生物学方面为COPD的临床治疗思路及用药提供科学依据。
1 实验材料与方法
1.1细胞及药物 人支气管上皮样细胞16HBE 购自中桥新舟;益气固表丸由党参、炒白术、茯苓、陈皮、法半夏、生薏苡仁、浮小麦、紫苏子、蜜款冬花、黄芩、伊贝母、蜜枇杷叶、防风组成,益气固表丸含药血清为前期大鼠实验制备的冻存血清。
1.2试剂及仪器 KM培养基(Hyclone,USA);胎牛血清(FBS,Hyclone,USA);青链双抗(上海生工);二甲基亚砜(DMSO,USA)、Lipofectamine®RNAi MAX Reagent、Trizol(Thermo,USA);SYBRGreen PCR试剂盒(Thermo,F-415XL,USA);反转录试剂盒(Thermo,K1622,USA);线粒体膜电位试剂盒(abcam,C2003S,中国);ATP ELISA试剂盒(abcam,S0026,中国);96孔培养板及6孔培养板(Costar,USA);酶标检测仪(Thermo, MK3,USA);细胞培养箱(Thermo,Scientific8000,USA);低温冷冻离心机(Sigma,3K15,USA);Real-time检测仪(ABI-7500,USA);涡旋混合器(Scientific Industries);RT-6100 酶标仪(雷杜,rt6100,中国);荧光倒置显微镜(OLYMPUS,IX7,日本)。
1.3COPD细胞模型建立 在37 ℃、5%CO2条件下,将16HBE细胞接种于含有FBS和青链双抗的KM培养基中培养。选用红云红河烟草集团的红河牌香烟(每支香烟焦油含量11 mg,烟气烟碱含量 1 mg,烟气一氧化碳含量13 mg),点燃后将过滤嘴端接注射器,将600 mL烟雾注入含25 mL的玻璃瓶中,即为100%香烟烟雾提取物(CSE)原液。CSE在实验前30 min制备,经过滤除菌后,用KM培养基稀释为1.25%,2.5%,5%,10%,20%的浓度分别处理1×105个/mL 16HBE细胞6 h、12 h、24 h、48 h。每个浓度细胞培养至预定时间,每孔加入20μLMTT(5 mg/mL),37 ℃、5%CO2培养箱中继续培养4 h,吸取孔内培养上清液,每孔加入150 μL DMSO,震荡10 min,用连续光谱酶标仪(波长492 nm)测定各孔的吸光度值,计算细胞抑制率[(1-实验组OD值/空白组OD值)×100%],选取CES的最佳干预浓度和时间用于后续实验。
1.4细胞siRNA转染、RT-qPCR筛选SIRT5最佳敲降靶序 将COPD细胞分为COPD组、COPD+siRNA 空转组、COPD+siRNA119组、COPD+siRNA 120组、COPD+siRNA 141组。每组调整细胞浓度为2×105个/mL,通过Lipofectamine®RNAi MAX Reagent 转染siRNA SIRT5,用Trizol提取细胞线粒体总RNA,用反转录试剂盒将总RNA反转录为cDNA,采用SYBR Green PCR试剂盒进行RT-qPCR,以GAPDH作为内参基因。SIRT5引物序列:上游为5’-GGAGCAAGGAGCCCAACGCCGGGCA-3’,下游为5’-CCACAAGAGGTACATCGAGTTTTAA-3’;GAPDH引物序列:上游为5’-AGAAGGCTGGGGCTCATTTG-3’,下游为5’-AGGGGCCATCCACAGTCTTC-3’。用2-ΔΔCT方法分析SIRT5mRNA相对表达量。并利用RT-qPCR验证转染效率,选取转染编号最佳的siRNA120用于后续实验。
1.5细胞分组干预 实验设6组:正常组16HBE细胞常规培养;COPD组COPD造模细胞常规培养;COPD+siRNA空转组取COPD细胞,siRNA空转染后培养;COPD+siRNA SIRT5组取COPD细胞,采用最佳的siRNA120转染后培养;COPD+益气固表丸组取COPD细胞,加入20%益气固表丸含药血清培养;COPD+siRNA SIRT5 +益气固表丸组取COPD细胞,采用最佳的siRNA120转染后,加入益气固表丸含药血清培养。
1.6检测指标及方法
1.6.1细胞形态 在电子显微镜下观察各组细胞形状、透亮度、折光性及密度。
1.6.2线粒体膜电位 将各组细胞按1×106个/mL的浓度重悬于培养基中;加入配置好的JC-1染液;在细胞培养箱中按37 ℃、5%CO2的条件孵育10~30 min;用培养基重悬细胞,再离心收集,重复2次,以洗涤细胞;在激发波长488~505 nm、发射波长515~575 nm条件下,采用流式细胞仪检测荧光信号的强度。当线粒体膜电位较高时,JC-1聚集在线粒体基质内,产生红色荧光;当线粒体膜电位下降时,J为单体不聚集在线粒体基质内,产生绿色荧光。使用Image J计算荧光强度。
1.6.3细胞内活性氧(ROS)含量 细胞按1×106个/mL重悬于培养基中,加入配置好的10 μmol/L DCFH-DA工作液, 37 ℃孵育30~60 min;1 000×g离心5~10 min收集细胞,用PBS 洗涤1~2次,离心收集细胞沉淀物用于荧光检测;将收集好的细胞用PBS重悬,在激发波长485~500 nm、发射波长525 nm条件下进行流式细胞仪检测,计算荧光强度。
1.6.4细胞中ATP含量 ATP反应液用10 mL含2 mmol/L EDTA的0.1 mol/L pH7.75 Tris-醋酸缓冲液稀释;在细胞培养板中(每孔含100 μL细胞培养液),每孔加入0.1 mL ATP释放因子,室温中反应5 min;吸取0.1 mL细胞溶解物,加入到另一块细胞培养板的各孔中,置于自动多孔荧光检测仪中,用自动加样器,每孔加入20 μL ATP反应液,酶标仪于636 nm处测各样本吸光度值。
1.6.5细胞中SIRT5表达情况 按照1.4中方法检测并计算各组细胞中SIRT5 mRNA相对表达量。
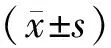
2 结 果
2.1显微镜下细胞形态 正常组细胞折光性好,细胞膜边界清晰,形态展开;COPD组和COPD+siRNA空转组细胞皱缩变圆,细胞密度低,细胞状态差; COPD+siRNA SIRT5组细胞状态更差,细胞大量皱缩变圆,折光性变差,细胞膜边界不完整,无展开形态;COPD+益气固表丸组 、COPD+siRNA SIRT5 +益气固表丸组细胞状态明显改善,细胞透光性变强。见图1。

图1 正常组和慢性阻塞性肺疾病细胞模型各组细胞形态(×400)
2.2显微镜下线粒体膜电位情况 与正常组比较,COPD各组红色荧光减弱,绿色荧光增强,表明线粒体膜电位下降,线粒体出现功能障碍;与COPD组比较,COPD+益气固表丸组 、COPD+siRNA SIRT5+益气固表丸组红色荧光增强,绿色荧光减弱。见图2。
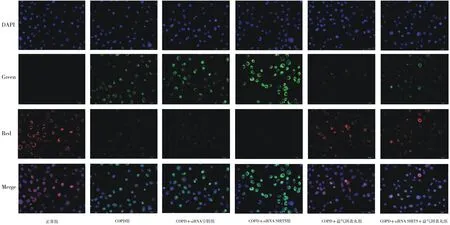
图2 正常组和慢性阻塞性肺疾病细胞模型各组电镜下线粒体膜电位荧光情况(×400)
2.3线粒体膜电位及线粒体中ROS含量 与COPD组比较,COPD+siRNA SIRT5组线粒体膜电位明显降低(P<0.05),ROS含量明显升高(P<0.05);与COPD组和COPD+siRNA SIRT5组比较,COPD+益气固表丸组和COPD+siRNA SIRT5 +益气固表丸组线粒体膜电位均明显升高(P均<0.05),ROS含量均明显降低(P均<0.05)。见图3。

图3 正常组和慢性阻塞性肺疾病细胞模型各组线粒体膜电位及线粒体中ROS含量
2.4细胞中ATP含量 COPD各组ATP含量均明显低于正常组(P均<0.05),且COPD+siRNA SIRT5组ATP含量明显低于COPD组(P<0.05); COPD+益气固表丸组和COPD+siRNA SIRT5 +益气固表丸组ATP含量均明显高于COPD组和COPD+siRNA SIRT5组(P均<0.05)。见图4。
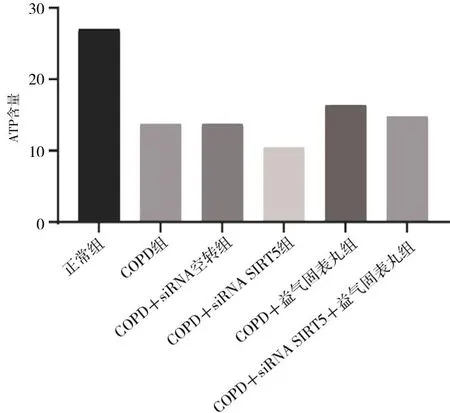
图4 正常组和慢性阻塞性肺疾病细胞模型各组细胞中ATP含量
2.5细胞中SIRT5 mRNA相对表达量 COPD各组SIRT5 mRNA相对表达量均明显低于正常组(P均<0.05),且COPD+siRNA SIRT5组SIRT5 mRNA相对表达量明显低于COPD组(P<0.05);COPD+益气固表丸组和COPD+siRNA SIRT5+益气固表丸组SIRT5 mRNA相对表达量均明显高于COPD+siRNA SIRT5组(P均<0.05)。见图5。
图5 正常组和慢性阻塞性肺疾病细胞模型各组细胞中SIRT5 mRNA相对表达量
3 讨 论
西医对于缓解COPD的临床症状、延长急性发作的间隔期、缩短发作时间及减少发作次数的治疗手段有限。随着中医治疗优势的不断显现,中药在COPD的临床治疗中发挥了重要作用。中医“治病必求于本”,本虚是决定COPD发生及发展的关键因素。《难经·六十九难》提示“虚则补其母”,脾为肺之母,脾主运化,其功能正常,才能化生精、气、血、津液给人体提供足够的养料,人体组织才能得到充分的营养。多数研究者运用培土生金的方法治疗COPD稳定期取得了良好的疗效,可以进一步改善患者的呼吸症状及全身症状[8-10]。张少华等[7]研究发现,具有脾虚特征的COPD 患者外周血有核细胞线粒体膜电位、细胞内活性氧含量异常,线粒体膜电位在肺脾气虚组最低,细胞内活性氧含量在肺脾气虚组最高,提示COPD 患者线粒体功能障碍与脾虚关系密切。益气固表丸主要作用是健脾益肺,根据上述研究推测益气固表丸可能改善COPD患者线粒体功能障碍。SIRT5是Sirtuin家族7个成员之一,是负向调控赖氨酸琥珀酰化修饰的一种去琥珀酰化酶[11]。有研究发现,SIRT5可以将超氧化物歧化酶1(SOD1)赖氨酸123位点上的琥珀酰基脱去,降低细胞内的活性氧含量,说明琥珀酰化抑制了SOD酶活性并影响其功能,通过上调SOD1的酶活性,可促进ROS的清除[12]。Sadhukhan等[13]报道,SIRT5敲除小鼠在禁食和运动条件下心脏出现脂肪酸代谢受损和ATP生成减少。Guedouari等[14]发现在能量缺失状态下,线粒体伸长以逃避自噬降解,SIRT5缺失抑制了线粒体延伸,导致线粒体吞噬增加,表明SIRT5能保护线粒体在能量缺失状态下不发生断裂和降解。Li等[15]研究发现,SIRT5可能通过调控转录因子NF-E2相关因子2(Nrf2)/血红素加氧酶-1(HO-1)和Bcl-2,减弱顺铂诱导的人肾HK-2细胞凋亡和线粒体损伤。
香烟烟雾是导致COPD发生及疾病进展的主要原因之一,可以干扰线粒体能量的产生,造成上皮细胞产生大量的ROS,引发气道顽固性炎症反应[16-17]。长期暴露于CSE的呼吸道上皮细胞的观察结果显示,CSE在线粒体形态学上引起了类似的畸变[18],这些形态学改变与线粒体功能障碍之间有潜在的联系,包括ATP含量降低、线粒体膜电位下降、ROS含量升高[19]。本研究使用CSE诱导16HBE细胞损伤,结果显示细胞内线粒体出现功能障碍,能量合成和转化功能的下降导致细胞的形态及密度的改变,同时线粒体膜电位、ATP含量及SIRT5 mRNA相对表达量下降,ROS含量升高;COPD+益气固表丸组与COPD组相比,细胞形态明显改善,线粒体膜电位、ATP含量、SIRT5 mRNA相对表达量均明显升高,ROS含量明显降低,证明益气固表丸可上调SIRT5表达,能够改善细胞膜电位及线粒体功能障碍。另外与COPD+siRNA SIRT5组比较, COPD+siRNA SIRT5+益气固表丸组线粒体膜电位、ATP含量、SIRT5 mRNA相对表达量均明显升高,ROS含量明显降低。因此推测益气固表丸可能参与调控与SIRT5表达相关的某些重要通路或关键酶的活性,对SIRT5的表达起作用,也可能具有与SIRT5同样的功能,参与调控琥珀酰化修饰,从而改善线粒体功能障碍。
综上所述, SIRT5表达量与COPD线粒体功能障碍有关,其表达减少会加重COPD线粒体功能障碍,益气固表丸可以通过上调SIRT5的表达而改善COPD线粒体功能障碍;在SIRT5缺失的情况下,益气固表丸可能通过其他作用靶点影响SIRT5的表达调控COPD线粒体功能,SIRT5调控的琥珀酰化可能是益气固表丸治疗COPD的新的作用靶点,有待进一步研究。
利益冲突:所有作者均声明不存在利益冲突。

