姜黄素衍生碳点缓解甘薯镉毒害的作用机制
高佳 潘志远 夏楠 李宗芸 孙健 李艳娟


高 佳,潘志远,夏 楠,等. 姜黄素衍生碳点缓解甘薯镉毒害的作用机制[J]. 江苏农业科学,2024,52(7):65-71.
doi:10.15889/j.issn.1002-1302.2024.07.009
(江蘇师范大学生命科学学院,江苏徐州 221116)
摘要:为研究碳点缓解植物镉胁迫的作用机制,为植物非生物胁迫下外源施用生物质碳点提供科学依据,以生物质姜黄素为碳源,通过简单的一步水热法制备水溶性碳点(CDs)。以甘薯为植物模型,设置如下4个试验处理:霍格兰营养液(CK);含0.7 mg/mL CDs的霍格兰营养液(CDs);含100 μmol/L CdCl2的霍格兰营养液(Cd);同时含有 0.7 mg/mL CDs、100 μmol/L CdCl2的霍格兰营养液(Cd+CDs),研究不同处理对甘薯叶片光合特性、根系抗氧化系统及NO积累量、镉离子吸收情况的影响。结果表明,合成的CDs平均尺寸为2.29 nm,表面富含酚羟基、甲氧基,保留了姜黄素的药理学特性;与受到镉胁迫的甘薯幼苗相比,添加CDs后,受到镉胁迫的甘薯幼苗的叶绿素a、叶绿素b、总叶绿素含量分别增加了55.0%、41.3%、51.6%,净光合速率、气孔导度、蒸腾速率分别提高了168.9%、33.8%、295%,胞间二氧化碳浓度显著降低了41.9%,MDA、脯氨酸含量、硝酸还原酶活性、NO积累水平显著降低,根尖镉离子内流显著减少。综上所述,CDs通过降低镉胁迫下甘薯幼苗体内的硝酸还原酶活性来减少甘薯体内镉诱导的NO积累,从而减少镉离子内流,缓解甘薯幼苗受到的镉胁迫,提高甘薯叶绿素含量和光合速率。
关键词:镉胁迫;甘薯;碳点;光合作用;一氧化氮
中图分类号:S181;S531.01 文献标志码:A 文章编号:1002-1302(2024)07-0065-06
随着经济的快速发展,各种工业用水被大量排放在环境中,造成环境重金属污染日益严重,其中镉污染最为突出。镉是植物非必需的矿质元素,但是由于其具有溶解性高、迁移性强等特点,使其在土壤中极易被植物吸收并通过作物的富集进入食物链,威胁人类健康[1-2]。有研究发现,即便是低剂量的镉也会对植物造成较强的毒性,植物遭受镉毒害后,常常会表现出叶片失绿发黄卷曲、根系生长受到抑制、光合速率降低、根系对矿质元素和水分的吸收受到抑制等症状,使得作物产量和品质降低[3]。甘薯属于旋花科植物,在我国有数百年的种植历史,是我国主要的粮食作物之一,具有丰富的营养价值,深受人们的喜爱[4]。然而,甘薯块根对镉具有一定的吸收和积累能力,使得甘薯的生长发育受到抑制。重要的是,人们食用过量积累镉元素的甘薯后有一定的健康风险。因此,通过研究镉胁迫下甘薯幼苗的生理及分子机制,从而提高甘薯对镉的耐受性,对实际生产具有重要的指导意义。
近年来,纳米技术得到快速发展,纳米材料由于自身优越的物理、化学、光学和生物学特性,使其在不同领域都具有重要的研究价值,因此众多研究者认为纳米材料是21世纪最具有应用前景的材料。碳点(CDs)是一种新型的纳米材料,其直径小于 10 nm,具有良好的生物相容性、低毒性、较好的水溶性和较大的比表面积等优点,被广泛应用于生物医学、农业生产和植物保护等领域[5]。生物质作为合成生物质CDs的原材料,与其他碳源相比具有众多优势,如价格低廉、来源广泛、绿色环保等。近年来,各种各样的生物质被用来制备CDs,并被广泛应用在农业生产中,以促进农业高效安全和可持续发展[6-7]。例如,Li等合成了丹参衍生CDs以显著缓解甘薯盐胁迫、低钾胁迫和低铁胁迫[8]。Lei所在课题组以黄柏粉为碳源制备出双发射CDs,显著提高了植物的光合作用及农作物产量[9]。由此可见,将纳米技术与生物技术交叉融合进行研究,能够有效解决农业上的难题,促进农业的可持续发展。
姜黄素来源于姜黄属植物的根状茎,是一种天然的多酚类化合物,其安全性较高,是食品中使用的9种天然色素之一。有研究发现,姜黄素具有众多药理活性,如抗氧化、抗炎和抗菌等,因此姜黄素被广泛应用在生物学领域[10]。然而,由于姜黄素水溶性极低、结构不稳定性,并且对光、热和pH值较为敏感,使其在生物中的应用受到严重限制。近年来,纳米技术为姜黄素在生物中的递送提供了新途径,如利用纳米材料作为载体将姜黄素递送到生物体内以提高其生物利用度,或将姜黄素制成纳米制剂以提升其稳定性[11-13]。然而,上述方法虽然提高了姜黄素的水溶性和生物利用度,但是仍然存在工艺复杂、载药量较低等问题。本研究以姜黄素为碳源,利用简单的水热法一步合成小尺寸的水溶性CDs,其表面含有丰富的酚羟基和甲氧基等功能官能团,因此制备的CDs不但具有良好的水溶性,而且保留了姜黄素的生物学属性。进一步通过水培法探究制备的CDs对镉胁迫下甘薯幼苗生理生长的影响及其作用机制,以期为CDs在农业上的应用提供理论依据。
1 材料与方法
本研究于2023年在江苏师范大学生命科学学院甘薯性状改良关键理论与技术实验室进行。供试植物材料为徐紫薯8号,由江苏徐淮地区徐州农业科学研究所提供。
1.1 碳点的制备
通过一步水热法制备CDs,首先称取300 mg姜黄素粉末溶于30 mL磷酸缓冲液(0.2 mol/L,pH值为12)中,搅拌均匀后倒入高压反应釜内,180 ℃反应8 h,反应结束后冷却到室温,所得溶液即为CDs溶液。为了除去CDs溶液中的杂质,混合溶液用022 μm过滤膜除去大分子杂质,随后将过滤液用1 000 u的透析袋透析8 h以除去未反应的小分子物质。将获得的CDs溶液保存在4 ℃冰箱中备用。
1.2 碳点的表征
CDs形态特征的表征采用透射电镜(TEM)和高分辨透射电镜(HRTEM),化学组成和表面官能团分析分别用射线光电子能谱仪(XPS)和傅里叶变换红外光谱(FTIR)分光光度计。
1.3 植物材料的培养与处理
剪取15 cm形态良好、茎部粗细一致、无病害的甘薯茎蔓,[JP2]用清水沖洗干净后插入1/2霍格兰营养液中进行水培生根培养,于昼—夜温度25 ℃—20 ℃、[JP]光—暗周期16 h—8 h、光照度300 μmol/(m2·s)的温室中培养1周后,挑选大小一致的甘薯幼苗,分别置于霍格兰营养液(CK)、含0.7 mg/mL CDs的霍格兰营养液(CDs)、含100 μmol/L CdCl2的霍格兰营养液(Cd)及同时含有0.7 mg/mL CDs和 100 μmol/L CdCl2的霍格兰营养液(Cd+CDs)中进行培养。每个处理设置6次重复,添加通气泵,每 5 d 置换1次处理液,培养15 d后收获,并测定相应生理指标。
]1.4 光合色素含量的测定
在每组处理中分别取相同部位的成熟叶片测定光合色素含量,去除叶片两端及叶脉后,称取 0.2 g 甘薯叶片放入含有15 mL无水乙醇的离心管中,分散均匀后置于黑暗环境中。24 h后取200 μL上述浸提液加入96孔酶标板中,以乙醇作为空白对照,用酶标仪分别测量提取液在649、665 nm 2个波长下的吸光度,相关公式如下:
Ca=13.95D665 nm-6.88D649nm;(1)
Cb=24.96D649 nm-7.32D665 nm;(2)
CT=Ca+Cb;(3)
色素含量(μg/mL)=(CVN)/(W/1 000)。(4)
式中:C为光合色素浓度,μg/mL;V为提取液总体积,mL;N为稀释的倍数;W为样品鲜重,g。
1.5 光合指标的测定
利用美国Li-cor公司生产的Li-6400便携式光合仪测定不同处理下甘薯幼苗的净光合速率、蒸腾速率、气孔导度和胞间CO2浓度,测定时间统一为09:00—10:00,分别选取植株第3、4张叶片进行测定,参比室CO2浓度为400 μmol/mol,光子通量为1 000 μmol/(m2·s),平均10 s记录1个读数,共记录2 min后,计算平均数后记录。
1.6 MDA含量的测定
取植物根系,用流水冲洗干净后擦干,并将其剪碎,称取0.2 g样品,放入提前预冷的研钵中,向研钵中加入1.8 mL含1%聚乙烯吡咯烷酮(PVP)的磷酸缓冲液(50 mmol/L,pH值为7.8),充分研磨成匀浆,倒入离心管中,4 ℃、12 000 r/min离心 10 min。取上清液,用南京建成生物工程研究所的试剂盒进行MDA含量的测定。
1.7 脯氨酸含量的测定
取植物根系,用流水冲洗干净后擦干,称取 0.2 g 样品,加入2 mL含1% PVP的磷酸缓冲液(50 mmol/L,pH值为7.8),剪碎植物根系并将其研磨成匀浆,制备成10%的匀浆液,3 500 r/min 离心10 min。取上清液,用南京建成生物工程研究所的试剂盒进行测定。
1.8 硝酸还原酶活性的测定
硝酸还原酶活性的测定采用磺胺比色法,取植物根系用流水冲洗干净后擦干,按照组织质量 ∶提取液体积=1 g ∶10 mL的比例(建议称取约0.1 g组织,加入1 mL提取液)进行组配,在冰浴中研磨成匀浆,8 000 r/min、4 ℃离心10 min。取上清液,用南京建成生物工程研究所提供的试剂盒进行测定[14]。
1.9 根细胞NO含量的测定
用具有NO特异性的荧光染料(DAF FM diacetate)监测根细胞中NO的积累水平[15]。取4种不同处理24 h后的甘薯根尖(3 cm左右),置于含有20 μmol/L荧光染料(DAF FM diacetate)的二甲基亚砜(DMSO)溶液中孵育。2 h后用蒸馏水反复冲洗根尖组织,随后用Leica DM5000 B荧光显微镜观察根细胞中NO的积累量。
1.10 根尖Cd2+离子流的测定
利用非损伤微测系统(NMT-100-SIM-YG)测定不同处理下徐紫薯8号根细胞Cd2+离子流的变化。试验步骤如下:分别采集不同处理下甘薯幼苗的根尖(3 cm),用测试液冲洗后,在测试液中平衡10 min,然后将根尖置于塑料培养皿中,用双层滤纸、树脂块固定,进行Cd2+离子流的测试。测试位点分别为根尖分生区(距尖端0~1.0 mm)、根尖伸长区(距尖端1.5~2.0 mm)和成熟区(距尖端 10~12 mm),每个点进行5 min连续测量记录。
1.11 数据处理
所有数据使用Excel进行整理,用SPSS Statistics 20.0软件对数据进行单因素方差分析,采用的方法为最小显著性差异法(LSD),用Origin 9.0作图。
2 结果与分析
2.1 CDs的表征
本试验以姜黄素作为原材料,通过一步水热法合成水溶性CDs。由高分辨透射电镜(HRTEM)结果(图1-a)可知,合成的CDs具有较好的单分散性,呈球形颗粒,尺寸均匀。由图1-b可知,合成的CDs具有明显可分辨的晶格条纹,间距为0.21 nm,说明合成的CDs具有石墨烯的(010)衍射面。通过测量150个纳米颗粒的直径可知,合成的CDs粒径范围在1.2~3.6 nm之间,平均粒径约为2.29 nm(图1-c)。
为了确定CDs的化学成分和表面官能团,进行如下表征分析:由傅里叶变换红外光谱(FTIR)(图1-d)可知,合成的CDs在3 050~3 700 cm-1宽吸收峰属于酚羟基(—OH)的拉伸振动,2 959、2 462 cm-1 处的特征峰分别属于甲氧基(—OCH3)中C—H的不对称振动峰、C—C健的伸缩振动,1 462 cm-1 处的吸收峰属于C[FY=,1]O双键或C[FY=,1]C双键的振动,1 000~1 300 cm-1处的吸收峰属于CDs的C—O—C的伸缩振动[16-17]。FTIR结果表明,合成的CDs表面保留了姜黄素中的酚羟基和甲氧基。众多研究发现,酚羟基、甲氧基是姜黄素发挥多种生物活性和药理作用的活性位点,因此推测,合成的CDs保留了姜黄素的药理作用和生物学特性,具有较强的抗氧化能力[18]。XPS能谱图结果表明,CDs中主要含有C、O这2种元素(图1-e)。
2.2 CDs对镉胁迫下甘薯叶绿素含量的影响
光合色素是植物进行光合作用的基础,重金属Cd可以通过抑制叶绿素的合成来降低植物的光合作用[19]。为了探究合成的CDs对镉胁迫下甘薯叶片光合色素的影响,本研究测定了不同处理下甘薯叶片的叶绿素a、叶绿素b、总叶绿素含量。由图2可见,与CK相比,单独的CDs处理能够提高甘薯幼苗的叶绿素a、叶绿素b、总叶绿素含量,但是影响不显著。镉胁迫能够显著抑制甘薯叶片的叶绿素a、叶绿素b、总叶绿素的生成。与单独镉胁迫的甘薯幼苗相比,添加CDs后,镉胁迫下甘薯幼苗的叶绿素a、叶绿素b、总叶绿素含量显著提高,分别增加了55.0%、41.3%、51.6%。上述结果表明,CDs能够缓解镉毒害,促进植物对光合色素的合成。
2.3 CDs对甘薯光合作用的影响
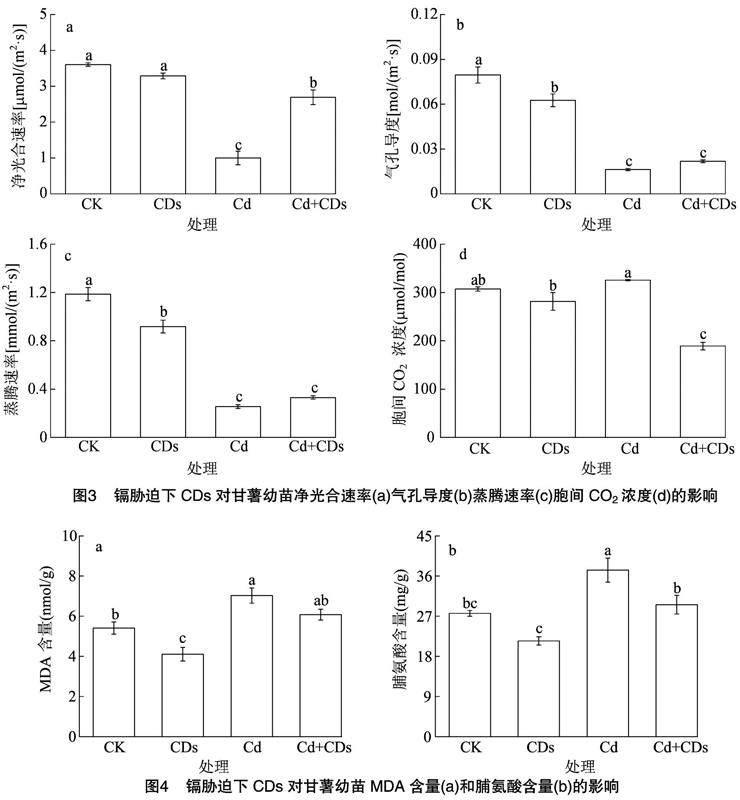
光合作用是植物生命活动的基础,受到镉胁迫后,植物的光合作用会受到显著抑制。由图3可知,与CK相比,CDs处理下甘薯幼苗的净光合速率、气孔导度、蒸腾速率和胞间二氧化碳浓度的变化没有显著差异,镉胁迫会显著降低甘薯幼苗的净光合速率、气孔导度和蒸腾速率,而胞间二氧化碳浓度略微升高,表明镉对甘薯幼苗光合作用的抑制并不是受到气孔因素的影响。与镉胁迫下的甘薯幼苗相比,添加CDs处理后,甘薯幼苗的镉毒害作用得到了显著缓解,其中净光合速率、气孔导度、蒸腾速率分别显著提高了168.9%、 33.8%、29.5%, 胞间二氧化碳浓度显著降低了41.9%。表明CDs能够显著缓解镉毒害,提高植物的光合作用速率。
2.4 CDs对甘薯幼苗体内MDA含量和脯氨酸含量的影响
镉胁迫会诱导植物体内产生大量活性氧,从而导致细胞膜脂受损,使得植物体内MDA含量升高,因此MDA含量的高低可以用来评价过氧化伤害的强弱。由图4-a可见,与CK相比,镉胁迫显著增加了甘薯幼苗体内MDA的含量,表明镉胁迫后植物受到严重的氧化损伤。然而与单独镉胁迫处理的甘薯幼苗相比,添加CDs后,受到镉胁迫的甘薯幼苗根中MDA含量降低,表明CDs处理降低了甘薯幼苗的膜脂过氧化程度。脯氨酸是植物体内的一种游离氨基酸,当植物受到胁迫时,通过增加脯氨酸含量来调节细胞渗透压以维持细胞膜结构的稳定性。因此,植物体内脯氨酸的含量积累可能是植物适应外界環境的表现,也可能是植物细胞受损的表现[20]。由图4可知,与CK相比,镉胁迫能够显著增加甘薯幼苗体内脯氨酸含量,说明镉胁迫使得甘薯细胞严重受损,而添加CDs后,受到镉胁迫的甘薯幼苗体内脯氨酸含量显著降低。表明CDs能够显著降低镉胁迫对甘薯幼苗造成的氧化损伤。
2.5 CDs对甘薯根尖离子流的影响
NO作为信号分子广泛参与植物生长发育及逆境胁迫应答,植物体内NO含量受体内合成和清除的影响。大量研究表明NO可以从多方面调控植物的镉胁迫应答。硝酸还原酶是植物体内NO形成的主要酶,为了探究CDs缓解甘薯镉毒害的作用机制,本研究进一步测定甘薯幼苗中硝酸还原酶含量。由图5可见,与CK相比,在镉胁迫下,甘薯幼苗体内的硝酸还原酶活性显著提高,而添加CDs处理后,会显著降低甘薯体内镉胁迫诱导的硝酸还原酶活性。利用NO特异性荧光探针(DAF FM diacetate)监测NO在甘薯根细胞内的分布情况。由图5-b可知,镉处理的甘薯幼苗根中荧光信号较强,表明镉胁迫诱导甘薯根中积累大量NO,而添加CDs后甘薯根的荧光信号显著降低。由于镉胁迫下植物体内NO含量上升,诱导根系[WTBX][STBX]IRT1[WTBZ][STBZ]基因上调表达,促进根系吸收镉离子。因此,猜测CDs处理后,甘薯幼苗的镉离子内流减少。进一步利用非损伤微测技术技术测定甘薯根系镉离子的吸收情况。由图5-b可见,镉处理后,甘薯幼苗根系分生区、伸长区和成熟区Cd2+流显著内流,而Cd+CDs处理组甘薯幼苗根系的Cd2+流内流显著降低。上述结果表明,合成的CDs通过抑制硝酸还原酶的形成,减少甘薯幼苗体内NO的积累,从而减少镉离子内流,减少镉毒害。
3 结论
本研究以姜黄素作为碳源,通过一步水热法合成CDs,通过CDs表征发现,合成的CDs表面含有丰富的酚羟基、甲氧基,表明制备的CDs不但具有较好的水溶性,而且保留了姜黄素的生物学活性。进一步以甘薯作为植物模型,探究合成的CDs对镉胁迫下植物的生理响应。结果表明,CDs显著提高了甘薯幼苗的镉耐受性。与镉胁迫的甘薯幼苗相比,添加CDs后镉胁迫的甘薯幼苗叶绿素a、叶绿素b、总叶绿素含量分别增加了55.0%、41.3%、516%,净光合速率、气孔导度、蒸腾速率分别提高了168.9%、33.8%、29.5%,胞间二氧化碳浓度显著降低了41.9%,MDA和脯氨酸含量显著降低。探究其作用机制发现,CDs主要通过抑制硝酸还原酶的活性来减少植物体内镉胁迫诱导的NO积累量,从而缓解镉毒害。本研究为植物生理学和纳米材料学科的交叉研究,可为提高植物耐镉性提供新的思路,有望在农业生产中推广应用。
参考文献:
[1]Kaya C,Ashraf M,Alyemeni M N,et al. The role of nitrate reductase in brassinosteroid-induced endogenous nitric oxide generation to improve cadmium stress tolerance of pepper plants by upregulating the ascorbate-glutathione cycle[J]. Ecotoxicology and Environmental Safety,2020,196:110483.
[2]Sharma S S,Dietz K J. The relationship between metal toxicity and cellular redox imbalance[J]. Trends in Plant Science,2009,14:43-50.
[3]Wang T,Song J,Liu Z,et al. Melatonin alleviates cadmium toxicity by reducing nitric oxide accumulation and IRT1 expression in Chinese cabbage seedlings[J]. Environmental Science and Pollution Research,2021,28(12):15394-15405.
[4]張海燕,段文学,解备涛,等. 不同时期干旱胁迫对甘薯内源激素的影响及其与块根产量的关系[J]. 作物学报,2018,44(1):126.
[5]Xu X K,Mao X P,Zhuang J L,et al. PVA-coated fluorescent carbon dot nanocapsules as an optical amplifier for enhanced photosynthesis of lettuce[J]. ACS Sustainable Chemistry & Engineering,2020,8:3938-3949.
[6]Swift T A,Fagan D,Benito-Alifonso D,et al. Photosynthesis and crop productivity are enhanced by glucose-functionalised carbon dots[J]. New Phytologist,2021,229(2):783-790.[HJ2mm]
[7]Li Y D,Xu X K,Lei B F,et al. Magnesium-nitrogen co-doped carbon dots enhance plant growth through multifunctional regulation in photosynthesis[J]. Chemical Engineering Journal,2021,422:130114.
[8]Li Y J,Tang Z H,Pan Z Y,et al. Calcium-mobilizing properties of salvia miltiorrhiza-derived carbon dots confer enhanced environmental adaptability in plants[J]. ACS Nano,2022,16(3):4357-4370.
[9]Li W,Wu S,Zhang H,et al. Enhanced biological photosynthetic efficiency using light-harvesting engineering with dual-emissive carbon dots[J]. Advanced Functional Materials,2018,28:1804004.[ZK)]
[10]Shim J S,Kim D H,Jung H J,et al. Hydrazinocurcumin,a novel synthetic curcumin derivative,is a potent inhibitor of endothelial cell proliferation[J]. Bioorganic & Medicinal Chemistry,2002,10(9):2987-2992.
[11]ChenFP,OuSY,TangCH.Core-shellsoy protein-soy polysaccharide complex (nano) particles as carriers for improved stability and sustained release of curcumin[J]. Journal of Agricultural and Food Chemistry,2016,64:5053-5059.
[12]Su Z,Han C,Liu E,et al. Formation,characterization and application of arginine-modified chitosan/γ-poly glutamic acid nanoparticles as carrier for curcumin[J]. International Journal of Biological Macromolecules,2021,168:215-222.
[13]Meng R,Wu Z,Xie Q T,et al. Preparation and characterization of zein/carboxymethyl dextrin nanoparticles to encapsulate curcumin:physicochemical stability,antioxidant activity and controlled release properties[J]. Food Chemistry,2021,340:127893.
[14]Reda M,Golicka A,Kabaa K,et al. Involvement of NR and PM-NR in NO biosynthesis in cucumber plants subjected to salt stress[J]. Plant Science,2018,267:55-64.
[15]Zhu X F,Jiang T,Wang Z W,et al. Gibberellic acid alleviates [JP2]cadmium toxicity by reducing nitric oxide accumulation and expression of IRT1 in Arabidopsis thaliana[J]. Journal of Hazardous [JP]Materials,2012,239-240:302-307.
[16]Chen X,Zou L Q,Niu J,et al. The stability,sustained release and cellular antioxidant activity of curcumin nanoliposomes[J]. Molecules,2015,20(8):14293-14311.
[17]Li Y D,Gao J M,Xu X K,et al. Carbon dots as a protective agent alleviating abiotic stress on rice (Oryza sativa L.) through promoting nutrition assimilation and the defense system[J]. ACS Applied Materials & Interfaces,2020,12(30):33575-33585.
[18]Tyagi P,Singh M,Kumari H,et al. Bactericidal activity of curcumin I is associated with damaging of bacterial membrane[J]. PLoS One,2015,10(3):e0121313.
[19]Jiang X,Dai J,Zhang X,et al. Enhanced Cd efflux capacity and physiological stress resistance:the beneficial modulations of Metarhizium robertsii on plants under cadmium stress[J]. Journal of Hazardous Materials,2022,437:129429.
[20]强晓晶. 小盐芥[WTBX][STBX]ThPIP1[WTBZ][STBZ]基因的水稻遺传转化及耐盐机理研究[D]. 北京:中国农业科学院,2015.
基金项目:江苏省高等学校自然科学研究面上项目(编号:21KJB210005);江苏省研究生科研与实践创新计划(编号:KYCX22_2795)。
作者简介:高 佳(1998—),女,江苏宜兴人,硕士研究生,主要从事纳米材料对植物生理生化影响方面的研究。E-mail:1162939456@qq.com。
通信作者:李艳娟,博士,讲师,主要从事纳米材料对植物生理生化影响方面的研究。E-mail:liyj@jsnu.edu.cn。

