大黄鱼UBXN1 基因鉴定及其过表达后的转录组分析
张东玲, 唐 欣, 王志勇
(集美大学,农业农村部东海海水健康养殖重点实验室,福建 厦门 361021)
包含泛素调节性X 结构域的蛋白家族(ubiquitin regulatory X domain-containing protein,UBXN)是一种具有泛素相关蛋白基序的蛋白亚类。在哺乳动物,该家族有13 个成员,即UBXN1、UBXN2A-2C、UBXN3A-3B、UBXN4、UBXN6~11,每个成员蛋白质C 末端都具有一个UBX 结构域,但N 端结构域是多种多样的,并且因为在细胞内定位方式的不同而发挥着不同的作用。根据结构的不同,UBXN 家族分为2 类,第一类UBAUBX 组成员(UBXN1/2C/3A-3B/7)包含一个N 端UBA 结构域和一个C 端UBX 结构域;第二类UBX 组成员(UBXN2A-2B/4/6/8-11)只含有一个C端UBX 结构域。Alexandru 等[1]通过蛋白质组学研究表明,UBA-UBX 组成员能够识别K48 和K11 链,优选K11,并与不同家族的E3 泛素连接酶结合,表明UBA-UBX 组成员在泛素-蛋白酶体途径中发挥着重要作用。泛素-蛋白酶体途径在免疫应答、抗原提呈、信号转导、细胞周期调控等生物学功能中发挥着重要作用,因此,UBXN家族蛋白极可能涉及生物的免疫过程。
UBXN1 是一个含有UBA 与UBX 结构域的泛素结合蛋白,最开始被鉴定为一个含有UBA 结构域的人类(Homo sapiens) Y33K 蛋白[2],后被发现广泛分布于真核生物中[3-5]。研究发现,UBXN1不仅参与p97 依赖的调控内质网中错误折叠蛋白质的降解过程,而且不依赖于 p97,作为干扰素通路的下游靶基因。UBXN1 在病毒感染后期被强烈诱导表达,并通过竞争TRAF3/6 与线粒体外膜蛋白MAVS 结合及MAVS 寡聚化,最终灭活RNA 病毒感染激活的干扰素信号通路和NF-κB 信号通路,避免过度炎症的发生;敲降UBXN1,能够诱导IFN-β 和促炎细胞因子表达,并抑制西尼罗河病毒和登革热病毒的复制[6]。Wang 等[7]进一步证实了UBXN1 负向调控NF-κB 信号通路,UBXN1 能够与泛素连接酶cIAP1/2 结合,通过竞争cIAPs 与TRAF2 的结合,显著降低TNFα 诱导的TNFR1 复合物的组装和RIPK1 的泛素化。此外,Hu 等[8]研究发现UBXN1能够阻断NF-κB 经典信号通路,并通过与Cul1 的相互作用抑制逆转录病毒和慢病毒复制。Yi 等[9]也表明PTRF 通过抑制UBXN1 表达激活NF-κB 活性。
大黄鱼(Larimichthys crocea)是我国养殖产量最大的海水经济鱼类,网箱养殖是其主要的养殖模式。高密度的养殖模式造成大黄鱼病害频发,盾纤毛虫病是鱼苗期主要病害,死亡率高达30%,尤其以网箱暂养阶段更为严重[10-11]。前期工作中,实验在大黄鱼抗盾纤毛虫全基因组关联分析(GWAS)中发现UBXN1 可能与该病的抗性相关[10]。在此基础上,本研究对大黄鱼UBXN1 基因序列和结构进行分析,采用荧光定量PCR (qRT-PCR)检测UBXN1 组织表达谱和诱导表达变化,并进行了亚细胞定位研究,及过表达后的转录组分析。研究结果为诠释UBXN1 基因的免疫功能和信号通路提供了新的参考资料。
1 材料与方法
1.1 实验动物
实验用大黄鱼来源于福建省宁德市官井洋大黄鱼养殖有限公司,体重约为4 g,实验前检测无寄生虫感染。本研究实验过程中操作人员严格遵守集美大学实验动物管理和使用伦理规范,并按照集美大学实验动物管理和使用伦理委员会制定的规章制度执行。
1.2 大黄鱼UBXN1 的序列确认和生物信息学分析
取大黄鱼肝脏和脾脏,混合后用于提取RNA,提取方法按照TransZol Up Plus RNA 试剂盒说明书操作。cDNA 合成根据Promega 的GoScript 反转录试剂盒操作说明进行,合成的第一链cDNA于-20 °C 保存备用。在本实验室大黄鱼基因组数据库中搜索UBXN1 cDNA 序列全长,设计引物(表1),PCR 扩增,测序确认UBXN1 序列。使用SMART 软件 (http: //smart.embl-heidelberg.de/smart/set_mode) 分析蛋白的功能结构域,ClustalX 进行序列比对,EXPASY 在线分析蛋白分子质量和理论等电点。

表1 实验中用到的引物Tab. 1 Primers in the experiments
1.3 大黄鱼UBXN1 的组织分布和诱导表达分析
用于组织分布检测的组织包括头肾、肾脏、脾脏、鳃、肝脏、肠道、皮肤、胃、心脏、脑和肌肉。以β-actin为内参进行qRT-PCR (表1),每组样品生物重复3 尾鱼,技术重复4 次。 qRT-PCR反应条件为95 °C 30 s;95 °C 10 s,60 °C 30 s,40个循环。2-ΔΔCT法计算基因的相对表达量,SPSS软件20.0 进行统计学分析,P<0.05 为差异显著。
寄生虫感染实验中,盾纤毛虫(Scuticociliatia)分离于染病的大黄鱼鱼苗,在海水中16 °C 培育扩增,每日投喂混合性菌群。大黄鱼鱼苗分为实验组和对照组,每组50 尾。盾纤毛虫的感染剂量为4.3×105个/L,感染前先将水池水位下降至1/3,盾纤毛虫感染大黄鱼48 h 后,随机抽检鱼苗,发现均被盾纤毛虫感染后,注满清洁海水,每日检测鱼苗病变及感染虫体数量。对照组除不感染寄生虫外,所有处理与实验组相同。寄生虫感染后,实验组和对照组在感染后0 h、12 h、1 d、2 d、3 d、5 d 和7 d 共7 个时间点,分别采集大黄鱼脾脏、脑、肝脏和肾脏,每个时间点每组取5尾鱼。qRT-PCR 分析大黄鱼在盾纤毛虫感染下,UBXN1 基因的表达变化。
1.4 亚细胞定位和过表达转化物的构建
设计构建亚细胞定位和过表达转化物的引物pEGFP-UBXN1F/R 和pcDNA-UBXN1F/R (表1),并以肝脏cDNA 为模板,PCR 扩增获得插入片段。用SacI 和SmaI 酶切pEGFP-N1 载体质粒,XhoI和Hind Ⅲ酶切pcDNA3.1(+)Myc-HisB 载体质粒,37 °C 酶切30 min,按照ClonExpress®Ⅱ一步克隆说明书将胶回收产物和酶切后的质粒进行连接。连接产物转化至DH5α 细胞,挑取单克隆,条带大小验证正确后,送厦门瑞辰铂生物科技有限公司测序。
1.5 大黄鱼UBXN1 的亚细胞定位和过表达
对于亚细胞定位分析,使用电转法将重组质粒pEGFP-UBXN1 转染至大黄鱼头肾细胞(福建农林大学陈新华教授赠送),28 °C,培养基为Leibovitzs L-15。细胞转染24 h 后,去除培养基,磷酸盐缓冲溶液(PBS)清洗细胞2 次,4%多聚甲醛固定细胞10 min。去除多聚甲醛,缓冲液重复清 洗3 次,0.2% Triton X-100s 透 化 细 胞。用DAPI 避光核染15 min,PBS 清洗细胞2 次,激光共聚焦显微镜拍片观察。
对于过表达分析,293T 细胞在5% CO2培养箱中37 °C 培养24 h,细胞铺满底部70%~80%时进行转染。按照 LipofectamineTM3000 Reagent 试剂盒[赛默飞世尔科技(中国)有限公司] 说明书进行转染,设置 pEGFP-N1 作为空载对照,pEGFPUBXN1 作为实验组。细胞转染24 h 后,收集细胞,免疫印迹(Western Blot)检测UBXN1 表达水平。
1.6 Western Blot 检测
转染后的细胞用预冷的PBS 清洗2 次,RIPA lysis 裂解细胞15 min,4 °C 条件下12 000×g,离心沉淀蛋白10 min;聚丙烯酰胺凝胶电泳(SDSPAGE)后,在半干转膜仪( Bio-Rad,美国) 上将蛋白转印至 PVDF 膜上,TBS-T 洗涤3 次,5% BSA的TBS-T 室温封闭1 h。加入 1∶1 000 的 His-tag抗体(兔多抗),4 °C 孵育过夜;TBS-T 洗涤3 次,二抗(山羊抗兔)继续孵育1 h,清洗3 次,加入显色液,拍照观察。
1.7 UBXN1 过表达后的转录组分析
确认蛋白过表达后,收集细胞提取RNA (3个生物学重复),将质量合格的RNA 样品进行文库构建,采用Illumina NovaSeq 6 000 平台进行高通量测序。转录组数据用FastQc 软件过滤得到净数据(clean reads),STAR 软件将clean reads 比对到人类参考基因组(GenBank: GRCH38)。StringTie软件对每个样本进行转录本组装,并利用StringTie软件merge 功能将所有组装的转录本进行合并,组成一个所有个体的综合转录本。使用Feature-Counts 工具对对基因表达量进行计数(count 计数)。基于对基因表达量的计数,利用DESeq2 软件对实验组和对照组样本进行差异表达基因筛选,|log2(Fold Change)|≥0.9,Padj<0.01 作为筛选标准。
2 结果
2.1 UBXN1 序列和结构分析
大黄鱼UBXN1 的ORF 全长为915 bp,编码304 个氨基酸(aa),包含9 个外显子、8 个内含子。蛋白质的分子质量约为34.35 ku,理论等电点为4.75。SMART 结构域预测UBXN1 有2 个功能结构域,UBA 和UBX (图1)。同源序列比对,大黄鱼与棘头梅童鱼(Collichthys lucidus) UBXN1 氨基酸一致性高达98.03%,与模式生物青鳉(Oryzias latipes) UBXN1 氨基酸一致性为82.74%,与人类UBXN1 同源性为32.01%。

图1 大黄鱼UBXN1 氨基酸序列的多重比对灰色箭头代表UBA 和UBX 结构域;黑色阴影代表完全相同的氨基酸,灰色阴影代表相似的氨基酸。Fig. 1 The multiple sequence alignment of LcUBXN1 from different species Gray arrows denote UBA and UBX domains; the same amino acids were represented by black shadow, and highly similar amino acids were represented by gray shadow.
2.2 大黄鱼UBXN1 的组织分布和亚细胞定位分析
采用荧光定量PCR 技术检测UBXN1 在健康大黄鱼各组织的表达水平。结果显示,UBXN1 在所有检测的组织中均有表达,脑中表达量最高,其次是肝脏、心脏和肾脏,在肌肉中表达量最低(图2-a)。亚细胞定位分析表明大黄鱼UBXN1 在细胞核和细胞质中均有表达(图2-b)。
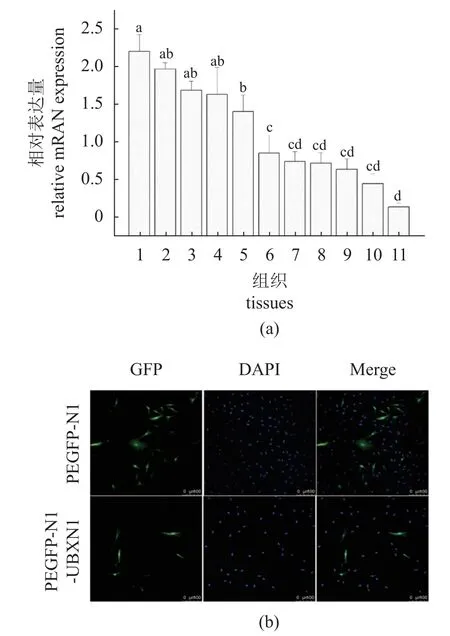
图2 UBXN1 在大黄鱼不同组织中的表达(a)和头肾细胞中的亚细胞定位(b)不同小写字母表示不同组织表达量差异显著(P<0.05);1. 脑,2. 肝 脏,3. 心 脏,4. 肾 脏,5. 鳃,6. 脾 脏,7. 皮 肤,8. 头 肾,9. 肠道,10. 胃,11. 肌肉;GFP. 绿色荧光蛋白,DAPI. 细胞核被染色,Merge. GFP 和DAPI 图合并。Fig. 2 Tissues distribution (a) and subcellular localization of LcUBXN1 (b)Different lowercase letters indicate that there are significant differences between different tissues(P<0.05); 1. brain, 2. liver, 3. heart, 4. kidney,5. gill, 6. spleen, 7. skin, 8. head kidney, 9. intestine, 10. stomach,11. muscle;GFP. green fluorescent protein, DAPI. cytoplasm dyed,Merge. GFP and DAPI pictures merged.
2.3 盾纤毛虫感染大黄鱼后UBXN1 的诱导表达分析
为了进一步了解UBXN1 如何参与大黄鱼抗盾纤毛虫的免疫反应,使用盾纤毛虫人工感染大黄鱼,检测UBXN1 在脾脏、脑、肝脏、肾脏中表达变化(图3)。结果显示,在脾脏中,UBXN1 在感染后第3 天表达量显著增加,而后恢复至正常水平。在脑中,UBXN1 在第12 小时瞬时表达量显著上调,然后逐步恢复至正常水平。在肝脏,UBXN1表达量逐渐上升,在第1 天达到峰值,然后逐渐降至正常水平。在肾脏,UBXN1 也表现出同样的表达趋势,先上升后下降,在第3 天表达量最高。
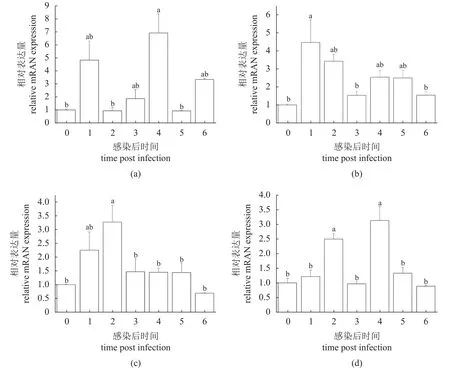
图3 盾纤毛虫感染下大黄鱼UBXN1 在不同组织中的表达变化(a)脾脏,(b)脑,(c)肝脏,(d)肾脏;0. 0 h,1. 12 h,2. 1 d,3. 2 d,4. 3 d,5. 5 d,6.7 d;不同小写字母表示不同时间点表达量差异显著(P<0.05)。Fig. 3 The expression level of LcUBXN1 upon scuticociliate in different tissues(a) spleen, (b) brain, (c) liver, (d) kidney; 0. 0 h, 1. 12 h, 2. 1 d, 3. 2 d, 4. 3 d, 5. 5 d, 6.7 d; different lowercase letters indicate that there are significant differences between different time intervals (P<0.05).
2.4 大黄鱼UBXN1 在293T 细胞过表达后转录组分析
Western Blot 检测外源蛋白UBXN1 在293T细胞中的表达变化。与空载体对照组相比,大黄鱼UBXN1 在293T 细胞成功过表达(图4-b)。转录组差异表达基因筛选表明,与对照组相比,12 个基因上调表达,4 个基因下调表达(图4-a,表2),RPL41/RPL39/XIST/RNA45SN4 表达 量 显著增加,而ATP8/ND4L 表达量显著减少。KEGG富集分析显示(图5),差异表达基因富集到10 个信号通路中,涉及多种疾病的发生。

图4 大黄鱼UBXN1 差异表达基因及其蛋白在293T 细胞系中的表达情况(a) 大黄鱼UBXN1 差异表达基因火山图;(b)外源大黄鱼UBXN1 蛋白在293T 细胞系成功过表达;1. 空载体组,2. 过表达组。Fig. 4 The volcano plot of differentially expressed genes and the exogenous expression in 293T cells of LcUBXN1(a) the volcano plot of differentially expressed genes; (b) the exogenous expression of LcUBXN1 protein in 293T cells confirmed by western blot using anti-His antibody. 1. empty vector group, 2. overexpression group.

图5 大黄鱼UBXN1 过表达后差异基因在KEGG 数据库中的注释Fig. 5 Distribution of genes after UBXN1 overexpression in L. crocea in KEGG pathways

表2 差异表达的基因Tab. 2 Differentially expression genes
3 讨论
盾纤毛虫是一种兼性寄生虫,在大黄鱼体内外均可寄生,可通过血液到达机体各个组织器官,以脑组织居多,最终鱼体出血、衰竭死亡。盾纤毛虫除感染大黄鱼外,还可感染多种海水鱼、虾、蟹、海参、沙蚕等,目前盾纤毛虫病尚无有效防治措施。实验前期从海区采集大黄鱼感染盾纤毛虫易感和抗性个体,进行低深度重测序,GWAS分析发现一个极显著的SNP 位于UBXN1 外显子上。多项研究表明UBXN1 负向调控NF-κB 信号通路[6-9],Valle 等[12]通过盾纤毛虫和大菱鲆(Scophthalmus maximus)互作转录组分析发现NF-κB 信号通路参与寄生虫感染过程,因此,推测UBXN1可能参与大黄鱼抗盾纤毛虫过程。
目前,哺乳动物UBX 家族成员仅有小部分生理功能被发现,大部分成员仍未被研究,鱼类中未见有关UBX 家族成员的报道。大黄鱼UBXN1包含UBA 和UBX 结构域,UBA 结构域能够结合泛素链[13],而UBX 结构域包含大约80 个氨基酸残基,与泛素具有弱同源性,三维结构和泛素的十分相似,能够与AAA-ATP 酶的分子伴侣-蛋白即 含 缬 酪 肽 蛋 白(valosin-containing protein, VCP/p97)的氨基末端相结合[14]。通过蛋白质间相互作用研究表明,VCP 蛋白的氨基末端结构域的两个亚结构域之间的疏水口袋是其与UBX 结构域的结合位点,VCP 与UBX 结构域的结合具有比与泛素蛋白结合更高的亲和力[15-17]。VCP 蛋白在细胞膜融合、转录调控、细胞周期调控、纺锤体组装和蛋白质折叠过程中扮演着重要的角色[18-21],这提示UBXN1 可能在细胞信号传导过程中扮演着重要的角色。此外,VCP 的突变在哺乳动物多个组织中产生疾病表型[22-23],提示UBXN1 可能与疾病发生相关,或者调控免疫信号转导。
在哺乳动物,UBXN1 的UBA 结构域(1~86 aa)可以与线粒体外膜上的MAS (438~467 aa)相结合,因此UBXN1 应该存在于哺乳动物的细胞质中,这与实验的亚细胞定位结果一致,说明鱼类与哺乳动物UBXN1 的免疫功能相似。但是,本研究发现UBXN1 也在细胞核中表达,暗示鱼类UBXN1 还存在其他信号调控通路。盾纤毛虫感染大黄鱼早期,UBXN1 在脾脏、脑、肝脏和肾脏的表达量有所提高,在感染后期恢复至正常水平。Yuan 等[24]研究发现,猪传染性胃肠炎病毒(TGEV)感染猪小肠上皮细胞IPEC-J2 晚期时,UBXN1 的蛋白和RNA 表达量显著增加;进一步研究发现,BXN1 可以与猪传染性胃肠炎病毒的S1 结合,敲降UBXN1,TGEV 在IPEC-J2 中复制量显著减少,且S1 蛋白下调表达;相反,过表达UBXN1,TGEV 复制量急剧增加。此外,UBXN1可以降解肌纤维蛋白质,其启动子区域单核苷酸的多态性与猪肌肉系水力水平相关[25]。寄生虫感染机理比较复杂,与病毒感染宿主机制不同,暗示UBXN1 在寄生虫感染宿主过程中可能扮演不同角色。UBXN1 单核苷酸多态性与大黄鱼抗盾纤毛虫性状相关性需进一步深入研究。
转录组筛选差异表达基因,相比空载体对照组,RPL41/RPL39 表达量显著增加,而ATP8/ND4L 表达量显著减少,通路富集分析表明,差异表达基因多与疾病发生相关。张洁等[26]报道RPL41呈剂量依赖性抑制卵巢癌A2780 细胞的增殖,通过调控Bax和Bcl-2 基因表达,参与细胞程序化死亡过程,导致A2780 细胞凋亡。Surmiak 等[27]研究发现,嗜中性粒细胞在抗蛋白酶3 IgG F 刺激下RPL41 表达量显著升高。Dave 等[28]研究表明,乳腺癌病例RPL39 A14V 突变率高达97.5%(39/40 肿瘤样本)。Huang 等[29]发现,敲降RPL39增加了沙门氏菌(Salmonella)在猪中性粒细胞内的增殖。下调基因ATP8 和ND4 是线粒体基因,调控线粒体能量代谢,并促进ROS 生成,也与肿瘤的发生相关[30-31]。尽管目前还没有报道这些差异表达基因在鱼类中的作用,但似乎都与免疫相关。未来的工作应主要集中在UBXN1 对这些基因的调控作用及深入研究它们的免疫功能。
(作者声明本文无实际或潜在的利益冲突)

