鞍带石斑鱼繁育群体的遗传多样性
龚师锐, 王 同, 宋乐龄, 杨 扬,2,钟朝岳, 陶宇浩, 刘晓春,3*
(1. 中山大学生命科学学院,水产动物疫病防控与健康养殖全国重点实验室,广东省水生经济动物良种繁育重点实验室,广东 广州 510275;2. 农业农村部热带海水鱼种质创新与利用重点实验室,海南 三亚 ;570000;3. 南方海洋科学与工程广东省实验室 (珠海),广东 珠海 519080)
鞍带石斑鱼(Epinephelus lanceolatus)俗称龙趸,隶属于鲈形目(Perciformes)石斑鱼科(Epinephelinae),广泛分布于印度和西太平洋的热带及亚热带水域,是重要的经济鱼类[1]。鞍带石斑鱼是石斑鱼种类中体型最大的物种,其最大体长270 cm,体重可达400 kg。由于其寿命长、先雌后雄、性成熟晚和产卵聚集性的生物学特征,其野生种群极易受到捕捞压力和栖息地变化的影响[2-3]。自20 世纪90 年代中期以来,由于过度捕捞,鞍带石斑鱼一直被列入世界自然保护联盟红色名单,并在澳大利亚、南非、印度等国受到保护(https: //www.iucnredlist.Org/)。此外,由于其在市场上高昂的价格和快速生长的优良性状,已成为亚太地区最受欢迎的水产养殖品种之一[4],并作为各类杂交石斑鱼的亲本用以改良石斑鱼生长性状,创制出多种优良杂交组合,如棕点石斑鱼(E.fuscoguttatus)♀×鞍带石斑鱼♂(虎龙杂交斑)[5]、云纹石斑鱼(E.moara)♀×鞍带石斑鱼♂(云龙石斑鱼)[6]、斜带石斑鱼(E.coioides)♀×鞍带石斑鱼♂(青龙杂交斑)[7]等,其中虎龙杂交斑(GS-02-005-2016)和云龙石斑鱼(GS-02-002-2018)已获得新品种证书,并深受养殖户和市场喜爱。
微卫星分子标记,即简单重复序列(simple sequence repeats,SSR),在基因组中含量丰富、具有高度的多态性,作为第2 代分子标记已经广泛应用于水产动物杂交优势的预测、群体的杂合度和种质资源保护等研究中[8]。关于微卫星分子标记在石斑鱼种质资源中的应用也有相关报道。于2011 年开展的南海斜带石斑鱼野生群体和人工繁殖群体的微卫星分析的结果表明,斜带石斑鱼野生群体和人工繁殖群体遗传多样性仍比较丰富,且人工繁殖群体没有出现明显的遗传分化和种质退化的现象[9]。另外一项于2012 年对中国东南沿海7 个赤点石斑鱼(E.akaara)养殖群体遗传变异的研究发现,不同养殖场间的种群存在着丰富的遗传多样性,具有明显的地理区域分布特征[10]。
物种的遗传多样性是其生存和进化关键因素,遗传多样性越高,物种适应环境变化的能力越强[11]。2008 年,相关研究利用RAPD (随机扩增多态 DNA,randomly amplified polymorphic DNA )技术对海南近海野生鞍带石斑鱼群体的遗传多样性进行了研究,发现该野生群体仍然保持着较丰富的遗传多样性[12]。在此之后,关于鞍带石斑鱼种质资源方面的研究再无相关报道。在前期的实验调查过程中,发现大多数的养殖公司未对鞍带石斑鱼繁育亲本进行电子标记,且由于养殖年限较久,在养殖过程中经常搬塘混养,导致亲本混杂较为严重,多种来源的鞍带石斑鱼混杂养殖,因此开展鞍带石斑鱼繁育群体的遗传多样性调查更为必要。本研究采用微卫星分子标记技术,对来自广东、海南和福建3 个省份、5 个地理位置的鞍带石斑鱼繁育群体进行遗传多样性分析,为鞍带石斑鱼繁育群体种质资源保护和遗传育种提供理论依据。
1 材料与方法
1.1 实验伦理声明
本研究获得了中山大学实验动物管理和使用伦理委员会批准(SYSU-IACUC-2022-B0131),实验过程中操作人员严格遵守中山大学伦理规范,并按照中山大学伦理委员会制定的规章制度执行。
1.2 实验材料
由于采样地点各良种场鞍带石斑鱼亲本养殖年限较久且长期搬塘混养未作标记,多种来源亲本混杂,在前期的调研中,采样群体多为野生捕捞亲本,少数由养殖群体筛选而来,因此本实验仅对养殖群体的采样地点进行记录,未对原始产地进行溯源。实验选用的150 个鞍带石斑鱼尾鳍样品分别取自海南省东方市(感城镇,GC,n=31)、海南省琼海市(长坡镇,CP,n=30)、广东省惠州市(澳头镇,AT,n=30)、福建省厦门市(湖里区,HL,n=30)和福建省厦门市(翔安区,XA,n=29),均为繁育群体。剪取每尾鱼的鳍条保存于95%无水乙醇中,随后运回实验室在-20 °C 冰箱保存。每个群体的采样位置见图1,详细采集时间、地点和数量见表1。
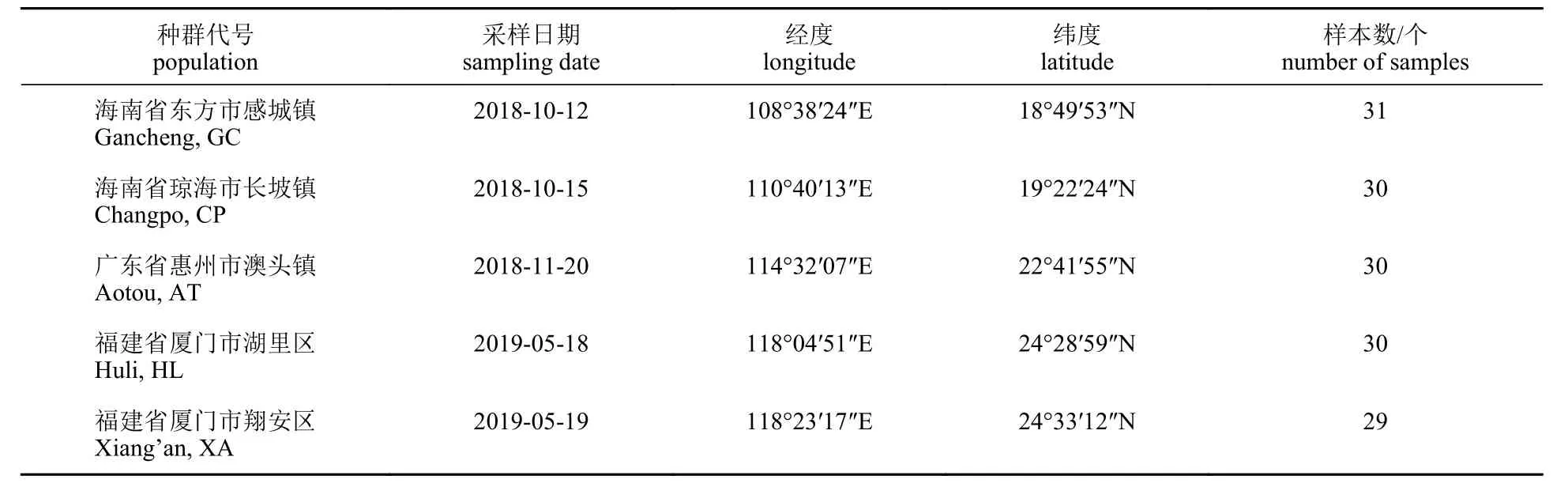
表1 5 个养殖群体鞍带石斑鱼群体的采样信息Tab. 1 Sample information of five breeding populations of E. lanceolatus

图1 5 个鞍带石斑鱼繁育群体采样点Fig. 1 Sampling sites of five breeding populations of E. lanceolatus
1.3 实验方法
样品DNA 的提取 参考 TIANGEN 海洋动物组织基因组 DNA 提取试剂盒(离心柱型) (DP324)[天根生物科技(北京)有限公司] 说明书步骤,对150 个鞍带石斑鱼尾鳍样品进行了基因组DNA提取。提取好的DNA 样品使用NanoDrop 2000(Thermo Fisher Scientific,美国) 分光光度计检测其浓度和纯度;同时使用1%琼脂糖凝胶电泳对提取DNA 的质量进行检测。
群体扩增 用于鞍带石斑鱼群体扩增的引物来自本实验室开发的微卫星引物(表2),引物合成在生工生物工程(上海)股份有限公司进行。PCR 反应体系如表3。PCR 反应程序设置:95 °C预变性3 min;95 °C 变性20 s、59.5 °C 退火20 s、72 °C延伸15 s,总共35 个循环;最后72 °C 延伸5 min。PCR 产物送至生工生物工程(上海)股份有限公司进行SSR 分型检测。DNA 于-20 °C 保存备用。
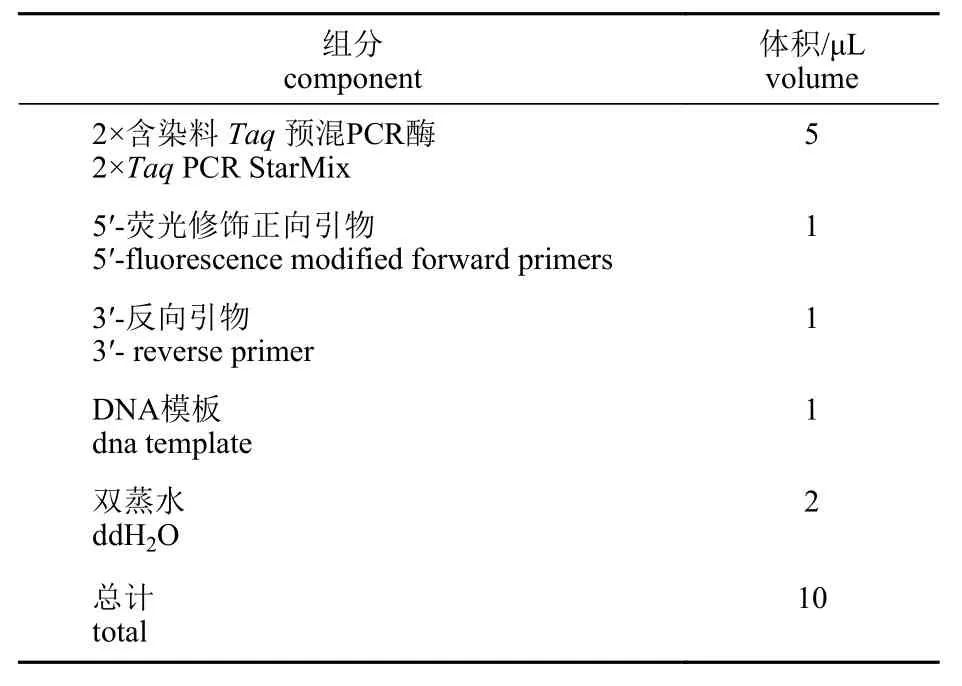
表3 荧光修饰引物PCR 反应体系Tab. 3 PCR reaction system with fluorescently modified primers
数据分析 对SSR 分型检测数据进行整理和基因型判读校正后,使用GenAIEx 6.502 软件[13]计算各微卫星位点的等位基因数(Na)、观测杂合度(Ho)、期望杂合度(He)以及Nei 氏标准遗传距离;使用 Cervus 3.0.7 软件[14]计算多态性信息含量(PIC);使用使用 Arlequin version 3.5.2.2 软件[15]基于 Pairwise differences 方法计算各群体的遗传分化指数(Fst),并进行分子方差分析(analysis of molecular variance, AMOVA);基于 Nei 氏遗传距离 ,使用 MEGA-X version 10.1.8 软件[16]构建群体间的 UPGMA 进化树[17]。最后使用Structure Selector[18]基于ΔK[19]分析群体遗传结构并得到最合适K值,并绘制结果图来评估5 个群体间的群体结构。
2 结果
2.1 群体内遗传多样性分析
鞍带石斑鱼群体内遗传多样性检测结果显示,来自5 个地理位置的鞍带石斑鱼繁育群体的Na为6.375~8.380,Ho为0.625~0.775,He为0.684~0.734,PIC为0.633~0.693。其中来自福建厦门翔安区的XA 群体具有最高的遗传多样性(He=0.734,PIC=0.693),来自海南琼海长坡镇的CP 群体具有最低的遗传多样性(He=0.685,PIC=0.633) (表4)。132An30位点引物在不同群体中最多获得了17 个等位基因,在8 对引物中获得的等位基因数最多。AD4-T1与AD3-T6 位点引物在不同群体中最多获得了7 个等位基因,等位基因数最少。在5 个群体中,利用8 个微卫星标记扩增出的40 组数据中,有 33组数据具有高多态性 (PIC>0.5),5 个数据具有中等多态性(0.5>PIC>0.25),2 个数据具有低多态性(0.25>PIC)。Hardy-Weinberg 平衡的卡方检验结果显示,5 个种群在8 个位点上有16 个表现为极显著偏离Hardy-Weinberg 平衡(PHWE<0.01), 8 个表现为显著偏离Hardy-Weinberg 平衡(PHWE<0.05)(表5),剩余16 个则不偏离。

表4 8 个SSR 位点在5 个鞍带石斑鱼繁育群体中的统计遗传学信息Tab. 4 Summary of eight pairs of microsatellites in the five groups of E. lanceolatus

表5 鞍带石斑鱼养殖群体的Hardy-Weinberg 平衡卡方检验Tab. 5 Hardy-Weinberg equilibrium chi-square test in five groups of E. lanceolatus
2.2 鞍带石斑鱼群体遗传分化关系
对5 个鞍带石斑鱼群体进行分子方差分析(analysis of molecular variance, AMOVA),结 果 显示5.36%的遗传变异来自群体间,95.45%来自所有个体间,表明群体间的遗传变异极小(表6)。GC、CP、AT、HL 和XA 群体间的Nei 氏遗传标准距离(Ds)为0.073 7~0.324 9,属于种间遗传[20](0.01<Ds<2.0)。遗传分化指数(Fst)为0.015 7~0.085 7,群体处于中等(0.05<Fst<0.15)及较小(Fst<0.05)的遗传分化(表7)。其中HL 群体与其他4 个群体均存在中等程度分化;XA 群体与AT 群体存在中等程度分化;其他群体之间仅存在较小程度遗传分化。

表6 基于5 个微卫星标记分子方差分析结果Tab. 6 Result of AMOVA based on five microsaltellite markers

表7 鞍带石斑鱼群体间的遗传分化指数 Fst(对角线下)和 Nei 氏遗传距离(对角线上)Tab. 7 Matrix of pair-wise Fst values (below diagonal) and Nei’s genetic distance (above diagonal) between E. lanceolatus
2.3 鞍带石斑鱼群体遗传结构聚类分析
根据 Nei 氏遗传距离构建的 UPGMA 聚类树中(图2),GC 和 CP 群 体 聚 为 一 支,再 与 AT 群体聚为一支,然后与XA 群体聚为一支,HL 群体单独为一支。结果与遗传距离、Fst结果基本一致。利用Structure 软件进行群体结构分析过程中,ΔK值的最高点为最可能的遗传聚类值,ΔK峰值出现在集群K=4,表明5 个鞍带石斑鱼群体的预测自由交配组数为4,因此,后续分群选择K=4 (图3)。基于上述Structure 的分析结果,当K=4 时,贝叶斯分析法的聚类结果见图4,表明5 个群体之间存在较强的基因交流。通过系统进化树分析显示,5 个群体交叉在一起,没有形成明显的地理格局分布(图5)。

图2 鞍带石斑鱼群体基于 Nei 氏遗传距离构建的UPGMA 聚类图Fig. 2 UPGMA dendrogram based on Nei's genetic distance among E. lanceolatus

图3 最佳聚群数K 与推断值ΔK 之间的关系Fig. 3 Relations between the rational groups number K and estimated value ΔK

图4 基于叶贝斯算法计算得到的鞍带石斑鱼繁育群体遗传结构图 (K=4)不同颜色表示不同的集群。Fig. 4 Genetic structure Map of E. lanceolatus based on Bayesian algorithm (K=4)Different colors represent different clusters.

图5 鞍带石斑鱼繁育群体系统进化树Fig. 5 Phylogenetic tree of E. lanceolatus
3 讨论
本研究采用实验室开发的8 对SSR 引物,在5 个不同地点的鞍带石斑鱼繁育群体中进行了检测,结果显示,8 对SSR 引物扩增效果良好,位点多样性较高,表明这些微卫星位点及引物可以用于鞍带石斑鱼群体的遗传学研究。在利用扩增后的结果对5 个种群的群体内遗传多样性进行分析的过程中,Na、Ho、He和PIC数值越大,说明种群内等位基因越丰富,遗传多样性越高,遗传变异越大。本研究中,来自福建厦门翔安区的XA群体具有最高的遗传多样性(Na=8.125,He=0.734),海南琼海长坡镇的CP 群体具有最低的遗传多样性(Na=6.750,He=0.685),这可能与CP 群体中有部分个体由养殖群体筛选而来导致。
PIC是指一个后代所获得的某个等位基因标记来自于它亲代的同一个等位标记的可能性大小,平均PIC是衡量等位基因片段多态性的理想指标。当PIC大于0.5 时为高度多态位点,0.25<PIC<0.5时为中度多态位点,PIC小于0.25 时为低度多态位点[21]。本研究中5 个群体的平均PIC均大于0.5,整体均值为0.659,表明鞍带石斑鱼繁育群体的遗传多样性仍然比较丰富。Hardy-Weinberg 平衡的卡方检验结果显示,在5 个种群的8 个位点检测到的40 个数据中,有16 个表现为极显著偏离Hardy-Weinberg 平衡,16 个不偏离。近年来鞍带石斑鱼的野生资源量下降,野生群体数量减少,而鞍带石斑鱼繁育群体多由自然捕捞,或者由野生种群经人工繁育得到的群体筛选而来,这很可能是造成位点偏离Hardy-Weinberg 平衡的原因。本研究中,利用Structure 进行的群体结构分析结果表明群体之间存在较强的基因交流,这也很大程度表明了鞍带石斑鱼繁育群体可能由自然捕捞而来或还未经多代选育,没有形成明显的群体分化。通过系统进化树分析显示,5 个群体交叉在一起,也没有形成明显的地理格局分布,反映出这些养殖的鞍带石斑鱼亲本来源可能相同(均由野生捕捞而来,或者亲本未经驯化)。
繁育群体的高遗传多样性是维持水产生物经济性能的保障[11]。石斑鱼养殖过程中生产性能降低、病害频发,常被怀疑是遗传多样性降低而导致。鞍带石斑鱼作为生长速率最快的石斑鱼,其经济性状明显,但是由于当前鞍带石斑鱼繁育群体多来自野生捕捞,且由于鞍带石斑鱼人工繁育技术尚不成熟,多靠激素催熟,导致繁殖后代受精率、孵化率及养殖成活率都偏低[22],在养殖过程中也面临病害等各种问题。在前期的实验中发现,各良种繁育场对鞍带石斑鱼的管理存在不足,绝大多数养殖场并未对鞍带石斑鱼进行电子标记,尽管了解部分个体的销售源头,但是繁育亲本的具体来源大多模糊不清,并且由于鞍带石斑鱼生产期间经常搬塘混养,导致多种来源个体混杂,难以追踪个体具体来源。尽管本研究结果表明,鞍带石斑鱼各繁育群体都保持较高的遗传多样性,然而鞍带石斑鱼亲本保种及选育仍是一个亟待解决的问题,需要不断加强亲本的源头管控及品种优化,关注种源的遗传多样性问题。本研究的数据和微卫星工具能够为加强鞍带石斑鱼的种质评价和管理提供分析方法。
(作者声明本文无实际或潜在的利益冲突)

