改性柑橘皮吸附剂的制备及其对嘌呤脱除效果的研究
刘婷婷,赵紫悦,尚永彪,2*
1(西南大学 食品科学学院,重庆,400715)2(川渝共建特色食品重庆市重点实验室,重庆,400715)
嘌呤(Purine)分子式为C5H4N4,属于含氮芳香族杂环化合物[1],分为游离态的嘌呤碱基和其他嘌呤大分子。人体几乎不能利用从食物中获得的嘌呤类物质,当短时间内摄入较多外源性嘌呤类物质,会引起机体内尿酸浓度升高,发生高尿酸血症[2-3],导致痛风病。尿酸以尿酸钠晶体的形式在肾脏和关节处沉积,导致痛风肾和痛风性关节炎[4],引发疼痛和一系列代谢性疾病甚至危及生命。
调查表明,柑橘在中国的种植面积及加工规模在不断扩大,其中加工副产品皮渣(占果重的20%~50%)年产量达1 200多万t以上。柑橘皮(orange peel,OP)资源因低利用率造成的资源浪费和环境污染问题已引起行业的高度重视[5]。OP渣中含有大量的纤维素、半纤维素、木质素和果胶等物质,其主要由大量的氨基、羧基、羟基等官能团组成[6];且橘皮疏松多孔,使橘皮具备了潜在的吸附作用,可用于食品中有害物质或者异味杂质的脱除。但由于角质和蜡质附着,吸附性能较差,直接将OP作为吸附剂应用到食品工业中时,吸附能力不理想[7]。有研究表明通过酸化处理、碱化处理、氧化处理等化学改性手段可以去除其表面部分角质层,丰富官能团的种类和数量,增加内部孔隙率和表面积[8-9];同时增加反应位点,极大提升了表面黏结性能和力学性能[10]。此外,酸碱改性也可以增加果胶分子羧基官能团数量[11],官能团氧含量越高,氧原子的高电负性越有利于极性分子的吸附,因此可提高其吸附性能[12]。但目前改性柑橘皮(modified orange peel, MOP)吸附剂的研究大都集中于吸附水中的As(III)[13]、Cu2+[14]以及菜籽油中的游离脂肪酸[15]等,对食品中嘌呤的吸附脱除还缺乏针对性研究。
本研究以OP为材料,通过不同改性方法的对比及改性工艺参数的优化探讨吸附剂的制备方法,并通过吸附动力学和热力学分析,结合扫描电镜(scanning electron microscope,SEM)和红外光谱技术(Fourier transform infrared spectroscopy,FTIR)对其改性前后进行表征,探究OP改性吸附剂对嘌呤的吸附机理,以期为新型高效绿色嘌呤吸附剂的制备和应用提供理论指导。
1 材料与方法
1.1 材料与试剂
OP,回收于中国农业科学院柑橘研究所;腺嘌呤、鸟嘌呤、黄嘌呤、次黄嘌呤纯度>99%,上海麦克林生化科技有限公司;KH2PO4、磷酸、甲醇为色谱醇,成都科隆化学品有限公司;其他试剂均为分析纯。
1.2 仪器与设备
LC-20A型高效液相色谱仪,日本岛津公司;HH-8型电热恒温水浴锅,上海力辰邦西仪器科技有限公司;PHS-4C+型酸度计,成都世纪方舟科技有限公司;FA2004A型电子分析天平,上海精天电子仪器有限公司;YLD-6000型烘箱,天津市通利信达仪器厂;Phenom Pro型扫描电镜,荷兰Phenom World公司;Spectrum100型红外光谱,美国珀金埃尔默公司。
1.3 实验方法
1.3.1 吸附剂样品的制备
去OP表面杂质及橘络,晾干后用超纯水清洗3次于105 ℃恒温干燥箱烘干至恒重。粉碎后过筛40~100目,得OP粉末,装入聚乙烯袋,密封保存在干燥器中,备用。
1.3.2 改性吸附剂样品的处理
称取5 g OP粉末于洁净烧杯中,分别采用碱法、酸碱法、碱-醇法、碱-醇-氯化钙法制备MOP。碱法加入100 mL质量分数为10%的NaOH溶液,浸泡处理2 h;酸碱法以料液比为1∶1先添加质量分数1.0%硫酸溶液浸泡1 h,后水洗至中性,再用10%NaOH溶液浸泡处理1 h;碱醇法以料液比1∶1添加无水乙醇、1.0 mol/L NaOH溶液浸泡处理2 h;碱-醇-氯化钙法以质量化2∶2∶1比例添加无水乙醇、1.0 mol/L NaOH溶液和CaCl2溶液浸泡处理2 h。4份样品分别处理后反复水洗直至滤出液为中性,抽滤后将样品置于105 ℃烘箱干燥,依次编号为MOP1、MOP2、MOP3、MOP4。
1.3.3 嘌呤的吸附效果对比试验
参考吴凡[16]的方法,将不同处理的MOP吸附剂分别加入到10 mL 50 mg/mL的嘌呤混标溶液(腺嘌呤、鸟嘌呤、黄嘌呤、次黄嘌呤质量比为1∶1∶1∶1)中,40 ℃ 100 r/min搅拌60 min,取1 mL溶液透过0.45 μm针头式过滤器于1.5 mL进样瓶,经HPLC检测计算处理前后嘌呤总浓度。HPLC条件:以KH2PO4-H3PO4(0.02 mol/L,pH 4.0)为流动相,流速1.0 mL/min,柱温30 ℃,紫外检测器检测波长254 nm,进样量10 μL。吸附实验中,吸附效果的好坏通常用吸附率和吸附量来反映。吸附率是利用改性吸附剂吸附前后嘌呤浓度的比值,用于评估溶液中吸附质的去除程度[17]。计算如公式(1)所示:
X/%=(C1-C2)/C1×100
(1)
式中:X,嘌呤吸附率,%;C1,未经处理溶液中嘌呤质量浓度,mg/L;C2,MOP吸附剂吸附后溶液嘌呤质量浓度,mg/L。
吸附量是单位质量吸附剂所能吸附的量,用于表征吸附剂的吸附性能[18]。计算如公式(2)所示:
q=(C1-C2)×v/m
(2)
式中:q,平衡吸附量,mg/g;C1,吸附前嘌呤的初始质量浓度,mg/L;C2,吸附后嘌呤的平衡质量浓度,mg/L;v,吸附溶液体积,L;m,吸附剂的质量,g。
1.3.4 OP改性制备吸附剂的工艺优化
1.3.4.1 单因素试验
分别以OP粒度40、60、80、100、120、140目,改性温度30、40、50、60、70、80 ℃,改性时间20、40、60、80、120 min,搅拌转速50、100、150、200、250、300 r/min为变量进行单因素试验。分别称取5 g OP粉末于洁净烧杯中,加入到10 mL质量浓度为50 mg/L的嘌呤混合溶液(腺嘌呤、鸟嘌呤、黄嘌呤、次黄嘌呤质量比为1∶1∶1∶1)中,按单因素实验设计完成吸附操作。吸附过程结束后,取1 mL溶液,透过0.45 μm针头式过滤器,存入1.5 mL进样瓶中,而后经HPLC检测计算处理前后嘌呤总浓度,对比其脱除嘌呤的效果。以吸附率及吸附量为指标考察碱改性处理条件对MOP吸附效果的影响。
1.3.4.2 正交试验
在上述单因素试验的基础上,采用L9(34)正交表设计试验,以OP粒度、改性处理温度、改性处理时间、转速为影响因子,以嘌呤吸附率和吸附量为试验指标。正交试验因素水平表见表1。

表1 L9(34)正交试验因素水平表Table 1 L9(34)Orthogonal test factors and levels
本研究采用准一级和准二级动力学方程、颗粒内扩散方程对实验数据进行拟合,探究MOP对嘌呤混标溶液的吸附速率以及吸附类型。其计算如公式(3)~公式(5)所示:
准一级动力学方程:
ln(qe-qt)=lnqe-k1t
(3)
准二级动力学方程:
(4)
颗粒内扩散方程如公式(5)所示:
qt=k3t1/2+C
(5)
式中,qt,t时间时改性吸附剂对嘌呤的吸附量,mg/g;qe,吸附平衡时的吸附容量,mg/g;k1,准一级动力学方程吸附速率常数,min-1;k2,准二级动力学方程速率常数,g/(mg·min);k3,颗粒内扩散模型速率常数,mg/(g·min1/2);C,边界层的厚度。
1.3.5 吸附热力学分析
Langmuir模型主要假设吸附质在吸附剂固体表面是单分子层吸附,表面上各个吸附位置分布均匀,每个分子之间不产生相互作用力[19]。这个模型已经成功应用于很多单分子层吸附,其表达如公式(6)所示:
定期配合上级部门做好水质化验工作,将水质标准控制在规定要求范围内,减少各种沉淀物的产生。为了减少碎屑的产生以及降低碎屑在柱塞和盘根配合面上摩擦,可在铜压套内壁前端车削一个凹槽,这样摩擦产生的碎屑在运动中可以储存在凹槽中,不在柱塞和盘根工作面间随柱塞的往复运动来回搓动,减轻柱塞和盘根的摩擦及磨损程度。
(6)
式中:ce,溶液中嘌呤的平衡质量浓度,mg/L;qe,吸附平衡时的嘌呤吸附量,mg/g;qm,吸附剂吸附嘌呤达平衡时的最大吸附量;mg/g;b,Langmuir常数,L/mg。
Freundlich模型是用来描述非均相吸附体系的经验式模型,若固体表面是不均匀的,交换吸附平衡常数将与表面覆盖度有关[20],其表达如公式(7)所示:
(7)
式中:qe,吸附平衡时的嘌呤吸附量,mg/g;ce,溶液中嘌呤的平衡质量浓度,mg/L;KF,理论平衡吸附容量常数,mg/g;n,Freundlich吸附常数。
1.3.6 SEM表征
将OP与MOP1样品粉碎过100目筛,装于SEM专用圆钉的表面。样品镀金后以15.0 kV的加速电压和1 000、3 000、5 000倍放大倍数转移到扫描电子显微镜观察。
1.3.7 FTIR光谱测定
取适量OP与MOP1粉末进行红外光谱测定,红外光谱扫描范围4 000~600 cm-1,光谱分辨率4 cm-1,扫描次数2次。
1.3.8 数据处理
所有试验均重复3次,每次3个平行,试验结果取其平均值。所得数据采用Microsoft Excel 2019以及Origin软件进行处理,用SPSS Statistics 21对数据进行显著性分析(P<0.05)。
2 结果与分析
2.1 不同改性方式制备OP吸附剂的嘌呤脱除效果对比
由表2可知,根据嘌呤吸附率和吸附量结果比较,4种不同处理处理得到的MOP对嘌呤的吸附效果均比OP好,MOP1又明显优于其他3种改性吸附剂(P<0.05)。因此选择碱改性法进行后续的单因素及正交优化试验,制备OP改性吸附剂。
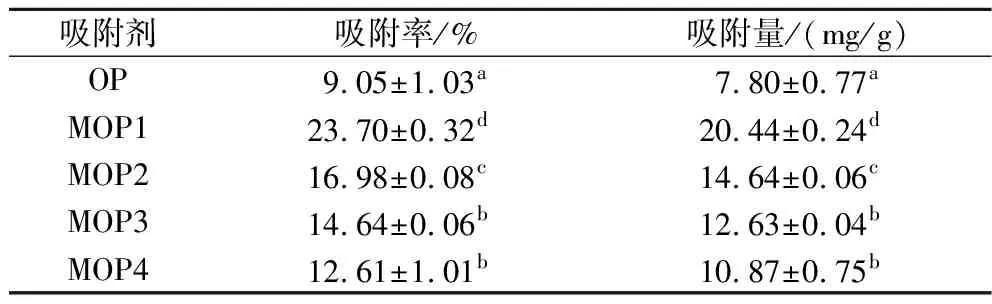
表2 嘌呤脱除效果对比Table 2 Comparison of purine removal effects
2.2 OP改性吸附剂制备条件的优化
对MOP1的改性条件进行单因素试验,由图1-a可知,在柑橘皮粉末粒度从40目增加到100目的过程中,嘌呤吸附率和吸附量都呈显著上升的趋势(P<0.05),此后继续增大目数至140目时,吸附效果没有明显变化。结合试验结果,制备MOP1吸附材料的OP粉末粒度定为100目。由图1-b可知,改性吸附材料对嘌呤吸附效果随着温度升高呈现先上升后下降的趋势,可能是随着温度升高,分子运动速度加快,发生有效碰撞的几率增大,改性吸附剂的吸附效果显著增强(P<0.05)。而温度继续升高时,吸附率反而降低了,这可能是因为MOP对嘌呤去除属于物理吸附,因为吸附一般是放热的,因此只要达到了吸附平衡,升高温度就会使吸附量下降[21]。另外也有可能是较高温度的改性处理对改性吸附剂的孔隙结构造成了破坏,不利于嘌呤脱除性能的提升。因此,改性处理温度选择40 ℃为宜。由图1-c可知,改性时间由20 min延长至60 min过程中,嘌呤吸附率和吸附量显著增大(P<0.05),且在改性时间为60 min时,达到最大值。因此,改性处理时间选择60 min。由图1-d可知,搅拌速度从50 r/min增加到250 r/min时,嘌呤吸附性能显著上升(P<0.05)。当转速达到250 r/min时吸附性能得到明显提升,因此,处理过程中转速定为250 r/min。

a-粒数;b-温度;c-时间;d-转速
2.3 制备工艺正交优化试验
由表3的试验结果可知,在不同处理条件下,所制得的MOP吸附材料对嘌呤的吸附率为25.88%~42.54%,嘌呤吸附量为29.50~48.49 mg/g。各因素对MOP1吸附嘌呤性能影响的主次关系为:C>B>A>D,即改性时间>改性温度>OP粒度>搅拌速度。正交试验得出的最佳处理条件为A1B2C1D2,对应为OP粒度80目、改性温度40 ℃、改性时间40 min、转速250 r/min。在此改性处理条件下,结合单因素试验所得最佳处理剂浓度及固液比,进行验证试验,最终测得嘌呤吸附率为43.13%,吸附量为49.17 mg/g,表明该正交试验得到的最优改性条件稳定可靠。
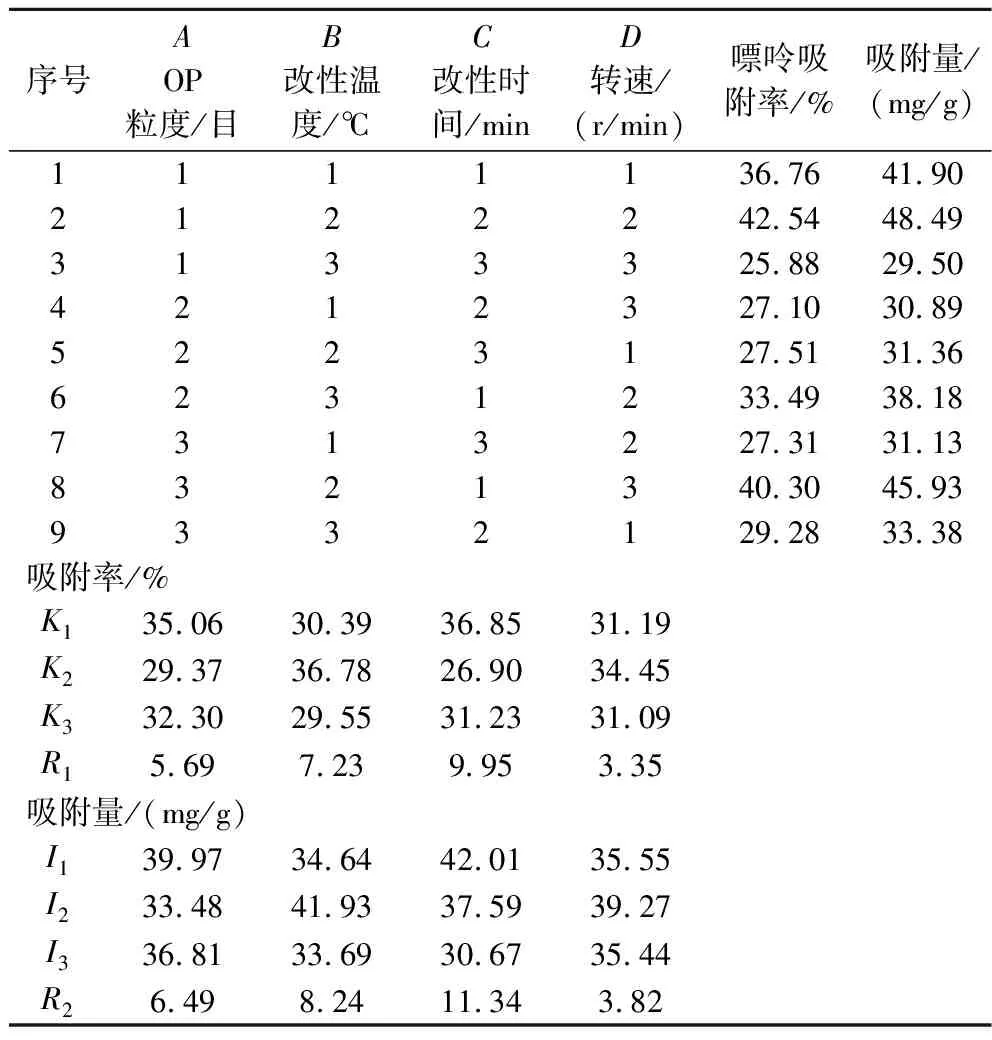
表3 正交试验设计及结果Table 3 Orthogonal experiment design and results
2.4 MOP吸附动力学性能研究
不同的吸附动力学方程和参数可以揭示MOP对嘌呤的吸附机理。利用动力学方程式对所得数据进行拟合,表4为吸附动力学方程中的相关参数。准一级动力学方程的相关系数R2为0.815 6,准二级动力学模拟的相关系数R2为0.992 7,后者比前者拟合效果更好;且根据得出的方程计算得到的平衡吸附量qe分别为30.40 mg/g和53.19 mg/g,后者更接近实验结果。颗粒内扩散拟合的相关系数为0.848 7,线性结果较差。表明MOP1对嘌呤的吸附过程更适用于准二级动力学方程,其吸附机理与嘌呤溶液的初始浓度和吸附剂的活性位点数有一定关系,吸附速率由化学吸附控制[22]。

表4 碱MOP吸附嘌呤的动力学相关参数Table 4 Kinetic-related parameters of MOP1 adsorption of purines
2.5 MOP等温吸附性能分析
由图2可知,不同的温度设置下,平衡吸附量均随着嘌呤溶液浓度的增大而增大,且温度对MOP1吸附嘌呤有一定的影响。在初始浓度较低时,吸附剂表面活性位点未达到饱和状态,所以吸附剂的吸附容量增加较快,嘌呤浓度持续增加,MOP1的吸附容量增加变缓直至不再变化。表5是不同温度下,MOP1对嘌呤吸附作用的Langmuir吸附等温线和Freundlich吸附等温线模型拟合结果,可以看出,3个不同温度下采用Langmuir吸附模型拟合得到的方程效果均优于Freundlich吸附等温方程,其中40 ℃下的相关系数R2(0.997 2)高于Freundlich吸附模型所得结果。说明Langmuir模型更符合MOP吸附的真实情况,吸附过程属于单分子层吸附,MOP1对嘌呤的吸附以化学吸附起主要作用。根据所得等温方程计算出40 ℃下的吸附容量qm为61.35 mg/g,与试验所得结果比较接近。
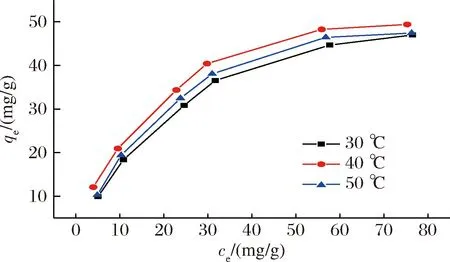
图2 不同温度下MOP1对嘌呤的吸附等温线Fig.2 Adsorption isotherms of MOP1 to purines at different temperatures

表5 等温吸附方程及其参数Table 5 Isothermal adsorption equation and its parameters
2.6 扫描电镜分析
对碱性改性前后的OP吸附剂分别进行1 000、3 000、5 000倍的电镜扫描,由图3可知,利用NaOH对OP改性处理之后,其形态特征发生了明显的变化,进而影响OP微观结构。从图3-a~图3-c中可以看出,未经处理的OP颗粒因含有大量的纤维素,表面相对较为光滑平整,纤维结构排列致密,孔隙较少且不明显。图3-d~图3-f中显示,改性处理之后,OP表面变得更加粗糙和疏松,孔隙增多,孔径变大。经碱液改性处理的MOP1脱嘌呤性能得到改善的原因可能是因为OP的有序结构在一定程度受到破坏,且NaOH使其所含的果胶分子上甲酯化的羧基皂化以提高羧基官能团的数目[23],形成的活性位点与嘌呤接触更加容易,所以更快发生物理或(和)化学吸附;也可能是MOP1作为典型的多孔隙物质,其多孔多褶皱的结构,提供的表面积更大。与此同时,提供的吸附位点和吸附空间也较多。另外,MOP1内部存在部分大孔和大量的微孔,介孔有助于减小传质阻力,促进传质过程,微孔有利于将嘌呤吸附进MOP内部从而提高其吸附性能。

a-改性前OP 1 000倍;b-改性前OP 3 000倍;c-改性前OP 5 000倍;d-改性后OP 1 000倍;e-改性后OP 3 000倍;f-改性后OP 5 000倍
2.7 红外光谱分析

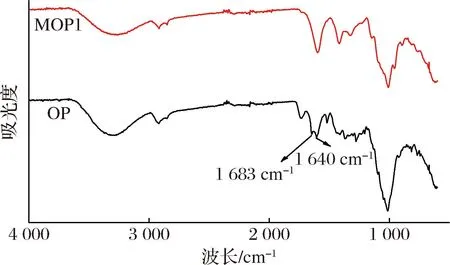
图4 OP改性前后的红外光谱图Fig.4 FTIR spectra of orange peel before and after modification
3 讨论
比较了不同改性方法处理OP,4种改性方法制备的OP吸附材料对嘌呤的吸附效果差异显著(P<0.05),其中碱法改性的吸附性能最好。碱性改性的最佳条件为OP粒度80目、改性温度40 ℃、改性时间40 min、转速250 r/min。在此改性条件下,最终测得嘌呤吸附率为43.13%,吸附量为49.17 mg/g。通过拟合模型,结果显示MOP1对嘌呤的吸附过程更适用于准二级动力学方程。此外,MOP1对嘌呤吸附热力学作用最符合Langmuir等温吸附模型,表明MOP1吸附嘌呤的整个过程主要是单分子层的化学吸附过程。扫描电镜结果直观的显示经过NaOH改性处理后的OP表面更加粗糙和疏松,孔隙增多,孔径变大,其表面的一些杂质及不利于吸附作用的物质被去除,比表面积增大,活性位点增加,利于吸附过程的进行。红外光谱结果表明,OP经过改性处理后,其表面大部分的官能团峰消失,同时也出现了新的吸收峰,MOP1的谱带强度发生了明显变化。改性处理使得OP的羟基和游离羧基含量增多,使改性吸附材料MOP1对嘌呤出现了选择性吸附。通过改性,OP渣对嘌呤类物质的吸附性大幅度提高,这为OP渣的有效利用及低嘌呤食品的开发提供了参考思路。

