PD1 及PDL1 在乳腺癌中的表达变化及其与患者临床病理参数和预后的关系
成兰云, 严晓苓, 邢晨阳, 冀 楠, 郭高敏, 陈文换
(涿州市医院,河北 涿州 072750)
程序性死亡受体(programmed death-1,PD1)和细胞程序性死亡配体(programmed cell death 1 ligand 1,PDL1)在T 淋巴细胞压迫和免疫反应的触发上具有决定性作用。PD1 属于CD28 类别的一部分,这种跨膜蛋白的构造主要包含288 个氨基酸残基,且其分子质量介于50~55 kD。PD1 的表现在参与抗原识别的免疫系统里显著增强,其被认定为衡量免疫系统活性的重要参数。PD1 由2 个配位元素构成,分别为PDL1 和PDL2,两者均属于B7 家族的跨膜元素。干扰素γ(interferon gamma,IFN-γ)主导PDL1 的表达,这种表达在造血细胞、肿瘤细胞等的表面分布十分广泛。PDL2 对IL-4 的反应比其他细胞更为敏感,在抗原传递细胞和Th2 型细胞中有所体现。
1 资料与方法
1.1 一般资料
收集2012 年1 月—2021 年10 月涿州市医院外科手术的患者信息,病理科保存的100 例确诊的浸润性乳腺癌的女性患者。100 例患者的年龄为25~78 岁,平均年龄(55.29±17.16)。其中<45 岁的患者有46 例,≥45 岁54 例;绝经者45 例,未绝经者55 例;临床分期:Ⅰ和Ⅱ期65 例,Ⅲ和Ⅴ期35 例;组织学分级:Ⅰ级26 例、Ⅱ级33 例、Ⅲ级41 例;肿瘤部位:外上象限74 例,其他部位26 例(外下象限13 例、内下象限4例、内上象限5例、中央部4例);肿瘤直径:<2 cm 47 例,≥2 cm 53 例;有淋巴结转移54 例,无淋巴结转移46 例。所有的乳腺组织样本均为离体标本。患者手术前均未接受任何与乳腺癌相关的治疗,包括新辅助化疗、内分泌治疗、靶向治疗、放疗等。本研究经涿州市医院医学伦理委员会批准,患者或其家属知情同意。
1.2 PD1及PDL1的检测方法
采用免疫组织化学技术,对手术切除的乳腺癌组织和与其相邻5 cm 或更远的正常乳腺组织中PD1 及PDL1 的表达进行评估。2 位资深病理医师采用双盲法对染色结果评分。PD1/PDL1 以细胞质和/或细胞膜出现棕黄至棕褐色为阳性。PDL1以阳性细胞数≥1%判为阳性,<1%判为阴性。PD1 表达于间质淋巴细胞,以阳性细胞数≥5%判为阳性,<5%判为阴性。
1.3 统计学分析
使用SPSS 26.0 软件分析检测数据,分别对2 个独立样本行t检验和χ2检验,对比分析乳腺癌部位及其周围正常组织内PD1 和PDL1 的表达情况;分析PD1 和PDL1 与各项临床病理指标之间的相关性,分析PD1 和PDL1 对预后的影响,P<0.05 为差异有统计学意义。
2 结果
2.1 具体表达情况
PD1 和PDL1 在乳腺癌组织中的表达阳性率分别为79.57%、79.57%,这2 个数值均超过PD1 表达于间质淋巴细胞的48.39%和22.58%;PD1的表达阴性率则是20.43%、20.43%,均不如PD1 表达于间质淋巴细胞的51.61%和77.42%。上述数据的差异有统计学意义(P<0.05)。乳腺癌组织PDL1 和间质淋巴细胞PD1的表达情况见表1。
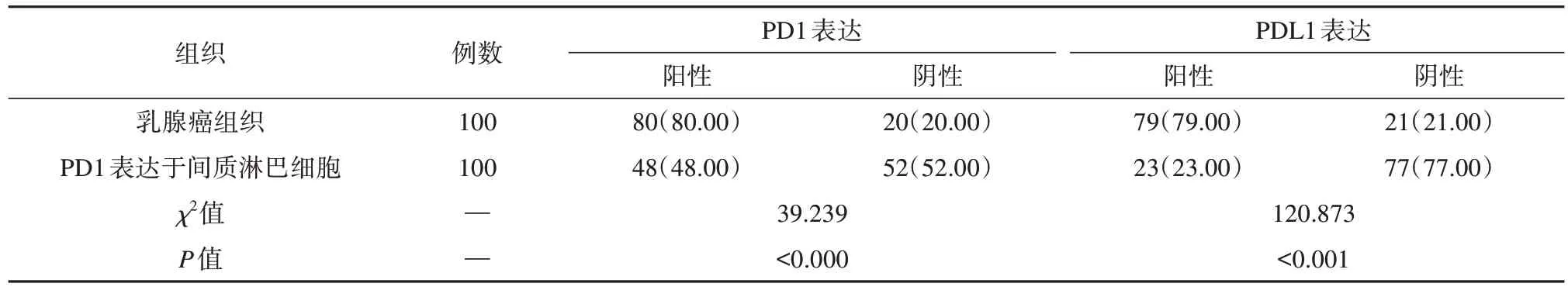
表1 乳腺癌组织和PD1表达于间质淋巴细胞PD1及PDL1表达情况
2.2 临床病理参数的相关性研究
Ⅱ级和Ⅲ级乳腺癌组织PD1阳性率超过Ⅰ级,同时,有淋巴结转移患者的PD1阳性率也超过未有淋巴结转移的患者,差异有统计学意义(P<0.05)。由于受性别、绝经程度、肿瘤尺寸、肿瘤位置、病程长短等因素影响,乳腺癌的PD1阳性率在数据分析中未获得明确的结果(P>0.05)。PD1在乳腺癌组织中的表达及其与临床病理参数的相关性研究见表2。
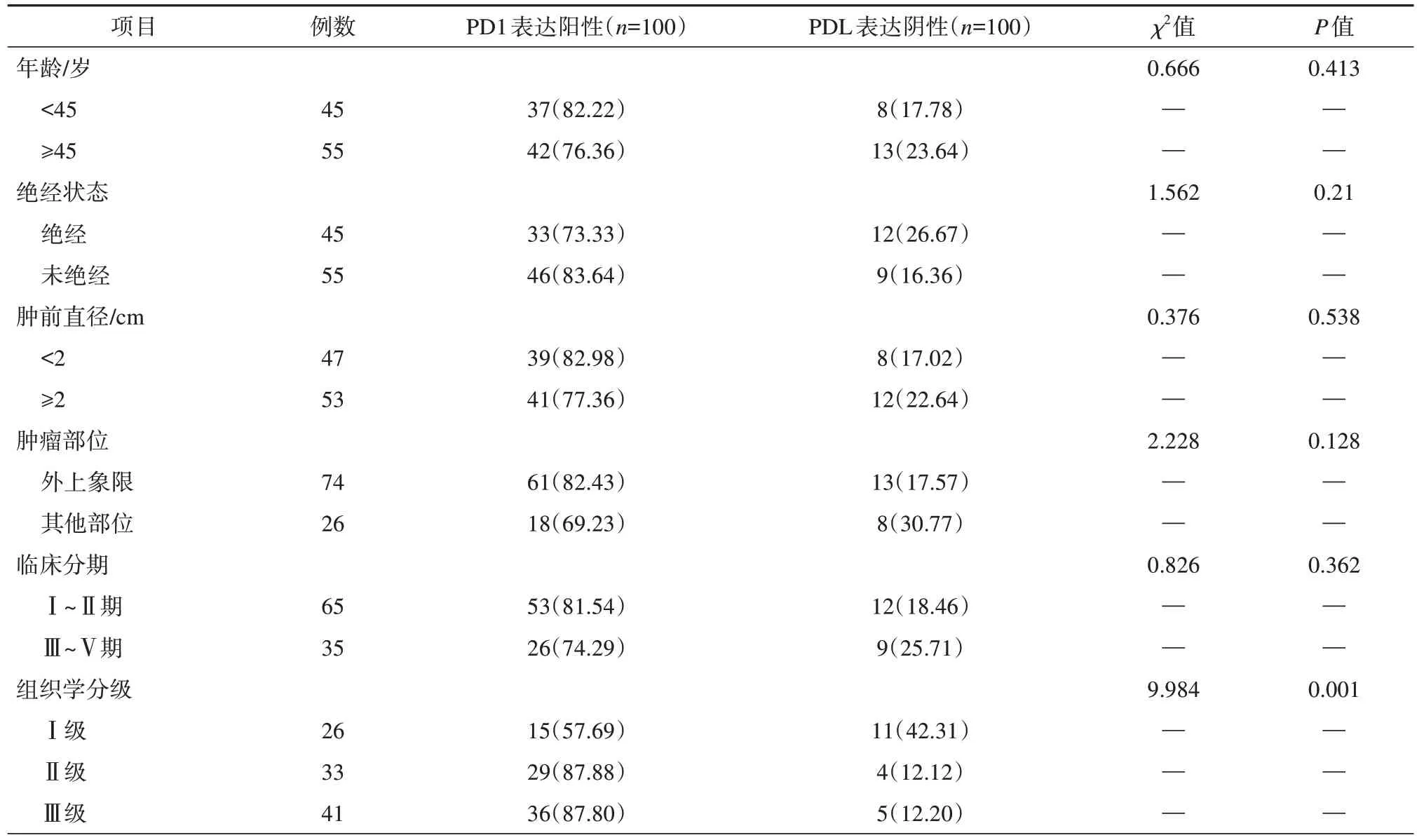
表2 乳腺癌组织PD1表达情况及其与临床病理参数的关系分析
PDL1 的阳性表达在乳腺癌的Ⅲ~Ⅴ阶段的病人中明显增加,而在组织学的Ⅱ级和Ⅲ级病人中,PDL1 的阳性表达比Ⅰ级病人更为显著,在统计学上具有显著差异(P<0.05)。由于性别、绝经状态、肿瘤大小、病灶位置及淋巴结转移的不同,对乳腺癌PDL1 阳性反应率的差异在数据分析中并无明显差异(P>0.05)。见表3。
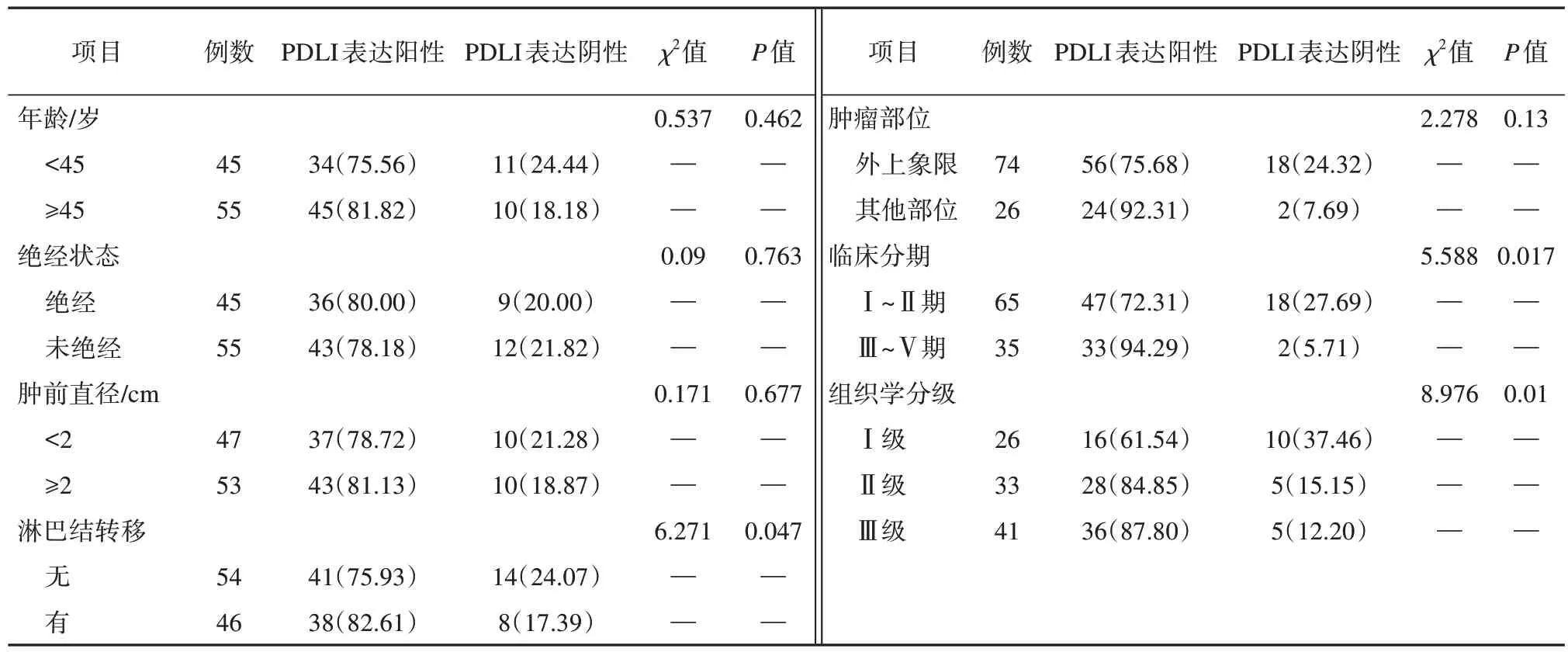
表3 乳腺癌组织PDLI表达情况及其与临床病理参数的关系分析
2.3 预后关系分析
PD1 和PDL1 在乳腺癌组织中表达阳性的病人,其生存期均短于阴性病人,在统计上具有显著差异(P<0.05)。过去3 年中,阳性患者的存活率普遍低于阴性患者,在统计学上具有重要意义(P<0.05)。乳腺癌组织PD1及PDL1表达情况及其与预后的关系分析见表4。
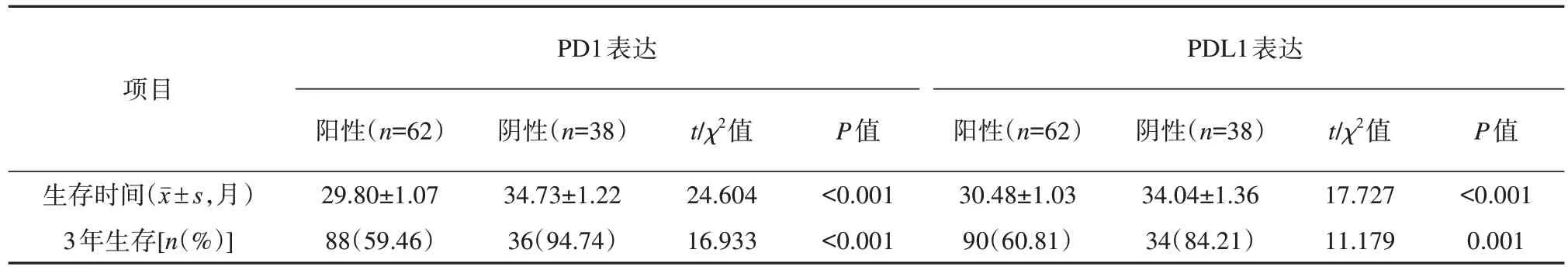
表4 乳腺癌组织PD1及PDL1表达情况及其与预后的关系分析
3 讨论
有研究表明,PDL2 的相互作用力量远胜PDL1,但PDL1 的调控作用则更为突出[1]。PD1 在正常状态下,一旦与配体结合,就有可能阻止自身的免疫反应,进而避免自身免疫性疾病的产生。尽管如此,PDL1 的表达量在许多癌症细胞内有所增加,这可能是由于其与淋巴细胞表面的PD1 产生交互,降低人体对癌症细胞的免疫响应,促使癌症细胞的免疫逃脱,最终导致癌症的形成和扩散。邱志敏等[2]调查结果显示,在乳腺癌组织里,PD1 和PDL1 的阳性表现程度均超过其周围的健康组织。深入分析可知,PD1 和PDL1 的正常表达水平与乳腺癌的肿瘤分期、组织分级、淋巴结的扩散情况等有密切联系。PD1/PDL1 是一种有效的浸润性乳腺癌治疗手段,采用该方法进行特定的治疗,能够避免肿瘤的再次发生,提升病人的生活品质。
一项关于PD1/PDL1 在乳腺癌中的分布及其临床价值的调查采用免疫组化法,分析39名乳腺癌病人及39 名非乳腺癌病人的乳腺癌组织样本[3]。研究结果显示,乳腺癌组织样本中PD1 蛋白的阳性分布占比较高,达到28.21%(11/39),这一数值超过非三阴性乳腺癌组织的10.26%(4/39),在统计学上具有显著差异(P=0.044)。在乳腺癌组织中,PD1蛋白的阳性表现占比高达41.03%(16/39),这个数值超过非三阴性乳腺癌组织的15.38%(6/39),在统计学上具有明显差异(P=0.025)。对比乳腺癌病人的年纪、更替情况、组织划分、肿瘤大小、淋巴结扩散情形、肿瘤侵犯神经情形及血管内的癌症栓塞情形,可知在乳腺癌患者的组织中,PD1 与PDL1 蛋白的阳性表达水平无明显差异(P>0.05)。依据前述研究结果,可以断定PD1 和PDL1 的表达水平对乳腺癌患者的病程发展没有影响。但乳腺癌组织中PD1和PDL1 的阳性表达比例明显高于非乳腺癌,提示PD1 和PDL1 可能是乳腺癌的一部分。因此,检测PD1 和PDL1 的表达,对乳腺癌的早期诊断具有重要作用。另外,切断PD1 和PDL1 的信号传导途径,也可能是乳腺癌的潜在治疗目标[4]。
这项研究的发现揭示了PD1 和PDL1 在乳腺癌组织中的阳性表达比在PD1 表达于间质淋巴细胞中更为显著,阴性表达则相对较少。PD1 表达阳性率在组织学分期Ⅰ的患者中,相较于分期Ⅱ和Ⅲ的患者,其有显著降低。但对于存在淋巴结转移的患者,其PD1 表达阳性率大大高于未发生淋巴结转移的患者。在临床分期Ⅰ~Ⅱ期的病人中,其乳腺癌组织PDL1 表达阳性率相对较低。同样,对于组织学分期为Ⅰ的病人,其PDL1 表达阳性率较分期Ⅱ和Ⅲ的病人要少,这表明PD1 和PDL1 可能是乳腺癌的一部分。这项研究的结果还揭示了,乳腺癌组织PD1 和PDL1 表达阳性的患者的生存期均短于阴性患者,3 年的生存率也低于阴性的患者,这表明PD1 和PDL1 表达阳性的乳腺癌患者的预后情况更为糟糕。PD1 和PDL1 在侵袭性乳腺癌的治疗中具有重要作用,通过这一特定的治疗靶点,可以有效地减缓或防止肿瘤的复发,进而提升患者的生活质量[5]。
综上所述,PD1 和PDL1 的阳性表现在乳腺癌中较为显著,且其与患者的临床病理指标和预后具有紧密联系,因此PD1 和PDL1 适合被应用于乳腺癌的实际治疗。

