丹参LBD基因家族的特性鉴定与抗热性分析
李万 樊昕华
摘 要:利用生物信息学方法,对丹参LBD(later organ boundaries domain)家族成员(SmLBDs)进行了系统的筛选和鉴定,并分析了其在高温胁迫(37 °C)下的表达模式。结果表明,丹参中共有52个SmLBDs,可分为groupI、groupII、groupIII、groupIV、groupV、groupVI和groupVII 共7组。52个SmLBDs编码蛋白的氨基酸残基数为103~298,相对分子质量为11.29~31.72 kDa,等电点分布于4.44~10.71,均为亲水性蛋白,且大多定位在细胞核中。此外,分析52个SmLBDs在高温胁迫(37 °C)下的表达模式发现,7个基因的表达水平下降,37个基因的表达水平上升,尤其是SmLBD8、SmLBD40和SmLBD44的表达水平显著提高,表明这些基因可能与丹参的抗热性相关。
关键词:丹参;LBD家族;亚细胞定位;高温胁迫
中图分类号:S567.23 文献标识码:A 文章编号:1674-0033(2024)02-0066-09
引用格式:李万,樊昕华.丹参LBD基因家族的特性鉴定与抗热性分析[J].商洛学院学报,2024,38(2):66-74.
Genome-wide Identification and Analysis of LBD
Gene Family in Salvia miltiorrhiza
LI Wan, FAN Xin-hua
(School of Biopharmaceutical and Food Engineering, Shangluo University, Shangluo 726000, Shaanxi)
Abstract: The members of the later organ boundaries domain (LBD) family of Salvia miltiorrhia LBD (SmLBDs) were systematically screened and identified using bioinformatics methods, and their expression patterns were analyzed under high temperature stress (37 °C). The results showed that there were 52 SmLBDs in Salvia miltiorrhiza, which could be divided into 7 groups: groupI, groupII, groupIII, groupIV, groupV, groupVI and groupVII. The amino acid residues of the 52 proteins encoded by SmLBDs ranged from 103 to 298, the relative molecular weights ranged from 11.29 to 31.72 kDa, and the isoelectric points were distributed from 4.44 to 10.71. All of 52 SmLBDs were hydrophilic proteins, and most of them were located in the nucleus. In addition, the expression patterns of 52 SmLBDs under high temperature stress (37 °C) were analyzed, and the expression levels of 7 genes were decreased, and 37 genes were increased, especially the expression level of SmLBD8, SmLBD40 and SmLBD44 was significantly increased, indicating that these genes may be related to the heat resistance of Salvia miltiorrhiza.
Key words: Salvia miltiorrhiza; LBD family; subcellular localization; high temperature stress
丹參(Salvia miltiorrhiza)为唇形科鼠尾草属多年生草本植物,是一种传统中药材,拥有悠久的历史,并被广泛应用。目前,由于丹参的市场需求量越来越大、野生丹参生境破坏加剧,野生丹参的产量已无法满足市场需要。同时,人工种植丹参存在抗性差、品质退化等问题,对丹参的产量和品质造成了极为严重的影响。因此,培育具有较强抗性的丹参已成为近年来的研究热点[1]。研究发现,侧生器官边界结构域(later organ boundaries domain,LBD)也被称为the asymmetric leaves2-like(ASL)基因家族,根据蛋白序列的不同可将LBD家族成员分为I类和II类[2-3],I类包含一个类似锌指结构域CX2CX6CX3C的基序[4],一个类似亮氨酸拉链结构域的甘氨酸-丙氨酸-丝氨酸(GAS-block)区域,以及一个蛋白质二聚体LX6LX3LX6L螺旋卷曲结构;II类只包含锌指结构CX2CX6CX3C[4]。研究表明,CX2CX6CX3C在LBD蛋白与DNA的结合中起重要作用,GAS-block和LX6LX3LX6L参与了LBD蛋白与其他蛋白的相互作用。例如,LBD与bHLH蛋白的相互作用可以降低CX2CX6CX3C对DNA的亲和力[2,5]。自从在拟南芥(Arabidopsis thaliana)中发现43个LBD蛋白以来,许多LBD蛋白已在水稻(Oryza sativa)、苹果(Malus domestica)等植物中被鉴定[6]。拟南芥AtLOB(AtASL4)基因主要表达在外侧组织的近端,可与SHOOTMERISTEMLESS(STM)蛋白和BREVIPEDICELLUS(BP)蛋白结合,调控幼叶的发育[4]。AtLBD41(AtASL38)在甜瓜(Cucumis melo)中的过表达可导致叶皱畸形,并具有明显的初始化现象。因此,推测它可能参与调控叶片的近轴极性和远轴极性[7]。AtLBD6(AtAS2)是水稻OsAS2的同源基因,其表达产物能够抑制叶片近轴区的细胞增殖和近远轴对称,与AS1和JAG协同形成扁平叶片,同时可参与水稻芽分化的调控和不同轮的边界表达,表明该基因可能调控花发育[8-10]。LBD10蛋白在拟南芥花粉发育过程中起关键作用[11]。在水稻中,OsIG1参与水稻的花器官数量和配子体发生[12]。OsLBD37和OsLBD38的过表达可以延缓水稻抽穗过程和速度,提高水稻产量[13]。苹果MdLBD13蛋白能抑制苹果中花青素的合成和氮的吸收[14]。玉米(Zea mays)ZmIG1调控雌配子的发育和叶片轴向分化[15]。桉树(Eucalyptus)EgLBD37基因的过表达使桉树的节间长度增加,植株较高,木质素木质化组分增加。EgLBD29的过表达使纤维的长度缩短,缩短了植物的循环生长。EgLBD22的过表达可增加韧皮部的纤维含量[16]。用10% PEG处理24 h后,葡萄(Vitis vinifera)VvLBD19表达上调,是对照的26倍[17]。研究表明,丹参易受不良环境影响,导致产量下降和品质降低,尤其是高温对丹参有效成分的积累十分不利[18-19]。因此,本文拟利用生物信息学和分子生物研究方法,从丹参中鉴定LBD基因家族成员(SmLBDs),通过分析其性质、基序(motif)组成、系统发育、亚细胞定位等,以及SmLBDs在高温胁迫下(37 ℃)的表达模式,筛选出对高温有明显响应的候选基因资源,为改善丹参对高温胁迫的抗性提供参考和理论依据,从而为提高丹参的产量和品质提供实验基础和数据支撑。
1 材料与方法
1.1 植物材料及生长条件
本研究使用的丹参植株由陕西天士力植物药业有限责任公司提供。将丹参植株移栽至10 cm×10 cm的方盆中(含有营养土和蛭石),置于人工气候箱中培养(20~22 °C,4 000 lx,16 h光照/8 h黑暗,湿度70%)。两周后,将长势相近的幼苗分为两组,第一组在37 °C下培养24 h(试验组),第二组在正常环境下培养24 h(对照组),随后采集相类部位的根、茎和叶组织各200 mg,混合后置于液氮中快速冷冻,并在-80 °C保存,待用。
1.2 丹参中LBD基因的鉴定及蛋白序列分析
为鉴定SmLBDs,通过本地Blast程序,利用TAIR数据库下载的46个AtLBDs蛋白序列,对丹参蛋白数据库中的SmLBDs(E<1×10-10)进行匹配和筛选。对获得的候选SmLBDs进行CDD(conserved domain database,https://www.ncbi.nlm.nih.gov/cdd/)分析,去除重复序列和错误序列,其余为丹参SmLBDs。利用MEGA7软件构建了丹参和拟南芥LBD蛋白的系统发育树(NJ、Jones- Taylor-Thornton JTT模型、1 000个重复和根值分析)。用MEME(http://meme-suite.org/)分析LBD蛋白的保守基序,基序数目设置为15个。
1.3 跨膜结构域和信号肽分析及亚细胞定位
利用ProtParam网站(http://us.expasy.org/tools/protparam.html)預测蛋白质性质,通过TOPCONS网站(https://topcons.cbr.su.se/)预测跨膜结构域和信号肽,使用CELLO网站(http://cello.life.nctu.edu.tw/)预测亚细胞定位。
1.4 RNA提取及基因表达的实时RT-PCR分析
使用天根生化科技(北京)有限公司总RNA提取试剂盒(DP419)提取总RNA;应用宝日医生物技术(北京)有限公司(takara中国)的反转录试剂盒PrimeScript RT reagent Kit(RR047A)合成cDNA;利用北京百泰克生物技术有限公司的荧光定量试剂2×Plus SYBR real-time PCR mixture(PR7702)实行荧光定量PCR(qPCR)分析。数据分析采用2-ΔΔct法进行分析[20]。
2 结果与分析
2.1 丹参LBD基因家族成员的鉴定
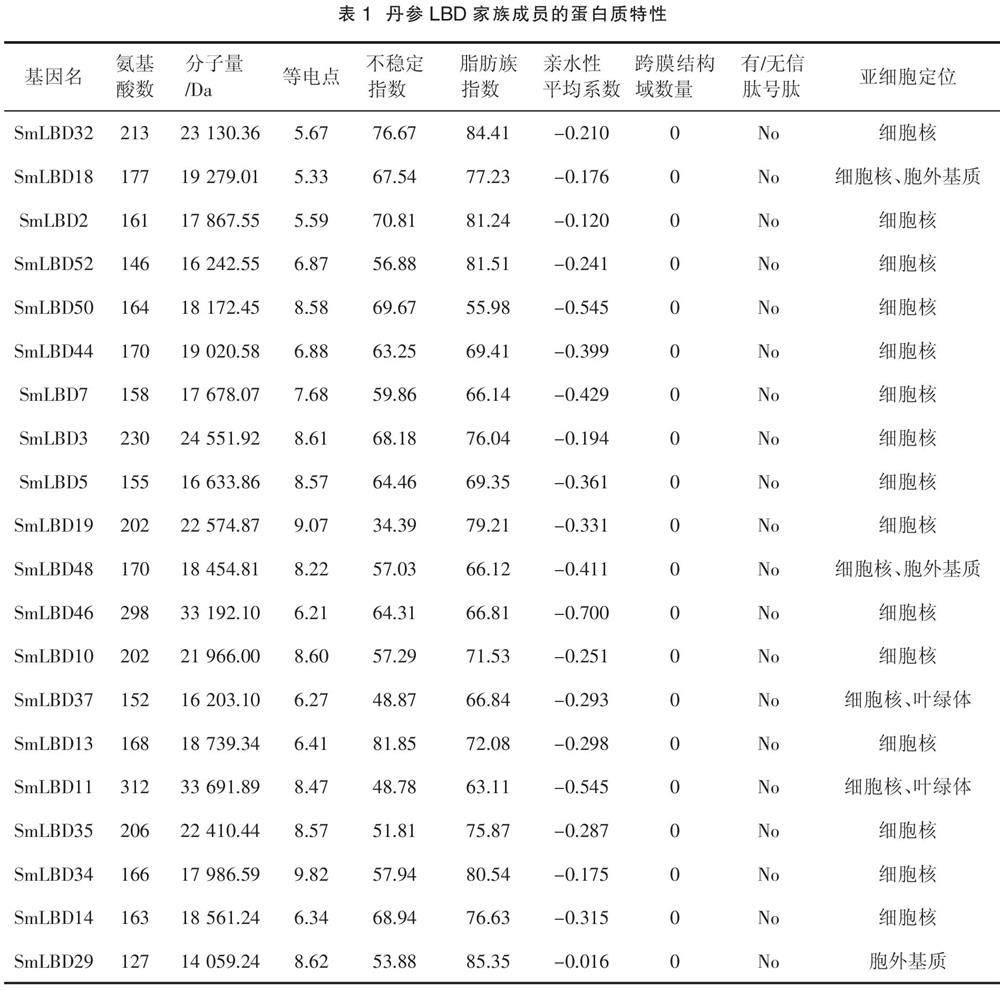
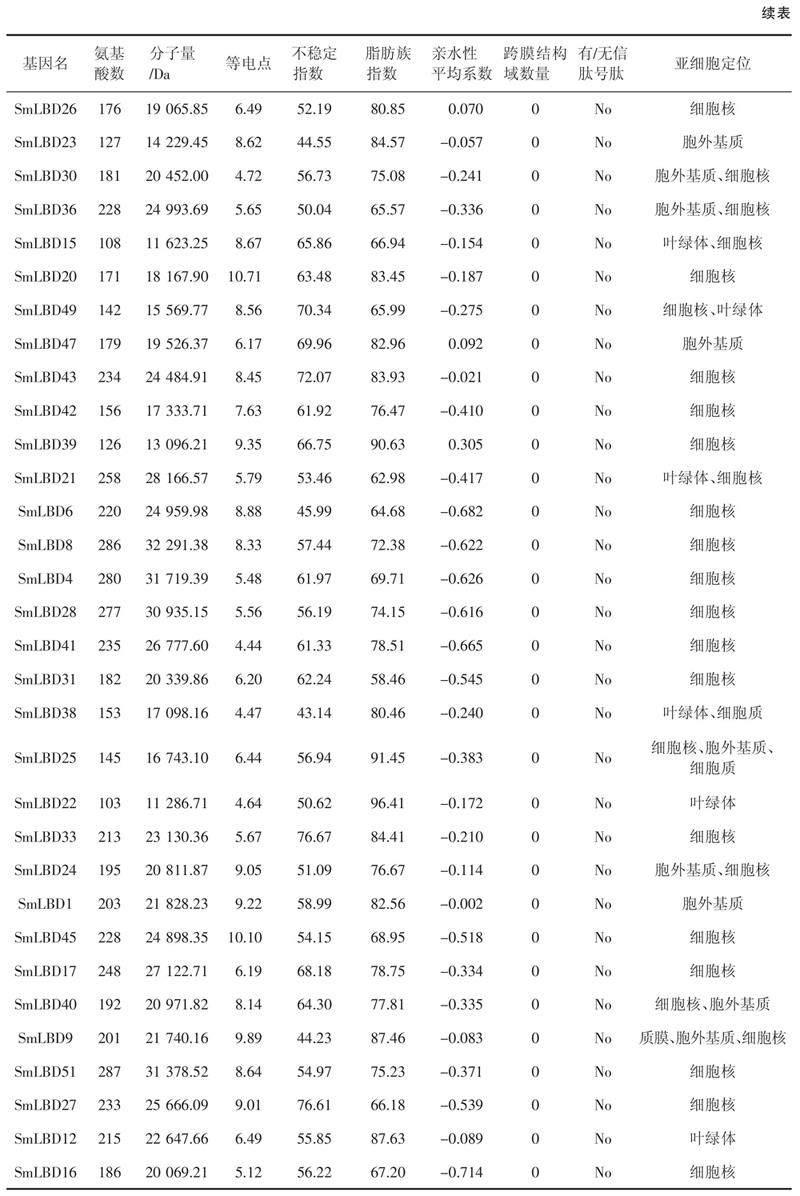
本研究鉴定了52个SmLBDs蛋白,如表1所示,SmLBD11是最大的蛋白,含有312个氨基酸残基,分子量为33.7 kDa。最小的蛋白是SmLBD22,只有103个氨基酸残基,分子量为11.3 kDa。52个SmLBDs蛋白的跨膜结构域数均为0,且没有信号肽,等电点范围为4.44(SmLBD41)~10.71(SmLBD20),亲水性平均系数(Grand average of hydropathicity,GRAVY)均小于0,范围为- 0.714(SmLBD16)~ - 0.002(SmLBD1),不稳定指数在34.39(SmLBD19)~81.85(SmLBD13),脂肪族指数为55.98(SmLBD50)~96.41(SmLBD22)。亚细胞定位分析表明,大部分基因位于细胞核中,而SmLBD18、SmLBD48、SmLBD24和SmLBD40存在于细胞核和胞外基质中,SmLBD37、SmLBD11、SmLBD15、SmLBD49和SmLBD21出现在细胞核和叶绿体中,SmLBD29、SmLBD23、SmLBD47和SmLBD1出现在胞外基质中,SmLBD9出现在细胞核、质膜和胞外基质中。
2.2 丹参LBD基因家族的系统进化分析
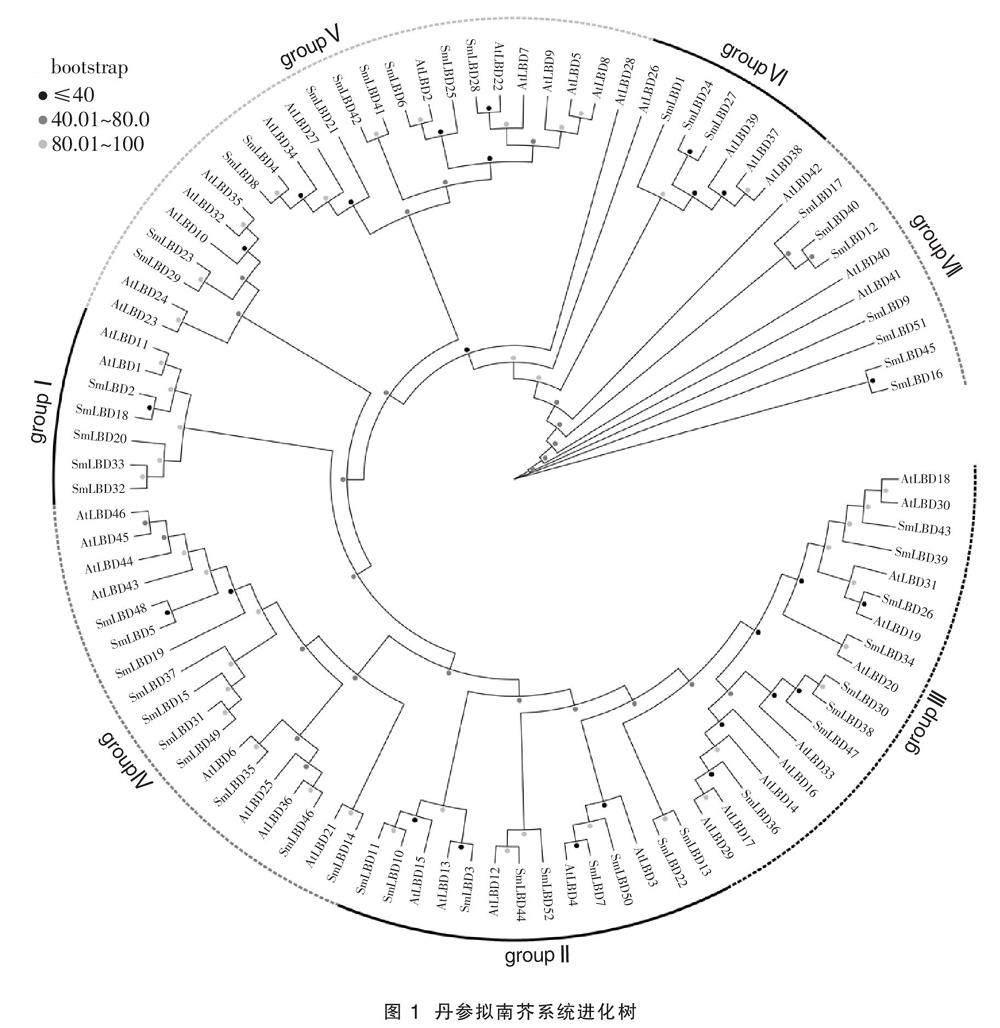
构建SmLBDs和AtLBDs的进化树,如图1所示,52个SmLBDs基因被分为groupI(包含5个成员)、groupII(包含9个成员)、groupIII(包含8个成员)、groupIV(包含10个成员)、groupV(包含10个成员)、groupVI(包含3个成员)和groupVII(包含7个成员),32个SmLBDs和AtLBDs的进化树组成16对同源基因,其中12对同源基因的bootstrap值高于80,分别为SmLBD52/SmLBD44、
SmLBD50/SmLBD7、SmLBD10/SmLBD11、SmLBD13/SmLBD22、SmLBD30/SmLBD38、SmLBD46/SmLBD35、SmLBD5/SmLBD48、SmLBD49/SmLBD31、SmLBD42/SmLBD41、SmLBD8/SmLBD4、SmLBD29/SmLBD23、SmLBD24/SmLBD27。
2.3 SmLBDs的保守基序分析
使用MEME(http://meme-suite.org/)在线工具鉴定了15个保守基序,如图2所示,groupII、gruopIII、groupIV和groupV的大部分SmLBDs都包含基序1,2,3和4。含有基序数量最多的7个基因分别是SmLBD4、SmLBD8、SmLBD10、SmLBD11、SmLBD32、SmLBD33和SmLBD45,分布在groupI、groupII、groupV和groupVII,共有11个基序,分别为基序1,2,3,4,5,7,9,10,11,14和15。含有基序数量最少的基因是groupVI的SmLBD27,只有2个基序,基序1和5。此外,groupVI只包含3个基因:SmLBD1,SmLBD24和SmLBD27,均包含基序1,2,5和11;除了SmLBD16仅含有基序7和11之外,其它51个基因都含有基序1;基序10只存在于SmLBD32和SmLBD33。
2.4 SmLBDs在高温条件下的表达分析
图3是通过检测SmLBDs在高温胁迫下的表达模式图,从图3中发现,SmLBD5、SmLBD6、SmLBD18、SmLBD19、SmLBD23、SmLBD28和
SmLBD36的基因表达量呈下降趋势;SmLBD1、SmLBD3、SmLBD9、SmLBD13、SmLBD26、SmLBD33、SmLBD35和SmLBD37这8个基因的表达量均无显著变化;其它37个基因的表达量呈上升趋势,尤其是SmLBD8、SmLBD40和SmLBD44的表达量升高了20倍以上,表明这三个基因对高温比较敏感,可能是丹参抵御高温胁迫的关键基因。
3 讨论与结论
LBD蛋白家族是一种植物特异性转录因子,在植物生长发育和逆境胁迫中发挥重要作用。本研究在丹参中发现了52个SmLBDs蛋白,并对其进行了系统分析。等电点范围为4.44~10.71,其中25个SmLBDs的等电点小于7,为酸性蛋白,27个SmLBDs大于7,为碱性蛋白。跨膜结构域和信号肽是分泌蛋白的标志[21],52个SmLBDs蛋白均不含有跨膜结构域和信号肽,即均为非分泌蛋白。GRAVY值大于0表明蛋白疏水,小于0表明蛋白质亲水,丹参SmLBDs的GRAVY值均小于0,表明均为亲水蛋白。脂肪族指数是衡量蛋白溶解性、稳定性和抗氧化性等特性的指标,值越大,说明该蛋白的溶解性和稳定性越好。丹参52个SmLBDs的脂肪族系数均在55.98以上,最大为96.41,表明这些蛋白具有较好的溶解性和稳定性。不稳定指数用来衡量目的蛋白在体外的稳定性,值小于40表明蛋白质较为稳定[22]。本研究发现,51个SmLBDs的不稳定指数大于40,说明蛋白性质不稳定,而SmLBD19的不稳定指数为34.39,即蛋白性质稳定。转录因子通常在细胞核中表达发挥作用,因此通过亚细胞定位分析发现,大部分SmLBDs定位于细胞核中,这也是其不含跨膜结构域和信号肽的原因。然而,有一部分SmLBDs定位在胞外基质、叶绿体和质膜等位置,表明这些蛋白可能具有其他的特殊功能,还需要进行深入研究加以确定。
Yamasaki等[23]研究认为保守基序在活性蛋白中发挥了功能或结构作用。因此,分析SmLBDs的motif组成有利于推测基因功能。此外,为了了解某个基因的功能,通过对与该基因相似度或同源性较高的其他基因的功能进行预测是一种较为常用的方法。例如,拟南芥AtLBD16、AtLBD17、AtLBD18和AtLBD29能够诱导愈伤组织形成,参与植株再生,根据进化树分布,位于同一分支的丹参SmLBD26、SmLBD30、SmLBD34、SmLBD36、
SmLBD38、SmLBD39、SmLBD43和SmLBD47应该具有类似功能[6]。AtLBD16、AtLBD18和AtLBD29主要在侧根中表达,可能和拟南芥根发育有关,丹参以根入药,因此,通过调控SmLBD36和SmLBD43等同源基因的表达,可能能够促进丹参根的发育,提高产量和品质[22]。AtLBD6与拟南芥的花和叶的发育有关[8-10],过表达AtLBD1和AtLBD11,可使植株长高,并增加节间长度[16],因此,可推测丹参中SmLBD35和SmLBD2等基因也有相似功能。其它SmLBDs的基因功能,可以依据已有的AtLBDs基因功能的研究结果进行分析预测,或者通过构建丹参和其他物种LBD基因的系统进化树进行预测。
LBD家族与植物对非生物胁迫的抗性有关,例如,葡萄VvLBD19的表达量在PEG处理后显著上调。在干旱胁迫下,马铃薯StLBD1-5和StLBD2-6的表达量显著下调,而StLBD2-6和StLBD3-5的表达量显著上调,表明这些基因可能有助于维持马铃薯的正常代谢,增强马铃薯的抗旱性[6,17]。然而,在丹参等药用植物中关于LBD与耐热性关系的研究鲜有报道。本研究通过分析高温胁迫下丹参52个SmLBDs的表達水平发现,44个SmLBDs可能与丹参的耐热性相关,尤其是SmLBD8、SmLBD40和SmLBD44的表达量在高温胁迫下极显著升高,表明这3个基因在丹参抵御高温胁迫中可能具有关键作用,可作为提高丹参耐热性的候选基因资源。
综上所述,本研究通过对丹参LBD基因家族进行系统的筛选和鉴定,并在高温胁迫下分析SmLBDs的表达模式,筛选出了3个可能与丹参耐热性相关的关键基因,为培育具有优良抗逆性的丹参品种,提高丹参产量和品质提供了试验基础和理论依据。
参考文献:
[1] 陈尘,韩立敏,化文平,等.丹参DHAR家族基因的鉴定及表达模式分析[J].园艺学报,2020,47(11):2181-2193.
[2] MATSUMURA Y, IWAKAWA H, MACHIDA Y, et al. Characterization of genes in the Asymmetric Leaves2/Lateral Organ Boundaries (AS2/LOB) family in Arabidopsis thaliana, and functional and molecular comparisons between AS2 and other family members[J].Plant J,2009,58(3):525-537.
[3] IWAKAWA H, UENO Y, SEMIARTI E, et al. The ASYMMETRIC LEAVES2 gene of Arabidopsis thaliana, required for formation of a symmetric flat leaf lamina, encodes a member of a novel family of proteins characterized by cysteine repeats and a leucine zipper[J].Plant Cell Physiol,2002,43(5):467-478.
[4] SHUAI B, REYNAGA-PENA C G, SPRINGER P S. The lateral organ boundaries gene defines a novel, plant-specific gene family[J].Plant Physiol,2002,129(2):747-761.
[5] MA H, ZHAO J. Genome-wide identification, classification, and expression analysis of the arabinogalactan protein gene family in rice (Oryza sativa L.)[J].J Exp Bot,2010,61(10):2647-2668.
[6] LIU H, CAO M, CHEN X L, et al. Genome-wide analysis of the Lateral Organ Boundaries Domain (LBD) gene family in Solanum tuberosum[J].Int J Mol Sci,2019,20(21):5360.
[7] MENG L S, LIU H L, CUI X, et al. ASYMMETRIC LEAVES2-LIKE38 gene, a Member of AS2/LOB family of Arabidopsis, causes leaf dorsoventral alternation in transgenic cockscomb plants[J].Acta Physiol Plant,2009,
31(6):1301-1306.
[8] SEMIARTI E, UENO Y, TSUKAYA H, et al. The ASYMMETRIC LEAVES2 gene of Arabidopsis thaliana regulates formation of a symmetric lamina, establishment of venation and repression of meristem-related homeobox genes in leaves[J].Development,2001,128(10):1771-1783.
[9] IWAKAWA H, IWASAKI M, KOJIMA S, et al. Expression of the ASYMMETRIC LEAVES2 gene in the adaxial domain of Arabidopsis leaves represses cell proliferation in this domain and is critical for the development of properly expanded leaves[J].Plant J,2007,
51(2):173-184.
[10] LUO J H, WENG L, LUO D. Isolation and expression patterns of LATERAL ORGAN BOUNDARIES-like genes
in Lotus japonicus[J].J Plant Physiol Mol Biol,2006,32(2):202-208.
[11] KIM M J, KIM M, KIM J. Combinatorial interactions between LBD10 and LBD27 are essential for male gametophyte development in Arabidopsis[J].Plant Signal Behav,2015,10(8):1-3.
[12] ZHANG J R, TANG W, HUANG Y L, et al. Down-regulation of a LBD-like gene, OsIG1, leads to occurrence of unusual
double ovules and developmental abnormalities of various floral organs and megagametophyte in rice[J].J Exp Bot,2015,66(1):99-112.
[13] LI C, ZHU S, ZHANG H, et al. OsLBD37 and OsLBD38, two class II type LBD proteins, are involved in the regulation of heading date by controlling the expression of Ehd1 in rice[J].Biochem Biophys Res Commun,2017,486(3):720-725.
[14] LI H H, LIU X, AN J P, et al. Cloning and elucidation of the functional role of apple MdLBD13 in anthocyanin
biosynthesis and nitrate assimilation[J].Plant Cell Tissue Organ Cult,2017,130(1):47-59.
[15] EVANS M M. The indeterminate gametophyte1 gene of maize encodes a LOB domain protein required for embryo Sac and leaf development[J].Plant Cell,2007,19(1):46-62.
[16] LU Q, SHAO F J, MACMILLAN C, et al. Genomewide analysis of the lateral organ boundaries domain gene family in Eucalyptus grandis reveals members that differentially impact secondary growth[J].Plant Biotechnol J,2018,16(1):124-136.
[17] HE H H, MA Z H, ZHANG Y X, et al. Identification and Expression analysis of LBD gene family in Grape[J].Sci Agric Sin,2018,51(21):4102-4118.
[18] 方鑫,楊峥,王晨旭,等.丹参DnaJ基因的鉴定及胁迫响应分析[J].南京农业大学学报,2022,45(1):94-102.
[19] 贺玉林.丹参有效成分的积累及其与生态因子的关系[D].北京:中国协和医科大学,2007:59-74.
[20] LI W, CHENG M, ZHAO Y P. Identification and characterization of potassium (K+) transporters in potato (Solanum tuberosum L.) [J].Taiwania,2022,67(3):422-434.
[21] 李欣宇,徐启宇,卫宇翔,等.高粱LKR基因结构及在种子发育中的表达特征分析[J].山西农业科学,2022(12):1591-1598.
[22] 刘俊,李龙,陈玉龙,等.杜仲LBD基因家族全基因组鉴定与进化表达分析[J].中草药,2022,53(10):3142-3155.
[23] YAMASAKI K, KIGAWA T, SEKI M, et al. DNA-binding domains of plant-specific transcription factors: structure, function, and evolution[J].Trends Plant Sci,2013,
18(5):267-276.

