Pdx-1、Ngn3联合MafA诱导干细胞分化为胰岛素分泌细胞移植治疗1型糖尿病大鼠的效果
闫淑芳,袁慧娟
(1.河南大学淮河医院 内分泌科,河南 开封 475000;2.河南省人民医院 内分泌科,河南 郑州 450003)
糖尿病作为慢性代谢性疾病,发病率逐年上升,寻求新的治疗方法十分必要。大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)可通过转染胰腺转录因子被成功分化为胰岛素分泌细胞(insulin-producing cells,IPCs)。胰腺的转录因子是控制胰腺的分化、发育、增殖和凋亡的关键基因。胰十二指肠同源盒1(pancreatic duodenal homeobox 1,Pdx-1)作为胰腺分化的关键转录因子,其外源性表达可以诱导非β细胞表达胰腺β细胞的相关基因,尤其是胰岛素基因[1-2]。前期研究已经证实Pdx-1可诱导BMSCs转分化为IPCs。另一个关键因子神经元素3(neurogenin,Ngn3)激活并启动上皮祖细胞分化为胰腺内分泌细胞[3]。V型肌腱膜纤维肉瘤癌基因同源基因A(V-type tendon fibrosarcoma oncogene homolog A,MafA)主要功能是在Pdx-1基因表达的前提下反式激活胰岛素相关基因的表达,参与胰腺β细胞的形成以及维持胰腺β细胞的功能。前期研究成功应用Pdx-1、Ngn3和MafA共转染BMSCs诱导为IPCs,且具有胰岛素分泌细胞的特性[4],那么分化的细胞移植到糖尿病大鼠体内是否具有降低血糖的作用呢?本研究拟通过Pdx-1、Ngn3和MafA共转染BMSCs诱导为IPCs,移植到1型糖尿病大鼠的肾被膜下观察其疗效。
1 材料与方法
1.1 实验动物
清洁级SD大鼠60只,雄性,90~120 g,购自郑州大学实验动物中心,饲养于郑州大学人民医院中心实验室,恒温18~23 ℃,相对湿度55%~66%,光线明暗各12 h,自由进食进水,适应性饲养7 d。
1.2 主要仪器及试剂
腺病毒载体pAd-EGFP、pAd-Cherry、pAd-MafA-EGFP和pAd-Pdx-1-T-Ngn3-Cherry(毒滴度为1010pfu·mL-1)(上海吉凯基因化学有限公司);高糖培养基、低糖培养基、胎牛血清(Gibco公司,美国);链脲佐菌素、水合氯醛、40 g·L-1多聚甲醛、胰岛素抗体(abcam公司)。
1.3 实验方法
1.3.1转染及诱导BMSCs
取生长良好的P3代细胞,待细胞融合达50%~60%,pAd-MafA-EGFP和pAd-Pdx-1-T-Ngn3-Cherry以MOI均为30转染BMSCs。常规培养于体积分数10%胎牛血清、4.5 mmol·L-1葡萄糖DMEM培养基,置于37 ℃、体积分数5%CO2恒温培养箱,每日倒置荧光显微镜下观察细胞形态变化及荧光表达情况,每2 d换液1次,每次换液前用磷酸盐缓冲液轻轻漂洗细胞两遍。
1.3.21型糖尿病大鼠模型的构建
SD大鼠适应性喂养1周后,禁食12 h,腹腔一次性注射链脲菌素(55 mg·kg-1),3 d后监测每日血糖,选取连续7 d测空腹血糖>16.65 mmol·L-1作为1型糖尿病大鼠模型[5]。45只SD大鼠均造模成功,造模后1周随机分组进行移植。15只normal组大鼠腹腔注射等量生理盐水。
1.3.3肾被膜下移植
取P3代BMSCs以及诱导7 d后的IPCS,胰蛋白酶消化备用。15只健康大鼠作为正常对照组,将造模成功的45只SD大鼠随机分为3组:sham-operation组、BMSCs组、IPCs组。腹腔注射水合氯醛(3 mL·kg-1)麻醉大鼠,剥离左侧肾脏,1 mL注射器吸取0.2 mL BMSCs(细胞数2×106)注射到BMSCs组大鼠的肾被膜下,0.2 mL IPCs(细胞数2×106)注射到IPCs组大鼠的肾被膜下,sham-operation组和normal组大鼠肾被膜下注射等体积的生理盐水。
1.3.4移植后监测空腹血糖、体重及行IPGTT实验
移植后第0、7、14、21、28天分别监测大鼠的体重和空腹血糖。将大鼠放至捕鼠器中固定,用剪刀剪去少许大鼠尾部尖端,挤出少量血液,滴在血糖试纸凹槽中,记录血糖仪显示的血糖数值。鼠笼放置于天平上,设置天平归零,将大鼠放入鼠笼中,观察读数并记录。移植后21 d,将大鼠禁食12 h,葡萄糖按照每公斤体重2 g灌入大鼠胃内[6],注射前及注射后30、60、90 min监测大鼠血糖并记录。
1.3.5免疫组织化学
移植后第28天按照每公斤体重3 mL水合氯醛麻醉大鼠,完整取出肾脏,生理盐水冲洗,迅速投入40 g·L-1多聚甲醛固定3 h,取出组织放入包埋盒,切片制片后进行组织化学染色,显微镜下拍照并进行ODI统计比较。
1.4 统计学方法
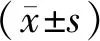
2 结果
2.1 移植后大鼠空腹血糖及体重变化情况
移植后第0、7、14、21、28天分别监测血糖,BMSCs和IPCs组大鼠血糖随时间下降,移植第21天两组大鼠空腹血糖低于移植第0天,且均低于同期sham-operation组(P<0.05),移植第28天,IPCs组大鼠空腹血糖低于BMSCs组(P<0.05)。见表1。
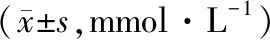
表1 各组大鼠在移植各阶段空腹血糖水平
移植后第0、7、14、21、28天分别称量各组大鼠体重,移植第28天normal组大鼠体重高于移植第0天(P<0.05),sham-operation组大鼠体重低于第0天(P<0.05),而IPCs组大鼠体重高于移植第0天(P<0.05)。见表2。
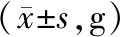
表2 各组大鼠在移植各阶段体重水平
2.2 大鼠腹腔葡萄糖耐量实验
糖尿病大鼠葡萄糖耐量试验曲线下面积大于正常大鼠,但各组糖尿病大鼠间也存在差异,糖尿病大鼠中IPCs组和BMSCs组曲线下面积小于sham-operation组,且IPCs组曲线下面积最小(P<0.05)。见图1。
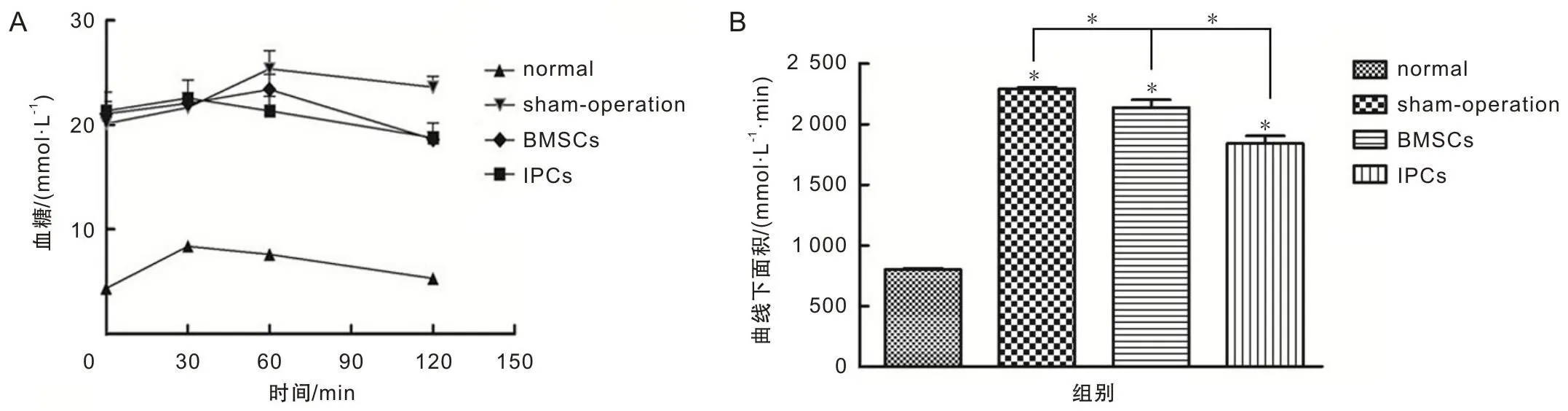
A图为各组大鼠腹腔糖耐量实验血糖水平曲线;B图为各组大鼠腹腔糖耐量实验血糖水平曲线下面积; *P<0.05。
2.3 大鼠肾脏免疫组化
大鼠肾脏免疫荧光显示,normal组和sham-operation组大鼠肾脏组织未见明显胰岛素表达,BMSCs组和IPCs组大鼠肾脏组织可见棕色荧光的胰岛素表达(图2),BMSCs组和IPCs组胰岛素荧光光密度高于sham-operation组(P<0.05),且IPCs组胰岛素光密度高于BMSCs组(图3)(P<0.05)。
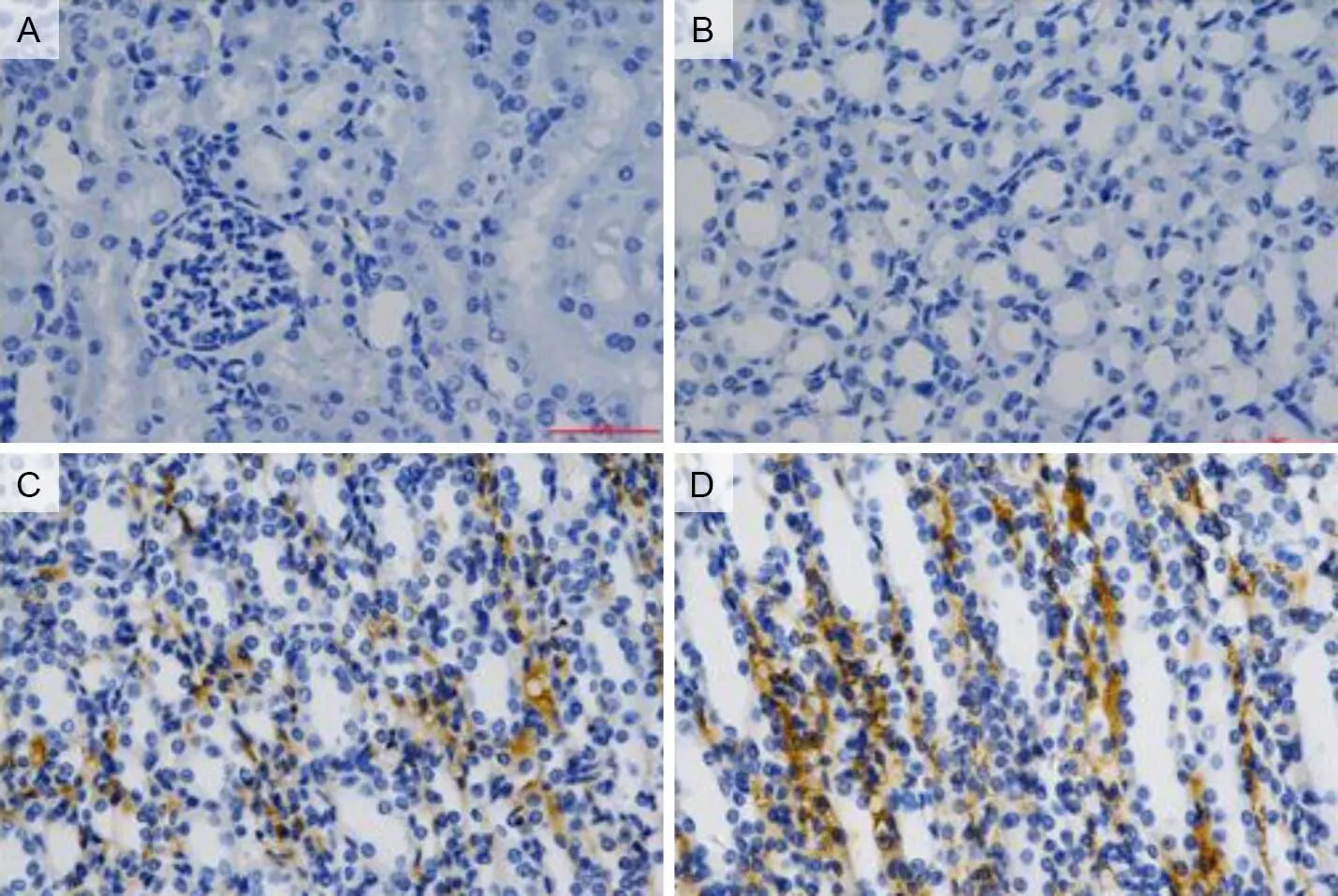
A为normal组;B为sham-operation组;C为BMSCs组;D为IPCs组。

图3 大鼠肾脏免疫组织化学图片
3 讨论
BMSCs分化为IPCs治疗糖尿病成为新的研究热点,前期研究已证实在体外BMSCs可被 Pdx-1-Ngn3联合MafA诱导分化为可分泌胰岛素并表达胰岛素相关基因的IPCs[4-5,7]。那么其移植到体内能否存活及治疗糖尿病大鼠呢?本研究拟通过Pdx-1-Ngn3联合MafA诱导BMSCs分化为IPCs,移植到1型糖尿病大鼠体内,观察其存活情况及疗效。
本研究免疫组织化学结果提示移植组大鼠肾脏组织中存在胰岛素分泌,证实移植的细胞可在移植部位存活并发挥分泌胰岛素的功能,进而降低糖尿病大鼠的血糖以及改善高糖毒性所致的体重减轻现象。这与既往研究证实干细胞的可降低糖尿病大鼠的血糖[1]一致。
随着移植时间的变化,各组大鼠血糖的变化提示移植细胞在体内发挥着降低糖尿病大鼠血糖的作用,且IPCs移植后糖尿病大鼠空腹血糖较其他糖尿病大鼠更低。这与体外实验发现的IPCs较BMSCs分泌胰岛素的水平高[4]是一致的。相反,各移植组糖尿病大鼠的体重随时间变化出现增加趋势,不排除这一现象系糖尿病大鼠高血糖状态得以缓解的表现,也不排除系糖尿病大鼠的胰岛素抵抗得以解除所致[8]。研究显示干细胞的外分泌及定向趋化作用可修复受损细胞的功能[9]。
腹腔糖耐量实验曲线下面积显示,移植组糖尿病大鼠的腹腔糖耐量实验曲线下面积小于sham-operation组,考虑可能与干细胞移植后两方面的作用有关,一是通过降低β细胞周围的血糖浓度使其高糖毒性解除改善内分泌功能,二是通过趋化作用修复受损的β细胞改善糖尿病大鼠的胰岛功能[10]。IPCs组腔糖耐量实验曲线下面积小于BMSCs组,可能与关键转录因子调控后其分化以及功能更加完善有关[3,11]。
该研究证实BMSCs体外诱导分化后移植到糖尿病大鼠体内可发挥降糖作用,其创新之处在于,既往研究多选择尾静脉、腹腔等部位移植细胞[11-12],对于后续干细胞的追踪存在一定的弊端,而本研究采用肾被膜下移植可使干细胞的追踪易于进行。但其也存在不足之处,例如本研究的大鼠样本量较小,研究时间较短,难免存在观察方面的误差。后续的研究可进一步加大样本量,延长实验观察时间,也可对移植细胞进行荧光染色进行追踪。
4 结论
BMSCs经体外诱导分化后移植到糖尿病大鼠体内可发挥分泌胰岛素的功能,从而降低糖尿病大鼠血糖。Pdx-1、Ngn3和MafA联合诱导后的IPCs发挥上述作用较BMSCs明显增强。

