虾青素立体异构体与牛血清白蛋白的相互作用
郑钦生,周乐松,张俊林,邹晓君,曹庸,刘晓娟
(华南农业大学食品学院,广东省功能食品活性物重点实验室,广东广州 510642)
虾青素(Astaxanthin,AST)是一种含氧类胡萝卜素,其分子结构是一条两端连接β-紫罗兰酮环的共轭双键长链,并且环上各含有一个羟基和酮基(图1)。基于这些结构特性,虾青素被赋予超强的抗氧化特性[1]。在自然界中,AST 主要以全反式的形式存在。由于具有手性碳原子,AST 产生了左旋(3S,3’S)、右旋(3R,3’R)和内消旋(3S,3’R)三种立体异构体,并分别存在于不同的生物体中,如雨生红球藻中主要存在左旋AST,而红法夫酵母中主要存在右旋AST。此外,也发现了部分生物体(南极磷虾、红蟹、尼瓦利亚衣藻等)同时存在三种AST 立体异构体。值得注意的是,这些AST 异构体在抗氧化、抗衰老和免疫调节活性等方面表现出不同的健康效应[2]。众所周知,生物体内的各种生理活动都离不开蛋白质的参与,活性物生理活性的发挥也需要通过与蛋白质的相互作用来实现。一般来说,AST 进入血液后会与血清白蛋白发生结合,进而被转运到各个组织中并作用于靶蛋白来发挥功能活性[3]。若AST 异构体与血清白蛋白之间的结合机制存在差异,则可能会触发“结合-转运-功效”的链式影响。且当AST 异构体在蛋白中具有相同的结合位点时,还会表现出潜在的竞争关系,这也会影响到最终功效的发挥[4,5]。因此研究AST 异构体与血清白蛋白的相互作用机制具有重要意义。

图1 AST立体异构体的分子结构Fig.1 Molecular structure of AST optical isomers
牛血清白蛋白(Bovine Serum Albumin,BSA)是研究最为广泛的血清白蛋白之一,不仅因为其具有构象清晰、成本低、易获取等优点,而且还与人血清白蛋白(Human Serum Albumin,HSA)有较高的结构同源性(76%)[6]。BSA 的空间结构由三个同源结构域(Ⅰ、Ⅱ和Ⅲ)组成,每个结构域各包含两个亚结构域(A 和B),其中亚结构域ⅡA 和ⅢA 的疏水口袋是小分子配体的主要特异性结合位点[7]。作为一种模式结合和转运蛋白,BSA 可以与许多内源性和外源性物质发生相互作用,进而起到储存和运输作用。并且它自身的手性识别功能可以将活性物立体异构体的微小结构差异通过结合亲和力、互作氨基酸残基、相互作用力等指标呈现出来。如在人参皂苷Rh2 与BSA 的相互作用中,左旋和右旋人参皂苷Rh2 在结合位点以及互作氨基酸残基上表现出明显的立体选择性,并且左旋人参皂苷Rh 2 具有更高的结合常数[8]。另一项基于多光谱和分子对接的研究发现,相比于左旋地克珠利,右旋地克珠利与血清白蛋白具有更强的结合亲和力,并且它们的结合均会导致蛋白质构象发生轻微变化[9]。由此可见,研究手性分子与BSA 的相互作用有助于阐明其立体选择性结合机制。然而,目前对于AST立体异构体与BSA 的结合机制仍未有报道。
本研究系统地探究了AST 立体异构体与BSA的相互作用。通过多光谱、表面等离子共振、分子对接等方法获得AST-BSA 复合物的结合信息,包括荧光猝灭机制、结合常数、热力学参数、相互作用力、蛋白构象变化和结合位点等。这些相互作用信息有助于阐明AST 立体异构体与BSA 的结合机制,并且对揭示AST 异构体在血液循环中潜在的转运、分布和代谢情况具有重要的理论指导意义。
1 材料与方法
1.1 原料
左旋虾青素(纯度>94%)、右旋虾青素(纯度>96%)由实验室制备(图2),分别从雨生红球藻(Haematococcus pluvialis)和红法夫酵母(Phaffia rhodozyma)中提取;牛血清白蛋白(纯度98%)、吲哚美辛(纯度>99%)、布洛芬(纯度>98%)、0.1 mol/L 磷酸缓冲盐溶液(Phosphate Buffer Solution,PBS),上海源叶生物科技有限公司;氨基偶联试剂盒、10×PBS-P+溶液、CM5 芯片,美国GE Healthcare 公司;二甲基亚砜(Dimethyl Sulfoxide,DMSO),天津天茂化工试剂厂;无水乙酸钠,上海易恩化学技术有限公司;其它化学品为试剂级;上述PBS 和10×PBS-P+的pH 值均为7.4。

图2 左旋AST(a)、右旋AST(b)及其手性鉴定(c)的高效液相色谱图Fig.2 High performance liquid chromatogram of (3S,3’S)-AST (a),(3R,3’R)-AST (b) and their chiral identification (c)
1.2 仪器与设备
荧光分光光度计RF-6000,日本岛津公司;表面等离子共振仪Biacore T200,美国GE Healthcare公司;圆二色谱仪Chirascan,英国应用光物理公司;恒温磁力搅拌水浴锅,常州澳华仪器有限公司。
1.3 方法
1.3.1 内源荧光光谱
取BSA 溶解于0.01 mol/L PBS 中得到10 μmol/L BSA 溶液;用DMSO 配制200 μmol/L 的左旋和右旋AST 溶液并用0.45 μm 针孔滤膜过滤。取干净离心管,依次加入600 μL BSA 溶液、2 250 μL PBS、30 μL 乙醇和0~120 μL 虾青素溶液,充分涡旋混匀后,在303 K 和310 K 下孵育20 min,结束后立即采用荧光分光光度计测定荧光强度。BSA 终浓度为2 μmol/L,虾青素终浓度为0~8 μmol/L,溶液总体积为3 mL,所含有机溶剂的体积分数小于5%。仪器设置的激发波长为280 nm,发射波长为300~400 nm,狭缝宽度为5 nm,以200 nm/min 的扫描速率进行测定。
由于小分子配体的存在会影响蛋白质对激发光的吸收和发射光的传播,这种现象称为内滤效应。因此需要利用方程(1)来校正荧光强度[10]。然后通过方程(2~5)对校正后的荧光强度进行进一步计算得到相互作用信息。
式中:
Fcor——校正后的荧光强度;
Fobs——实际测得的荧光强度;
Aex——蛋白质配体复合物在激发波长处的吸光度;
Aem——蛋白质配体复合物在发射波长处的吸光度。
式中:
F0——蛋白质的原始荧光强度;
F——存在猝灭剂时蛋白质的荧光强度;
Kq——双分子猝灭速率常数,L/(mol·s);
τ0——BSA 的荧光寿命,3×10-9s[11];
Ksv——Stern-Volmer 淬灭常数,L/mol;
[Q]——淬灭剂的浓度,μmol/L;
KA——结合常数,L/mol;
n——结合位点数;
R——气体常数,8.314 J/(mol·K);
T——温度,K;
ΔH——焓变,kJ/mol;
ΔS——熵变,J/(mol·K);
ΔG——吉布斯自由能,kJ/mol。
1.3.2 同步荧光光谱
按照1.3.1 节方法配制样品,反应温度为303 K。仪器设置激发波长和发射波长的间隔Δλ分别为15 nm(发射波长280~330 nm)和60 nm(发射波长310~380 nm),其他参数不变。
1.3.3 位点竞争实验
按照1.3.1 节方法配制BSA、AST 溶液和设置荧光分光光度计参数。布洛芬和吲哚美辛溶于无水乙醇中得到500 μmol/L 的溶液,采用0.45 μm 针孔滤膜过滤溶液。取干净离心管,先加入600 μL BSA 溶液、2 250 μL PBS 和30 μL 布洛芬或吲哚美辛溶液,混匀后在303 K 下反应20 min。之后加入0~120 μL AST 溶液,混匀后再次在303 K 下反应20 min,孵育结束后立即检测。布洛芬和吲哚美辛终浓度为3 μmol/L。
1.3.4 表面等离子共振
通过氨基偶联法将BSA 固定在CM5 传感器芯片的通道Fc2 上,获得7 058.3 RU 的密度。然后活化并封闭通道Fc1,以其作为不偶联蛋白的参比通道。在DMSO 中配制左旋和右旋AST 母液,然后用1.5×PBS-P+溶液进行首次稀释,再用含体积分数5% DMSO 的1.5×PBS-P+溶液进行梯度稀释,最终浓度范围为0~2.67 μmol/L,样品溶液中DMSO体积分数为5%。按照仪器操作说明书将1.5×PBS-P+溶液和DMSO 混合配制校正溶液。以含体积分数5%DMSO 的1.5×PBS-P+溶液为运行缓冲液,在室温、30 μL/min 流速下进行检测。利用仪器自带软件对所得曲线进行拟合分析,得到结合速率常数ka、解离速率常数kd和解离平衡常数KD。
1.3.5 圆二色谱
按照1.3.1 节方法配制样品,其中AST 终浓度为2 μmol/L,反应温度为298 K。仪器扫描范围190~260 nm,扫描速度100 nm/min。相同溶剂组成的PBS 作为空白对照组。利用Pro-Data 和CDNN 软件对数据结果进行拟合曲线和解析二级结构含量。
1.3.6 分子对接模拟
采用AutoDock Vina 软件进行分子对接模拟。BSA的原始晶体结构文件在RCSB蛋白数据库(PDB ID:4F5S[12])中下载,左旋AST(PubChem CID:5281224)和右旋AST(PubChem CID:12358421)在PubChem 数据库中下载。在对接开始前,将BSA 的水分子和配体分子全部去除,并补充电荷和原子。为确定所有可能的结合位点,首先对AST进行盲对接。在AutoDock Tool 界面,将对接范围扩大至覆盖BSA 的所有氨基酸残基,对接得到10个最优的结合位点,它们可作为下一次对接的预测结合位点。然后进行第二次对接,将对接范围覆盖上一步盲对接所得到的10 个最优位点,通过缩小范围来获得更准确的结果。最后,从第二次对接的结果中选择最优结合模式的结果,通过Open Babel GUI、PyMOL 和Discovery Studio 软件进行处理,得到三维空间图和二维相互作用力图。
1.4 数据统计分析
以上实验均平行测定3 次。实验数据用IBM SPSS Statistics 25.0 和OriginPro 2022b 软件进行统计分析和绘图。采用方差分析(ANOVA)确定统计学差异,P<0.05 为显著性差异。
2 结果与讨论
2.1 荧光猝灭机制
由于BSA 内部的色氨酸(Tryptophan,Trp)、酪氨酸(Tyrosine,Tyr)和苯丙氨酸(Phenylalanine,Phe)荧光团对周围环境的极性很敏感,因此可通过内源荧光光谱(Intrinsic Fluorescence Emission Spectroscopy,IFES)得到关于分子间相互作用的可靠信息。如图3 所示,在加入AST 异构体后,334 nm 处的荧光发射峰明显下降,并且表现出浓度依赖的猝灭效果,这表明AST 与BSA 发生相互作用导致BSA 的荧光猝灭。
为了进一步阐明AST 异构体和BSA 之间的荧光猝灭机制,采用Stern-Volmer 方程(2)进行计算分析,结果如图4 和表1 所示。随着温度从303 K升高到310 K,左旋和右旋AST 的Stern-Volmer 淬灭常数Ksv分别从1.95×104和2.11×104L/mol 下降到1.14×104和1.29×104L/mol(P<0.05)。一般来说,荧光猝灭机制可分为静态猝灭和动态猝灭两种机制。若蛋白质受体与小分子配体之间结合形成复合物,其Ksv会表现出随温度升高而降低的趋势,称为静态猝灭机制。而动态猝灭是由于受体与配体之间发生运动碰撞引起的,表现为Ksv随温度升高而增加[13]。研究结果显示,左旋和右旋AST 的Ksv都随着温度升高而下降,表明AST 异构体与BSA发生结合,静态猝灭是主要的荧光猝灭机制。此外,异构体的双分子猝灭速率常数Kq均达到1012L/(mol·s),远高于生物分子的最大散射碰撞猝灭常数[2.00×1010L/(mol·s)],再一次支持静态猝灭机制的结果[14]。

表1 AST异构体与BSA相互作用的双分子猝灭速率常数和Stern-Volmer猝灭常数Table 1 Bimoecular quenching constant and Stern-Volmer quenching constant of interaction between AST isomers and BSA

图4 左旋AST(a)和右旋AST(b)与BSA相互作用的Stern-Volmer方程拟合图Fig.4 Stern-Volmer plot of BSA interacting with (3S,3’S)-AST(a) and (3R,3’R)-AST (b)
2.2 结合常数、结合位点数和结合动力学参数
为进一步探究AST 异构体和BSA 结合常数KA和结合位点数n,使用双对数方程(3)对上述所得荧光强度进行分析,结果如表2 和图5 所示。一般情况下,当小分子配体-蛋白受体复合物的结合常数KA在107~109L/mol 之间时代表较强的结合亲和力,而低于106L/mol 时则代表较弱的结合亲和力[15]。如表2 所示,AST-BSA 的KA均为103L/mol,可以推测BSA 对AST 异构体具有较弱的结合亲和力。其中左旋与右旋AST 在303 K 时的KA分别为8.14×103和8.53×103L/mol。虽然右旋AST 比左旋AST 具有更高的KA,但结果没有显著性差异(P>0.05),表明二者对BSA 具有相似的结合亲和力。此外,左旋和右旋AST 在303 K 时的n值分别为0.92 和0.93,它们均小于1,表明AST异构体在BSA 中均只有一个结合位点。

表2 AST异构体与BSA相互作用的结合常数和结合位点数Table 2 Number of binding sites and binding constants of interaction between AST isomers and BSA

图5 左旋AST(a)和右旋AST(b)与BSA相互作用的双对数方程拟合图Fig.5 Double logarithmic plots of BSA interacting with(3S,3’S)-AST (a) and (3R,3’R)-AST (b)
虽然内源荧光光谱具有研究结合常数的潜力,但该技术依赖于周围环境对生色氨基酸的影响程度来计算结合常数,排除了其他氨基酸对结合的贡献。因此,为进一步确定AST 异构体与BSA 的结合参数,我们选择表面等离子共振技术(Surface Plasma Resonance,SPR)来测定AST-BSA 的结合亲和力和结合动力学。如图6 所示,注入AST 溶液后,仪器的响应值随时间变化而逐渐增加,说明AST 与偶联在芯片上的BSA 发生结合。表3 显示AST 异构体与BSA 的解离平衡常数KD均达到10-7mol/L(KA=1/KD,相当于106L/mol 的KA),说明AST 与BSA 具有中等强度的结合亲和力。其中右旋AST(3.91×10-7mol/L)与左旋AST(4.17×10-7mol/L)表现出相近的KD(P>0.05),与前面IFES 的结果一致表明AST 立体异构体与BSA 的结合没有表现出明显的立体选择性[16]。此前已有学者[17]研究了血清白蛋白对人工合成全反式AST(左旋:内消旋:右旋=1:2:1)的结合亲和力(1.47×10-6mol/L),与我们的SPR 结果(10-7mol/L)较为接近,进一步证明了SPR 数据的准确性。此外,从整体的动力学曲线来看,AST 异构体的结合和解离曲线较为相似,都呈现慢结合与慢解离状态,但是左旋和右旋AST的结合速率常数[4.76×103和3.27×103L/(mol·s)]和解离速率常数(2.00×10-3和1.28×10-31/s)存在较大差异(P<0.05)。并且当AST 浓度为0.35、0.53、0.79、1.19 和1.78 μmol/L 时,左旋和右旋AST的最高结合响应值分别为13.84、20.60、25.93、40.58、57.22 RU 和13.20、17.14、19.22、24.81、33.19 RU。可以看到在相同AST 浓度下左旋AST的响应值均高于右旋AST,这种由于手性结构表现出的差异在其它研究中也有所发现[18],表明左旋和右旋AST 与BSA 的结合存在差异。

表3 AST异构体与BSA相互作用的结合速率常数、解离速率常数及解离平衡常数Table 3 Association rate constant,dissociation rate constant and equilibrium constants values of AST isomers interacting with BSA
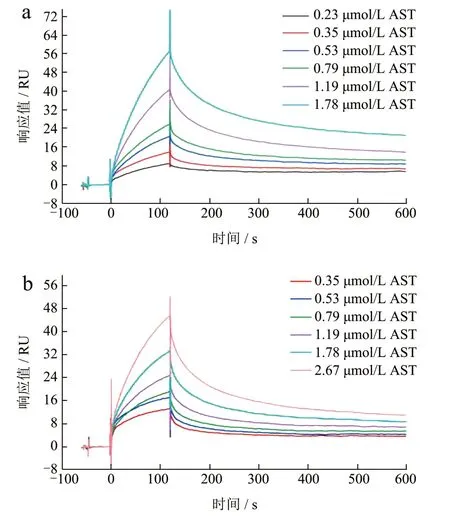
图6 左旋AST(a)和右旋AST(b)与固定化BSA相互作用的传感图Fig.6 Sensing diagram of immobilized BSA interacting with(3S,3’S)-AST (a) and (3R,3’R)-AST) (b)
对比以上两种方法所得到的结果,发现采用SPR(106L/mol)得到的结合亲和力约为IFES(103L/mol)的103倍。这是由于除生色氨基酸之外,SPR 还可以同时检测到BSA 其它氨基酸的相互作用信息[19]。由此可见,SPR 获得的结合亲和力更加真实,在Afkham 等[20]和Maleki 等[21]研究中也得到一致的看法。虽然IFES 受限于检测原理,但这个方法可作为SPR 的辅助验证手段,并且它还可以获得其它方面的相互作用信息,如蛋白质构象变化、相互作用力等,这些结果将在以下实验得到验证。
2.3 热力学参数和主要相互作用力
AST 具有多种官能团,如芳香环、酮基和羟基,因此AST 异构体可能会以不同的结合模式与BSA发生相互作用,并在热力学参数上表现出差异。此外,热力学参数是判断相互作用力的重要依据。为了确定AST 异构体与BSA 结合的相互作用力,我们使用了方程(4)和(5)分析了第2.2 节中IFES的结合亲和力。
左旋和右旋AST 与BSA 相互作用的焓变ΔH分别为-175.09 和-149.42 kJ/mol,熵变ΔS分别为-502.72 和-417.65 J/(mol·K)(表4)。AST 立体异构体均呈现负值的ΔH和ΔS,表明驱使它们与BSA 发生结合的主要相互作用力是氢键和范德华力[22],这与之前关于类胡萝卜素-BSA 相互作用的报道一致[23]。产生这种现象的原因主要是因为AST 异构体具有的相同官能团,而手性结构的差异并不会改变主要相互作用力类型,这在其它异构体的研究中也有相同的结果[24]。尽管如此,左旋AST 比右旋AST 具有更小的ΔH和ΔS表明二者存在结合差异。

表4 AST异构体与BSA相互作用的热力学参数Table 4 Thermodynamic parameters of AST isomers interacting with BSA
2.4 虾青素异构体结合位点的确定
现有研究表明,BSA 与小分子配体结合的主要位点位于亚结构域ⅡA(位点Ⅰ)和ⅢA(位点Ⅱ)的疏水腔内,而吲哚美辛和布洛芬分别是位点Ⅰ或Ⅱ的典型配体[23]。因此选择这两种典配体进行位点竞争实验(Site Marker Experiments,SME),并通过方程(3)来计算存在位点竞争物质时AST-BSA的结合常数,以此来确定AST 异构体在BSA 上的结合位点。
结果如表5 所示,左旋和右旋AST 与BSA的结合常数分别为8.14×103和8.53×103L/mol。当加入吲哚美辛后,左旋和右旋AST 的结合常数分别降低至0.55×103和0.14×103L/mol。在加入布洛芬后,左旋和右旋AST 的结合常数分别为0.54×103和0.57×103L/mol。可以看到吲哚美辛或布洛芬的存在会使AST 异构体的结合常数显著降低(P<0.05),这个现象表明两个竞争物质都会影响BSA 与AST 异构体的结合。与此同时,发现布洛芬和吲哚美辛在两种AST 异构体中的结合常数都没有表现出显著差异。由此可推断左旋和右旋AST 的结合位点均位于亚结构域ⅡA 和ⅢA 之间的交界处,在Li 等[25]课题组的研究中也发现相似的结果,原因可能是受到AST 长链结构的影响。

表5 竞争性实验中AST异构体与BSA相互作用的结合常数Table 5 Binding constants for the interaction of BSA with AST isomers in competitive experiments
2.5 虾青素异构体对牛血清白蛋白构象的影响
蛋白质(特别是血清白蛋白)是动态柔性物体,它能够根据自身所处环境的微小变化,自发地进行分子构象转变。因此,小分子与蛋白质的相互作用不仅会影响蛋白质在结合口袋处的结构,而且对其整体二级结构也可能造成较大影响[26]。为了探究AST 异构体对BSA 结构的影响,采用了圆二色谱(Circular Dichroism,CD)和同步荧光光谱(Synchronous Fluorescence Emission Spectra,SFES)进行测定。CD 可以在190~260 nm 波长下直接分析BSA 的二级结构含量,结果如图7 和表6 所示。天然BSA 的CD 光谱分别在209 nm 和221 nm附近出现α-螺旋的波谷,解析得到其二级结构组成为56.83%α-螺旋、8.63%β-折叠、13.70%β-转角和22.27%无规则卷曲,表明BSA 的二级结构主要是α-螺旋[27]。当加入左旋和右旋AST 后,BSA的CD 波谷仅轻微下降,α-螺旋分别变为56.80%和57.23%。然而二级结构含量并没有明显变化(P>0.05),表明AST 异构体与BSA 的结合不会明显改变蛋白二级结构。这一结果有助于BSA 维持其原有的生理功能。

表6 存在和不存在AST异构体时BSA的二级结构含量Table 6 Secondary structure content of BSA in the presence and absence of AST isomers

图7 存在和不存在AST异构体时BSA的CD光谱Fig.7 CD spectra of BSA in the absence and presence of AST isomers
对于SFES,光谱中最大发射波长位置的变化可以反映生色氨基酸周围环境极性的变化,以此来观察AST 异构体对BSA 微环境的影响。当激发和发射波长的间隔Δλ固定为15 或60 nm 时,可以分别获得Tyr 或Trp 残基的微环境信息[28]。对于天然BSA,Tyr 和Trp 的最大发射波长分别在300 和340 nm(图8)。随着左旋和右旋AST 的加入,Tyr和Trp 的最大发射波长均没有发生位移变化,说明AST-BSA 相互作用不会改变BSA 的微环境。由此可见,CD 和SFES 一致表明AST 与BSA 的相互作用不会明显改变蛋白构象。从第2.4 节中可以得到一个合理的解释,即AST 没有结合到BSA 内部的疏水口袋,因此对蛋白质构象的影响较小。

图8 左旋AST(a)和右旋AST(b)与BSA相互作用的同步荧光光谱Fig.8 Synchronous fluorescence emission spectroscopy of BSA interacting with (3S,3’S)-AST (a) and (3R,3’R)-AST (b)
2.6 虾青素异构体与牛血清白蛋白的模拟结合
分子对接(Molecular Docking,MD)可以预测小分子与蛋白质的相互作用信息并呈现出可视化的结果,有助于进一步了解AST 异构体与BSA 之间的结合机制。表7 显示左旋AST、右旋AST 与BSA 的结合自由能均为-8.9 kcal/mol,表明二者具有相等的结合亲和力。如图9 所示,最优的对接模式表明AST 异构体具有相似的结合模式,二者均结合在BSA 三个结构域的交界处,并且与BSA 结合的相互作用力类型为氢键、范德华力和疏水相互作用力。这与第2.2~2.4节的研究结果较为一致,在理论层面提供了进一步的支持。虽然左旋和右旋AST 在上述方面具有相似的结果,但在形成氢键的数目和键长方面表现结合差异。其中左旋AST与Lys504、Thr190残基形成键长为2.0 Å、2.7 Å 的氢键,而右旋AST 与Arg435 残基形成键长为2.9 Å 的氢键。此外,还发现AST 立体异构体都是通过酮基或羟基与氨基酸形成氢键,可见这两个官能团对AST 的结合起到重要作用。

表7 AST异构体与BSA的分子对接结合参数Table 7 Binding parameters of BSA with AST isomers obtained by molecular docking

图9 左旋AST(a)和右旋AST(b)与BSA相互作用的分子对接结果及对比分析(c、d)Fig.9 Molecular docking results of BSA interacting with (3S,3’S)-AST (a) as well as (3R,3’R)-AST (b) and comparative analysis (c,d)
左旋和右旋AST 与BSA 相似的结合自由能再一次反映出它们之间的结合没有明显的立体选择性,这种情况可以从AST 的分子结构和结合位点两方面来解释。AST 立体异构体的结构差异在于两端环上的羟基,由于AST 的长链结构限制了它们可选择的结合位点,导致无法像其他小分子异构体那样自由调整分子朝向来选择最合适的结合口袋[8,29]。此外,结合位点处芳香族氨基酸残基(Trp、Tyr 和Phe)的存在对手性分子的立体选择性具有较大影响[30],然而分子对接结果显示AST-BSA 的互作氨基酸残基中仅出现一个Tyr 残基,这不利于展现AST 立体异构体的立体选择性作用。
3 结论
本研究通过IFES、SFES、SME、CD、SPR 和MD 方法研究了AST 立体异构体与BSA 的相互作用。SME 表明AST 异构体的结合位点均位于BSA亚结构域ⅡA 和ⅢA 的交界处,相同的结合位点导致AST 异构体具有相似的相互作用力(氢键和范德华力)和结合亲和力,这在IFES 和SPR 中得到了证明。SPR 还表明AST-BSA 的结合动力学都表现为慢结合、慢解离状态,左旋AST 的最高结合响应值高于右旋AST。IFES 的结果还显示左旋AST 具有更低的ΔH和ΔS。MD 模拟结果与上述实验结果具有较高符合度,同时还发现AST 立体异构体在氢键数目和键长上表现结合差异。此外,CD 和SFES一致证明AST 与BSA 的相互作用不会对蛋白构象造成较大影响。总之,左旋和右旋AST 对BSA 的结合没有明显的立体选择性,但在最高结合响应值、热力学参数和氢键数表现出结合差异。这些相互作用参数有助于阐明AST 立体异构体与BSA 的结合机制,并为AST 异构体在血液循环中潜在的药代动力学提供重要的理论指导信息。

