芦台春酱香型白酒酿造过程中真菌菌群多样性及代谢分析
王佳丽,胥 强,路程顺,赵淑先,张同存,罗学刚*
(1.天津科技大学 生物工程学院,天津 300457;2.天津科技大学 工业发酵微生物教育部重点实验室暨天津市工业微生物重点实验室,天津 300457;3.山西师范大学 食品科学学院,山西 太原 030031;4.天津芦台春酿造有限公司,天津 301500)
中国白酒是世界六大蒸馏酒之一,其是在相对开放的生产环境下,以高粱等谷物为原料,采用大曲等糖化发酵剂,由多种复杂微生物与谷物相互作用固态发酵而成的[1-3]。由于酿造工艺和环境的不同,目前,根据风味类型,中国白酒主要可分为12种香型[4]。其中,酱香型白酒有着悠久的生产历史,是中国传统白酒的三种基本香型之一(酱香型、浓香型、清香型)[5]。窖池发酵是酱香型白酒酿造过程中的重要步骤,乙醇和白酒的风味物质在这个阶段产生[6]。由于发酵环境的变化(即氧气的减少,乙醇的增加),微生物群落的多样性也发生变化,曲霉属(Aspergillus)、芽孢杆菌属(Bacillus)、丝衣霉属(Byssochlamys)、乳杆菌属(Lactobacillus)、毕赤酵母菌属(Pichia)、酿酒酵母菌属(Saccharomyces)、裂殖酵母菌属(Schizosaccharomyces)等一些耐受厌氧和乙醇的微生物群落通常会在这个阶段占主导地位[7]。然而,目前人们对窖池发酵的研究还较少。
白酒的品质不仅与生产工艺有关,还与地理环境、水质、气候、粮食选择等因素密切相关[8]。不同的生产地区、生产工艺会导致发酵过程中微生物区系的演化存在差异,从而导致白酒成分和质量出现差异[9-10]。随着现代分子生物学的发展,越来越多的技术被广泛应用于微生物区系的研究[6,11],这些技术的应用为进一步研究白酒发酵提供了技术支撑。传统上,酱香型白酒主要产于中国西南地区(贵州省和四川省)[12],然而,近几十年来,中国其他一些地区(如山东、湖南、广西、黑龙江、北京、河南等)也能够生产出优质的酱香型白酒[13-14]。生产地区的增加,也带来了酱香型白酒口味的多样性[15]。1972年,中国著名白酒专家周恒刚利用从茅台酒窖泥中分离出来的己酸菌,在天津研制出了中国第一代优质麸曲酱香酒,命名为“芦台春”,是中国北方酱香型白酒的经典代表之一[16],但迄今为止,其发酵过程中的微生物区系特征及与白酒香气、风味、品质之间的关系和机理尚不清楚。
前期已对芦台春酱香型白酒发酵过程中的细菌菌群多样性进行分析[17],在此基础上,本研究进一步对其不同轮次出窖酒醅中的真菌菌群多样性进行分析,同时对酿酒过程中的理化指标及挥发性风味成分进行检测,并探究微生物与其代谢物间的相关性,从而解析北方酱香型白酒发酵过程中的分子机理,以期为今后北方酱香型白酒的生产研究奠定重要基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
同一批次第1轮次(LTJP1C)(前期轮次)、第4轮次(LTJP4C)(中期轮次)、第7轮次(LTJP7C)(后期轮次)出窖酒醅样品:天津芦台春酿造有限公司,每轮次样品各3份,共9个样品,保存在-80 ℃的超低温冰箱中。
1.1.2 试剂
葡萄糖(分析纯):天津市北方天医化学试剂厂;氢氧化钠(分析纯):天津市凯通化学试剂有限公司;盐酸(分析纯)、2-辛醇(色谱纯):天津市江天化工技术有限公司;次甲基蓝(分析纯):天津市大茂化学试剂厂;酒石酸钾钠(分析纯):天津市天力化学试剂有限公司;亚铁氰化钾(分析纯):天津市恒兴化学试剂制造有限公司;OMEGA-soil脱氧核糖核酸(deoxyribonucleic acid,DNA)Kit:美国Omega Bio-Tek公司;AxyPrep DNA Gel Extraction Kit:美国Axygen Biosciences公司;其他试剂均为国产分析纯。
1.2 仪器与设备
FE20实验室pH计:梅特勒-托利多仪器(上海)有限公司;85-2型恒温磁力搅拌器:天津市华仪鑫达仪表有限公司;BS210S电子分析天平:北京赛多利斯天平有限公司;0-30酒精计:河北省武强县阜阳仪表厂;5975C+7890A气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪:美国安捷伦公司;固相微萃取(solid-phase micro-extrac tion,SPME)进样器、萃取头(50/30 μm DVB/CAR/DVB):美国Supelco公司。
1.3 方法
1.3.1 酒醅样品微生物菌群基因组抽提及聚合酶链式反应扩增
采用OMEGA-soil DNA Kit提取酒醅样品中的微生物菌群基因组,以其为模板,采用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')对真菌菌群的ITS1可变区基因序列进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增程序为:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),最后72 ℃延伸10 min。PCR扩增体系(20 μL):5×FastPfu缓冲液4 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)2 μL,引物ITS1F(5 μmol/L)0.8 μL,引物ITS2R(5 μmol/L)0.8 μL,FastPfu聚合酶0.4 μL;模板DNA 10 ng。使用2%琼脂糖凝胶回收PCR产物,利用AxyPrepDNA Gel Extraction Kit进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST进行检测定量[14,17-18]。
1.3.2 Illumina Miseq高通量测序及生信分析
根据Illumina MiSeq平台标准操作规程将纯化后的PCR扩增片段构建文库,委托上海美吉生物医药科技有限公司利用Miseq PE300平台进行高通量测序。使用Trimmomatic软件对原始测序序列进行质控,并使用FLASH软件进行拼接。使用UPARSE软件(version 7.1 http://drive5.com/uparse/)根据97%的相似度对序列进行操作分类单元(operational taxonomic units,OTU)聚类,并在聚类的过程中去除单序列和嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Unite数据库(Release 8.0),设置比对阈值为70%[14,17-18]。
1.3.3 酒醅理化指标的测定
参照DB34T 2264—2014《固态发酵酒醅分析方法》,采用酒精计法测定酒精度,采用中和滴定法测定总酸含量,采用葡萄糖标准溶液反滴定法测定还原糖含量。
1.3.4 酒醅挥发性香气成分的测定
采用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)-气相色谱-质谱法[19]测定酒醅中的挥发性香气成分。
1.3.5 数据处理与统计分析
使用SIMCA-P11.5软件进行主成分分析(principal componentsanalysis,PCA)和偏最小二乘法-判别分析(partial least squares-discriminant analysis,PLS-DA),使用Canoco 5软件进行典范对应分析(canonical correspondence analysis,CCA)。
2 结果与分析
2.1 芦台春酱香型白酒发酵过程中不同轮次出窖酒醅真菌菌群α-多样性分析
不同轮次出窖酒醅样品真菌菌群的α-多样性分析结果见表1。由表1可知,芦台春酱香型白酒不同轮次出窖酒醅样品的Shannon指数由第一轮次的0.92逐步上升至第七轮次的2.53,Simpson指数变化则相反,说明酱香型白酒发酵过程中真菌菌群的多样性随着轮次的增加而有所增加。同时,出窖酒醅样品的Chao1指数由第一轮次的56.25增加至第四轮次的96.23,随后降至第七轮次的86.96,ACE指数变化趋势相同,表明真菌菌群的丰度随着轮次的增加呈先升高后降低的趋势。
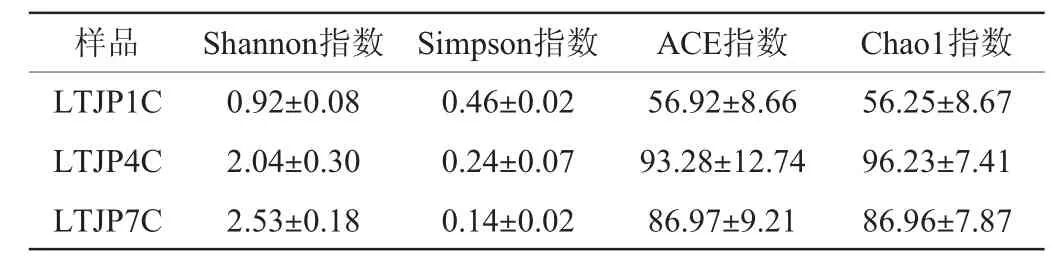
表1 芦台春酱香型白酒发酵过程中不同轮次出窖酒醅样品中真菌菌群的α-多样性分析结果Table 1 Analysis of fungal alpha diversity in fermented grains in different rounds during Lutaichun sauce-flavor Baijiu fermentation
2.2 芦台春酱香型白酒发酵过程中不同轮次出窖酒醅真菌菌群结构分析
2.2.1 基于门水平真菌菌群结构分析
基于门水平对酱香型白酒发酵过程中不同轮次出窖酒醅样品的真菌菌群结构进行分析,结果见图1。
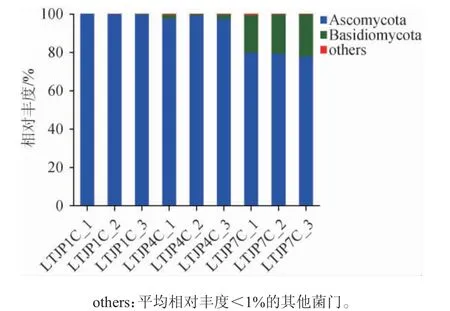
图1 基于门水平芦台春酱香型白酒发酵过程中不同轮次出窖酒醅样品的真菌菌群结构Fig. 1 Structure of fungal communities in fermented grains in different rounds during Lutaichun sauce-flavor Baijiu fermentation at phylum level
由图1可知,从三个轮次出窖酒醅样品中共检测出2个主要的真菌门,分别为子囊菌门(Ascomycota)(92.27%)和担子菌门(Basidiomycota)(7.57%),其中子囊菌门(主要是酵母菌和霉菌)是白酒发酵的主要真菌,从第一轮次到第七轮次,随着轮次的增加,子囊菌门逐步降低,相对丰度由前期的99.87%降至后期的78.98%,但子囊菌门在三个轮次中依然维持较高水平,而担子菌门则与子囊菌门的变化趋势相反,相对丰度由0.13%升至20.73%,但一直保持较低水平。
2.2.2 基于属水平真菌菌群结构分析
基于属水平对酱香型白酒发酵过程中不同轮次出窖酒醅样品的真菌菌群结构进行分析,结果见图2。
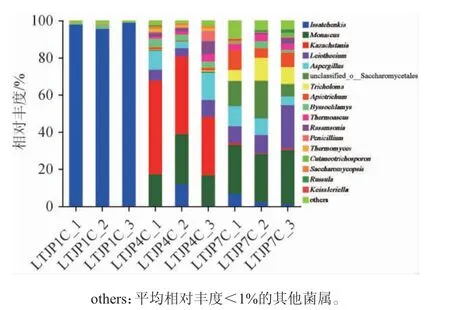
图2 基于属水平芦台春酱香型白酒发酵过程中不同轮次出窖酒醅样品的真菌菌群结构Fig. 2 Structure of fungal communities in fermented grains in different rounds during Lutaichun sauce-flavor Baijiu fermentation at genus level
由图2可知,从三个轮次出窖酒醅样品中共检测到17个主要的真菌属,分别为伊萨酵母属(Issatchenkia)(35.08%)、红曲霉属(Monascus)(15.74%)、哈萨克斯坦酵母属(Kazachstania)(14.01%)、Leiothecium(6.81%)、曲霉属(Aspergillus)(5.90%)、未分类的酵母目(unclassified_o__Saccharomycetales)(4.66%)、Apiotrichum(2.97%)、丝衣霉属(Byssochlamys)(2.05%)等,其中,伊萨酵母属、红曲霉属和哈萨克斯坦酵母属占据优势地位。由于在窖池发酵过程中,环境处于厌氧状态并进行酒精发酵,使得上述菌属成为绝对的优势真菌。伊萨酵母属、哈萨克斯坦酵母属、未分类的酵母目、Apiotrichum、Cutaneotrichosporon、复膜孢酵母属(Saccharomycopsis)等均属于酵母菌,酵母菌为白酒酿造过程中的绝对优势真菌菌群,平均总相对丰度为57.57%。ZHANG H X等[20]对白酒多批次发酵过程中真菌群落的多样性进行研究,发现酱香型白酒发酵中涉及的主要真菌种类为毕赤酵母属(Pichia)(41.75%)、酵母菌属(13.07%)、嗜热菌(9.16%)、红曲霉属(6.80%)、曲霉属(4.69%)、裂殖酵母属(3.76%)、嗜热真菌属(3.74%)和接合酵母菌属(1.41%),另外,随着发酵批次的增加,真菌菌群多样性也随之增加。本研究也有类似结果,但具体菌属的种类及丰度有所差异。
从第一轮次到第七轮次,酵母菌的相对丰度随着轮次的增加而降低,由第一轮次的97.56%逐渐下降至第七轮次的26.90%,霉菌则逐渐升高。其中,伊萨酵母属的相对丰度由第一轮次的97.48%逐渐下降至第七轮次的3.53%;哈萨克斯坦酵母属和复膜孢酵母属的相对丰度则在第四轮次达到最高,分别为41.26%和1.10%,其他轮次处于极低水平;而未分类的酵母目、Apiotrichum和Cutaneotrichosporon均在第一轮次相对丰度极低,随后逐渐升高,第七轮次相对丰度最高,分别为13.51%、7.87%和1.14%。在不同发酵时期酒醅中的真菌群落是动态变化的,微生物结构会因不同轮次发酵的差异而改变。王琳[21]运用高通量测序技术对茅台镇1~7轮次窖池发酵酒醅中的微生物进行研究,发现七个轮次共有的优势真菌属为酵母菌属、嗜热子囊菌属,第一和第二轮次的绝对优势真菌属为酵母菌属,第三和第四轮次的第一优势真菌属为裂殖酵母属,接合酵母菌属为第五到七轮次的第一优势真菌属。由此可以看出,天津地区芦台春酱香型白酒窖池发酵酒醅中真菌与茅台镇生产酱香白酒中的真菌菌群具有一定差异,其优势真菌属在不同轮次均不同。
芦台春酱香型白酒与茅台酱香型白酒均以优质糯高粱为原料,采用相同的纯粮固态酿造工艺酿造而成。然而,白酒生产也会受到气候、地形和土壤等方面的影响[18]。茅台、郎酒酱香型白酒的酿酒用水取自赤水河,西南地区属于亚热带湿润季风气候区,夏热冬暖,每年大部分时间气温在3~25 ℃,平均气温15 ℃左右,每年多云天数一般在150 d以上,年相对湿度在70%以上。而芦台春酱香型白酒产自天津宁河区芦台镇,其酿酒用水取自芦台当地地下800 m。芦台镇属于温带湿润季风气候区,全年大部分时间气温在-5~27 ℃,平均气温在12 ℃左右,年日照时数可达近3 000 h,年相对湿度在60%以上,且较茅台镇四季更为分明[17]。显然,这种环境差异会改变环境微生物群落的组成[18]。而白酒的风味和品质依赖于微生物群落之间的协同作用,这些微生物群落的差异就会赋予白酒不同的风味[9]。因此,探索酱香型白酒窖池发酵酒醅中的菌群可以为了解白酒发酵的完整微生态提供有价值的信息,为调节酱香型白酒的发酵过程提供理论指导。
2.3 基于真菌属水平芦台春酱香型白酒发酵过程中不同轮次出窖酒醅的主成分分析
基于真菌属的相对丰度对芦台春酱香型白酒发酵过程中不同轮次出窖酒醅样品进行主成分分析,结果见图3。由图3可知,第一主成分(PC1)的方差贡献率为42.0%;第二主成分(PC2)的方差贡献率为33.8%,两个主成分共解释了75.8%的变量,可以反映真菌属在出窖酒醅样品间的分布情况。由图3A可知,相同轮次的出窖酒醅样品相距较近聚在一起。结合图3B可知,第一轮次出窖酒醅样品与伊萨酵母属(Issatchenkia)相关性较大;第四轮次出窖酒醅样品与哈萨克斯坦酵母属(Kazachstania)、曲霉属(Aspergillus)、丝衣霉属(Byssochlamys)、罗萨氏菌属(Rasamsonia)、青霉属(Penicillium)、嗜热真菌属(Thermomyces)、复膜孢酵母属(Saccharomycopsis)等相关性较大;而第七轮次出窖酒醅样品与红曲霉属(Monascus)、Leiothecium、未分类的酵母目(unclassified_o__Saccharomycetales)、Apiotrichum、嗜热子囊菌属(Thermoascus)、Cutaneotrichosporon、凯氏腔菌属(Keissleriella)等相关性较大。
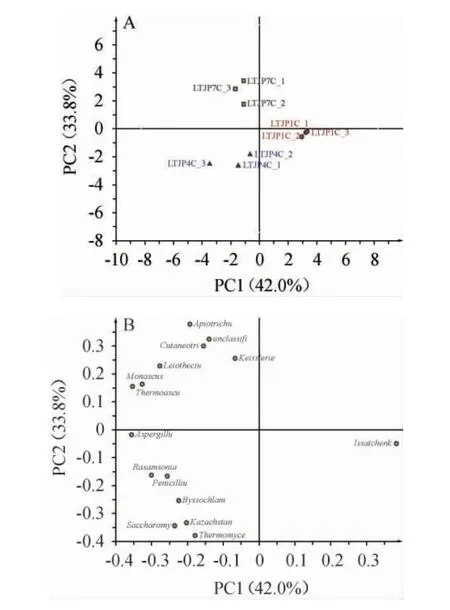
图3 基于真菌属相对丰度芦台春酱香型白酒发酵过程中不同轮次出窖酒醅样品的主成分分析得分图(A)及载荷图(B)Fig. 3 Principal component analysis score diagram (A) and load chart(B) of pit-unloading fermented grains samples from different rounds of Lutaichun sauce-flavor Baijiu during fermentation process based on the relative abundance of fungi
2.4 酱香型白酒发酵过程中不同轮次出窖酒醅的理化指标
总酸、还原糖和酒精度为重要的理化因子[22],不同轮次出窖酒醅样品的理化指标见图4。由图4可知,随着轮次的增加,出窖酒醅样品的酒精度呈先上升后下降的趋势,从第一轮次的2.9%vol上升到第四轮次的5.0%vol,之后下降至第七轮次的1.9%vol;出窖酒醅样品中的总酸含量呈上升的趋势,从第一轮次的1.08 g/100 g逐渐上升至第七轮次的4.80 g/100 g;而出窖酒醅样品中的还原糖含量呈先升高后下降的趋势,从第一轮次的0.60 g/100 g上升到第四轮次的1.50 g/100 g,之后下降至第七轮次的0.90 g/100 g,整体处于较低水平。
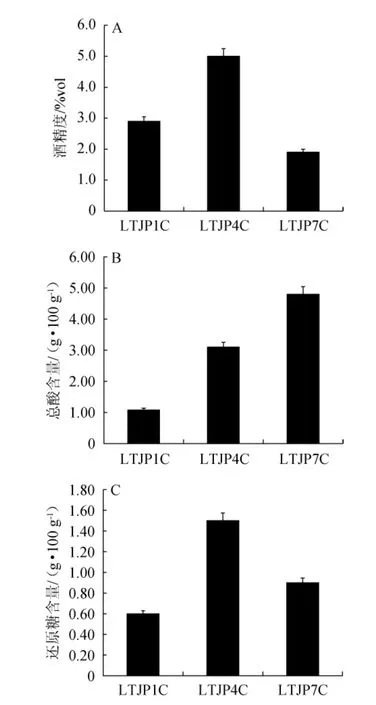
图4 酱香型白酒发酵过程中不同轮次出窖酒醅样品酒精度(A)、总酸(B)和还原糖(C)含量的变化Fig. 4 Changes of alcohol (A), total acid (B) and reducing sugar (C)content of pit-unloading fermented grains samples from different rounds of Lutaichun sauce-flavor Baijiu during fermentation process
2.5 酱香型白酒发酵过程中不同轮次出窖酒醅的挥发性风味成分
通过HS-SPME-GC-MS测定酱香型白酒发酵过程中不同轮次出窖酒醅样品的挥发性风味成分,结果见表2。由表2可知,从不同轮次出窖酒醅样品中共检出67种挥发性风味成分,包括29种酯类、12种醇类、3种酸类、1种酮类、3种醛类、6种吡嗪和13种其他类组分。随着轮次的增加,挥发性风味成分的总量和种类基本呈先上升后下降的趋势,在第四轮次时挥发性风味成分的总量和种类最多,为优质基酒的产出提供了物质前提。酯类和醇类物质呈先上升后下降的趋势,醛类物质呈上升趋势,而酸类、酮类和吡嗪类物质则在中后期轮次相对较高。酯类物质由第一轮次的7.09 μg/g上升至第四轮次的13.65 μg/g,之后下降至第七轮次的12.57 μg/g;醇类物质由第一轮次的10.76 μg/g上升至第四轮次的17.87 μg/g,之后下降至第七轮次的15.67 μg/g;酸类物质由第一轮次的0.56 μg/g上升至第四轮次的2.81 μg/g,之后在第七轮次维持在2.76 μg/g;酮醛类和吡嗪类物质则基本处于较低的水平。其中,第四轮次酒醅样品中正己酸乙酯、庚酸乙酯、3-羟基丁酸乙酯、丁二酸二乙酯、苯乙酸乙酯、十五酸乙酯、油酸乙酯、乙醇等含量最高,而第七轮次酒醅样品中壬酸乙酯、乙酸苯乙酯、正己醇、2,3-丁二醇、糠醇、糠醛等含量最高。
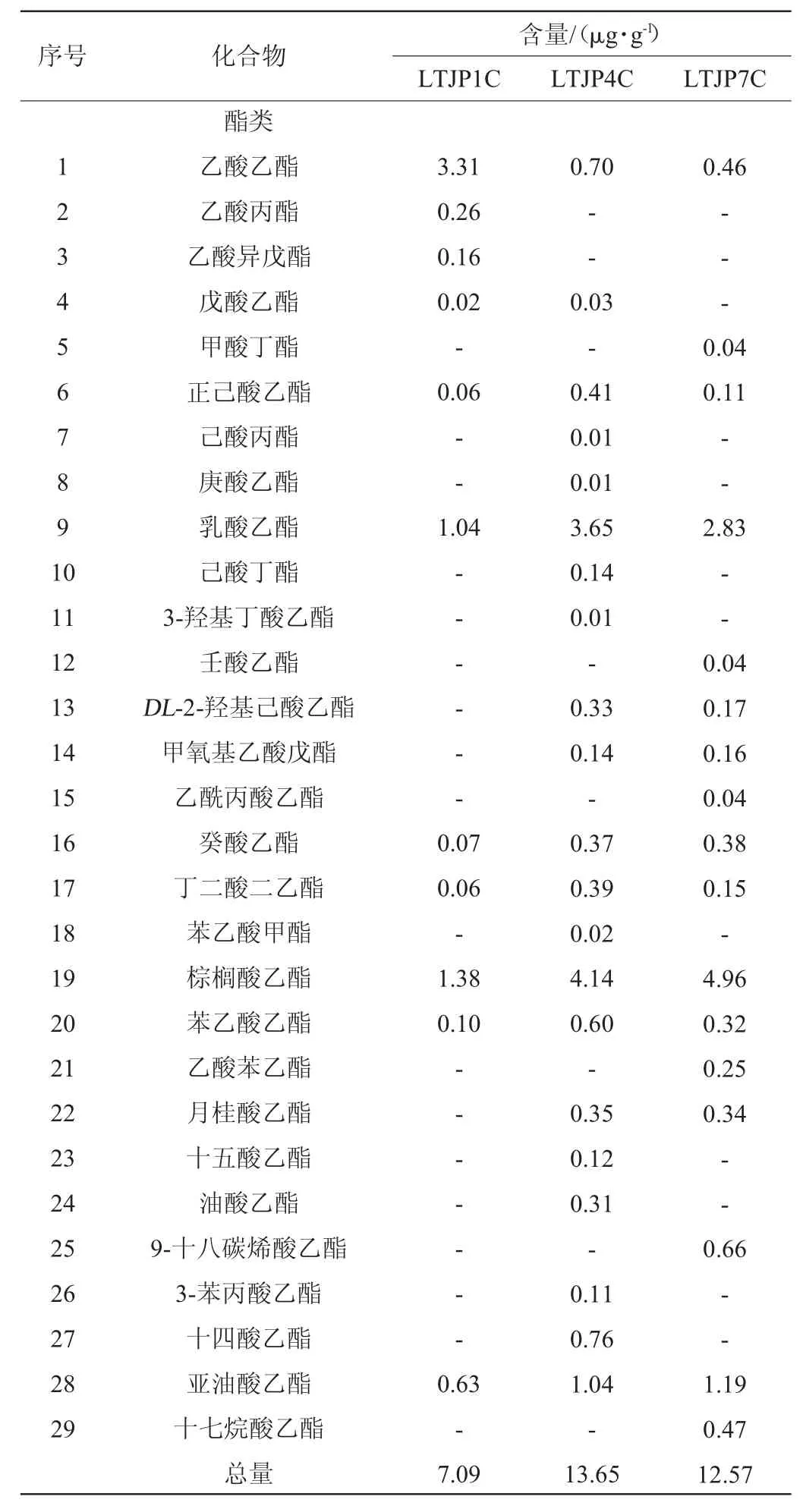
表2 芦台春酱香型白酒发酵过程中不同轮次出窖酒醅样品挥发性风味成分GC-MS分析结果Table 2 Results of GC-MS analysis of volatile flavor compounds of pit-unloading fermented grains samples during Lutaichun sauce-flavor Baijiu during fermentation process
2.6 芦台春酱香型白酒发酵过程中不同轮次酒醅真菌菌群与代谢物间相关性分析结果
2.6.1 理化因子与真菌微生物的CCA
在酱香型白酒固态发酵过程中,微生物组成和环境因素对群落演替有很大影响[22-23]。因此,对芦台春酱香型白酒发酵过程不同轮次酒醅理化因子与真菌属进行CCA,结果见图5。由图5可知,酒精度与总酸含量呈负相关,而与还原糖含量呈正相关。酒精度、还原糖含量与第四轮次酒醅样品呈正相关,而总酸含量与第七轮次酒醅样品呈正相关,说明第四轮次是酱香型白酒发酵最重要的时期,这个阶段发酵产生大量酒精,而到发酵第七轮次,酱香型白酒发酵中产酒能力降低,产酸成为主要的发酵过程。哈萨克斯坦酵母属(Kazachstania)、丝衣霉属(Byssochlamys)、罗萨氏菌属(Rasamsonia)、青霉属(Penicillium)、嗜热真菌属(Thermomyces)、复膜孢酵母属(Saccharomycopsis)等与酒醅中酒精度呈正相关,说明在白酒发酵的主要轮次,上述菌属(主要是酵母菌)在白酒发酵中起到重要作用。而红曲霉属(Monascus)、Leiothecium、未分类的酵母目(unclassified_o__Saccharomycetales)、Apiotrichum、Cutaneotrichosporon、凯氏腔菌属(Keissleriella)等则与总酸含量呈正相关,表明随着轮次的增加,后期发酵由产酒为主转为产酸,产酒的菌属逐渐被替代,其他霉菌属丰度有所升高。综上,总酸、还原糖和酒精度是窖池发酵微生物演替的重要理化因子。
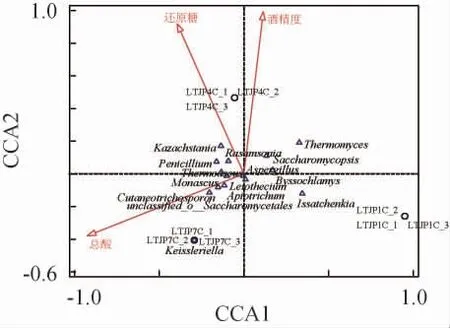
图5 理化因子与真菌属的典范对应分析结果Fig. 5 Canonical correspondence analysis results of physicochemical factors and fungal communities
2.6.2 挥发性风味成分与真菌微生物的PLS-DA
在窖池发酵过程中,窖池中某些有害微生物的生长会受到抑制,原料继续被分解,为己酸菌、甲烷菌和产酯酵母提供碳源,促进风味前体的增加,为酱香风味的形成创造了有利环境[24]。为探究真菌对窖池发酵过程中酒醅风味物质的影响,根据文献[25-26]报道的酒醅中重要挥发性风味成分以及含量较高的成分,从67种挥发性香气物质中挑选出31种重要的挥发性风味成分,对不同轮次酒醅样品中31种主要挥发性风味成分与真菌微生物间的相关性进行PLS-DA,结果见图6。由图6可知,伊萨酵母属(Issatchenkia)与白酒发酵过程中具有水果香味的乙酸乙酯、有愉快的香蕉香味的乙酸异戊酯、有苹果白兰地香气和辛辣味的异戊醇等相关性较大;哈萨克斯坦酵母属(Kazachstania)、丝衣霉属(Byssochlamys)、罗萨氏菌属(Rasamsonia)、青霉属(Penicillium)、嗜热真菌属(Thermomyces)、复膜孢酵母属(Saccharomycopsis)等与白酒发酵过程中有水果香气味的正己酸乙酯、有菠萝香气味的庚酸乙酯、呈果香、葡萄香、青香和白酒似香气的3-羟基丁酸乙酯、有愉快气味的丁二酸二乙酯、有浓烈而甜的蜂蜜香气的苯乙酸乙酯、十五酸乙酯、呈鲜花香气的油酸乙酯、有酒的气味和刺激性辛辣味的乙醇等相关性较大;而Leiothecium、未分类的酵母目(unclassified_o__Saccharomycetales)、Apiotrichum、Cutaneotrichosporon等菌属则对白酒发酵过程中的具有油脂、水果和白兰地酒似香气的壬酸乙酯、近似于玫瑰的、带有蜜样的底香的花香香气、甜的草莓似的水果样味道的乙酸苯乙酯、有淡青的嫩枝叶气息、微带酒香、果香和脂肪气息的正己醇、2,3-丁二醇、有苦味的糠醇、有类似苯甲醛的特殊气味的糠醛等形成起到重要作用。
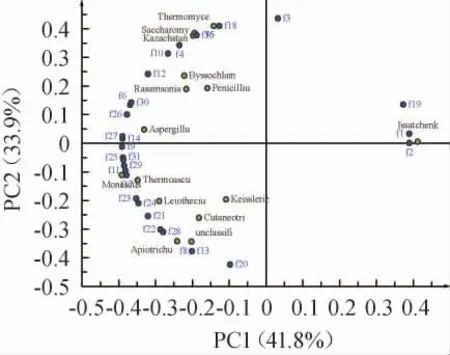
图6 挥发性风味成分与真菌群落的偏最小二乘-判别分析结果Fig. 6 Partial least squares-discriminant analysis results of volatile flavor compounds and fungal community
目前,已有研究人员对白酒发酵菌群与代谢物的相关性进行了研究,邹恬杏等[25]研究了洞酿酱香酒第四轮次酒醅发酵过程中的微生物群落与挥发性代谢物之间的相关性,发现嗜热子囊菌属、复膜孢酵母属与多种酯类物质呈正相关;吴成等[26]对酱香型白酒四轮次堆积发酵风味物质与微生物群落进行相关性分析,发现酵母菌主要与醇类物质如丙醇、异丁醇、异戊醇、β-苯乙醇等呈显著正相关,而丝状真菌主要与酸类和酯类物质如乙酸、丙酸、异丁酸、乳酸乙酯、油酸乙酯、己酸丁酯等呈显著正相关。本研究也同样得出了类似的结果,微生物产生的代谢物与白酒的质量和风味密切相关,这些微生物发挥它们各自的和/或协同作用,释放不同的酶来催化一系列复杂的生化反应,并将原料转化为醇、醛、酸、酯和其他芳香化合物,这些化合物从根本上影响了白酒的风味和质量[6]。
3 结论
通过高通量测序分析发现,天津地区芦台春酱香型白酒发酵过程中真菌菌群的多样性随着轮次的增加而有所增加,丰度则呈先升高后降低的趋势,酵母菌(主要为伊萨酵母属)是发酵过程中的主要真菌,且其相对丰度随着轮次的增加逐步降低。芦台春酱香型白酒发酵过程中,随着轮次的增加,酒精度及还原糖含量呈先上升后下降的趋势,而总酸含量呈上升趋势;发酵过程中理化因子与真菌菌群的CCA结果表明,总酸、还原糖和酒精度是窖池发酵微生物演替的重要理化因子。随着轮次的增加,挥发性风味成分的总量和种类基本呈先上升后下降的趋势,其与真菌菌群的PLS-DA结果表明,伊萨酵母属(Issatchenkia)与乙酸乙酯、乙酸异戊酯、异戊醇等相关性较大;哈萨克斯坦酵母属(Kazachstania)、丝衣霉属(Byssochlamys)、罗萨氏菌属(Rasamsonia)、复膜孢酵母属(Saccharomycopsis)等与正己酸乙酯、庚酸乙酯、3-羟基丁酸乙酯、丁二酸二乙酯、苯乙酸乙酯、油酸乙酯、乙醇等相关性较大;而Leiothecium、未分类的酵母目(unclassified_o__Saccharomycetales)、Apiotrichum、Cutaneotrichosporon等则对壬酸乙酯、乙酸苯乙酯、正己醇、2,3-丁二醇、糠醇、糠醛等的形成起到重要作用。本研究首次揭示了天津地区酱香型白酒不同轮次出窖酒醅的真菌微生物演替及其代谢,有助于阐释白酒发酵过程中的深层分子机制,为传统白酒的工艺控制和改进提供一定的理论指导。

