连翘多胺氧化酶基因家族的鉴定及干旱和盐胁迫下的表达分析
陈佳茜,郭广洋,谭新杰,吕淑芳,胥华伟,原 梦,邓 萍,侯典云*
•药材与资源•
连翘多胺氧化酶基因家族的鉴定及干旱和盐胁迫下的表达分析
陈佳茜1, 2,郭广洋1, 2,谭新杰1, 2,吕淑芳1, 2,胥华伟1, 2,原 梦1, 2,邓 萍1, 2,侯典云1, 2*
1. 河南科技大学农学院,河南 洛阳 471023 2. 河南省药食兼用资源评价与创新利用工程研究中心,河南 洛阳 471023
研究连翘多胺氧化酶(polyamine oxidase,)基因家族在盐和干旱胁迫下的响应特征。通过分析连翘转录组数据鉴定出5个连翘基因家族成员,结合蛋白质理化性质和基序分析、蛋白质结构分析、系统进化分析、结构域等方式进行相关性分析,并探究了盐和干旱胁迫下基因的表达水平。连翘基因家族氨基酸数介于235~541 aa,相对分子质量在26 069~59 328,等电点在5.27~5.86;不稳定系数为35.68~44.14,总平均亲水性皆为负值,推测连翘PAO家族蛋白均为不稳定型、酸性、亲水性蛋白,α-螺旋与无规则卷曲为蛋白主要二级结构形式。鉴定出的5个连翘基因家族成员均具有特异性表达模式;在盐和干旱胁迫下5个连翘基因家族成员的表达均受到诱导,可能参与连翘的盐胁迫及干旱胁迫响应调控,为深入探讨连翘基因家族的功能奠定了基础。
连翘;基因家族;基因表达;胁迫;蛋白质结构分析
多胺(polyamines,PAs)是小分子质量的脂肪胺,存在于植物细胞中参与各种生物过程[1]。PAs主要包括腐胺(Put)、亚精胺(Spd)和精胺(Spm)3种。PAs与逆境胁迫及衰老有关的植物激素脱落酸(ABA)和乙烯(ETH)关系密切,在调控生长、发育、衰老等方面发挥重要作用外,还参与对各种生物和非生物胁迫耐受功能的响应[2],在提高植物抗逆性、维持植物生长发育等方面具有重要作用[3]。研究表明,多胺含量的变化可能是植物提高胁迫条件下耐受性的方式之一[4]。在植物生长发育过程中,多胺除合成代谢外,还会通过氧化方式维持植物体内的多胺平衡。其中,经多胺氧化酶(polyamine oxidase,PAO)途径分解多胺是最常见方式之一[5]。大部分的PAOs以多胺为底物,催化生成更小分子多胺,以及1分子氨基醛和H2O2[6],进而维持植物细胞体内的多胺的稳定,提高植物抗生物胁迫及非生物胁迫的能力[7]。
当受到非生物因素胁迫时,植物表型及生理生化会发生变化,也会通过改变自身基因序列的表达来调节对环境的适应性。PAOs先后在水稻[8]、拟南芥[9]和其他植物中发现具有多胺分解代谢、植物发育和非生物胁迫耐受性的作用[10]。目前已从烟草[11]、玉米[12]、甜橙[13]、番茄[14]和大麦[15]等植物中鉴定分离出了一系列编码PAO的基因,并研究了在一定非胁迫条件下的基因家族成员的响应。
连翘(Thunb.) Vahl为木犀科连翘属落叶灌木,多产于我国河南、河北、山东、陕西、山西等地区[16],多以干燥果实入药,具有清热解毒、消肿散结、疏散风热等功效[17]。据报道,连翘生产极易受干旱、盐碱地等影响[18-19],导致产量不佳。目前,关于连翘非生物胁迫研究主要集中在不同品种之间的比较[19-20],抗胁迫相关基因的研究较少,对连翘基因家族信息的全面分析鲜有报道。
本研究以连翘转录组数据为基础,筛选鉴定连翘基因家族成员,并对该家族成员进行了理化性质、保守结构域、保守基序、以及盐和干旱胁迫下的表达水平等分析研究,为进一步研究连翘基因家族的功能提供理论基础。
1 材料与仪器
1.1 材料
研究所用连翘叶片及果实采自河南洛阳市宜阳县连翘种植基地,由河南科技大学侯典云教授鉴定为连翘(Thunb.) Vahl。连翘愈伤组织材料为本实验室培养。
1.2 仪器
JJ223BC型电子天平(精度0.001 mg,双杰测试仪器公司)、5415R型低温高速离心机(Eppendorf 公司)、JY04S-3D型凝胶成像分析系统(君意电泳公司)、实时荧光定量PCR仪(Lightcycler96,Roche公司,瑞士)等。多糖多酚植物RNA提取试剂盒、ChamQ Universal SYBR qPCR Master Mix、实时荧光定量PCR(qRT-PCR)反转录试剂盒均购自南京诺维赞生物科技股份有限公司。
2 方法
2.1 愈伤组织胁迫处理
在愈伤组织生长7周左右时,在基础诱导培养基中添加200 mmol/L NaCl作为盐胁迫处理,添加400 mmol/L甘露醇作为干旱处理,分别在在不同时间(1、3、5、7、10 d)进行取材,液氮冷冻,−80 ℃备用。
2.2 基于转录组的连翘PAO基因家族的筛选与鉴定
从连翘转录组序列中筛选获得基因家族相关序列,使用ORF Finder(https://www.ncbi. nlm.nih.gov/orffinder/)在线分析预测基因序列的开放阅读框(open reading frame,ORF),获得连翘基因家族相关基因序列全长,本研究所用到的拟南芥基因组注释信息和基因组序列信息来自于拟南芥基因组数据库TAIR(https://www.arabidopsis.org/)中下载PAO家族蛋白序列;从水稻基因组数据库(https:// ricedata.cn/gene/)中下载水稻PAO家族蛋白序列。将初步获得的连翘PAO蛋白序列通过结构域在线分析软件SMART(http://smart.embl.de/)对保守结构域进行分析。
2.3 连翘PAO家族蛋白理化性质及保守基序分析
利用在线分析工具Expasy ProtParam tool (https://web.expasy.org/protparam/)分析连翘PAO家族蛋白的理化性质。利用SOPMA和signa IP 5.0在线分析对家族蛋白质二级结构特征和蛋白信号肽进行预测。利用在线分析工具The MEME (https:// meme-suite.org/meme/tools/meme)在线分析连翘PAO家族蛋白的基序,并进行可视化分析。
2.4 连翘PAO家族系统进化关系分析
通过NCBI在线查询相关植物PAO家族蛋白序列,并使用软件MEGA 7.0对筛选出的连翘PAO家族与其进行多重序列比对,基于比对结果,使用邻接法构建系统进化树。
2.5 荧光定量PCR分析
使用多糖多酚植物RNA提取试剂盒提取连翘叶片、果实、愈伤组织以及胁迫处理后不同时间的愈伤组织的RNA,按照qRT-PCR反转录试剂盒说明书操作,利用Primer Premier 5.0软件设计相关引物(表1),内参基因为,使用ChamQ Universal SYBR qPCR Master Mix对以上提取RNA进行荧光定量PCR验证。荧光定量PCR反应程序:预变性95 ℃、30 s;变性95 ℃、10 s;退火60 ℃、30 s;40个循环。反应体系20 μL:2×ChamQ Universal SYBR qPCR Master Mix 10 μL,上、下游引物各0.5 μL,cDNA为1.0 μL,用ddH2O补至20 μL。

表1 qRT-PCR引物
3 结果与分析
3.1 连翘PAO基因家族成员鉴定
基于连翘转录组数据,筛选获得21条连翘基因家族相关序列,使用ORF Finder在线分析网站获得连翘基因家族氨基酸序列全长,并与拟南芥及水稻基因家族序列进行BLAST比对,将初步获得的连翘PAO家族蛋白序列通过结构域在线分析软件SMART对保守结构域进行分析,通过筛选,最终鉴定到5个基因家族成员,依次命名为~。通过对连翘PAO家族蛋白序列保守结构域进行分析,结果见图1,发现连翘PAO家族均含有Pfam Amino_oxidase的完整结构域。
对筛选出的连翘PAO家族进行蛋白理化性质分析(表2),结果表明连翘PAO家族编码蛋白质氨基酸数介于235~541 aa,预测得到的理论相对分子质量为26 069~59 328,等电点在5.27~5.86;不稳定系数为35.68~44.14,推测连翘PAO家族均为不稳定蛋白。总平均亲水性皆为负值,推测连翘PAO家族蛋白均为酸性、亲水性蛋白。预测蛋白质二级结构结果显示,连翘PAO家族蛋白均含有α-螺旋、β-转角、无规则卷曲和自由延伸链,其中α-螺旋与无规则卷曲类别占比较高,其为PAO蛋白的主要二级结构形式。
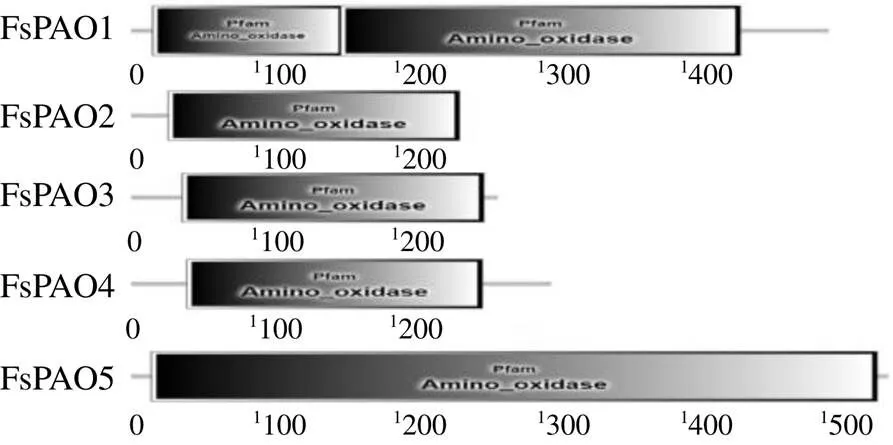
图1 连翘PAO家族蛋白保守结构域

表2 连翘PAO基因家族蛋白理化性质分析
3.2 连翘PAO家族的蛋白保守基序分析
对连翘PAO家族中的保守Motif进行分析预测结果表明(图2),连翘PAO家族中含有8个保守Motif,每个成员含有的Motif有所相同,FsPAO2、FsPAO3、FsPAO4含有相同的Motif。FsPAO1及FsPAO5含有相同的Motif,但它们所含有的Motif位置不同,这些差异可能揭示这些蛋白功能的多样性,并且说明了连翘基因家族的蛋白序列是相对保守的。

图2 连翘PAO家族成员保守基序分析
3.3 连翘PAO家族系统进化关系分析
为探索不同植物PAO家族蛋白间的进化关系,通过NCBI将连翘PAO家族蛋白质序列与拟南芥、水稻、玉米、番茄、甜橙PAO家族蛋白质序列进行多序列对比,并构建系统进化树(图3),通过对系统进化树的分析,并结合“2.2”项中的蛋白保守基序分析结果,可将连翘PAO家族分为3类:连翘FsPAO1与拟南芥AtPAO1相近,隶属于亚家族I,连翘FsPAO2、FsPAO3、FsPAO4与拟南芥AtPAO2、AtPAO3、AtPAO4相近且具有相似Motif,归类于同一分区,属于亚家族Ⅲ一类,连翘FsPAO5与甜橙CsPAO1、CsPAO2以及拟南芥AtPAO5相近,划分于亚家族II。
3.4 连翘PAO基因家族成员在连翘不同组织器官中的表达
为了探究连翘基因家族成员在不同组织中的表达情况,利用荧光定量PCR测定了连翘在连翘叶片、果实以及愈伤组织中的转录水平(图4),在果实、叶片、愈伤组织中的相对表达量存在显著差异(<0.05)。结果显示,连翘基因家族在叶片、果实以及愈伤组织中均有表达,但表达量不尽相同。相比较下,在连翘愈伤组织中的相对表达量最高,显著高于在叶片中的表达;在连翘果实中的相对表达量相对较高,在叶片及愈伤组织中的相对表达量相近;在连翘果实中的相对表达量最高,其次为愈伤组织,均高于在叶片中的表达;在连翘果实中的相对表达量最高,显著高于叶片中的表达,在愈伤组织中的相对表达量显著低于在叶片中的表达;在连翘果实中的相对表达量最高,显著高于在叶片及愈伤组织中的表达。

图3 连翘PAO家族系统发育进化树
3.5 连翘PAO基因家族成员在盐胁迫下的表达
为探究盐胁迫处理下连翘基因家族成员的表达情况,对不同处理时间的愈伤组织进行了基因表达分析(图5)。其中,在NaCl处理后1 d后的相对表达量迅速上升到最大值,达到15倍以上,并在处理3 d后急速下降,在愈伤组织适应胁迫条件后达到稳定状态;在NaCl处理后的表达水平下调,并在处理7 d时相对表达量回调,并有上升趋势;在NaCl处理1 d后相对表达量明显下降,并在7 d后开始逐渐上升;在NaCl处理1d后相对表达量随着处理时间的增加而逐渐上升;在NaCl处理1 d后相对表达量开始上升,并在处理5 d后达到最大值,相对表达量上升3.5倍,在处理7 d后相对表达量下降;结果表明,连翘PAO基因家族成员在盐胁迫条件下均受到诱导,但处理时间的不同,具有不同的响应效果。

图4 连翘PAO基因家族成员在不同组织的相对表达量

与处理0 d比较,*P < 0.05, **P <0.01, ***P < 0.001, ****P < 0.000 1,下图同。
3.6 连翘PAO基因家族成员在干旱胁迫下的表达
根据荧光定量PCR结果分析(图6),在干旱胁迫条件下,表现出相同的表达水平趋势,在处理3 d后约为7倍之多,但相比较下对于盐胁迫的响应更为显著。在干旱胁迫条件下,在处理5 d后相对表达量显著上调,表明在盐胁迫以及干旱胁迫条件下的响应可能有所不同。在干旱胁迫条件下,在处理5d后相对表达量上升,而后下降,相比较下,对于盐胁迫的响应更为明显。相似的,在干旱胁迫条件下的相对表达量趋势为随着处理时间的增加而逐渐上升,表明可能对于盐胁迫和干旱胁迫都具有响应效果。在干旱胁迫条件下,相对表达量的结果为先上升后下降之后上升,在处理10 d时达到最大值,表明对于盐胁迫和干旱胁迫都做出响应,但响应效果有所不同。这些结果表明,连翘基因家族成员在干旱胁迫下的相对表达量均有变化,随处理时间的增加,具有不同的响应效果。

图6 在干旱胁迫条件下连翘PAO基因家族成员的
4 讨论
植物在生长发育过程中会受到各种生物和非生物胁迫的影响,在受到非生物胁迫时,调节自身基因适应环境也是主要方法之一。在水稻[21]中,在种子萌发期的表达水平增高会通过增加了PAO酶活性,维持ROS稳态,影响Na+含量,从而提高水稻耐盐性。在玉米[22]中,干旱条件下基因家族表达可能提高光合光反应效率和整体耐受性。在辣椒[23]中,和在拟南芥中的过表达通过改变转基因植物的生理和分子水平来提高其对低温胁迫的耐受性。在大豆[24]中过表达也会提高大豆的耐盐性,提高种子发芽率。在棉花[25]中,基因的启动子区域存在响应干旱胁迫的顺式作用元件,转入拟南芥中降低了拟南芥幼苗的抗旱能力。
本研究中,从转录组中筛选出21条相关基因家族成员,通过生物信息学分析,最终得到5条PAO蛋白,植物中的PAO通常分为4个亚家族[8, 26-27],本研究中生物信息学分析结果表明,连翘5个PAO蛋白分为3个亚家族,而没有属于亚家族IV的成员。理化性质、蛋白结构域、进化关系、家族分类、蛋白保守基序均显示出属于同一亚家族的成员具有相似的特征,不同亚家族的成员之间表现为多样性,这可能与连翘基因家族的进化密切相关。
基因表达结果显示在不同器官和组织中的表达具有差异性,有报道证明番茄基因家族在不同组织中的表达同样具有差异性[14]。实时荧光定量PCR结果表明,有在叶片、果实和愈伤组织中均有表达。在果实中有较高的表达水平,在愈伤组织中有较高的表达水平,推测基因家族的组织表达多样性与功能多样性之间可能具有一定的相关性。
为进一步探究连翘基因家族对盐胁迫以及干旱胁迫下的响应模式,本试验结合转录组筛选结果对盐胁迫及干旱胁迫下的连翘基因家族成员的表达进行分析,发现在200 mmol/L NaCl处理下,、、表达显著上调,与棉花[28]中基因的先上升后下降结果类似,、表达下调,说明基因家族成员对盐胁迫也能产生应答反应。在400 mmol/L甘露醇处理后,表达均表现为显著上调,与相关报道中[29]逆境处理后PAO活性先上升后下降的趋势相同。这些结果与之前关于PAO提高抗旱机制的报告一致[30],由此可见,连翘基因家族成员均受到盐胁迫和干旱胁迫影响,推测它们可能参与到盐胁迫及干旱胁迫的响应过程,但这些基因的分子调控机制及潜在功能还需进一步研究探讨。
综上所述,本研究从连翘基因组中分析出了5个基因家族,分类分析和组织表达分析显示出其可能的生化和生理功能多样性,在盐胁迫和干旱胁迫响应中表现出不同的逆境胁迫相关性,为后续这些基因的功能鉴定提供了重要参考。
利益冲突 所有作者均声明不存在利益冲突
[1] Gholami M, Fakhari A R, Ghanati F. Selective regulation of nicotine and polyamines biosynthesis in tobacco cells by enantiomers of ornithine [J]., 2013, 25(1): 22-27.
[2] 张灵, 陶亚军, 方琳, 等. 植物多胺的代谢与生理研究进展 [J]. 植物生理学报, 2020, 56(10): 2029-2039.
[3] Tripathi D K, Bhat J A, Ahmad P,. Polyamines and nitric oxide crosstalk in plant development and abiotic stress tolerance [J]., 2023, 50(2): 1-4.
[4] 李霞, 程运河, 马晓东, 等. 多胺在植物抗逆中的生理机制 [J]. 世界林业研究, 2018, 31(4): 23-28.
[5] 刘宝宝, 张士璀. 多胺氧化酶在多胺代谢中的作用 [J]. 鲁东大学学报: 自然科学版, 2014, 30(4): 336-341.
[6] Cona A, Rea G, Angelini R,. Functions of amine oxidases in plant development and defence [J]., 2006, 11(2): 80-88.
[7] Moschou P N, Wu J, Cona A,. The polyamines and their catabolic products are significant players in the turnover of nitrogenous molecules in plants [J]., 2012, 63(14): 5003-5015.
[8] Ono Y, Kim D W, Watanabe K,. Constitutively and highly expressedpolyamine oxidases localize in peroxisomes and catalyze polyamine back conversion [J]., 2012, 42(2/3): 867-876.
[9] Fincato P, Moschou P N, Spedaletti V,. Functional diversity inside thepolyamine oxidase gene family [J]., 2011, 62(3): 1155-1168.
[10] Yu Z, Jia D Y, Liu T B. Polyamine oxidases play various roles in plant development and abiotic stress tolerance [J]., 2019, 8(6): 184.
[11] Yoda H, Hiroi Y, Sano H. Polyamine oxidase is one of the key elements for oxidative burst to induce programmed cell death in tobacco cultured cells [J]., 2006, 142(1): 193-206.
[12] Xi Y, Hu W J, Zhou Y,. Genome-wide identification and functional analysis of polyamine oxidase genes in maize reveal essential roles in abiotic stress tolerance [J]., 2022, 13: 950064.
[13] Wang W, Liu J. Genome-wide identification and expression analysis of the polyamine oxidase gene family in sweet orange () [J]., 555(2): 421-429.
[14] 李会, 王超, 黄思杰, 等. 番茄多胺氧化酶()基因家族鉴定及表达分析 [J]. 西北植物学报, 2018, 38(4): 607-614.
[15] Cervelli M, Cona A, Angelini R,. A barley polyamine oxidase isoform with distinct structural features and subcellular localization [J]., 2001, 268(13): 3816-3830.
[16] 陈虹宇, 任子蓓, 黄炳旭, 等. 不同地域连翘的光合特性研究 [J]. 林业与生态科学, 2023, 38(2): 218-226.
[17] 聂承冬, 沙冬梅, 何晓勇, 等. 连翘的化学成分研究[J]. 中草药, 2023, 54(17): 5487-5497.
[18] 薛腾笑, 任子蓓, 任士福. NaCl胁迫对美国金钟连翘生理特性的影响 [J]. 江苏农业科学, 2018, 46(11): 104-108.
[19] 司瑜韬. 连翘不同种群的干旱适应性研究及与干旱相关基因FsTSP克隆 [D]. 郑州: 河南农业大学, 2021.
[20] 韩雪. 干旱胁迫对东北连翘生理特性的影响 [J]. 黑龙江农业科学, 2015(11): 117-119.
[21] 刘光宇, 江万霞, 雷天, 等. 多胺氧化酶3参与水稻萌发期的耐盐性 [J]. 遗传学报, 2022, 49(5): 458-468.
[22] Pakdel H, Hassani S B, Ghotbi-Ravandi A A,. Contrasting the expression pattern change of polyamine oxidase genes and photosynthetic efficiency of maize (L.) genotypes under drought stress [J]., 2020, 45: 73.
[23] Zhang J W, Liang L, Xiao J C,. Genome-wide identification of polyamine oxidase () family genes: Roles ofandin the cold tolerance of pepper (L.) [J]., 2022, 23(17): 9999.
[24] Du Y Y, Song Y, Zhang Y,. The improvement of soybean salt tolerance by overexpressed[J]., 2023, 92(4): 1109-1124.
[25] 朱雪峰. 棉花基因抗旱功能初步分析 [D]. 石河子: 石河子大学, 2019.
[26] Sagor G H, Inoue M, Kim D W,. The polyamine oxidase from lycophyte(), unlike that of angiosperms, back-converts thermospermine to norspermidine [J]., 2015, 589(20 Pt B): 3071-3078.
[27] Wang W, Paschalidis K, Feng J C,. Polyamine catabolism in plants: A universal process with diverse functions [J]., 2019, 10: 561.
[28] 成新琪, 程文翰, 王凡龙, 等. 棉花多胺氧化酶基因(GhPAO)的克隆及非生物胁迫下的表达分析 [J]. 分子植物育种, 2015, 13(10): 2206-2214.
[29] 徐盛春. 烟草种子和幼苗多胺代谢的调控及与其耐寒性关系的研究 [D]. 杭州: 浙江大学, 2009.
[30] Ghotbi-Ravandi A, Shariati M, Shobbar Z S,. Expression pattern and physiological roles of Plastid(PTOX) in wild and cultivated barley genotypes under drought stress[J]., 2019, 162: 313-320.
Identification and expression analysis ofgene family under salt and drought stress
CHEN Jiaxi1, 2, GUO Guangyang1, 2, TAN Xinjie1, 2, LV Shufang1, 2, XU Huawei1, 2, YUAN Meng1, 2, DENG Ping1, 2, HOU Dianyun1, 2
1. College of Agriculture,, Henan University of Science and Technology, Luoyang 471023, China 2. Henan Engineering Research Center for Evaluation and Innovative Utilization of Homology of Medicine and Food, Luoyang 471023, China
To study the response characteristics of Lianqiao ()polyamine oxidase () gene family under salt and drought stress.Five members of thegene family were identified by analyzing thetranscriptome data. The correlation analysis was carried out by means of protein physical and chemical properties and motif analysis, protein structure analysis, phylogenetic analysis, and structural domains. The gene expression levels were analyzed under salt and drought stress.The amino acid number of thegene family ranged from 235 to 541 aa; The molecular weight from 26 069 to 59 328; The isoelectric point ranged from 5.27 to 5.86; The instability coefficients from 35.68 to 44.14, and the total average hydrophilicity was negative, so it was hypothesized that all the proteins of thegene family were unstable, acidic, hydrophilic proteins, with α-Helix and irregular coil being the main secondary structural forms of PAO proteins.The five identified members of thegene family had specific expression patterns, and salt stress and drought stress induced the expression of the five members of thegene family, which might be involved in the regulation ofin response to salt stress and drought stress. Through this study lays a foundation for in-depth exploration of the function of thegene family.
(Thunb.) Vahl;gene family; gene expression; stress; protein structure analysis
R286.12
A
0253 - 2670(2024)09 - 3077 - 08
10.7501/j.issn.0253-2670.2024.09.021
2023-10-09
国家自然科学基金项目(U1404829);中央本级重大增减支项目“名贵中药资源可持续利用能力建设项目”(2060302);河南省自然科学基金资助项目(202102110156);河南省科技攻关(242102110325);河南省中药材产业科技特派员服务团、河南省中药产业技术体系建设专项资金资助
陈佳茜(1999—),硕士研究生,主要从事药用植物分子生物学研究。E-mail: chenjiaxi0120@163.com
通信作者:侯典云(1975—),教授,博士生导师,主要从事药用植物资源评价与利用研究。Tel: (0379)64282340 E-mail: dianyun518@163.com
[责任编辑 时圣明]

