伴RAS突变成人T细胞急性淋巴细胞白血病患者的临床特征及转归
徐蜜蜜 相梦琪 程佳 许姝姝 宋铁梅
摘要:目的 探讨伴RAS突变成人T细胞急性淋巴细胞白血病(T-ALL)患者的临床特征及转归。方法 选取2016年1月~2022年12月我院初治成人T-ALL患者137例,通过二代测序检测出RAS突变阳性患者19例(14%),回顾性分析这19例患者临床资料,比较化疗和异基因造血干细胞移植(allo-HSCT)的疗效。结果 19例RAS突变以早期前体T(ETP)表型最常见;19例患者的一疗程完全缓解(CR)率为79%,两个疗程CR率为93%;3年总生存(OS)率为(60±12)%,无事件生存(EFS)率为(41±12)%,累积复发率(CIR)为(62±2)%。其中,6例仅使用化疗的患者均在诊断后2年内死亡;13例接受allo-HSCT的患者3年OS率为(90±10)%,EFS率为(62±15)%。结论 RAS突变在成人T-ALL中常见,免疫表型以ETP常见,成人RAS突变T-ALL患者的诱导缓解率高,但易复发,与仅化疗患者相比,allo-HSCT能降低该类患者复发率,延长患者生存期。
关键词:急性淋巴细胞白血病;T细胞;RAS突变;异基因造血干细胞移植
T细胞急性淋巴细胞白血病(T-ALL)是一种以T淋巴祖细胞的恶性转化和增殖为特征的侵袭性血液恶性肿瘤,占成人ALL的20%~25%[1~2]。研究显示,成人T-ALL长期预后差。随着基因测序技术的发展,发现RAS突变阳性与预后较差有关[3]。本研究分析了19例成人RAS突变T-ALL患者的临床及实验室特征和转归。
1研究对象和方法
1.1 初诊检查
留取患者初诊时EDTA抗凝的骨髓样本约10 mL,采用流式细胞术对分离出的单个核细胞按标准程序处理,分析散点图进行免疫表型评价;行直接培养法或24 h短期培养法,采用R显带技术,后至少分析10个中期细胞,以确定患者核型;从骨髓样本提取循环DNA,采用多重巢式PCR方法检测43种急性白血病相关融合基因;从骨髓样本分离单个核细胞提取基因组DNA,使用ABI Ion Torrent S5测序仪行二代测序,评价血液肿瘤中NRAS、KRAS等在内的51个常见基因突变。
1.2 治疗
19例RAS突变患者中,9例患者的诱导化疗方案为去甲氧柔红霉素+长春新碱+泼尼松±环磷酰胺±培门冬酶,5例为去甲氧柔红霉素或阿克拉霉素+阿糖胞苷+粒细胞刺激因子±高三尖杉酯碱±培门冬酶,3例为环磷酰胺+长春新碱+表柔比星+地塞米松±培门冬酶,2例接受维奈克拉联合阿扎胞苷诱导治疗。
患者获得完全缓解(CR)后,根据危险分层、患者年龄、供体可用性、患者亲属态度和经济状况,决定是否进行移植。共13例接受了异基因HSCT(allo-HSCT),其中9例为亲缘单倍型相合HSCT,3例为非血缘HSCT,1例为同胞全相合HSCT。所有患者均采用清髓性预处理方案,12例为改良BUCY(白消安+环磷酰胺),1例為TBICY(全身照射+环磷酰胺),接受非血缘和单倍型移植的患者预处理方案中加用抗胸腺细胞球蛋白。接受同胞全相合移植的患者采用MTX联合环孢素A(CsA)的方案预防移植物抗宿主病(GVHD),非血缘和单倍型移植的患者采用MTX、CsA及霉酚酸酯的方案预防GVHD。中性粒细胞绝对计数连续3 d>0.5×109/L为粒系造血重建,其第1天为粒细胞植活时间;血小板脱离输注后连续7 d>20×109/L为巨核系造血重建,其第1天为血小板植活时间。
1.4 观察指标
疗效判断参考指南[1]。随访截止时间为2023年9月30日,中位随访时间为26(2~84)个月。复发定义为已获得CR的患者外周血或骨髓又出现原始细胞(>5%),或出现髓外疾病。无事件生存(EFS)期定义为疾病确诊至疾病复发或进展、死亡或者至末次随访的时间,总生存期(OS)定义为疾病确诊至死亡或末次随访的时间。
1.5 统计学方法
统计分析采用SPSS 20.0和R 4.3.0软件,统计绘图采用Graphpad Prism 8软件。计量资料非正态分布,采用中位数M(范围)描述,组间比较采用非参数曼-惠特尼U检验。计数资料采用率(比)进行描述,组间比较采用卡方检验或Fisher精确检验。采用Kaplan-Meier法计算OS率和EFS率,并应用Log-rank检验进行组间生存率的比较。累积复发率(CIR)和非复发死亡为竞争因素,采用Grays检验。P<0.05为差异有统计学意义。
2结果
2.1 临床特征
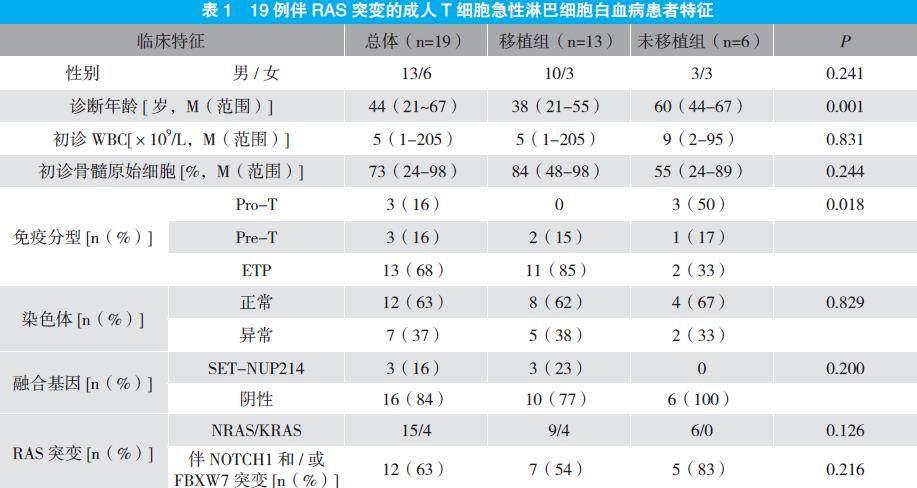
19例患者中,男13例,女6例,中位诊断年龄44(21~67)岁;免疫表型以早期前体T(ETP)最常见,占69%;详细临床特征见表1。
2.2 基因突变结果
19例RAS突变阳性的患者中有15例为NRAS突变,4例为KRAS突变,未出现两者共突变,均属于错义突变。NRAS突变最常发生在12和13号密码子。RAS突变的中位等位基因突变频率(VAF)为14.2(3.0~49.5)%,其中NRAS突变为16.7(3.9~48.5)%,KRAS突变为10.6(3.0~49.5)%。
2.3 治疗结果
19例RAS突变患者一个疗程CR率达79%,两个疗程总CR率为93%;1例持续未缓解患者于诊断后6个月死亡;3年OS率为(60±12)%,EFS率为(41±12)%,CIR为(62±2)%。其中,6例仅使用化疗的患者均在诊断后2年内死亡;13例接受allo-HSCT巩固治疗,其3年OS率为(90±10)%,EFS率为(62±15)%,CIR为(50±3)%。
3讨论
成人T-ALL长期预后差。国内有研究报道,成人T-ALL的5年总体生存率仅为25%。近年来,关于T-ALL分子生物学研究结果帮助优化了治疗分层。NOTCH1和FBXW7(N/F)的激活突变的发现是一个开创性进展,研究报道这类人群预后较好。而RAS基因突变或PTEN改变与较差的预后相关[4]。
RAS基因编码的RAS蛋白经翻译后修饰可定位于细胞膜内侧并通过RAS/RAF/MEK和RAS/PI3K等信号通路传导细胞信号,激活核内转录因子,调控细胞增殖、分化和凋亡。RAS突变常指NRAS和KRAS突变,它在白血病的发生中也具有致病作用。本研究通过二代测序共检测出19例RAS突变患者,占同期收治的初诊成人T-ALL的14%,突变率略高于国外学者报道的10%~11%,以NRAS突变更常见,未出现NRAS和KRAS共突变病例。免疫表型以ETP最常见,未成熟表型在成人中更常见,似乎可以解释这一结果[5]。
来自成人ALL研究小组的研究还基于四种分子改变对成人T-ALL进行危险分层,结果显示在没有RAS或PTEN基因异常的情况下,存在N/F突变预示着近50%的该类患者具有非常好的预后,被认为是低危组。该人群的5年OS率为82%,EFS率为76%。相反,没有N/F突变或存在RAS或PTEN改变预示着预后较差,被认为是高危组,5年OS率为44%,EFS率为32%。其中,仅RAS突变而不包含PTEN异常人群的5年OS率为45%,EFS率为31%[6~7]。本研究结果显示,RAS突变阳性成人T-ALL患者的3年OS为率(60±12)%,3年EFS率为(41±12)%。本研究目前的中位随访时间为26个月,后期拟延长随访时间去进一步验证这类人群的长期生存情况。本研究还显示,该人群诱导缓解率高,两疗程CR率达93.3%,但仍具有较高复发率,3年CIR达(62±2)%,进一步比较移植组和未移植组的OS、EFS,发现移植组显著高于未移植组。
综上所述,RAS突變在成人T-ALL中检出率为14%,以NRAS突变更常见,免疫表型以ETP为主。成人RAS突变阳性成人T-ALL患者的诱导缓解率高,易复发,与仅化疗患者相比,allo-HSCT能降低其复发率,从而改善该类患者的生存情况。
参考文献
[1]中国抗癌协会血液肿瘤专业委员会、中华医学会血液学分会白血病淋巴瘤学组.中国成人急性淋巴细胞白血病诊断与治疗指南(2021年版)[J].中华血液学杂志,2021,42(9):705-16.
[2]周霞,侯健,王东星.Ras及其信号转导异常与血液系统恶性肿瘤治疗研究进展 [J].中华血液学杂志,2004,25(4):58-61.
[3]肖童,刘嘉,高蕾.靶向药物结合异基因造血干细胞移植治疗急性T淋巴细胞白血病 [J].临床内科杂志,2023,40(10):654-58.
[4]黄走方,王婷玉,傅明伟,等.成人T细胞急性淋巴细胞白血病治疗及预后分析[J].中国医学科学院学报,2019,41(4):485-491.
[5]邬成业,李玉龙,董晓燕,等.急性T淋巴细胞白血病患者NOTCH1与FBXW7基因突变特征及对预后的影响[J].中华医学杂志,2022,102(25):1910-1917.
[6]袁田,田晨,王亚非,等.急性T淋巴细胞白血病的诊疗新进展[J].国际输血及血液学杂志,2021,44(3):198-206.
[7]朱原辛,朱明清,戴海萍,等.异基因造血干细胞移植治疗急性早前T淋巴细胞白血病23例临床观察[J].中华血液学杂志,2019,40(12):1021-1025.

