高角量子数原子轨道的可视化—原子结构教学研究
*王裕平
(贵州应用技术职业学院 黔南州计算机辅助药物设计与分子模拟重点实验 贵州 558000)
众所周知,物质是由原子、分子或者离子构成的。在化学反应中,原子是保持物质化学性质的最小微粒。故在化学教学中,“原子”是一个非常重要的概念;使学生深入理解原子的概念与结构是一件至关重要的任务,同时也是学生学好化学的基础。若要使得学生深入理解原子的概念,就必须熟悉原子模型的发展及近代化学对原子结构的描述。
早在公元前5—4 世纪,古希腊哲学家Δημόκριτος、Λεύκιππος 等人就已提出物质是由大量、不可分割的细小微粒构成的观点,这些微粒也就是所谓的“原子”。原子种类、状况及结合力的不同,形成了丰富多彩的物质世界。中世纪期间,由于受宗教和神学的压制,未得到继续发展。1803 年,英国化学家Dalton 发展了原子论,他认为原子是一个坚实、不可再分的实心球;同类原子的属性也是一样的,在化学变化中保持稳定的状态与性质;Dalton 原子论为近代化学的发展奠定了基础。直到1897 年,John Thomson 在真空放电时,发现了电子,为我们进一步揭示原子结构提供了有力线索,从而形成了原子结构的“枣糕模型”。
随后Ernest Rutherford 在1911 年设计了24He散射实验,并进行了长时间观察;实验发现绝大多数24He 穿过金箔后,依然保持原有的速度或出现极小偏转,也有一些偏转比较大,个别被反弹了回来。从而证明原子内部是空的,其质量基本集中在一个点上,占据总质量99.9%以上,电子在其周围像行星绕太阳运动一样(太阳质量同样也占据了整个太阳系总质量的99.98%)。但是该原子结构模型与经典电磁学理论是冲突的,它不能解释原子的稳定性,也不能说明原子光谱的分立性。
因此,1913 年,丹麦物理学家Bohr 做出原子定态、基态及激发态的假设,并首次引入能量、轨道半径的“量子化”观点。该观点不仅能解释原子的稳定性,也可说明H 原子光谱的分立性。但依然存在缺陷,对于稍复杂一点的原子,比如He,都会出现严重的问题。因此,Bohr 的原子理论依然不是最佳模型。主要原因在于它保留了所谓的“经典轨道”概念,并没有完全摒弃经典力学的观点。直到量子力学完全建立,在该力学体系下,原子结构有了至今为止最为完美的解释—电子云模型,而且现在已经可以通过扫描隧道显微镜观察到原子的模样。
1.原子轨道知识点教学浅谈
(1)概念理解。目前,以近代物理学的观点来看,原子轨道只是一个形象上的概念;学习者绝不可望文生义。在量子力学的描述中,一切微观粒子的运动并没有确定的轨道和能量。微观粒子具有波粒二象性,它的运动行为是通过波函数来表达的。所以,原子轨道是指用于描述原子中,某个单电子运动的波函数,它并不是一条形象的轨道,如抛物线、圆等,它是通过求解薛定谔方程所得到的一个函数式。其次,原子中,各个电子之间并不是相互独立的,存在各种相互作用,如Coulomb 相关、Fermi 相关等;因此,这里所谓的单电子波函数也是在一系列近似条件下而求解得到的。
化学教学中,为更加象形描述原子轨道,一般将原子轨道分解为角度分布函数和径向分布函数的乘积来表达。化学教材中常见的原子轨道轮廓图即为角度分布函数在球坐标下的图像,光谱学标记为s、p、d、f、g、h、i、j……轨道;能够正确表达相关图像也是化学教学中极其重要的一环。除此之外,还有等值线图、电子密度等表达方式[1-2]。
(2)化学史的作用。在化学基础知识教学中,也应该充分重视化学史的应用,原子结构基础知识教学是化学中的重点也是难点。但该部分知识具有完整的化学史材料,因此可以充分利用化学史进行原子结构知识教学,从而促进学生对知识、科学本质的理解以及概念转变。统计研究表明,结合化学史进行教学,可以提高学生对科学本质的理解及学习兴趣,从而加深学生对原子结构知识的理解[3-4]。
(3)Bohr 原子模型的重要性。Bohr 原子模型是近代原子结构理论的开端,首次提出了轨道与能量的量子化概念,是化学相关专业学生进一步学习量子力学概念的基础。在此方面,相关研究者还提出以发散思维为主、收敛思维为辅及有所为有所不为、张弛有度的哲学方法进行教学。通过对该内容的学习,可以使得学生在获得基础知识的同时,也能学到许多科学的思想方法、学习方法和研究方法[5]。
(4)化学模型教学策略。模型思维在数学、物理中是一种至关重要的研究方法,比如学习者经常听到数学模型、物理模型等概念。但是随着近代化学的发展,尤其是量子化学及计算机的高速发展使得模型思维、模型认知在化学学习或教学中也变得越来越重要,从而形成了本教学研究中的化学模型教学方法。物质结构决定性质,故原子结构知识点几乎贯穿整个基础化学教学或学习的始终;其次,该知识点也是最能体现模型思维的典型案例之一。从模型认知视角来探讨原子结构教学,对于提高原子结构的教学效果以及开展模型认知教学都有一定的参考意义[6]。
通过原子结构模型知识的学习,还可以引发学生的认知冲突,从而激发学生进一步探索原子结构的兴趣,引导学生构建新的原子结构模型去进一步探索原子结构,实现化学素养的提升[7]。同时,也可以避免形成陈述式课堂。
除此之外,也有教师在课堂上通过自行设计分光镜,来分析有关元素的光谱进行教学。但是,该方法在一般条件的课堂很难实现[8]。
针对此问题,有些教师借助量子化学密度泛函方法来建立相关分子轨道模型的计算,并绘制相关分子轨道轮廓图、能级图或借助Orbital Viewer 软件,进行互动性课堂教学;将学生较难理解的内容定量、直观地呈现出来。以此来激发学生学习的主动性和积极性,从而达到提高教学质量的目的[9-10]。
2.Gaussian软件辅助教学
(1)原子轨道模型的Gaussian计算
虽然最近研究中,有给出过g 轨道在Matlab 中的可视化,但前提是要知道原子轨道的具体表达式[11]。这些表达式往往较长,书写代码极不方便,很难处理更高角量子数的原子轨道。因此,在该教学研究中,将借助Gaussian、Gauss view 等软件来解决这一问题;并一次性输出s-i 轨道的角度分布函数图。
由于教学目的是画出s-i 轨道角度分布图;故只需保证Gaussian 计算结果的各个分子轨道与期望的原子轨道之间严格一一对应即可。
所以,在输入文件中先使用自定义基组gen 关键词将s-i 轨道表示出来。此时轨道初猜不可用程序默认数据,否则结果将把以上定义的各轨道混合到一起,无法区分。因此,需要用关键词cards 指定初始猜测,具体可参见guess 关键词中cards、save、only 等选项的使用。
为实现分子轨道与所期望的原子轨道一对一,在指定初始猜测时,还需将每一行中除了期望得到的轨道,其余所有系数都指为0,目标轨道系数指为1。由于s-i 共有49 个原子轨道,所以初始猜测系数将形成以上的[49×49 单位矩阵]。
(2)Gauss view可视化处理
将上述Gaussian 软件计算产生的atom-orbital.chk 文件用Gauss view 软件打开,与查看普通分子轨道一样的操作,即可得到角量子数为s-i 的49 个原子轨道角度分布函数图像。
由于s-g 轨道图像基本已比较熟悉[11],以下将列出11 个h 轨道和13 个i 轨道的角度分布函数图;图1为11 个h 轨道的角度分布函数图。
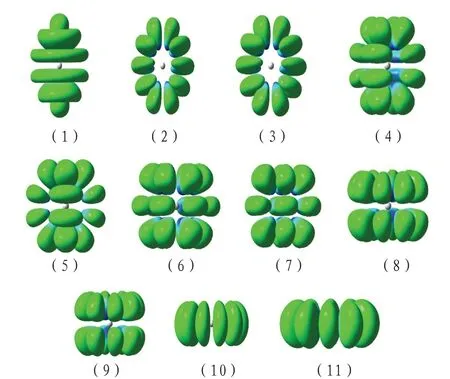
图1 11 个h 原子轨道的角度分布函数图
图2 为13 个i 轨道的角度分布函数图。

图2 13 个i 原子轨道的角度分布函数图
由以上可知在s-i 轨道中,随着角量子数的增加,图像中的节面也越来越多,花瓣数也逐渐增加。如有涉及到的成键方式或杂化轨道,必然也更加复杂。整个计算、处理过程学生需要全程参与,如此一来,学生明白了原子轨道概念的同时,也知道了教材中轨道图像的具体来源;势必加深对原子结构知识的理解,为以后学习化学打下坚实的基础。
3.教学研究总结
在对原子结构基础知识教学中,充分利用化学史素材有助于提高课堂气氛及学生对概念的理解,同时也有利于核心概念的转换与提高。再者就是应该重视对Bohr 原子结构模型的讲解,该模型初步引入了原子轨道半径与能量的“量子化”及定态、基态、激发态等观点;为以后深入学习、理解化学基础知识打下坚定的基础。其次,在化学基础知识教学中,适当使用化学模型也是一种提高学生科学素养及独立思考的有效方法。
在该教学中,我们有效使用了简单、方便的Gaussian 与Gauss View 软件作为辅助工具;通过建立正确的“化学模型”—原子轨道计算模型,让学生亲身体验原子轨道角度分布函数图像的绘制,并且还给出了目前所有教材中都未曾介绍的高角量子数原子轨道,如h、i 轨道等;从而进一步提高了学生对知识的理解,在提高学习成绩的同时也锻炼了学生的化学模型思维、数据处理能力及科学素养。

