透明细胞肾细胞癌的不常见组织学形态及诊断思路
贾景丹,王朝夫,杨晓群
透明细胞肾细胞癌(clear cell renal cell carcinoma, CCRCC)是肾脏最常见的恶性上皮源性肿瘤,占肾细胞癌的60%~75%[1],与其他恶性肿瘤一样,具有生物异质性的普遍特征,即组织学形态异质性。CCRCC经典型组织学形态为肿瘤细胞呈巢状、腺泡状或管状结构,胞质透明,偶尔嗜酸性,伴有丰富的毛细血管网,与VHL双等位基因失活相关[2]。肿瘤细胞核级别与胞质颜色相匹配,当细胞核级别较低时(WHO/ISUP 1~2级),细胞质透明;当细胞核级别较高时,细胞质偏向嗜酸性。免疫表型除表达上皮性标记和肾细胞源性标记PAX8外,肿瘤细胞特征性地弥漫胞膜表达碳酸酐酶Ⅸ(carbonic anhydrase Ⅸ, CAⅨ),而不表达或灶性表达CK7。分子遗传学特征为3p25缺失/VHL基因突变,PBRM1、SETD2、BAP1等基因高频突变,预后与TNM分期、WHO/ISUP核级、肉瘤样/横纹肌样分化及肿瘤性坏死相关,其中WHO/ISUP分级系统中界定的CCRCC 4级形态为瘤细胞多形性、瘤巨细胞、横纹肌样或肉瘤样形态[3]。在临床诊断工作中,我们越来越多地遇到CCRCC中伴有一种或多种不常见或特殊的组织学形态,并与其他亚型的肾脏肿瘤有形态学的交叉,给病理诊断带来很大挑战。本文结合临床实际工作经验和文献复习来介绍CCRCC不常见的组织学形态,并提出诊断和鉴别诊断的思路。
1 CCRCC模拟“血管瘤”
CCRCC中缺氧诱导因子(hypoxia inducible factor, HIF)通路被激活,HIF通路相关蛋白如HIF-1a、CAⅨ、GLUT1表达增加,促进血管生成,导致肿瘤内血管增生[4]。丰富的毛细血管网是CCRCC的特征性形态,有助于病理医师诊断CCRCC并与其他类型的肾细胞癌鉴别。在转移性肿瘤中,这种精细的分枝血管系统也是提示肾脏为原发部位的有用线索。尽管肾脏是一个血管系统丰富的器官,但肾脏的原发性血管源性肿瘤罕见,如毛细血管瘤、吻合性血管瘤等。部分低级别CCRCC会模拟“血管瘤”形态[5],易误诊,尤其在穿刺活检标本中。通常这类肿瘤大体上呈红褐色或出血。镜下血管瘤样成分表现出不同的比例和分布,呈弥漫性或散在岛状,或呈大小不等的脉管样囊腔,充满大量红细胞,似毛细血管瘤,周边的间质纤维化及含铁血黄素沉积,部分囊壁衬附低核级的透亮细胞(图1A),易被红细胞掩盖;或相互吻合交织成网,部分衬附靴钉样细胞,似吻合性血管瘤;或呈索状的微血管,间质疏松及胶原化,可见新生的小血管腔(图1B),似上皮样血管内皮瘤。仔细观察均可发现,微血管旁单个或簇状分布的模拟有光晕效应的小淋巴细胞的癌细胞,免疫组化标记上皮膜抗原(EMA)(图1C)及肾细胞源性标志物PAX8可将其勾勒出来,且CAⅨ为特征性的细胞膜着色。这提醒病理医师在肾切除标本和穿刺活检标本中,遇到血管瘤样形态的病变时,一定要广泛取材并加做免疫组化标记,以排除单个或小簇状癌细胞的存在。
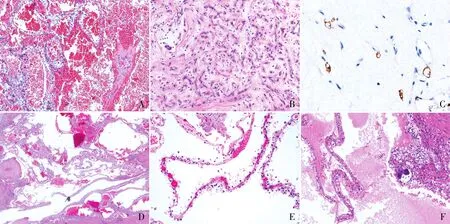
图1 A. 透明细胞肾细胞癌模拟“血管瘤”,癌细胞密度低,易被掩盖;B.透明细胞肾细胞癌呈索状的微血管样,间质疏松及胶原化,可见新生小血管腔;C.透明细胞肾细胞癌癌细胞EMA阳性,Ventana Ultraview两步法;D.透明细胞肾细胞癌伴显著囊性变;E.低度恶性潜能多房囊性肾肿瘤,囊壁衬覆单层胞质透亮细胞,核级低,上皮下有丰富的充满红细胞的薄壁毛细血管;F.TFE3重排性肾细胞癌,多房囊性,癌细胞胞质淡染,可见砂砾体样钙化
2 CCRCC伴显著囊性变
CCRCC伴显著囊性变时(图1D),与低度恶性潜能多房囊性肾肿瘤(multilocular cystic renal neoplasm of low malignant potential, MCNLMP)的鉴别诊断一直是临床病理诊断的难点,两者形态学有交叉,免疫表型相似,CK7和CAⅨ均可阳性,且均可有3p25缺失。MCNLMP大体上完全由多房囊腔构成,界清,有纤维性包膜。镜下囊壁衬覆单层胞质透亮细胞(WHO/ISUP核级:1级,少量为2级),上皮下有丰富毛细血管,多数血管内充满红细胞(图1E);囊壁衬覆上皮常常脱落或消失,仅留下“裸露”的薄壁毛细血管;偶见内衬上皮为复层或呈小乳头状;囊壁间隔内存在类似于囊腔衬覆的肿瘤细胞灶,第五版WHO肾肿瘤分类中量化了肿瘤细胞灶的大小,即无膨胀性生长瘤结节或不超过20×(1 mm)的显微视野[2]。另外,还需与囊性TFE3重排性肾细胞癌鉴别,该肿瘤患者年龄一般较年轻,癌细胞胞质淡染,非真正的透亮,核级低或有不明显的小核仁,砂砾体样钙化可提示诊断(图1F),免疫组化标记CK7和CAⅨ常阴性,而TFE3、Cathepsin K和Melan A呈阳性,分子遗传学有MED15∷TFE3融合[6]。
3 CCRCC伴嗜酸性小球或包涵体
少数CCRCC肿瘤细胞胞质内存在较多嗜酸性小球或包涵体(图2A),圆形或椭圆形,大小不一,嗜伊红性较强,与周围细胞质界限清楚。乳头状肾细胞癌中也有此现象[7-8]。有研究发现其为纤维样蛋白和(或)过氧化物酶体组成的复合物,是自噬缺陷的产物,且主要出现于核级别较高的肾癌中[9]。与经典型CCRCC相同,肿瘤细胞特征性表达PAX8和CAⅨ,并有VHL基因突变。

图2 A.透明细胞肾细胞癌伴嗜酸性小球或包涵体;B.透明细胞肾细胞癌伴乳头状结构;C.透明细胞肾细胞癌伴核下空泡;D.透明细胞乳头状肾细胞肿瘤,“流产式”管状结构,纤维肌瘤样间质;E.透明细胞肾细胞癌伴合胞体型多核巨细胞(箭头),插图为合胞体型多核巨细胞PAX8阳性(箭头),Ventana Ultraview两步法;F.透明细胞肾细胞癌伴“伸入”现象(箭头)(图E、F由浙江大学第一附属医院白燕峰主任提供)
4 CCRCC伴乳头状结构
乳头状生长模式是CCRCC罕见的形态学变异,一般是在经典型CCRCC中出现不同比例的乳头状结构(图2B),乳头衬覆胞质透亮或嗜酸性细胞,未见泡沫细胞和砂砾体样钙化。当这种乳头状结构占肿瘤的很大一部分时,文献报道其比例可达50%~90%[10],需要与乳头状肾细胞癌、透明细胞乳头状肾细胞肿瘤(clear cell papillary renal cell tumour)和TFE3重排性肾细胞癌鉴别。该类肿瘤细胞特征性地表达CAⅨ,不表达CK7和TFE3,并检测到3p25缺失或VHL、PBRM1、SETD2等基因突变,未发现7/17三体或MET基因突变以及TFE3基因融合。
5 CCRCC伴核下空泡
透亮的胞质、低级别的核及核下空泡,易让人想到透明细胞乳头状肾细胞肿瘤,然而“核下空泡”并非透明细胞乳头状肾细胞肿瘤所特有的,CCRCC中也可出现(图2C)。在鉴别诊断中,需要病理医师严格按照诊断标准诊断,透明细胞乳头状肾细胞肿瘤表现为厚的纤维被膜,纤维肌瘤样间质,“流产式”管状和乳头结构(图2D),CK7弥漫阳性,CAⅨ呈“杯口状”着色模式,GATA3一般阳性,且无特异性分子遗传学改变(即无3p25缺失,无VHL、TSC1、TSC2、MTOR、ELOC突变)[2]。
6 CCRCC伴合胞体型多核巨细胞及“伸入”现象
高级别的CCRCC有时会含有怪异的多核巨细胞,文献中称之为“CCRCC伴合胞体型多核巨细胞”[11]。合胞体型多核巨细胞区域与经典型CCRCC区域陡然过渡,有时位于坏死区域周围。其典型的特征是有丰富细颗粒状嗜酸性胞质,并有空泡化或透亮区域,细胞核数目多,排列在细胞的外围或中心位置,与邻近的高级别单个核的肿瘤细胞的核形态相似,通常只存在一个突出的核仁(图2E)。部分病例中多核巨细胞胞质内含有中性粒细胞或少量淋巴细胞(图2F),即“伸入现象”。其他的形态学表现包括胞质内嗜酸性小球和核内包涵体等。免疫组化染色显示合胞体型多核巨细胞CK(AE1/AE3)、PAX8(图2E插图)、CAⅨ、CD10、EMA和vimentin阳性,而β-HCG、TFE3、组织蛋白酶K、CK7、CK20、HMB45、CD68、SMA和S-100均阴性,表明其本质仍为CCRCC。有研究称合胞体型多核巨细胞和“伸入”现象可以作为CCRCC WHO/ISUP 4级核的形态特点,该类患者预后也更差[12]。该类肿瘤需注意与上皮样血管平滑肌脂肪瘤(黑色素标记HMB45、Melan A等和SMA阳性,散发病例有TSC2突变)、TFE3/TFEB重排性肾细胞癌及尿路上皮癌伴有合体滋养细胞分化等相鉴别。
7 CCRCC伴纤维肌瘤样间质
CCRCC伴纤维肌瘤样间质罕见[13],显微镜下可见纤维肌瘤样间质将胞质透亮的肿瘤细胞巢分割成多结节状(图3A),肿瘤细胞表达PAX8和CAⅨ,但CK7不表达或小灶状着色,分子病理可检测到3p25缺失或VHL基因突变。近些年来,透明细胞乳头状肾细胞肿瘤、伴有纤维肌瘤样间质的肾细胞癌(RCC with fibromyomatous stroma)和ELOC突变肾细胞癌(ELOC-mutated renal cell carcinoma)先后被认识和报道[14-16],胞质透亮、管状乳头状结构和纤维肌瘤样间质是其共同特点。这几种肿瘤的鉴别诊断亦成为病理医师工作中的难点,其鉴别诊断要点总结见表1。透明细胞乳头状肾细胞肿瘤一般有厚的纤维被膜,间质呈纤维肌瘤样;肿瘤细胞一般排列成“流产式”的管状和乳头结构,还可呈巢状、缎带状或囊性;肿瘤细胞胞质透明,核级低(WHO/ISUP核级1~2级),核远离基底形成“核下空泡”。肿瘤细胞弥漫性表达CK7和CAⅨ,后者呈“杯口状”染色模式,还可表达GATA3,不表达CD10。目前尚无已知的特异性分子遗传学改变[2]。ELOC突变肾细胞癌,以往的文献称为TCEB1突变肾细胞癌,有明显的纤维肌瘤样间质,且将肿瘤细胞分隔成多结节状;肿瘤细胞排列成腺泡状、分枝管状和乳头状;肿瘤细胞胞质透明、丰富,胞膜清楚,核级低(WHO/ISUP核级1~2级)(图3B)。肿瘤细胞弥漫性表达CAⅨ,定位于细胞膜,弥漫性或大部分表达CK7(图3C)。检测到ELOC突变才能明确诊断该肿瘤。伴有纤维肌瘤样间质的肾细胞癌在第五版WHO肾肿瘤分类中并未作为一个独立的疾病体描述,而是在ELOC突变肾细胞癌的鉴别诊断中提及,其具有TSC/MTOR突变,部分病例与结节性硬化症有关。在组织学形态上同样有明显纤维肌瘤样间质;肿瘤细胞一般形成拉长的分枝管状结构,可有乳头状结构;胞质透明丰富,可有嗜酸性小球;核级低(WHO/ISUP核级1~2级)(图3D)。在免疫组化染色模式上,除CK7弥漫阳性外,肿瘤细胞CAⅨ呈弥漫膜阳性,部分呈“杯口状”(图3E)。在预后方面,与CCRCC相比,这3种肿瘤预后较好。

表1 伴有纤维肌瘤样间质的CK7阳性的透明细胞肾肿瘤鉴别要点

图3 A.透明细胞肾细胞癌伴纤维肌瘤样间质;B. ELOC突变肾细胞癌,纤维肌瘤样间质,瘤细胞排列成腺泡状和分枝管状结构,胞质透明丰富;C. ELOC突变肾细胞癌CK7弥漫阳性,Ventana Ultraview两步法;D.伴有纤维肌瘤样间质的肾细胞癌,纤维肌瘤样间质,肿瘤细胞排列呈拉长的分枝管状结构,胞质透明丰富;E.伴有纤维肌瘤样间质的肾细胞癌CAⅨ弥漫膜阳性,部分呈“杯口状”,Ventana Ultraview两步法;F.透明细胞肾细胞癌伴骨化生
获得一个精准的病理诊断需要进行分子病理检测,然而很多医院病理科,尤其是基层医院病理科并未开展高通量分子病理检测。结合第五版WHO肾肿瘤分类的观点,我们建议在没有分子证据的情况下,将其诊断为“伴有纤维肌瘤样间质的CK7阳性的透明细胞肾肿瘤,需鉴别ELOC突变肾细胞癌、伴有纤维肌瘤样间质的肾细胞癌、透明细胞乳头状肾细胞肿瘤和透明细胞肾细胞癌,该系列肿瘤是一组具有相似组织学特征、不同分子遗传学特征的肾细胞肿瘤的总称,生物学行为总体属于惰性,术后以随访监控为主,必要时行基因检测。”
8 CCRCC伴骨化生
肾细胞癌中出现骨化生的现象并不常见,文献中CCRCC、嫌色性肾细胞癌和TFE3重排性肾细胞癌伴骨化生大多为个案报道[17-19],发生骨化生的CCRCC一般分期早,预后好。镜下表现为经典型的CCRCC中出现小灶或大片骨化生(图3F)。
综上,本文总结了CCRCC中可出现的不常见或特殊的组织学形态以及诊断和鉴别诊断思路,在日常诊断工作中仍需要病理同仁去发现肾细胞癌更多的形态学特别之处。希望通过本文能提高病理同仁对CCRCC的诊断水平,识别出少见的组织学形态与之相似的其他类型肾细胞癌,使更多患者获益。

