西藏地区结直肠癌免疫治疗和靶向治疗相关分子标志物的检测及意义
罗含欢 刘斌云 霍真 边巴扎西 王倩 多布啦 尼玛卓玛 达珍 王寒 郭平平

摘要:目的 研究西藏地区结直肠癌中SWI/SNF 相关、基质相关、肌动蛋白依赖性染色质调节因子A 亚科成员4 (SMARCA4)/Brahma相关基因1、V-raf鼠类肉瘤病毒癌基因同源物B(BRAF)、P53、程序性死亡受体1(PD-1)及程序性死亡配体1(PD-L1)免疫组织化学表达和BRAF、神经营养因子酪氨酸受体激酶(NTRK)基因改变情况,为西藏地区结直肠癌患者的靶向治疗及免疫治疗提供依据。方法 收集2015年1月至2021年7月西藏自治区人民医院经手术切除病理确诊为结直肠癌病例64例,全部病例均进行SMARCA4、BRAF、P53、PD-1、PD-L1免疫组织化学染色和NTRK1、NTRK2、NTRK3融合基因荧光原位杂交检测及BRAF V600E基因突变PCR检测。结果 64例结直肠癌病例男女比例1.21∶1,平均年龄(56.59±13.27)岁;46例(71.88%)位于结肠,18例(28.12%)位于直肠;60例(93.75%)为腺癌,4例(6.25%)为其他类型;11例(17.19%)为T1或T2期,53例(82.81%)为T3或T4期;24例(37.50%)出現淋巴结转移。免疫组织化学方面,64例中1例(1.56%)SMARCA4部分肿瘤细胞表达减弱或缺失,4例(6.25%)BRAF肿瘤细胞阳性表达,35例(54.69%)P53为突变型表达;45例(70.31%)PD-1肿瘤相关免疫细胞阳性比例分数<10%,19例(29.69%)≥10%;52例(81.25%)PD-L1联合阳性分数<10,12例(18.75%)≥10。64例NTRK1、NTRK2、NTRK3融合基因检测均为阴性;4例(6.25%)检测到BRAF V600E基因突变;1例SMARCA4表达缺失病例未检测到SMARCA4基因改变。PD-L1的表达与错配修复缺陷/高度微卫星不稳定和PD-1的高表达呈显著正相关(χ2=10.223,P=0.001;χ2=11.979,P=0.001)。结论 西藏地区结直肠癌中较少出现SMARCA4表达减弱或缺失及NTRK融合基因改变,少数病例有BRAF V600E基因突变,Pan-TRK和BRAF免疫组织化学可作为NTRK融合基因及BRAF基因突变的初筛方法。错配修复缺陷/高度微卫星不稳定的病例中更容易出现PD-L1蛋白高表达,这部分患者有望获益于免疫治疗。P53突变与PD-L1表达无相关性,PD-1的高表达和PD-L1的高表达呈正相关。
关键词:西藏地区;结直肠癌;SWI/SNF 相关、基质相关、肌动蛋白依赖性染色质调节因子A 亚科成员 4;程序性死亡受体1;程序性死亡配体1;V-raf鼠类肉瘤病毒癌基因同源物B;神经营养因子酪氨酸受体激酶
中图分类号: R735.3+4文献标识码: A文章编号:1000-503X(2024)02-0184-09
DOI:10.3881/j.issn.1000-503X.15852
Detection and Significance of Molecular Markers in Immunotherapy and Targeted Therapy of Colorectal Cancer in Tibet
LUO Hanhuan1,LIU Binyun2,HUO Zhen3,BIANbazhaxi4,WANG Qian1,DUObula1,NImazhuoma1,DA Zhen1,WANG Han1,GUO Pingping1
1Department of Pathology,Tibet Autonomous Region Peoples Hospital,Lhasa 850000,China
2High Altitude Medical Research Institute of Tibet Autonomous Region,Lhasa 850000,China
3Department of Pathology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
4Department of General Surgery,Tibet Autonomous Region Peoples Hospital,Lhasa 850000,China
Corresponding author:HUO Zhen Tel:010-69159365,E-mail:huozhen1976@126.com
ABSTRACT:Objective To study the expression of SWI/SNF-related,matrix-associated,actin-dependent regulator of chromatin,subfamily A,member 4(SMARCA4)/Brahma-related gene 1,V-raf murine sarcoma viral oncogene homolog B(BRAF),P53,programmed cell death protein-1(PD-1),and programmed death-ligand 1(PD-L1),and changes in the expression of BRAF and neurotrophic tyrosine receptor kinase(NTRK) in the patients with colorectal cancer in Tibet,thereby providing a basis for targeted therapy and immunotherapy for this disease in Tibet.Methods A total of 64 patients with colorectal cancer resected in the Tibet Autonomous Region Peoples Hospital from January 2015 to July 2021 were enrolled in this study.The expression of SMARCA4,BRAF,P53,PD-1,and PD-L1 was detected by immunohistochemical staining.The gene fusion involving NTRK1,NTRK2,and NTRK3 was detected by fluorescence in situ hybridization,and the BRAF V600E gene mutation by polymerase chain reaction.Results The 64 patients with colorectal cancer were at a male-to-female ratio of 1.21∶1,with the mean age of (56.59±13.27) years.The tumors were located in the colon in 46(71.88%) patients and in the rectum in 18(28.12%) patients.Sixty(93.75%) patients presented adenocarcinoma,and 4(6.25%) patients presented other types of tumors.The patients in T1/T2 and T3/T4 phases accounted for 17.19%(n=11) and 82.81%(n=53),respectively.Lymph node metastasis occurred in 24(37.50%) patients.The immunohistochemical staining results showed partially down-regulated or absent expression of SMARCA4 in 1(1.56%) patient,positive BRAF expression in 4(6.25%) patients,and mutant expression of P53 in 35(54.69%) patients.The PD-1-expressing tumor associated immune cell was proportion score<10% in 45(70.31%) patients and≥10% in 19(29.69%) patients.The PD-L1 combined positive score was<10 in 52(81.25%) patients and≥10 in 12(18.75%) patients.The gene fusion of NTRK1,NTRK2,and NTRK3 was negative in all the patients,and BRAF V600E gene mutation was positive in 4(6.25%) patients.The SMARCA4 gene alteration was not detected in the patient with partial expression missing of SMARCA4.The PD-L1 combine positive score was correlated with the deficient mismatch repair(dMMR)/microsatellite instability-high (MSI-H) and the PD-1 expression (χ2=10.223,P=0.001;χ2=11.979,P=0.001).Conclusions The down-regulated or absent SMARCA4 expression and NTRK gene fusion are rare in the patients with colorectal cancer in Tibet.A few patients present BRAF V600E gene mutations,and Pan-TRK and BRAF expression can be used for the primary screening of NTRK gene fusion and BRAF gene mutation.The patients with dMMR/MSI-H are prone to high expression of PD-L1 and expected to benefit from immunotherapy.No significant correlation exists between P53 mutation and PD-L1 expression.The high expression of PD-1 is positively correlated with the high expression of PD-L1.
Key words:Tibet;colorectal cancer;SWI/SNF-related,matrix-associated,actin-dependent regulator of chromatin,subfamily A,member 4;programmed cell death protein-1;programmed death-ligand 1;V-raf murine sarcoma viral oncogene homolog B;neurotrophic tyrosine receptor kinase
Acta Acad Med Sin,2024,46(2):184-192
结直肠癌(colorectal cancer,CRC)是全球最常见的恶性肿瘤之一,在美国癌症协会公布的《2021年度癌症统计报告》中,CRC的发病率及病死率均位于第三[1]。随着生活水平的提高、饮食习惯和结构的改变以及人口的老龄化,CRC在我国发病率呈逐年上升趋势,中国2020年CRC的新发病例数为56万例,因CRC死亡病例达29万例[2]。随着分子检测技术的发展,已证实CRC发病主要有两种途径:一是以癌基因和抑癌基因为代表的染色体不稳定性途径,如癌基因KRAS、BRAF、PIK3等,以及抑癌基因P53、APC、DPC4等;二是因错配修复基因突变失活或甲基化失活导致的微卫星不稳定性途径[3-4]。近年,免疫检查点抑制剂在恶性肿瘤治疗方面取得突破性进展,是目前的研究热点之一。本研究纳入2015年1月至2021年7月西藏自治区人民医院经手术切除病理确诊的CRC病例,采用光镜、免疫组织化学(immunohistochemistry,IHC)、荧光原位杂交(fluorescence in situ hybridization,FISH)和PCR检测等方法,总结分析西藏地区藏族人群CRC中SWI/SNF 相关、基质相关、肌动蛋白依赖性染色质调节因子A 亚科成员 4/Brahma相关基因1(SWI/SNF-related,matrix-associated,actin-dependent regulator of chromatin,subfamily A,member 4/Brahma-related gene 1,SMARCA4/BRG1)、V-raf鼠类肉瘤病毒癌基因同源物B(V-raf murine sarcoma viral oncogene homolog B,BRAF)、P53、程序性死亡受体 1(programmed cell death protein-1,PD-1)、程序性死亡受體配体 1(programmed death-ligand 1,PD-L1)表达情况,及BRAF和神经营养因子酪氨酸受体激酶(neurotrophic tyrosine receptor kinase,NTRK)基因改变情况,为西藏地区CRC患者的靶向治疗及免疫治疗提供依据。
1 资料和方法
1.1 资料来源
收集2015年1月至2021年7月西藏自治区人民医院病理科存档的经手术切除确诊的CRC病例64例,并查阅临床和病理资料。本研究经西藏自治区人民医院伦理委员会审批(伦理审查编号:ME-TBHP-KJ-23-03),豁免知情同意。
1.2 方法
所有病理切片由2名病理科副主任及以上医师重新阅片,按照2019年世界卫生组织消化系统肿瘤分类标准[5]进行病理分型及分级。采用IHC EnVision法检测PD-L1(克隆号:22C3,安捷伦科技有限公司)、 PD-1(克隆号:UMAB199,中杉金桥公司)、SMARCA4/BRG1(克隆号:GR005,基因科技上海股份有限公司)、BRAF(克隆号:EPR2208Y)、Ki-67(克隆号:MIB-1)、P53(克隆号:DO-7),后3种均为安必平医药科技股份有限公司产品,同时设立阳性和阴性对照。NTRK1、NTRK2、NTRK3基因断裂探针试剂(荧光原位杂交法)购于北京安必平生物科技有限公司,BRAF V600E基因突变检测试剂(荧光PCR法)购于厦门艾德生物医药科技股份有限公司,均按照试剂盒说明书进行操作。
1.3 结果判读
SMARCA4、P53和Ki-67细胞核出现棕褐色颗粒判读为阳性,未出现棕褐色颗粒为阴性;P53突变情况根据细胞核着色情况判定,结果判断参照文献[6-7],其中肿瘤细胞核均无着色提示无义突变,>60%的肿瘤细胞核强着色提示错义突变,1%~60%肿瘤细胞不均匀着色提示野生型,另有文献报道的少数病例中出现P53细胞质着色模式[8],在本研究中未观察到,此种情况的判读标准本研究不涉及。BRAF、PD-1细胞质出现棕褐色颗粒判读为阳性,未出现棕褐色颗粒为阴性,PD-1在肿瘤相关免疫细胞中的表达计数方法为PD-1染色肿瘤相关免疫细胞占所有肿瘤相关免疫细胞百分比,根据是否大于10%分为<10%(低表达)和≥10%(高表达)两组;PD-L1细胞膜/细胞质出现棕褐色颗粒判读为阳性,未出现棕褐色颗粒为阴性,PD-L1表达按照联合阳性分数(combined positive score,CPS)进行表达分级,计数方法为PD-L1染色细胞数(肿瘤细胞、淋巴细胞、巨噬细胞)除以活的肿瘤细胞总数,再乘以100得出,根据CPS是否大于10分为CPS<10(低表达)和CPS≥10(高表达)两组。NTRK1、NTRK2、NTRK3在100倍油镜下观察FISH荧光信号,判读标准:计数100个互不重叠的肿瘤细胞核,当红色荧光信号和绿色荧光信号发生分离时,记为NTRK基因断裂。扩增阻滞突变系统-PCR严格按BRAF V600E基因突变检测试剂盒说明书进行加样和操作,均设置阳性及阴性对照。
1.4 统计学处理
采用SPSS 25.0统计软件,符合正态分布的计量资料以均数±标准差表示,不符合正态分布的计量资料以中位数和四分位数间距表示;分类变量以频数和频率表示。PD-L1与性别、年龄、病理特征等相关参数之间的关系差异比较采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
64例西藏自治区人民医院手术切除CRC患者中,男35例、女29例,男女比例为1.21∶1,年龄24~83岁,平均年龄(56.59±13.27)岁,其中38例(59.38%)年龄≤60岁,26例(40.63%)年龄>60岁,均为藏族。46例(71.88%)为结肠占位,其中24例(52.17%)位于右半结肠,22例(47.83%)位于左半结肠;18例(28.12%)为直肠占位。
2.2 病理特征
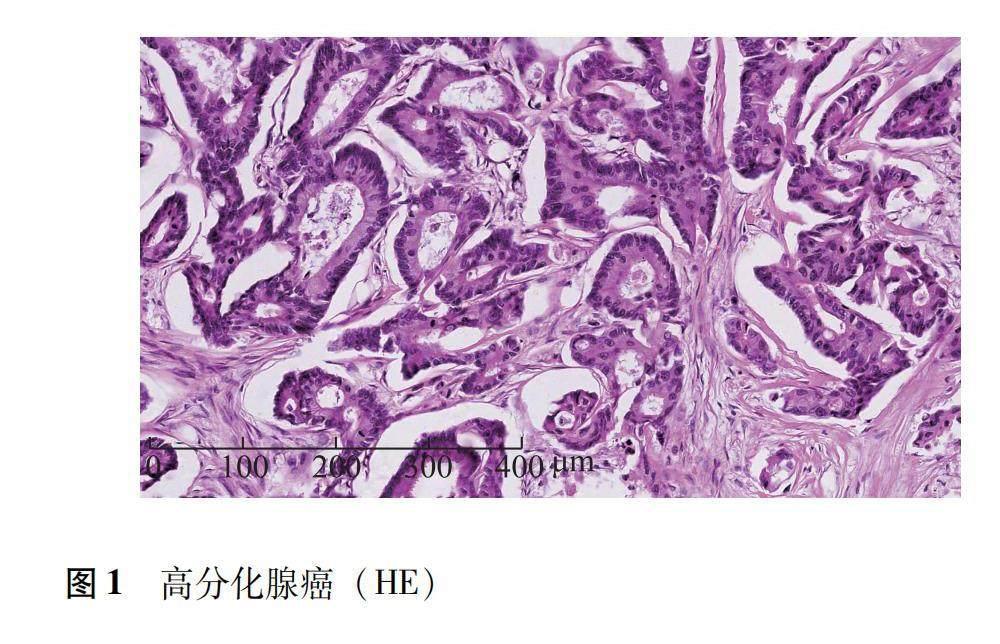
病理类型上,64例CRC病例中60例(93.75%)为腺癌,其中28例(46.67%)为高/中分化腺癌(图1、2),32例(53.33%)为低分化腺癌(图3、4);4例(6.25%)为其他类型,其中1例未分化癌、1例腺鳞癌、1例小细胞癌、1例混合性腺癌和小细胞癌。肿瘤分期上,11例(17.19%)为T1或T2期,53例(82.81%)为T3或T4期。淋巴结转移方面,24例(37.50%)出现淋巴结转移,40例(62.50%)未出现淋巴结转移。
2.3 免疫组织化学结果
64例病例均进行IHC染色,其中63例(98.44%)SMARCA4肿瘤细胞为强阳性表达,仅有1例(1.56%)SMARCA4部分肿瘤细胞表达减弱或缺失(图5);4例(6.25%)BRAF肿瘤细胞阳性表达(图6);35例(54.69%)P53为突变型表达模式(图7),其中24例(68.57%)为错义突变型表达模式,11例(31.43%)为无义突变型表达模式;1例PD-1肿瘤细胞阳性表达,其余63例PD-1肿瘤细胞均为阴性;45例(70.31%)PD-1肿瘤相关免疫细胞阳性比例分数<10%,19例(29.69%)≥10%(图8);52例(81.25%)PD-L1综合评分CPS<10(图9),12例(18.75%)CPS≥10(图10);64例病例中肿瘤细胞Ki-67增殖指数从15.00%到90.00%(平均57.89%)。此外,10例(15.63%)出现错配修复蛋白表达缺失,提示错配修复缺陷/高度微卫星不稳定性(mismatch repair deficiency/microsatellite instability-high,dMMR/MSI-H)。
2.4 基因检测结果
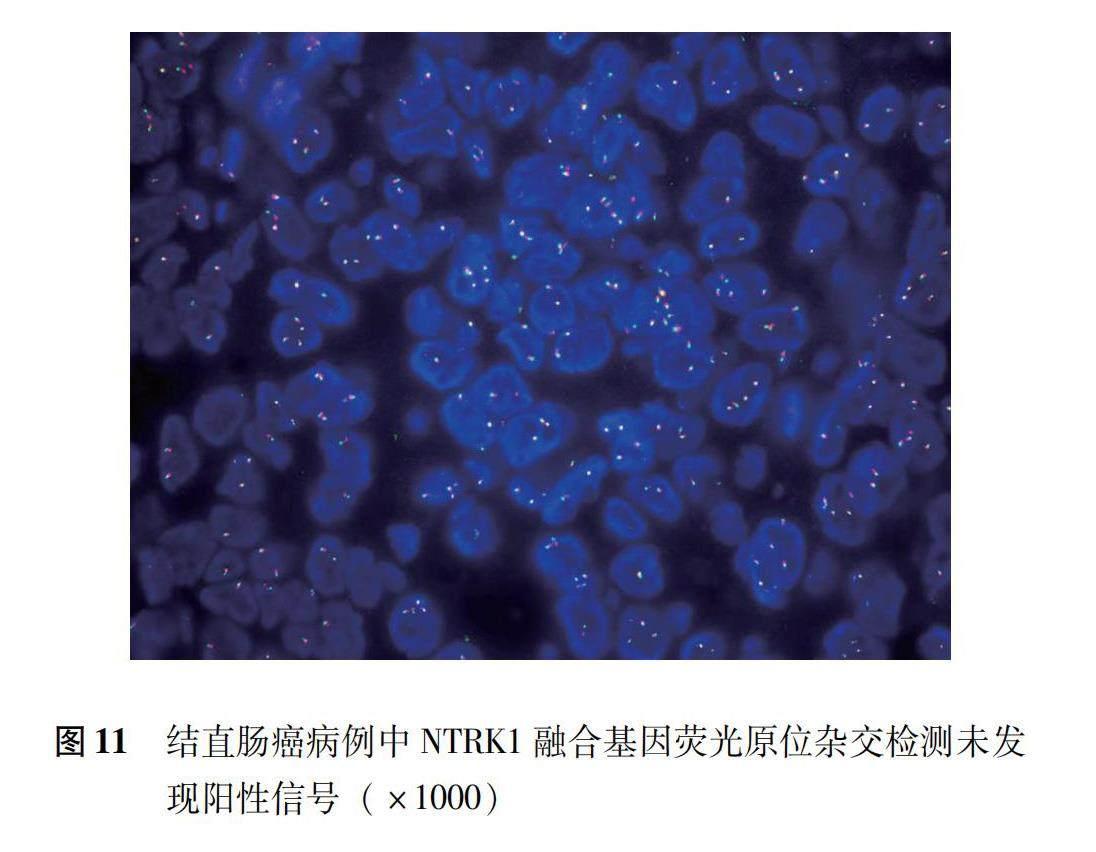
64例均进行NTRK1、NTRK2、NTRK3融合基因FISH检测,均未见阳性信号(图11)。64例均进行BRAF V600E基因突變检测,4例(6.25%)发现BRAF V600E基因突变(均为BRAF IHC阳性病例)(图12)。1例SMARCA4免疫组织化学肿瘤细胞部分表达减弱或缺失的病例进行了二代测序检测,未发现SMARCA4基因改变。
2.5 PD-L1相关因素分析结果
PD-L1 在CRC中的表达与患者年龄、性别、原发部位、分化程度、肿瘤浸润程度、淋巴结转移与否及P53突变均无相关性(P均>0.05)。与dMMR/MSI-H和PD-1的高表达呈显著正相关(χ2=10.223,P=0.001;χ2=11.979,P=0.001)(表1)。
3 讨论
CRC作为最常见的消化道恶性肿瘤之一,其发病机制尚未完全明确[9]。大部分CRC患者诊断时已发生转移,预后较差。目前CRC的传统治疗方法主要是手术、化疗和放疗,虽然显著改善了患者的预后,但CRC的死亡率、复发率并未显著降低。因此,探索新的治疗方式减少术后复发的风险和死亡率,是CRC领域的研究重点。
近年肿瘤微环境逐渐被重视,应用免疫检查点抑制剂调节免疫功能逐渐成为一种新兴的治疗方法[10]。PD-1及PD-L1作为一对负性免疫共刺激分子,在肿瘤免疫逃逸中发挥着重要作用。研究提示肿瘤间质细胞表达 PD-L1 在肿瘤免疫逃逸中发挥重要作用[11]。巨噬细胞可通过表达 PD-L1 与 T 淋巴细胞表面 PD-1 结合,导致 T 淋巴细胞对肿瘤细胞杀伤作用下降,引起肿瘤细胞免疫逃逸[12]。有研究表明PD-1/PD-L1信号通路可能通过诱导 T 细胞外周耐受、凋亡、功能衰竭以及抑制 T 细胞增殖、共刺激信号失衡等诸多方面发挥肿瘤细胞的免疫逃逸作用[13]。针对 PD-1/PD-L1 的免疫治疗在黑色素瘤、肺癌等治疗中取得疗效,被推荐应用于晚期、发生转移以及不适合一线多药物化疗的肿瘤患者[10],为晚期 CRC 患者的治疗带来希望[14]。有研究表明抗 PD-1/PD-L1 免疫治疗在dMMR/MSI-H的CRC患者治疗中有显著疗效[15]。但针对 PD-1 和 PD-L1 信号通路在CRC中的表达及其相关调控机制的研究较少,有报道PD-L1 在CRC中的表达与患者年龄、性别、发生部位、淋巴结转移情况、肿瘤浸润程度均无关,而与肿瘤分化程度相关,在低分化组中PD-L1阳性表达率明显高于高/中分化组,差异有统计学意义[16]。另有研究显示是否淋巴结转移、不同临床病理分期及不同肿瘤分化程度患者 PD-L1 蛋白的表达差异有统计学意义[17]。本研究显示PD-L1 在CRC中的表达与患者年龄、性别、原发部位、分化程度、肿瘤浸润程度、淋巴结转移与否均无相关性,与dMMR/MSI-H和高表达PD-1呈正相关,与文献[16]报道不完全一致。
CRC发病是一个在多种因素作用下基因不断突变导致细胞异常增殖的过程。近年来,CRC治疗已进入靶向治疗时代,其中表皮生长因子受体(epidermal growth factor receptor,EGFR)基因是临床上治疗CRC的主要靶点之一,而KRAS 和BRAF基因是否突变与EGFR靶向治疗密切相关[18]。2021 版《结直肠癌分子检测高通量测序中国专家共识》中强调对于确诊CRC 患者,应检测 KRAS 和 BRAF 基因情况,以便对预后进行分层,指导临床治疗[19]。准确检测 CRC 中 KRAS 及 BRAF基因状态非常关键。BRAF 基因突变主要为第11外显子及15外显子上的突变,第 15 外显子上的V600E 密码子突变约占突变类型的90%[20]。BRAF 基因突变与多种肿瘤的发生发展过程密切相关,并可作为肿瘤预后的标志物之一[21]。国内外报道的CRC中 BRAF 基因突变率为 4%~13%[22]。研究表明BRAF基因突变型CRC患者无法从抗EGFR单抗药物治疗中获益,而且BRAF基因突变的转移性CRC预后差,突变患者无进展生存期和总生存期较野生型患者明显缩短[23]。本研究BRAF V600E的突变率为 6.25%,与文献报道[24]基本相符。BRAF基因突变型CRC在患者性别、肿瘤分化程度、是否远处转移和淋巴结转移、肿瘤部位和肿瘤分期等方面的特点文献报道不一致,有研究显示BRAF基因突变与CRC肿瘤浸润深度和分化程度相关,在肿瘤浸润深度为T4和低分化的CRC患者中,BRAF基因突变率较高[25]。本研究4例 BRAF突變的病例3例为女性,4例病理类型均为低分化腺癌,浸润深度T3/T4,均可见脉管侵犯,3例有淋巴结转移,与部分文献报道[24]一致。由于样本量的局限性,笔者将继续收集病例进一步研究总结BRAF突变型CRC的特点并完善KRAS等相关基因的检测。
NTRK基因融合作为另一种重要的在多种实体瘤中表达的融合基因类型备受关注,NTRK 基因融合的患者可从 NTRK 抑制剂(拉罗替尼)中获益。笔者前期的研究显示西藏地区CRC病例中均未发现Pan-TRK蛋白的表达[26],为更准确地判读西藏地区NTRK融合基因情况,以及NTRK基因改变与Pan-TRK免疫组织化学表达之间的关系,本研究对全部64例病例均进行NTRK1、NTRK2、NTRK3融合基因检测,结果均为阴性,与笔者之前研究显示全部病例Pan-TRK免疫组织化学均为阴性结果[26]相一致,提示西藏地区NTRK基因融合的发生频率极低,Pan-TRK免疫组织化学可以作为NTRK融合基因改变的初筛方法。本研究病例数有限,后续有待扩大病例数进一步深入研究。
SMARCA4蛋白是SWI/SNF复合物,是ATP依赖性染色体重塑复合物家族成员,具有解旋酶和ATP酶活性,可以促进染色体构象发生改变,对基因转录进行调控。SWI/SNF复合物在转录调控中的功能主要为增殖和分化,相关肿瘤的形态特征表现为分化差和高度增殖,表明其主要缺陷是未能激活促进或维持终末分化的基因。SMARCA4蛋白在正常组织中表达,在胸部肉瘤、胃食管交界及胃未分化癌等多种肿瘤中可出现表达缺失[27-28]。在胃肠道SWI/SNF复合物缺失性肿瘤中,主要出现SMARCA4缺失,占63%[29]。SMARCA4表达缺失的肿瘤通常分化差,在病理形态学上多表现为去分化、小细胞和横纹肌样特征。有研究显示SMARCA4缺失型肿瘤与免疫缺陷的微环境相关,从而导致患者不能从免疫检查点抑制剂中获益[30]。SMARCA4免疫组织化学染色可能更有助于预测SMARCA4的缺失情况[31],但SMARCA4蛋白表达缺失与基因改变情况并不完全对应,大多数SMARCA4表达缺失的病例中可发现SMARCA4基因改变,出现SMARCA4基因改变不一定会出现蛋白表达缺失。本研究仅1例出现SMARCA4部分肿瘤细胞的表达减弱或缺失,二代测序检测并未发现其基因突变,该病例病理类型为高分化腺癌,并没有去分化和横纹肌样的形态学特点,目前文献缺乏这种情况的相关报道,如何解释这种现象,需要积累类似病例并进一步深入研究。
P53是一种抑癌基因,其在正常细胞中可以诱导细胞周期阻断在G0/G1期,使细胞程序性凋亡,发生突变时失去监管作用,引起细胞周期异常,出现细胞增殖过多、凋亡减少,从而促进肿瘤的进展[32]。P53抑癌基因是人类研究最早、最多且最易发生突变的肿瘤相关基因之一,约半数的恶性肿瘤P53基因突变,有报道P53在CRC中的突变率为40%~50%[33]。P53基因突变时出现P53蛋白的异常表达,文献报道可以出现以下多种异常表达模式,主要表现为胞核异常表达,胞核异常表达有以下几种模式,一种为全部肿瘤细胞均不表达P53蛋白,为无义突变型表达模式;一种超过60%的肿瘤细胞强阳性表达,为错义突变型模式[6-7],少数病例可以出现胞质异常表达[8]。有报道在神经内分泌肿瘤可以出现局部区域的弥漫强阳性表达,也检测到P53基因突变[34]。本研究未观察到局部胞核弥漫强阳性表达和胞质表达两者情况。本研究54.69%病例出现P53突变型表达,以错义突变型表达模式为主,占2/3以上。CRC中P53与PD-L1表达情况的相关研究较少,有研究显示PD-L1水平与P53突变情况无关,也有研究显示P53野生型CRC中PD-L1表达水平较高,提示P53野生型CRC患者可能具有更好的免疫治疗前景[33],本研究显示P53突变与PD-L1表达情况无相关性。
综上,西藏地区CRC中较少出现SMARCA4表达减弱或缺失及NTRK1、NTRK2、NTRK3融合基因改变,少数病例出现BRAF V600E基因突变,Pan-TRK和BRAF免疫组织化学可作为NTRK融合基因及BRAF基因突变的初筛方法。dMMR/MSI-H的病例中更容易出现PD-L1高表达,这部分患者有望获益于免疫治疗。P53突变与PD-L1的表达无相关性,PD-1的高表达和PD-L1的高表达呈显著正相关。
利益冲突 所有作者声明无利益冲突
作者贡献声明 罗含欢:起草论文,参与研究选题、设计,按编辑部的修改意见进行修改,对病理切片、免疫组织化学切片进行阅片及结果判定;刘彬云:负责相关检测工作及数据整理;霍真:参与研究选题、设计,对重要学术性内容做出关键性修订,对拟发表的文稿作最后审阅和定稿,对病理切片、免疫组织化学切片进行阅片及结果判定;边巴扎西:负责临床相关数据收集、分析;王倩:负责病理数据收集及整理;多布啦:负责病理图片采集和病理蜡块收集;尼玛卓玛:负责病理图片采集和病理切片整理;达珍:负责病理相关资料收集,病理切片收集归档;王寒:负责病理相关数据收集、统计分析;郭平平:负责相关检测工作
参 考 文 献
[1]Siegel RL,Miller KD,Fuchs HE,et al.Cancer statistics,2021[J].CA Cancer J Clin,2021,71(1):7-33.DOI:10.3322/caac.21654.
[2]International Agency for Research on Cancer.Latest global cancer data:cancer burden rises to 19.3 million new cases and 10.0 million cancer deaths in 2020[EB/OL].[2021-01-10].https://www.iarc.fr/faq/latest-global-cancer-data-2020-qa/.
[3]Di J,Yang H,Jiang B,et al.Whole exome sequencing reveals inter tumor heterogeneity and distinct genetic origins of sporadic synchronous colorectal cancer[J].Int J Cancer,2018,142(5):927-939.DOI:10.1002/ijc.31140.
[4]Druliner BR,Ruan X,Sicotte H,et al.Early genetic aberrations in patients with sporadic colorectal cancer[J].Mol Carcinog,2018,57(1):114-124.DOI:10.1002/mc.22738.
[5]WHO Classification of Tumours Editorial Board.WHO classification of tumours of the digestive system [M].Lyon:International Agency for Research on Cancer,2019.
[6]白杨,吴林林,安建多,等.结直肠癌组织中KRAS、NRAS、BRAF、PIK3CA基因突变与临床病理特征及MMR蛋白、p53蛋白表达的相关性研究[J].诊断病理学杂志,2021,28(3):183-188.DOI:10.3969/j.issn.1007-8096.2021.03.005.
[7]Kim KM,Ahn AR,Park HS,et al.Clinical significance of p53 protein expression and TP53 variation status in colorectal cancer[J].BMC Cancer,2022,22(1):940.DOI:10.1186/s12885-022-10039-y.
[8]Jansson A,Gentile M,Sun XF.P53 mutations are present in colorectal cancer with cytoplasmic p53 accumulation[J].Int J Cancer,2001,92(3):338-341.DOI:10.1002/ijc.1189.
[9]郭濤,辛振,王富豪.卵泡素样3基因在结肠癌组织中的表达及其与预后的关系[J].实用医学杂志,2021,37(22):2871-2876.DOI:10.3969/j.issn.1006.
[10]Shen X,Zhao B.Efficacy of PD-1 inhibitors and PD-L1 expression status in cancer:meta-analysis[J].BMJ,2018(362):K3529.DOI:10.1136/bmj.k3529.
[11]Noguchi T,Ward JP,Gubin MM,et al.Temporally distinct PD-L1 expression by tumor and Host cells contributes to immune escape[J].Cancer Immunol Res,2017,5(2):106-117.DOI:10.1158/2326-6066.CIR-16-0391.
[12]Sharma P,Hu-Lieskovan S,Wargo JA,et al.Primary,adaptive,and acquired resistance to cancer immunotherapy[J].Cell,2017,168(4):707-723.DOI:10.1016/j.cell.2017.01.017.
[13]邢玉斐,潘雪,钱斌,等.晚期非小细胞肺癌患者外周血PD-1和PD-L1分子的表达及其意义[J].中华医学杂志,2019,99(2):111-114.DOI:10.3760/cma.j.issn.0376-2491.2019.02.007.
[14]乔梦,蒋涛,赵沙,等.PD-1/PD-L1抑制剂联合其他方式治疗在非小细胞肺癌治疗中的研究进展[J].肿瘤,2017,37(6):663-669.DOI:1000-7431(2017) 06-0663-07.
[15]Oliveira AF,Bretes L,Furtado I.Reviews of PD-1/PD-L1 inhibitors in metastatic Dmmr/MSI-H colorectal cancer[J].Front Oncol,2019(9):396.DOI:10.3389/fonc.2019.00396.
[16]王超,郑绘霞.MSI,PD-L1及IL-6在结直肠腺癌中的表达及意义[J].中国医学创新,2018,15(26):36-40.DOI:10.3969/j.issn.1674-4985.2018.26.009.
[17]刘宗航,史丽芸,郑立锋,等.PD-1/PD-L1在结直肠癌组织中的表达及其临床意义[J].中国临床研究,2019,32(10):4.DOI:10.13429/j.cnki.cjcr.2019.10.015.
[18]Zhai Z,Yu X,Yang B,et al.Colorectal cancer heterogeneity and targetedtherapy:clinical implications,challenges and solutions for treatment resistance[J].Semin Cell Dev Biol,2017(64):107-115.DOI:10.1016/j.semcdb.2016.08.033.
[19]陈功,王峰.结直肠癌分子检测高通量测序中国专家共识[J].临床肿瘤杂志,2021,26(3):253-264.DOI:10.3969/j.issn.1009-0460.2021.03.011.
[20]陈海霞,何亚楠,王维娜,等.结直肠癌组织中KRAS和BRAF基因突变与临床病理特征及预后的关系[J].现代肿瘤医学,2021,29(4):626-631.DOI:10.3969/j.issn.1672-4992.2021.04.017.
[21]Palomba G,Doneddu V,Cossu A,et al.Prognostic impact of KRAS,NRAS,BRAF,and PIK3CA mutations in primary colorectal carcinomas:a population-based study[J].J Transl Med,2016,14(1):292.DOI:10.1186/s12967-016-1053-z.
[22]Lai E,Pretta A,Immpera V,et al.BRAF-mutant colorectal cancer,a different breed evolving[J].Expert Rev Mol Diagn,2018,18(6):499-512.DOI:10.1080/14737159.2018.1470928.
[23]Ye ZL,Qiu MZ,Tang T,et al.Gene mutation profiling in Chinese colorectal cancers patients and its association with clinicopathological characteristics and prognosis[J].Cancer Med,2020,9(2):745-756.DOI:10.2139/ssrn.3405556.
[24]司马学琴,苏延停,曾智.二代测序检测结直肠癌KRAS和BRAF基因突变与预后的关系[J].实用医学杂志,2022,38(21):2670-2675.DOI:10.3969/j.issn.1006-5725.2022.21.007.
[25]林志坚,徐韫健,温广明.KRAS,NRAS,BRAF及PIK3CA基因突变与结直肠癌患者临床病理特征的关系[J].中华临床实验室管理电子杂志,2021,9(4):5.DOI:10.3877/cma.j.issn.2095-5820.2021.04.005.
[26]罗含欢,霍真,边巴扎西,等.西藏地区手术切除结直肠癌病理类型及错配修复蛋白、人表皮生长因子受体2、Pan-TRK表达和Eostein-Barr病毒感染情况分析[J].中国医学科学院学报,2023,45(3):422-428.DOI:10.3881/j.issn.1000-503X.15343.
[27]郑茗嘉,郑强,王悦,等.SMARCA4缺失的原发性胸部肉瘤的临床病理特征[J].中华病理学杂志,2019,48(7):6.DOI:10.3760/cma.j.issn.0529-5807.2019.07.007.
[28]张婉秋,吴海波.胃食管交界和胃的SMARCA4(BRG1)缺失型未分化癌临床病理学分析[J].诊断病理学杂志,2023,30(3):248-252.DOI:10.3969/j.issn.1007-8096.2023.03.010.
[29]Chang B,Sheng W,Wang L,et al.SWI/SNF complex-deficient undifferentiated carcinoma of the gastrointestinal tract:clinicopathologic study of 30 cases with an emphasis on variable morphology,immune features,and the prognostic significance of different SMARCA4 and SMARCA2 subunit deficiencies[J].Am J Surg Pathol,2022,46(7):889-906.DOI:10.1097/PAS.0000000000001836.
[30]Velut Y,Decroix E,Blons H,et al.SMARCA4-deficient lung carcinoma is an aggressive tumor highly infiltrated by FOXP3+cells and neutrophils[J].Lung Cancer,2022(169):13-21.DOI:10.1016/j.lungcan.2022.05.001.
[31]Armon S,Hofman P,Ilié M.Perspectives and issues in the assessment of SMARCA4 deficiency in the management of lung cancer patients[J].Cells,2021,10(8):1920.DOI:10.3390/cells10081920.
[32]施一翔,劉敬禹,江旭,等.Ki-67、p53及拓扑异构酶-Ⅱ对结直肠癌肝转移患者预后的价值[J].海军医学杂志,2020,41(1):51-55.DOI:10.3969/j.issn.1009-0754.2020.01.016.
[33]常守凤,党雅梅,张晓玲,等.结直肠癌组织的PD-L1水平和P53突变情况及临床意义分析[J].临床肿瘤学杂志,2022,27(12):1119-1123.DOI:1009-0460(2022) 12-1119-05.
[34]Li J,Wang J,Su D,et al.p53 immunohistochemistry patterns are surrogate biomarkers for TP53 mutations in gastrointestinal neuroendocrine neoplasms[J].Gastroent Res Pract,2021:2510195.DOI:10.1155/2021/2510195.
(收稿日期:2023-09-18)

