微波消融在潜在可切除的结直肠癌伴同时性多发肝转移中的临床应用
韩磊 武雪亮 郭飞 郗宇宁 常晓燕 张春泽 张剑锋 马鹏程
摘要:目的 分析微波消融在初始評估为潜在可切除的结直肠癌伴同时性多发肝转移中的临床效果。方法 选取2018年10月1日至2020年10月1日河北北方学院附属第一医院普通外科、北京中医药大学东直门医院中西医肿瘤微创医学中心、河北医科大学第四医院外二科收治的潜在可切除的结直肠癌伴同时性多发肝转移患者,统计其一般资料、病理特征、治疗方式和临床疗效,根据治疗方式,分为转化治疗+腹腔镜结直肠癌根治术+肝病灶切除组(手术切除组)和转化治疗+腹腔镜结直肠癌根治术+肝病灶微波消融组(微波消融组),比较两组患者相关手术指标(手术时间、术后肛门首次排气时间、住院时间等)和术后并发症(吻合口狭窄、吻合口出血、切口感染等),同时进行生存期随访,包括总生存期和无疾病生存期,绘制生存曲线,分析两种治疗方式的临床疗效。结果 共纳入潜在可切除的结直肠癌伴同时性多发肝转移患者198例,经FOLFOX或FOLFIRI方案行新辅助化疗成功后66例,其中,手术切除组30例,均达到了根治效果,微波消融组36例,共消融57个肿瘤;54个肿瘤在第1次消融后达到完全消融(94.74%),后经再次消融后均达到无疾病证据;微波消融组患者手术时间、术中出血量、术后首次排气时间、进流质饮食时间、住院时间及住院费用均显著少于手术切除组(P均<0.001);微波消融组患者术后视觉模拟评分法疼痛评分显著低于手术切除组(P<0.001),切口感染(P=0.740)、吻合口漏(P=1.000 )、吻合口狭窄(P=1.000)等并发症两组比较差异均无统计学意义;总生存时间(P=0.191)和无疾病生存时间(P=0.934)两组患者差异无统计学意义;结论 对于初始评估为潜在可切除的结直肠癌伴同时性多发肝转移患者,经转化治疗后两组均安全、有效,且有着相似的生存结局,但微波消融组在术后恢复、经济及耐受性方面更具优势,建议临床推广。
关键词:微波消融;潜在可切除;结直肠癌伴同时性多发肝转移;诊疗;生存预后
中图分类号: R735.3文献标识码: A文章编号:1000-503X(2024)02-0161-08
DOI:10.3881/j.issn.1000-503X.15900
Clinical Application of Microwave Ablation in Potentially Resectable Colorectal Cancer With Simultaneously Multiple Liver Metastases
HAN Lei1,WU Xueliang1,2,GUO Fei1,XI Yuning1,CHANG Xiaoyan3,ZHANG Chunze4,ZHANG Jianfeng5,MA Pengcheng6
1Department of General Surgery,2Insistute of Oncology,The First Affiliated Hospital of Hebei North University,Zhangjiakou,Hebei 075000,China
3Center of Minimally Invasive Therapy in Oncology of Traditional Chinese and Western Medicine,Dongzhimen Hospital of Beijing University of Chinese Medicine,Beijing 100029,China
4Department of Anus and Intestine Surgery,Peoples Hospital of Tianjin,Tianjin 300000,China
5Second Department of General Surgery,The Fourth Hospital of Hebei Medical University,Shijiazhuang 050000,China
6School of Mathematics and Computing Science,Guangxi Center for Applied Mathematics,Guilin University of Electronic Technology,Guilin,Guangxi 541200,China
Corresponding author:WU Xueliang Tel:15530399696,E-mail:wxlwlk@163.com
ABSTRACT:Objective To analyze the clinical efficacy of microwave ablation in the colorectal cancer with simultaneously multiple liver metastases that was initially evaluated as potentially resectable.Methods The patients with potentially resectable colorectal cancer with simultaneous multiple liver metastases treated in the Department of General Surgery of the First Affiliated Hospital of Hebei North University,the Center of Minimally Invasive Therapy in Oncology of Traditional Chinese and Western Medicine in Dongzhimen Hospital of Beijing University of Chinese Medicine,and the Second Department of General Surgery in the Fourth Hospital of Hebei Medical University from October 1,2018 to October 1,2020 were selected in this study.The general data,pathological features,treatment methods,and clinical efficacy of the patients were collected.According to the treatment methods,the patients were assigned into a surgical resection group(conversion therapy+laparoscopic primary resection+hepatectomy)and a microwave ablation group(conversion therapy+laparoscopic primary resection+microwave ablation).The surgical indicators(operation duration,time to first postoperative anal exhaust,hospital stay,etc.)and postoperative complications(anastomotic stenosis,anastomotic hemorrhage,incision infection,etc.)were compared between the two groups.The survival period was followed up,including the overall survival period and disease-free survival period,and the survival curves were drawn to analyze the clinical efficacy of the two treatment regimens.Results A total of 198 patients with potentially resectable colorectal cancer with simultaneous multiple liver metastases were included in this study.Sixty-six patients were cured by neoadjuvant chemotherapy(FOLFOX or FOLFIRI),including 30 patients in the surgical resection group and 36 patients in the microwave ablation group(with 57 tumors ablated).After the first ablation,54(94.74%)tumors achieved complete ablation,and all of them reached no evidence of disease status after re-ablation.The microwave ablation group had shorter operation duration,less intraoperative blood loss,shorter time to first postoperative anal exhaust,shorter time of taking a liquid diet,shorter hospital stay,and lower hospitalization cost than the surgical resection group(all P<0.001).In addition,the microwave ablation group had lower visual analogue scale score(P<0.001)than the surgical resection group.The incidences of complications such as incision infection(P=0.740),anastomotic fistula(P=1.000),and anastomotic stenosis(P=1.000),the overall survival period(P=0.191),and the disease-free survival period(P=0.934)showed no significant differences between the two groups.Conclusions For patients with colorectal cancer with simultaneous multiple liver metastases initially assessed as potentially resectable,laparoscopic primary resection+surgical resection/microwave ablation after conversion therapy was safe,effective,and had similar survival outcomes.Microwave ablation outperformed surgical resection in postoperative recovery,economy,and tolerability,being worthy of clinical promotion.
Key words:microwave ablation;potentially resectable;colorectal cancer with simultaneously multiple liver metastases;diagnosis and treatment;survival and prognosis
Acta Acad Med Sin,2024,46(2):161-168
结直肠癌远处转移最主要的靶器官是肝脏和肺[1],结直肠癌肝转移是结直肠癌治疗中的难点,15%~25%结直肠癌患者在确诊时即合并有肝转移,即同时性肝转移,而另15%~25%的患者将在结直肠癌原发灶根治术后发生肝转移,即异时性肝转移,其中绝大多数的肝转移灶初始无法获得根治性切除,需要进行一系列的转化治疗[2-4]。这类病变患者总生存期一般较短,有报道未经治疗的肝转移患者的中位生存期仅6.9个月,无法切除的肝转移患者的5年生存率低于5%,而肝转移灶若能完全切除或可以达到无疾病证据(no evidence of disease,NED)状态,其中位生存期为35个月,5年生存率亦可达到30%~57%[5-6]。2018年以前中国结直肠癌肝转移指南中将结直肠癌肝转移的治疗目标定为显微镜下无残留切除(resection 0,R0),要求通过外科手术将肝脏转移灶完全切除,并保证一定的切缘,而在2018年之后的相关诊疗共识,尤其是2023年版的中国结直肠癌诊疗规范和中国结直肠癌肝转移诊断和综合治疗指南中倾向于将R0切除转变为NED,对于结直肠癌肝转移患者,NED较原来的R0切除在特定人群上有了更多的扩展[7-9]。因此,对这类结直肠癌伴肝转移(colorectal cancer liver metastasis,CRLM)患者需要在多学科协作理念指导下,通过以外科为主,联合肿瘤内科、放射治疗、介入、影像(人工智能)、病理等相关学科,进行全面系统地围手术期评估,个性化地制定治疗计划,开展相应的综合治疗,包括手术切除、化学治疗、放射治疗、靶向治疗、免疫治疗、消融、介入栓塞治疗等,一站式或分次处理原发灶和转移灶,从而综合提高CRLM患者手术切除率和5年生存率[10-12]。
近年,热消融技术逐步进入临床医师的视野,相对于肿瘤负荷过大、肿瘤解剖位置不佳、毗邻重要的血管或胆道结构和肝外疾病或其他合并症而不能切除的肝转移病灶,消融以其在保留肝实质、可重复干预、住院时间明显缩短、并发症发生率降低等诸多方面的优势,逐步在临床普及,从而提高了转化治疗后的NED率和生存期[13-14]。因此,本研究回顾性收集整理3家大型区域综合性医院初诊为CRLM患者的发病、诊疗情况,尤其是初始评估为潜在可切除的多发肝转移患者,分析其转化治疗成功后行结直肠癌原发灶+微波消融的临床效果,并与原发灶+肝转移灶手术切除比较,为不适合或无法耐受肝病灶切除手术的患者提供有效、安全和经济的治疗方案。
1 资料和方法
1.1 资料来源
回顾性分析2018年10月1日至2020年10月1日河北北方学院附属第一医院普通外科、北京中医药大学东直门医院中西医肿瘤微创医学中心、河北医科大学第四医院外二科收治的CRLM患者。详细记录患者的一般情况,包括:年龄、性别、临床分期(根据美国癌症联合委员会第8版分期标准[15])、病理类型、分化程度、肠癌肝转移复发风险评估、转移瘤数量、直径、肿瘤标志物、手术方式、基因检测结果、转化治疗方案、手术切除和微波消融等。本研究经河北北方学院附属第一医院(伦理审查编号:K2022013)、北京中医药大学东直门医院(伦理审查编号:KJ2022CX045)、河北医科大学第四医院(伦理审查编号:2022MEC025)伦理委员会审核通过,豁免知情同意。
1.2 纳入标准
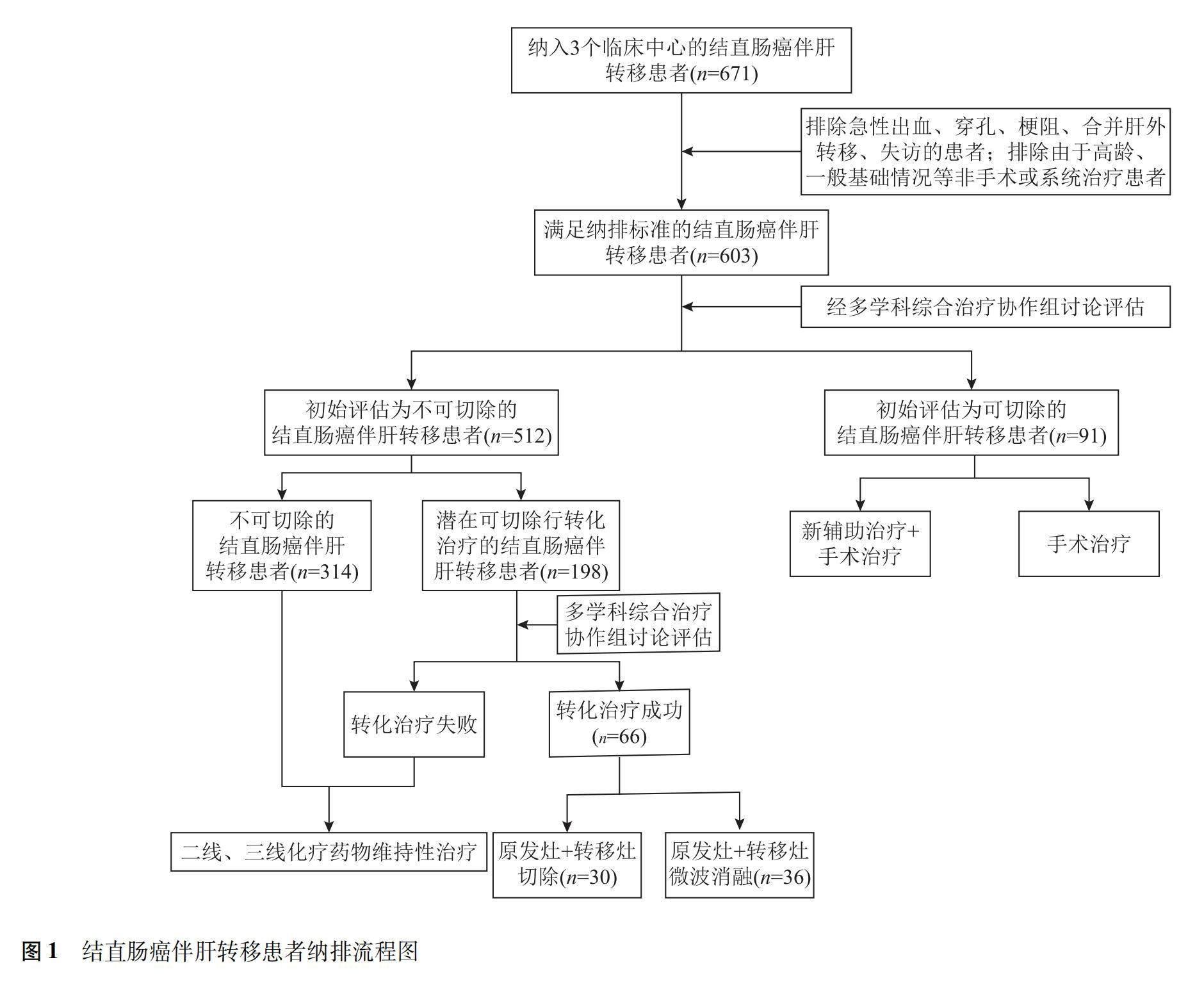
(1)必须由结肠镜活检病理确诊为腺癌;(2)经腹、盆腔CT平扫+增强、直肠MRI平扫+增强诊断为伴同时性多发肝转移;(3)排除急性出血、穿孔、梗阻等行急诊手术;(4)病例资料详实,包括基因检测、蛋白等,有完整的随访记录;(5)必须由院内专业的多学科综合治疗团队(multidisciplinary team,MDT)讨论决定治疗方案并全程追踪。
1.3 排除标准
(1)经头、胸部平扫+增强CT或其他检查发现存在肺转移、颅脑转移等;(2)一般情况较差,难以耐受系统性治疗;(3)治疗过程中,中断治疗或放弃治疗等;(4)对经MDT讨论确定的治疗方案不执行、不配合或拒绝;(5)患者病例资料不完整,失访。
1.4 治疗原则
将最终纳入的病例通过头、胸、腹、盆腔CT平扫+增强,盆腔MRI平扫+增强,直肠超声检查,经MDT讨论分为初始评估可切除和初始评估不可切除两组,对于初始评估可切除的患者行原发灶并肝转移灶1期切除或新辅助治疗后行1期切除,而对于初始评估不可切除的患者在MDT讨论下分为不可切除和潜在可切除(即患者当时暂不能进行手术,但是通过MDT评估,有潜在可切除机会),在MDT理念指导下,纳入初始评估为潜在可切除的结直肠癌伴同时性多发肝转移患者,参考精准的临床分期和基因检测、相关肿瘤标志物等结果,确定转化治疗方案:FOLFOX方案(奥沙利铂85 mg/m2,1次/d;亚叶酸钙400 mg/m2,1次/d;氟尿嘧啶400 mg/m2,1次/d;氟尿嘧啶2400 mg/m2,46 h微量泵泵入,1次/2周)±靶向治疗(右半结肠癌或左半结肠癌伴RAS基因突变者加用贝伐珠单抗5 mg/kg,1次/2周;左半結肠癌伴RAS基因野生型加用西妥昔单抗初始剂量400 mg/m2,其后剂量250 mg/m2,1次/周)、FOLFIRI方案(伊立替康180 mg/m2,1次/d;亚叶酸钙400 mg/m2,1次/d;氟尿嘧啶400 mg/m2,1次/d;氟尿嘧啶2400 mg/m2,46~48 h微量泵泵入,1次/2周)±靶向治疗(同前),后经MDT讨论评估为转化治疗成功的患者行原发灶+手术切除肝转移灶、微波消融治疗等,而对于评估为转化治疗失败的患者,根据患者的意愿继续行全身系统治疗[7-8]。
1.5 生存期随访
所有结直肠癌伴同时性多发肝转移均纳入各中心结直肠癌数据库,由各中心团队专业的随访人员通过门诊服务、电话或微信跟踪,参考复查情况,包括体格检查、血清癌胚抗原、甲胎蛋白、外周血细胞分析、生化检查、肝肾功能、胸腹部CT、电子肠镜等结果,将生存数据收集整合,包括总生存期(overall survival,OS)和无疾病生存期(disease free survival,DFS),最终随访时间为2023年10月1日。
1.6 统计学处理
采用SPSS 26.0软件进行统计分析,符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验,不符合正态分布的计量资料以M(IQR)表示,组间比较采用秩和检验;计数资料以例数和百分数表示,组间比较采用卡方检验;生存率采用Kaplan-Meier曲线进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况和病理特征
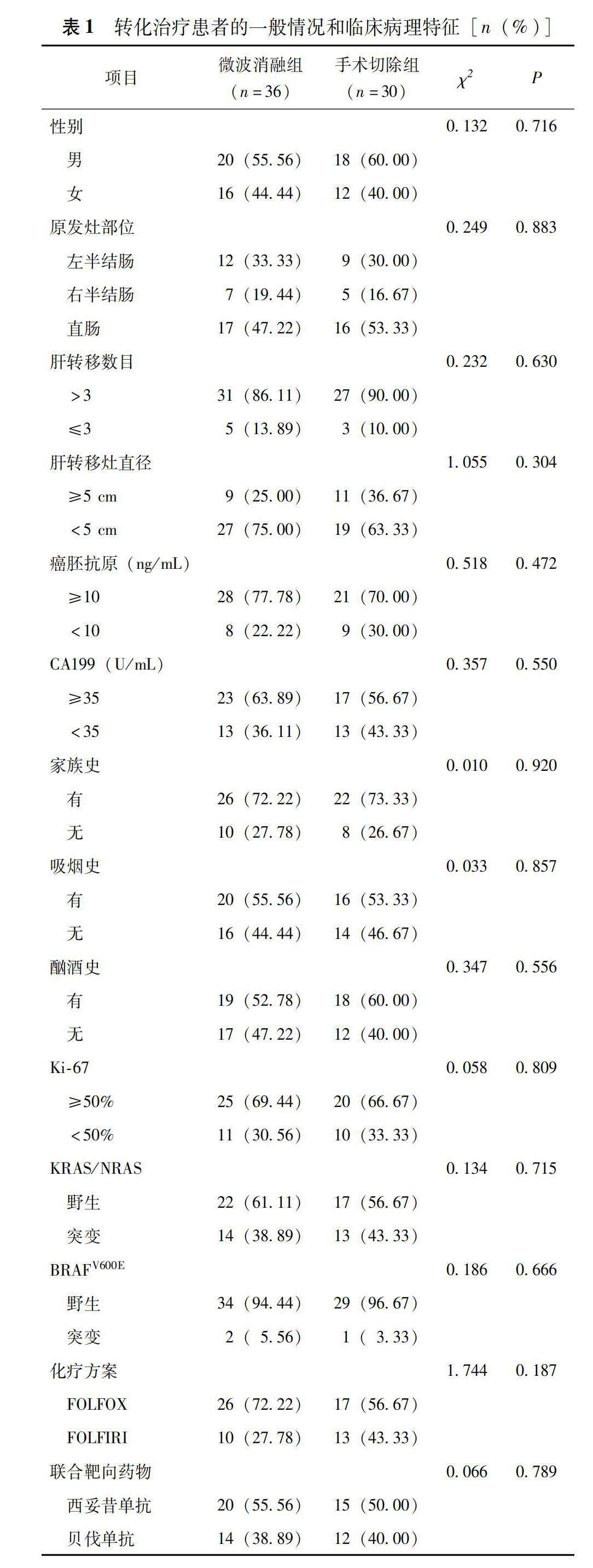
共纳入CRLM患者671例,排除急诊手术、肝外转移、失访等患者,最终纳入198例潜在可切除肝转移灶的结直肠癌伴同时性多发肝转移患者,行转化治疗,经MDT讨论评估,共66例转化治疗成功,30例经手术切除,年龄(58.92±7.74)岁;36例行微波消融(含多次消融),共消融57个肿瘤,54个肿瘤在第1次消融后达到完全消融(94.74%),年龄(59.45±7.88)岁,均达到NED状态(图1)。手术切除组与微波消融组患者性别、家族史、吸烟史、原发灶部位、肝转移灶数量、肝转移灶直径、血清癌胚抗原、糖类抗原199、转化基因RAS等基因状态、化学治疗+靶向治疗方案等差异均无统计学意义(P均>0.05)(表1)。
2.2 围手术期相关指标及治疗费用
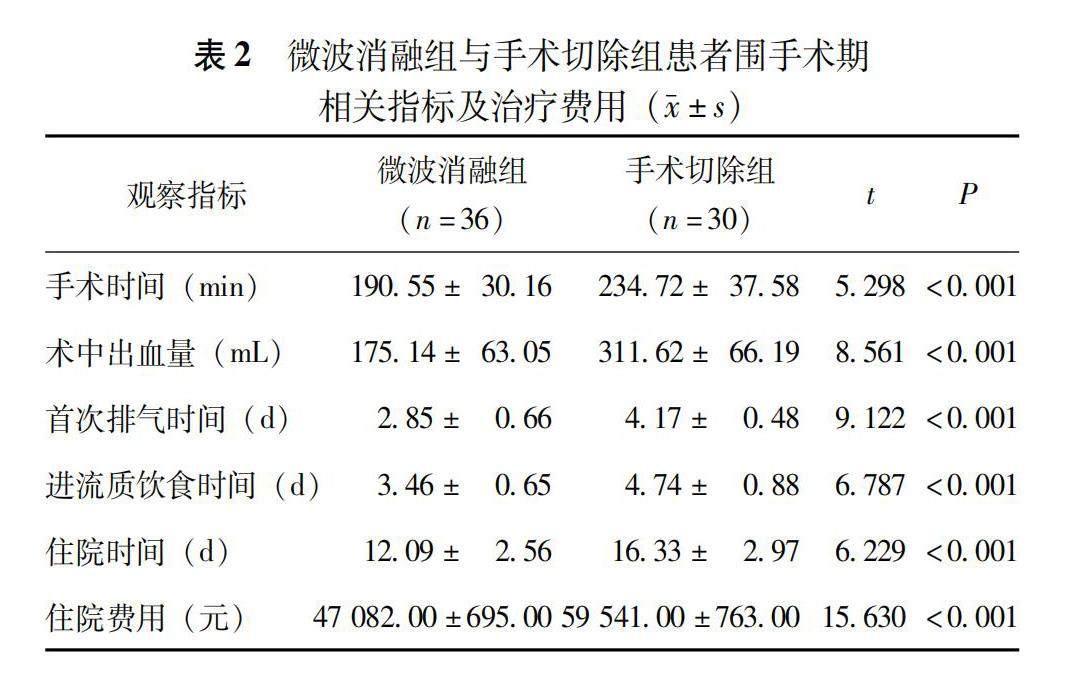
微波消融组患者手术时间、术中出血量、术后首次排气时间、进流质饮食时间、住院时间及住院费用均显著少于手術切除组(P均<0.001)(表2)。
2.3 术后视觉模拟评分法评分及并发症情况
微波消融组患者术后视觉模拟评分法评分显著低于手术切除组(t= 28.061,P<0.001),两组患者在切口感染、吻合口狭窄、吻合口漏、输尿管损伤等并发症发生率方面差异均无统计学意义(P均>0.05)(表3)。
2.4 随访情况
末次随访时间为2023年10月1日,中位随访时间为25.0个月。平均OS为(29.68±5.35)个月,其中微波消融组OS为(29.23±5.31)个月,手术切除组OS为(31.07±6.25)个月。平均DFS为(17.06±4.04)个月,其中微波消融组DFS为(16.83±3.89)个月,手术切除组DFS为(17.25±4.11)个月。两组OS(P=0.191)、DFS(P=0.934)差异均无统计学意义,即两组患者在预后方面差异均无统计学意义(图2、3)。
3 讨论
2023版中国结直肠癌肝转移诊断和综合治疗指南指出,对于CRLM患者应采取MDT治疗模式,结直肠肿瘤的MDT应该由普通外科(胃肠、肝胆胰)、肿瘤内科、消化内科、放疗科、病理科、营养科、影像科、内镜科等资深专家[16-18],根据患者病情,结合患者的心理、家庭、社会影响等因素,共同制定治疗目标、治疗措施,从而实现个体化和精准化治疗[19-20]。对于CRLM患者,首先要根据患者肝转移灶的部位、数目和大小,评估是否可以与原发灶一站式切除,对于初始评估不可切除的CRLM患者,建议根据一般状况,包括患者基础病情况、营养、体质、免疫、临床风险评分、基因检测、原发灶部位等,制定转化治疗方案,对于有潜在NED可能的CRLM患者进行的转化治疗尤其重要,转移灶的早期退缩更是预后的重要参考指标之一[21-22]。
对于转化治疗有效或成功的CRLM患者,手术完全切除肝转移灶仍是目前能治愈CRLM患者的最佳方式,故符合条件的患者均应在适当的时候接受手术治疗。部分最初肝转移灶无法切除的患者经治疗后转化为可切除病灶时亦建议行手术治疗。而对于手术切除难度较大的个别转移灶,预计术后残余肝脏容积不够、左右肝均多发转移不宜手术的或经转化治疗后转移灶明显退缩但仍不适合手术切除,或患者自身状况无法承受手术风险者,可考虑局部毁损治疗,从而使更多的患者有机会达到NED状态,提高5年生存率[23-24]。目前此类方法应用较多的是消融,包括射频和微波,微波传导不受组织干燥碳化的限制,使肿瘤内部在较短的时间内就可产生较高的温度和更大的消融带,因而相较于射频消融,其肿瘤细胞的坏死更彻底,且不会对其他肝组织造成创伤,安全性良好。目前,国内对手术切除和消融局部毁损治疗临床疗效的研究较少,部分研究仅涉及单纯肝转移灶的处理和原发灶+转移灶的1期处理,对于结直肠癌多发肝转移经转化治疗后的一站式处理临床相关报道较少。
本研究通过严格筛选,入组的66例经转化治疗后的结直肠癌伴同时性多发肝转移患者分别给予腹腔镜结直肠癌根治术+肝病灶切除和腹腔镜结直肠癌根治术+微波消融治疗,相较于手术切除组,微波消融组的手术时间和住院时间明显缩短、术中出血量减少、术后恢复较快,同时住院费用降低;而且,术后患者疼痛评分降低,尽管部分微波消融组患者并不能一次完全处理所有转移病灶,需要术后经CT引导多次微波消融,但最终均达到了NED状态,且两组患者整体并发症及生存预后差异均无统计学意义。
目前,腹腔镜结直肠癌切除术的优势已被充分证实,结合笔者中心发现,对位于肝脏内部的转移灶,可在术中利用特有的腔镜超声引导下行转移灶微波消融。对于位于肝脏表面的转移灶,可以在腹腔镜直视下直接消融,尤其对于临近膈肌、横结肠、胆囊、胃等重要组织、器官的转移灶,可以在腹腔镜直视下有效隔离,减少甚至避免其受到消融带来的机械、物理损伤。对于术中肝转移灶消融后的出血、漏胆可及时发现、处理,降低术后并发症发生率;此外,微波消融可有效避免术中正常肝脏组织的牵拉,减轻机体应激反应,亦提高了手术的安全性;再者,肿瘤细胞能够通过消融直接被吸收入血,可成为内源性肿瘤抗原,抑制机体免疫逃逸,激活抗肿瘤免疫反应。笔者团队观察到部分肝多发转移病例中,较大的肝转移灶消融后再次复查时小的肝转移灶也达到影像学缓解;相较于手术切除肝转移灶,微波消融仅需消融肝转移灶及其周围0.5~1.0 cm安全消融边界,可以保留更多的正常肝组织,具有可多次、重复性消融的优势,减少了剩余肝组织少、肝功能衰竭等并发症的发生风险。另外,笔者中心采取同期行腹腔镜结直肠癌根治术+肝转移灶微波消融/切除术的一站式治疗模式,避免了目前国内外诊疗中心先于胃肠外科行腹腔镜结直肠癌根治术,待患者病情恢复或出院后再转至肝胆外科或介入外科行肝转移灶消融或切除带来的二次或多次麻醉、手术、住院时间长、治疗费用高、患者身心压力大等弊端,对患者术后生活质量的改善和生存时间的延长均有重要意义。Song等[25]纳入62例行微波消融和34例行手术切除的CRLM患者,比较临床结局,结果显示微波消融组住院时间和住院费用均明显低于手术切除组,且微波消融组中出现严重并发症的案例十分少见,两组OS和DFS差异亦无统计学意义。因而,证实消融治疗可能是治疗不能手术的CRLM患者的一种安全、经济、有效的方法,且在一定程度上比肝切除更有优势。Hu等[26]回顾性分析24例结直肠癌根治性肝转移患者(微波消融组)和12例结直肠癌根治性肝切除术(手术切除组)的临床资料,结果显示微波消融组患者共消融53个肿瘤,52个肿瘤在第1次消融后达到完全消融(98.1%),微波消融组无严重并发症,长期生存率与手术切除组差异无统计学意义。因而证实结直肠癌肝转移微波消融术在保证疗效的同时避免了大范围肝切除,操作安全、可行、可重复。
综上,腹腔镜下结直肠癌根治术联合肝转移灶微波消融治疗的一站式治疗模式在治疗潜在可切除的结直肠癌伴同时性多发肝转移患者中有明确的临床疗效,且安全性较好,创伤较轻,并发症较少,术后恢复较快。因而,建议临床推广应用。
利益冲突 所有作者声明无利益冲突
作者贡献声明 韩磊:参与主体论文设计与撰写;武雪亮:参与主体文章书写与修改;郭飞:参与患者随访,提供部分数据;郗宇宁:参与部分统计学分析与部分论文修改;常晓燕:提供部分数据,参与设计部分实验;张春泽:进行部分数据整合;张剑锋:提供部分数据资料,参与部分患者随访统计;马鹏程:提供部分数据
参 考 文 献
[1]Siegel RL,Miller KD,Goding Sauer A,et al.Colorectal cancer statistics,2020[J].CA Cancer J Clin,2020,70(3):145-164.DOI:10.3322/caac.21601.
[2]Giannis D,Sideris G,Kakos CD,et al.The role of liver transplantation for colorectal liver metastases:a systematic review and pooled analysis[J].Transplant Rev(Orlando),2020,34(4):100570.DOI:10.1016/j.trre.2020.100570.
[3]Yang AD,Brouquet A,Vauthey JN.Extending limits of resection for metastatic colorectal cancer:risk benefit ratio[J].J surg Oncol,2010,102(8):996-1001.DOI:10.1002/jso.21701.
[4]Lv Y,Feng QY,Wei Y,et al.Benefits of multidisciplinary treatment strategy on survival of patients with colorectal cancer liver metastasis[J].Clin Transl Med,2020,10(3):e121.DOI:10.1002/ctm2.121.
[5]Norén A,Sandstrm P,Gunnarsdottir K,et al.Identification of inequalities in the selection of liver surgery for colorectal liver metastases in Sweden[J].Scand J Surg,2018,107(4):294-301.DOI:10.1177/1457496918766706.
[6]Margonis GA,Sergentanis TN,Ntanasis-Stathopoulos I,et al.Impact of surgical margin width on recurrence and overall survival following R0 hepatic resection of colorectal metastases:a systematic review and meta-analysis[J].Ann Surg,2018,267(6):1047-1055.DOI:10.1097/SLA.0000000000002552.
[7]中華医学会外科学分会胃肠外科学组,中华医学会外科学分会结直肠外科学组,中国抗癌协会大肠癌专业委员会,等.中国结直肠癌肝转移诊断和综合治疗指南(2018版)[J].中国实用外科杂志,2018,17(6):527-539.DOI:10.19538/j.cjps.issn1005-2208.2018.07.03.
[8]中国医师协会外科医师分会,中华医学会外科学分会胃肠外科学组,中华医学会外科学分会结直肠外科学组,等.中国结直肠癌肝转移诊断和综合治疗指南(2023)[J].中国临床医学,2023,30(1):166-198.DOI:10.12025/j.issn.1008-6358.2023.20222306.
[9]中华人民共和国国家卫生健康委员会,中华医学会肿瘤学分会.中国结直肠癌诊疗规范(2023年版)[J].中华外科杂志,2023,61(8):617-644.DOI:10.3760/cma.j.cn112139-20230603-00222.
[10]Shepherdson M,Kilburn D,Ullah S,et al.Survival outcomes for patients with colorectal cancer with synchronous liver only metastasis[J].Anz J Surg,2023,93(7-8):1847-1853.DOI:10.1111/ans.18482.
[11]Boas FE,Bodei L,Sofocleous CT.Radioembolization of colorectal liver metastases:indications,technique,and outcomes[J].J Nucl Med,2017,58(Suppl 2):104S-111S.DOI:10.2967/jnumed.116.187229.
[12]Vendrely V,Terlizzi M,Huguet F,et al.How to manage a rectal cancer with synchronous liver metastases? A question of strategy[J].Cancer Radiother,2017,21(6-7):539-543.DOI:10.1016/j.canrad.2017.07.021.
[13]Tinguely P,Dal G,Bottai M,et al.Microwave ablation versus resection for colorectal cancer liver metastases-a propensity score analysis from a population-based nationwide registry[J].Eur J Surg Oncol,2020,46(3):476-485.DOI:10.1016/j.ejso.2019.12.002.
[14]Tan CQY,Ho A,Robinson HA,et al.A Systematic review of microwave ablation for colorectal pulmonary metastases[J].Anticancer Res,2023,43(7):2899-2907.DOI:10.21873/anticanres.16461.
[15]Weiser MR.AJCC 8th edition:colorectal cancer[J].Ann Surg Oncol,2018,25(6):1454-1455.DOI:10.1245/s10434-018-6462-1.
[16]中華人民共和国国家卫生健康委员会.中国结直肠癌诊疗规范(2023版)[J].中华消化外科杂志,2023,22(6):667-698.DOI:10.3760/cma.j.cn115610-20230526-00236.
[17]Fennell ML,Das IP,Clauser S,et al.The organization of multidisciplinary care teams:modeling internal and external influences on cancer care quality[J].J Natl Cancer Inst Monogr,2010,2010(40):72-80.DOI:10.1093/jncimonographs/lgq010.
[18]Adam R,de Gramont A,Figueras J,et al.Managing synchronous liver metastases from colorectal cancer:a multidisciplinary international consensus[J].Cancer Treat Rev,2015,41(9):729-741.DOI:10.1016/j.ctrv.2015.06.006.
[19]Collienne M,Neven A,Caballero C,et al.EORTC 1409 GITCG/ESSO 01-a prospective colorectal liver metastasis database for borderline or initially unresectable diseases(CLIMB):lessons learnt from real life.From paradigm to unmet need[J].Eur J Surg Oncol,2023,49(11):107081.DOI:10.1016/j.ejso.2023.107081.
[20]Li H,Gu GL,Li SY,et al.Multidisciplinary discussion and management of synchronous colorectal liver metastases:a single center study in China[J].World J Gastrointest Oncol,2023,15(9):1616-1625.DOI:10.4251/wjgo.v15.i9.1616.
[21]Siriwardena AK,Serrablo A,Fretland AA,et al.The multi-societal european consensus on the terminology,diagnosis and management of patients with synchronous colorectal cancer and liver metastases:an E-AHPBA consensus in partnership with ESSO,ESCP,ESGAR,and CIRSE.[J].HPB,2023,25(9):985-999.DOI:10.1016/j.hpb.2023.05.360.
[22]Schiergens TS,von Einem J,Thomas MN,et al.Multidisciplinary treatment of colorectal liver metastases[J].Minerva Med,2017,108(6):527-546.DOI:10.23736/S0026-4806.17.05371-X.
[23]Kron P,Linecker M,Jones RP,et al.Ablation or resection for colorectal liver metastases? A systematic review of the literature[J].Front Oncol,2019(9):1052.DOI:10.3389/fonc.2019.01052.
[24]Xu Y,Zhang Y,Zheng CZ,et al.Thermal ablation versus hepatic resection for colorectal cancer with synchronous liver metastases:a propensity score matching study[J].Eur Radiol,2022,32(10):6678-6690.DOI:10.1007/s00330-022-09080-z.
[25]Song P,Sheng L,Sun Y,et al.The clinical utility and outcomes of microwave ablation for colorectal cancer liver metastases[J].Oncotarget,2017,8(31):51792-51799.DOI:10.18632/oncotarget.15244.
[26]Hu Y,Yang Z,Sun Y.Analysis of the feasibility of microwave ablation for colorectal liver metastases:a preliminary report[J].Videosurgery Mininv,2019,15(1):30-35.DOI:10.5114/wiitm.2019.86921.
(收稿日期:2023-10-24)

