油菜素内酯调控植物耐盐机理研究进展
陈晨 程大伟 李兰 顾红 郭西智 李明 陈锦永
摘要:油菜素内酯(brassinosteroid,BR)作为新型、高效的植物激素,广泛参与植物的各种生理过程,可以缓解多种非生物胁迫。阐述了BR处理缓解盐胁迫的生物学功能,总结了拟南芥、农作物水稻以及多种园艺植物的BR信号通路,并通过介绍BR的耐盐机理,进一步分析了植物遭受盐胁迫时的应答信号转导通路,旨在为加强BR在提高植物耐盐方面的应用提供理论依据。
关键词:油菜素内酯;植物激素;耐盐;作用机理doi:10.13304/j.nykjdb.2022.0923
中图分类号:Q946.885 文献标志码:A 文章编号:10080864(2024)02000112
土壤盐渍化问题在全球范围内日渐严重,据统计,目前全球盐渍土面积已达11亿hm2,其中,我国盐渍土面积为3 690万hm2[1],且盐渍化土壤面积呈逐年递增趋势。由于工业污染和农业生产中化学肥料和农药污染的不断加剧,以及气候变化引起的地下水蒸发、海平面上升等原因,导致土壤中盐含量不断加大。当土壤中盐含量超出植物所能承受的范围时,便会过量产生活性氧等有害物质,导致次生毒害,也会造成植物光合下降、呼吸紊乱、离子失衡等问题,严重影响植物生长,减少农业生產的效益。因此,探索提高植物耐盐性、减轻盐胁迫的方法,对植物优质高产有重要意义。
传统的育种方法可提高植株的耐盐能力,但此方法存在周期较长、占用土地资源等缺点,难以及时解决生产中出现的问题。高效的栽培措施是解决盐胁迫问题的有效途径,例如利用植物激素进行的化学调控可增强植物耐盐性[23],且该方法具有操作简单、量少效优、安全无害的优点,适于推广应用。油菜素内脂(brassinosteroid,BR)被列为第六大类植物激素,在植物中广泛分布,可参与多种生理过程,具有提高植物耐盐性的作用。本文综述了BR处理对盐胁迫的缓解作用,并总结了拟南芥、水稻以及多种园艺植物中的BR信号通路,介绍了BR的耐盐作用机理,分析了植物遭受盐胁迫时的应答信号通路,以期为加强BR在提高植物耐盐方面的应用提供理论依据。
1 BR 简介
1970 年,Mitchell 等[4]从油菜花粉中分离出一种高生理活性物质,将其称为油菜素(brassins)。1979年, Grove等[5]提取到一种油菜素甾醇的结晶,X射线结构分析结果证实该晶体是甾体物质,将其命名为芸薹素内酯(brassinolide,BL),是最早被发现的一种BR。之后,越来越多的BR被分离提炼得到,并于1998年被正式列为第六大类植物激素。目前已经得到的BR达70多种,其中芸薹素内酯(BL)、2,4-表油菜素内酯(2,4-epibrassinolide,2,4-EpiBL/EBR)和2,8- 高油菜素内酯(2,8-homobrassinolide,2,8-HomoBL/HBL)是活性较高的3种[6],在植物生长发育中起着重要的调控作用。
BR在植物的花粉、种子以及根、茎、叶中都有较低水平的分布,广泛参与各种生理过程,并在植物的抗逆性方面起着重要作用。虽然BR在植物体内含量较低,但却拥有超高的活性,菜豆的第2节间伸长试验中只需要1 ng便可明显地促进节间伸长[4],0.5 μg·L-1的BR即可对水稻叶片倾斜有较强促进作用[7]。BR发挥有效作用的用量远低于其他植物激素,有极大的应用价值。
2 BR 缓解盐胁迫的生物学功能
BR 可以促进植物DNA、RNA 和蛋白质的合成,具有增强酶活性的效能,还可以缓解干旱、高温、重金属等多种非生物胁迫。BR能缓解干旱对花椒幼苗的伤害,促进抗氧化酶的活性,提高渗透物质含量[8];EBR 能缓解高温胁迫对番茄光合作用的抑制[9],同时可提高抗氧化酶的活性;EBR还能提高铝胁迫下大豆的净光合速率[10]。BR还具有缓解盐胁迫的作用,表现在种子萌发、光合作用、幼苗生长、果实产量及品质、愈伤组织及再生植株等多个方面,对解决日渐突出的土壤盐渍化问题具有重要应用价值。
2.1 促进种子萌发
种子萌发期是植物对盐胁迫十分敏感的时期,遭遇盐胁迫时,种子萌发受抑制,即使萌发,长出幼苗的生长状况也不佳。吴雪霞等[11]研究表明,NaCl处理明显抑制茄子种子的萌发,而外源BR 处理显著提高了NaCl 处理茄子种子的发芽率、发芽势、发芽指数以及种子活力,起到促进种子萌发的作用。范翠枝等[12]通过番茄种子萌发试验发现,10-9、10-8 mol·L-1的2,4-表油菜素内酯(EBR)处理使150 mmol·L-1 NaCl胁迫下的发芽率分别增加82% 和59%,即BR 可以在盐胁迫下促进种子萌发。
2.2 促进幼苗正常生长
植物遭受盐胁迫后会对植物的正常生长发育产生影响,包括外部形态及内部的生理生化2方面。植株能否正常生长发育,体现在根长、株高、鲜重等指标上。Hu等[13]研究表明,BR促进马铃薯根的伸长,0.10和0.01 μg·L-1的BR促进根伸长和侧根发育,而1.00~100.00 μg·L-1 的BR 抑制根伸长。吴雪霞等[11]利用外源BR 处理茄子,结果表明,0.05 mg·L-1的EBR处理对茄子幼苗的生长影响最大,株高、根长和植株鲜重相比于单独的盐处理分别提高89.76%、40.86% 和89.67%。这在番茄[14]上也有体现,且表现出一定的剂量效应。
2.3 提高产量和果实品质
盐胁迫下植物的生长发育滞缓,产量和品质下降。可溶性蛋白、维生素C(Vc)含量等是衡量果蔬产品营养价值的重要指标,外源BR处理可以促进盐胁迫下作物达到优质高产的效果。张林青[15]研究表明,盐胁迫下番茄果形指数随着BR处理水平的增加呈先增大后减小的趋势,BR 为0.2 mg·L-1时果实硬度为14.36 kg·cm-2,平均单果重和可溶性固形物相比对照分别提高8.81% 和23.46%,Vc含量较多;但随着BR剂量的增大,以上生理指标呈下降趋势。
2.4 提高愈伤组织再生能力
沟叶结缕草通过诱导愈伤组织进行无性繁殖并大量生产,但遭遇盐胁迫时生产受阻。宋靓苑等[16]研究表明,EBR处理可以提高盐胁迫下沟叶结缕草愈伤组织及再生植株抗氧化酶活性,减少细胞膜的损伤,有效提升沟叶结缕草愈伤组织及再生植株的耐盐能力,但其作用效果也呈现一定的剂量效应。
3 BR 的信号通路
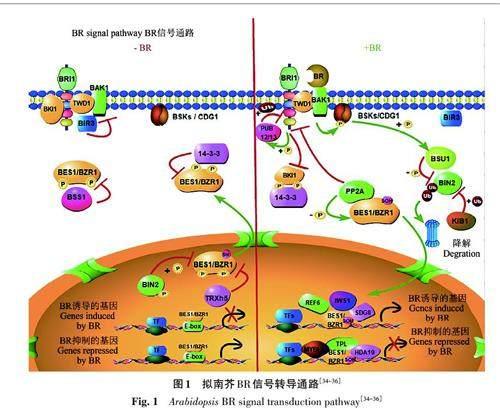
3.1 拟南芥中的BR 信号通路
拟南芥中BR信号转导的主要调控方式是可逆磷酸化与去磷酸化反应。在无BR 参与时,BRI1(brassinosteroid insensitive 1)抑制激酶1 (BRI1 kinase inhibitor 1, BKI1)和14-3-3 蛋白分别抑制BR信号受体BRI1 和转录因子BZR1/BES1的活性,促进BZR1/BES1在细胞质中保留[17],BRI1受体的互作调控蛋白1(BRI1 associated receptorkinase1, BAK1)与BAK1 负调控激酶3 (BAK1interacting receptor like kinase 3, BIR3)互作,抑制BAK1和BRI1的结合[18],同时BZR1/BES1与BSS1蛋白互作,保持失活状态[19], 硫氧还蛋白THXh5(thioredoxin H type 5)降低细胞核中的BZR1[20],使这些转录因子 (transcription factor,TF)失活,不传导BR信号。
BR通过与一系列的受体结合形成激活转录因子BZR1/BES1 的信号通路。首先,BR 与BRI1[21]结合,激活BRI1,进而促进BKI1 的磷酸化[2223],并与BKI1 分离,被活化的BKI1 与14-3-3蛋白互作,解离到细胞质中,可同时解除对BRI1和BZR1/BES1的抑制作用,增加BZR1/BES1在核内的积累[17]。BIR3在感知BR后被BAKI和BRI1释放[18],同时活化的BR/BRI1 与共受体BAK1 结合,激活BAK1,活化的BAK1又将BRI1磷酸化[24],TWD1(twisted dwarf 1)蛋白和BRI1互作,有助于形成BRI1-BAK1 复合物[25],进而将BR 信号激酶(BR signaling kinases, BSKs)[26] 和CDG1(constitutive differential growth 1)磷酸化激活[27],活化的BSK1与磷酸酶BSU1结合[28],激活 BSU1,活化的BSU1 使GSK-3(glycogen synthase kinases3)类激酶BIN2(brassinosteroid insensitive 2)去磷酸化失活,抑制其对 BZR1/BES1的磷酸化作用,而去磷酸化的BIN2为无活性的形式,易被蛋白酶体降解[29]。E3泛素连接酶家族成员KIB1在BR存在下介导了BIN2 的泛素化和降解,同时阻止了BIN2 与底物的互作[30]。同时,蛋白磷酸酶PP2A的活性也被BRI1/BAK1 复合体上调,PP2A 将BZR1/BES1去磷酸化,使BZR1/BES1变为有活性的形式[31]转移到细胞核中,具有结合E-box元件的能力,并可与辅因子(如组蛋白修饰酶REF6 和SDG8、转录伸长因子IWS1 、BR 相关转录因子PIF4 和BIM1)相互作用,诱导相关基因的表达[3233]。另外,BES1/BZR1 与BR 响应元件BRRE(BR-response element: CGTGC/TG) 位点结合,并与共抑制剂TPL 和MYBL2 及组蛋白脱乙酰酶(histone deacetylase,HDAC)互作,以抑制BR相关基因的表达[34]。甲基化的PP2A 又可与活化的BRI1结合并将其去磷酸化使其降解,BR信号终止。此外,BRI1也可以自身磷酸化使其失活,进而降低BR反应[35]。拟南芥BR信号转导通路模式如图1所示。
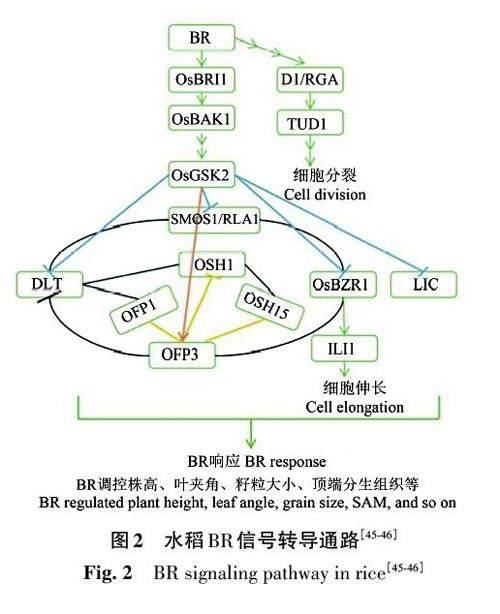
3.2 水稻中的BR 通路
目前,关于BR 信号转导的研究在作物中也取得了一定进展。研究表明,EBR通过与多种植物激素的互作可促进玉米胚芽鞘的生长,提高玉米深播种的耐受性[37]。水稻BR信号转导存在许多与拟南芥同源的相关基因,包括OsBRI1[38]、OsBAK1[39]、OsBZR1[40]等,降低OsBRI1、OsBZR1 的表达可导致节间长度缩小、叶片直立、植株矮小等表型,而减少OsBAK1 表达可使叶片直立、增加种植密度,具有增产潜力。dlt 突变体呈现半矮秆、叶片深绿、分蘖少、对BR 处理敏感性降低的性状,DLT (dwarf and low-tillering)基因参与BR的信号转导[41]。水稻BR不敏感矮秆突变体tud1(taihudwarf 1)呈现的性状相比于矮秆突变体d1(dwarf1)具有上位性,且TUD1与D1互作,共同参与BR信号传递[42]。过量表达LIC 转基因植株的性状与dlt 突变体类似,即LIC 是BR 负调控因子[43]。研究发现,水稻具有与拟南芥不同的BR信号转导通路,水稻中缺乏拟南芥BSU1的对应物,其对应基因编码PPKL家族蛋白,其中PPKL1 已被证明可负调节BR信号传导[44]。OFP3蛋白与GSK2和DLT互作,是BR信号通路中的负调节因子,降低OFP3 的表达促进水稻幼苗的生长,过表达会降低植株高度[45]。水稻中BR 信号通路(图2)的基因以及相关转录因子基因的表达所引起的性状均与叶片夹角、植株高度等相关,这与水稻种植密度和生长发育有重要联系,直接影响水稻产量,在水稻增产方面有巨大潜力,BR对水稻及其他作物的调控作用仍需进一步研究。
3.3 园艺植物中的BR 信号通路
BR信号转导途径在园艺植物上也取得了一定的研究进展。Ji等[47]研究表明,在梨的成熟过程中,外源BR处理会增加梨的内源BR水平,延缓其成熟,这是由于BZR1 同源基因PuBZR1 的过度表达抑制了转录因子基因PuERF2 的表达,间接抑制了乙烯生物合成基因PuACO1 和PuACS1a的表达,减少了乙烯的产生,从而延缓果实成熟进程。BR信号通路中bzr1 基因的突变抑制了番茄芽的生长,而BZR1 的过度表达(OE-BZR1)显著促进了芽的生长,BR通过转录因子BZR1对BRC1调节来促进番茄芽的生长[48]。An等[49]研究表明,番茄在响应低温胁迫时,BR信号中的BZR1调控脱落酸(abscisic acid,ABA)合成关键基因NCED1的转录表达,促进ABA积累,提高番茄植株的低温抗性。BR还可以促进猕猴桃根系的侧根生长,可能是由于BR通过调节外排载體PIN蛋白和流入载体AUX1/LAX蛋白的合成和定位来调节生长素在侧根中的积累和分布,进而促进侧根发育[50]。BR 还可以通过降低HMGR(3-hydroxy-3-methylglutaryl CoA reductase, 3-羟基3-甲基戊二酸单酰辅酶A还原酶)的活性促进葡萄花青素的积累和着色[51]。虽然BR在园艺植物方面的应用和研究有明显的增多趋势,但是相比于模式植物拟南芥和水稻,对园艺植物中的BR生物合成和信号转导了解仍较少。
4 BR 的耐盐机制
BR处理对植物的抗盐作用主要通过以下几点实现:①保护细胞膜和叶绿体的结构,提高叶绿素酶的活性,促进叶绿素的合成,减少光合色素的损失,增强光合速率。②增强体内的超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)、类胡萝卜素等抗氧化性酶及抗氧化物质的活性,增强抗氧化能力。降低丙二醛 (malondialdehyde,MDA)含量,减少过量活性氧的产生,防止对细胞膜结构的破坏。③增加可溶性糖、脯氨酸等渗透调节物质调节细胞的渗透压,维持正常pH。
4.1 BR 对光合作用的影响
光合作用是植物获得生长所需能量的重要途径,当遭遇盐胁迫时,光合作用受到抑制,叶绿素a、叶绿素b、类胡萝卜素含量以及叶绿素a/b均明显降低,从而减少光合作用中光能的吸收和传递[52]。盐胁迫下,植物的净光合速率下降,叶绿素含量降低。适宜水平的BR有利于降低高盐对光合作用的抑制,从而促进植株光合作用。王金平等[53]研究表明,EBR增加了樟树盐胁迫下光合色素的含量,提高了对光能的捕获、吸收、传递和转换,增强了光合能力。
4.2 BR 对活性氧水平和抗氧化酶活性的影响
正常情况下,植物细胞会产生适量的活性氧,但当遭受盐胁迫时,植物细胞会积累大量的H2O2、活性氧等有害物质,对膜系统、DNA等造成损伤。MDA是膜脂过氧化的最终分解产物,其积累可导致代谢失衡,破坏细胞膜的完整性。因此,MDA含量可以反映细胞氧化损伤的程度,即可反映植物受盐害程度。植物拥有活性氧清除系统如超氧化物歧化酶、过氧化氢酶、过氧化物酶、抗坏血酸过氧化物酶(ascorbate peroxidase, APX)、谷胱甘肽还原酶(glutathione reductase,GR)等[54],酶活性越高,其抗氧化伤害的能力也就越强,可减少活性氧产生速率,缓解盐胁迫。?zdemir等[55]研究发现,EBR处理可显著增加盐胁迫下水稻中APX活性,降低盐胁迫下水稻植株中MDA含量,緩解盐胁迫对幼苗的抑制。张林青[14]研究表明,番茄叶片中CAT和POD活性随着BR水平的增加呈先上升后下降的趋势,过高水平的BR加重了对细胞膜通透性的破坏作用,说明BR具有剂量效应,处理时需要适宜的水平;同样BR 处理降低了MDA 含量,提高了幼苗的耐盐生长能力。Liu等[56]研究表明,一定水平的BR可提高高盐胁迫下植物的耐盐性,但同样水平的BR在低盐条件下却可能呈现抑制作用,这种现象被称为激素压力水平依赖性双向效应(stress-level-dependentbiphasic,SLDB),且认为与H2O2的积累有关。
4.3 BR 对植物渗透调节的影响
遭遇盐胁迫时,植物细胞外水势高于细胞内,抑制了根系对水的吸收,引起渗透胁迫。渗透调节是植物减少伤害的重要方式,主要表现在有机渗透调节和无机渗透调节2个方面。参与有机渗透调节的物质主要有可溶性糖(soluble sugar,SS)、游离氨基酸(free amino acids,FAA)、脯氨酸(proline,Pro)和有机酸(organic acids,OA)等[57]。在正常情况下,植物主动吸收并积累无机盐离子,缓解离子失衡,其中Na+、K+起到非常重要的作用,需要保持适当的平衡。一般情况下,无机渗透调节和有机渗透调节同时存在,只是在不同的植物、器官和组织中所占的比例不同。孙珊珊等[58]研究发现,EBR处理可以提高黑麦草中脯氨酸、可溶性蛋白和可溶性糖等渗透调节物质的含量 ,以更好地调节细胞内的渗透势,从而较好地缓解盐胁迫对植株造成的伤害。郑春芳等[59]研究表明,在75和150 mmol·L-1 NaCl胁迫下,番茄幼苗地上部和根部K+/Na+显著下降,离子平衡被盐胁迫破坏,而EBR能提高地上部和根部K+/Na+,说明BR通过调控盐胁迫下番茄幼苗植株选择性吸收K+的生理功能,通过提高K+/Na+来增强植株耐盐性。
5 BR 参与下的盐胁迫反应
5.1 感知盐胁迫
最早感受逆境胁迫信号并产生相应生理反应的是植物根系,根系可影响整个植株的正常生长发育,研究根部对盐反应的机制是研究植物耐盐的基础。NaCl是易溶且广泛存在的盐,在盐胁迫时,根内皮层的凯氏带和木栓层可起到抵制盐离子危害的作用,但是大量的Na+可通过质膜上的非选择性阳离子通道(non-selective cation channels,NSCCs)进入根部[60],对植物造成盐胁迫。
MOCA1 是质膜蛋白,可在质膜上产生鞘脂GIPC(glycosylinositol phosphorylceramide),结合Na+,从而打开Ca2+通道。Ca2+的流入会引起下游的盐胁迫反应,推测OSCA1[reduced hyperosmolalityinduced(Ca2+)i increase 1]是细胞中感受高盐渗透引起的Ca2+信号的关键蛋白[61]。此外,受体激酶RLK成员FER是细胞壁传感器,可感知由盐诱导产生的细胞壁变化。FER 蛋白的胞外结构域与果胶相互作用,通过增加细胞质中游离钙离子(Ca2+)cyt水平来传送信号,从而诱导细胞壁修复信号途径[62]。
5.2 盐胁迫下的盐过敏感通路
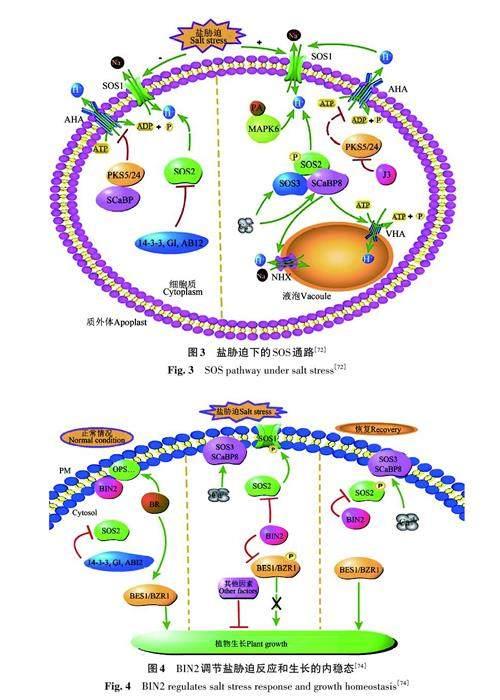
细胞内Ca2+、活性氧(reactive oxygen species,ROS)含量的增多是早期盐胁迫的反应信号[6364]。植物为了应对盐胁迫,形成了一套完整的盐过敏感(salt overly sensitive, SOS)通路。SOS通路主要包含SOS1/NHX7、SOS2/CIPK24、SOS3/CBL4 和SCaBP8/CBL10 共4 种组分。SOS1 是质膜上的Na+/H+反转运器NHX,可被SOS2激活,主要负责Na+的外排,在根表皮细胞和木质部细胞中表达,大部分Na+可以通过根质膜Na+/H+反向转运体SOS1/NHX7被泵出根细胞,将细胞内Na+外排到土壤中[65]。SOS1还促进了Na+从根部到叶部的运输,而高亲和力K+转运体HKT1的作用与此相反,它通过减少叶片中Na+的积累来控制根/芽Na+的分布,减少叶片的盐胁迫伤害[66]。SOS2是SNF1/AMPK 家族中的丝氨酸/苏氨酸蛋白激酶,也是CBLs- 蛋白激酶(CBL interacting protein kinases,CIPKs),可被盐胁迫下产生的Ca2+信号激活[67]。SOS3/ SCaBP8是钙调磷酸酶B型蛋白,负责感知和结合Ca2+[68],通过与CIPKs 互作引起蛋白磷酸化,与SOS2激酶形成复合物激活SOS2,进而激活SOS1,激活耐盐调控通路。
正常情况下,SOS1处于自抑制状态,质膜上的H+-ATP 酶活性被SCaBP 和PKS5 (SOS2-likeprotein5)/PKS24抑制,并保持负电位。ABI2、14-3-3、GI、J3以及PKS5抑制SOS2活性 [6970],未发生信号转导。
遭遇盐胁迫时,细胞内的Na+增多,一方面VHA 负责编码液泡膜上的真空H+-ATP酶,为Na+向液泡内的运输产生质子电化学梯度,通过在液泡中积累Na+来控制细胞与外界环境的渗透平衡[71];另一方面,植物通过多种途径激活SOS1活性,促进Na+外排。Na+结合到植物细胞质膜外侧GIPC,引起细胞表面电势变化,质膜上的H+-ATP酶产生质子梯度,激活SOS1活性,起到了减少Na+输入和K+ 输出的作用[64];也可由SOS3/CBL4 和SCaBP8/CBL10 感知并结合Ca2+ ,然后与SOS2/CIPK24 互作[68],从而激活SOS2,SOS2-SOS3 复合物磷酸化Na+/H+反转运器SOS1/NHX7,将Na+运出细胞;或是14-3-3蛋白感知盐诱导的Ca2+信号后与PKS5 相互作用,并抑制PKS5 活性[70],SOS2 蛋白被释放。研究表明,14-3-3和GI蛋白通过26S蛋白酶途径降解,从而释放SOS2激酶活性[69],进一步激活SOS1,达到缓解盐胁迫的效果。盐胁迫下的SOS通路模式见图3。
5.3 BR 参与下的盐胁迫信号转导通路
BR合成于根部,在低水平下可以促进主根生长,在植物的根系发育中起着重要作用[73]。BR参与植物耐盐胁迫信号通路,Li等[74]研究证明,SOS2与BR信号通路中的BIN2互作,且BIN2对SOS途径的调节对盐胁迫的反应独立于BR信号通路,在盐胁迫后的恢复期对SOS通路的关闭起到重要调节作用。
正常条件下,SOS2 活性受到抑制,BES1 和BZR1被釋放并促进植物生长。在盐胁迫下,盐胁迫诱导的钙信号减少了BIN2和SOS3/SCaBP8之间的相互作用。此时,BIN2从质膜解离,磷酸化BZR1/BES1,抑制其转录活性,延缓植物生长,导致BZR1/BES1的下游DWF4等关键酶基因在盐胁迫下的表达下降。在胁迫后恢复阶段,SOS3 和SCaBP8与BIN2相互作用,可增强BIN2对SOS2 的抑制作用,释放BZR1/BES1 使植物恢复生长[74]。BIN2还可以抑制SOS2的活性以避免其过度激活。已知BZR1/BES1与DWF4的启动子结合抑制其表达,从而形成BR合成的负反馈调节环[75]。BIN2调节盐胁迫反应和生长的内稳态模式见图4。
6 BR 与其他激素的相互作用
植物是复杂的生命系统,每种植物激素都有其特定的生理作用,但不是单独存在、独立发挥作用,而是与其他激素一起构成系统的调节网络,共同调节植物的生长发育。
脱落酸(ABA)调控植物的衰老和叶片脱落,在果实成熟、根系发育、气孔调节、逆境调控方面也具有重要作用,被认为是抗逆激素。研究表明,ABA和BR通过调节BIN2的活性调节植物的各种生理过程[75]。ABA抑制种子的萌发和生长,BR信号通路中的BIN2与ABA信号通路中的转录因子ABI5 互作并将其磷酸化,可起到稳定作用。然而,BR信号中BZR1可直接结合ABI5并抑制其表达[76],BR抑制BIN2活性,拮抗ABA的抑制作用。ABA可通过对ABI2的去磷酸化调控细胞壁受体激酶FER活性,调控对盐胁迫的感知[77]。
盐胁迫时,气孔的及时关闭可减少水分的流失。为了应对盐胁迫,内源ABA含量上升,ABA信号激活SnRK2s 激酶以磷酸化多种ABA 信号通路转录因子,并通过OST1 激酶、CPK8 激酶、H+-ATP酶等调节关闭气孔[78],降低光合和蒸腾作用,减少水分的流失。BR同样具有调控气孔运动的作用,在拟南芥和番茄中低水平的BR诱导气孔张开,而高水平的BR促进气孔关闭[79],其中高水平BR 促进气孔关闭的机制是由于高水平BR导致活性氧增多、促进ABA合成进而导致气孔关闭[80],即BR和ABA共同调控气孔运动。
盐胁迫导致过氧化物增多[63],其中包含H2O2。研究表明,H2O2 诱导了BZR1 转录因子的氧化,通过增强其与PIF4和ARF6等结合亲和力来增加BZR1 的转录活性,BRs 通过与H2O2 的相互作用促进保卫细胞淀粉的降解,从而促进气孔的开放[81]。
脯氨酸是有机渗透调节物质,可调节非生物胁迫引起的渗透失衡,盐胁迫下脯氨酸积累缓解渗透胁迫,ABA对P5CS1 基因的调节可引起脯氨酸的积累,同时受BR信号的抑制调控[82]。
BR通过调节乙烯(ethylene,ETH)合成过程中ACC 合成酶ACS 的稳定性,激活ETH 的合成[83]。ETH也可影响植物耐盐性,目前报道的机制多与活性氧清除相关[84]。茉莉酸 (jasmonic acid,JA)可导致Ca2+积累,增强质膜H+-ATPase活性,减少K+流失,有利于维持离子平衡,提高耐盐性[85]。
健壮的根系对提高耐盐性非常重要。BR可以促进根系的生长,原因是由于BR刺激了植物生长素的代谢过程。Bao等[86]研究表明,BR可以显著促进生长素在不同组织中的运输,调节编码生长素极性运输载体的PIN 基因的表达,可促进根部发育。在调节根部干细胞生态位中的QC(quiescent center)细胞分裂方面,BR和生长素可拮抗性地调节PLT 的表达。根尖分生区的发育也存在多种激素互作调控的现象,细胞分裂素可通过细胞分裂素反应转录因子ARR12激活SHY2 表达阻遏生长素信号,SHY2可抑制PIN 表达,影响根系分生组织的发育[87]。另外,生长素可增强BR信号过程中的BRX 表达,进而提高PIN3 的表达,因而多种激素互作,共同促进根分生组织发育[88]。同样,BR 和生长素通过对BR 合成调控因子DWARF4 的调节,可影响植物侧根的形成和生长[89]。BR对根系的调控作用体现在多个方面,依靠与多种激素的互相协作发挥作用。
7 展望
目前,BR抗氧化性调控研究多集中于SOD、POD、CAT等,其他的抗氧化物质,如抗坏血酸、叶黄素、花青素等,是否在BR的调控中起作用仍需探索,且受到盐碱胁迫后SOD活性显著升高的具体原因未知。BR对不同植株、不同器官、不同生长环境下起到的作用及剂量效应不同,都需要进一步研究。光合作用方面,胡文海等[52]研究表明,外源BR处理提高了黄瓜的净光合速率,但BR处理并没有引起叶绿素含量的增加,主要是促进了光合结构对CO2的利用能力,这与张林青[14]、王金平等[53]的研究结果不同,BR提高光合作用的作用机理仍有待进一步研究。另外,ABA、ETH能够在植物盐胁迫信号转导和调控中发挥重要作用,其中BR 和ABA 之间的互作主要是对BIN2的调控引起的,且已有相关验证[89],但更详细的机理仍有待发掘。ABA含量升高可促进JA的快速积累,JA又可促进ABA受体蛋白基因的表达[90],即ABA与JA信号通路存在交叉。BR在参与盐胁迫应答中是否可能同样依赖于ETH、JA等其他激素,研究BR与其他激素的互作对构建BR盐胁迫应答网络其有重要意义。盐胁迫产生的生理生化反应是个复杂的信号转导网络,其中包括Ca2+信号、活性氧信号、渗透调节等。本研究针简单地介绍了SOS途径与BR信号转导通路,但BR信号与其他植物激素共同参与植物抗盐胁迫的其他调节机制尚没有清晰的网络,需要进一步探索。
参 考 文 献
[1] 赵起越,夏夜,邹本东. 土壤盐渍化成因危害及恢复[J]. 农业
与技术, 2022, 42(11): 115-119.
[2] 汤日圣,黄益洪,唐现洪,等. 生物源脱落酸对盐胁迫下辣椒
苗生长和某些生理指标的影响[J]. 江苏农业学报 ,2009,
25(4): 856-860.
TANG R S, HUANG Y H, TANG X H,et al .. Effects of
microoraganism-sourced ABA on the growth and some
physiological indexes of pepper seedling under salt stress [J].
Jiangsu J. Agric. Sci., 2009, 25(4):856-860.
[3] 尚庆茂,宋士清,张志刚,等. 外源BR 诱导黄瓜(Cucumis
sativus L.)幼苗的抗盐性 [J]. 中国农业科学,2006,39(9): 1872-
1877.
SHANG Q M, SONG S Q, ZHANG Z G,et al .. Exogenous
brassinosteroid induced the salt resistance of cucumber
(Cucumis sativus L.) seedlings [J]. Sci. Agric. Sin., 2006, 39(9):
1872-1877.
[4] MITCHELL J W, MANDAVA N, WORLEY J F,et al .. Brassinsa
new family of plant hormones from rape pollen [J]. Nature,
1970, 225(5237): 1065-1066.
[5] GROVE M D, SPENCER G F, ROHWEDDER W K.
Brassinolide, a plant growth-promoting steroid isolated from
Brassica napus pollen [J]. Nature, 1979, 281: 216-217.
[6] 鄭婷,程建徽,魏灵珠,等. 油菜素内酯及其在园艺植物中的
研究进展[J/OL]. 分子植物育种 ,2022 [2022-09-28]. https://
kns.cnki.net/kcms/detail/46.1068.s.20220113.1105.004.html.
ZHENG T, CHENG J H, WEI L Z, et al .. Progress of
brassinosteroids and reasearch advancements on horticultural
plants [J/OL]. Mol. Plant Breed., 2022 [2022-09-28]. https://
kns.cnki.net/kcms/detail/46.1068.s.20220113.1105.004.html.
[7] WADA K,MARUMO S,IKEKAWA N,et al .. Brassinolide and
homobrassinolide promotion of lamina inclination of rice
seedlings [J]. Plant Cell Physiol., 1981, 22(2): 323-325.
[8] 习世宏,褚祥. 油菜素内酯对花椒幼苗生长和抗旱性影
响 [J]. 陕西林业科技 ,2014(5): 1-4.
XI S H,CHU X. Effect of natural brassinoide on the growth and
drought resistance of Zanthoxylum bungeanum seedlings [J].
Shaanxi For. Sci. Technol., 2014(5):1-4.
[9] OGWENO J O, SONG X S, SHI K,et al .. Brassinosteroids
alleviate heat-induced inhibition of photosynthesis by
increasing carboxylation efficiency and enhancing antioxidant
systems in Lycopersicon esculentum [J]. J. Plant Growth Regul.,
2008, 27(1): 49-57.
[10] 董登峰,李杨瑞,江立庚. 油菜素内酯对铝胁迫大豆光合特
性的影响[J]. 作物学报 ,2008,34(9): 1673-1678.
DONG D F,LI Y R, JIANG L G. Effects of brassinosteroid on
photosynthetic characteristics in soybean under aluminum
stress [J]. Acta. Agron. Sin., 2008, 34(9):1673-1678.
[11] 吴雪霞,查丁石,朱宗文,等. 外源24-表油菜素内酯对盐胁迫
下茄子种子萌发和幼苗生理特性的影响[J]. 植物生理学报 ,
2011,47(6): 607-612.
WU X X,CHA D S,ZHU Z W,et al .. Effects of exogenous 24-
epibrassinolide on seed germination, physiological characteristics of
eggplant seedlings under NaCl stress [J]. Acta Phytophysiol.
Sin., 2011, 47(6):607-612.
[12] 范翠枝,吴馨怡,关欣,等. 油菜素内酯浸种对盐胁迫番茄种
子萌发的影响及其生理机制[J]. 生态学报 ,2021,41(5):
1857-1867.
FAN C Z,WU X Y,GUAN X,et al .. Concentration effects and
its physiological mechanism of soaking seeds with brassinolide
on tomato seed germination under salt stress [J]. Acta Ecol.
Sin., 2021, 41(5):1857-1867.
[13] HU Y Q,XIA S T,SU Y,et al .. Brassinolide increases potato
root growth in vitro in a dose-dependent way and alleviates
salinity stress [J/OL]. Biomed. Res. Int., 2016, 2016:8231873
[2022-09-28]. https://doi.org/10.1155/2016/8231873.
[14] 张林青. 油菜素内酯对鹽胁迫下番茄幼苗生理指标的影
响 [J]. 北方园艺 ,2013(1): 1-3.
ZHANG L Q. The affection of brassinolide on the physiological
indexes of tomato seedlings [J]. Northern Hortic., 2013(1):1-3.
[15] 张林青. 盐胁迫下油菜素内酯对番茄产量和品质的影
响 [J]. 北方园艺 ,2012(20): 23-25.
ZHANG L Q. Effect of brassinolide on yield and quality of
tomato under salt stress [J]. Northern Hortic., 2012(20):23-25.
[16] 宋靓苑,林恬逸,许静雯,等. 盐胁迫下表油菜素内酯对沟叶
结缕草愈伤组织生长和再生的影响[J]. 核农学报 ,2020,
34(7): 1440-1446.
SONG L Y,LIN T Y,XU J W,et al .. Effects of epibrassinolide
on callus growth and regeneration of Zoysia matrella (L.) Merr.
under salt stress [J]. J. Nucl. Agric. Sci., 2020, 34(7): 1440-
1446.
[17] WANG H J, YANG C J, ZHANG C,et al .. Dual role of BKI1
and 14-3-3s in brassinosteroid signaling to link receptor with
transcription factors [J]. Dev. Cell, 2011, 21(5): 825-834.
[18] IMKAMPE J,HALTER T,HUANG S H,et al .. The Arabidopsis
leucine-rich repeat receptor kinase BIR3 negatively regulates
BAK1 receptor complex formation and stabilizes BAK1 [J].
Plant Cell, 2017, 29(9): 2285-2303.
[19] SHIMADA S,KOMATSU T,YAMAGAMI A,et al .. Formation
and dissociation of the BSS1 protein complex regulates plant
development via brassinosteroid signaling [J]. Plant Cell, 2015,
27(2): 375-390.
[20] TIAN Y,FAN M,QIN Z,et al .. Hydrogen peroxide positively
regulates brassinosteroid signaling through oxidation of the
BRASSINAZOLE-RESISTANT1 transcription factor [J/OL].
Nat. Commun., 2018, 9: 3463 [2022-09-28]. https://doi. org/
10.1038/s41467-018-03463-x.
[21] WANG Z Y, SETO H, FUJIOKA S,et al .. BRI1 is a critical
component of a plasma-membrane receptor for plant
steroids [J]. Nature, 2001, 410(6826): 380-383.
[22] WANG J, JIANG J J,WANG J,et al .. Structural insights into
the negative regulation of BRI1 signaling by BRI1-interacting
protein BKI1 [J]. Cell Res., 2014, 24(11): 1328-1341.
[23] WANG X L,CHORY J. Brassinosteroids regulate dissociation
of BKI1, a negative regulator of BRI1 signaling, from the
plasma membrane [J]. Science, 2006, 313(5790): 1118-1122.
[24] WANG X F, KOTA U, HE K, et al .. Sequential
transphosphorylation of the BRI1/BAK1 receptor kinase
complex impacts early events in brassinosteroid signaling [J].
Dev. Cell, 2008, 15(2): 220-235.
[25] ZHAO B L,LYU M H,FENG Z X,et al .. TWISTED DWARF 1
associates with BRASSINOSTEROID-INSENSITIVE 1 to
regulate early events of the brassinosteroid signaling
pathway [J]. Mol. Plant, 2016, 9(4): 582-592.
[26] TANG W Q, KIM T W, OSES-PRIETO J A, et al .. BSKs
mediate signal transduction from the receptor kinase BRI1 in
Arabidopsis [J]. Science, 2008, 321(5888): 557-560.
[27] KIM T W, GUAN S, BURLINGAME A L,et al .. The CDG1
kinase mediates brassinosteroid signal transduction from BRI1
receptor kinase to BSU1 phosphatase and GSK3-like kinase
BIN2 [J]. Mol. Cell, 2011, 43(4): 561-571.
[28] RYU H, KIM K, CHO H, et al .. Predominant actions of
cytosolic BSU1 and nuclear BIN2 regulate subcellular
localization of BES1 in brassinosteroid signaling [J]. Mol. Cell,
2010, 29(3): 291-296.
[29] PENG P, YAN Z Y, ZHU Y Y,et al .. Regulation of the
Arabidopsis GSK3-like kinase brassinosteroid-insensitive 2
through proteasome-mediated protein degradation [J]. Mol.
Plant, 2008, 1(2): 338-346.
[30] ZHU J Y, LI Y, CAO D M,et al .. The F-box Protein KIB1
mediates brassinosteroid-induced inactivation and degradation
of GSK3-like kinases in Arabidopsis [J]. Mol. Cell, 2017, 66(5):
648-657.
[31] TANG W, YUAN M, WANG R, et al .. PP2A activates
brassinosteroid-responsive gene expression and plant growth
by dephosphorylating BZR1 [J]. Nat. Cell Biol., 2011, 13(2):
124-131.
[32] YIN Y H, WANG Z Y, MORA-GARCIA S,et al .. BES1
accumulates in the nucleus in response to brassinosteroids to
regulate gene expression and promote stem elongation [J]. Cell,
2002, 109(2): 181-191.
[33] WANG Z Y, NAKANO T, GENDRON J,et al .. Nuclearlocalized
BZR1 mediates brassinosteroid-induced growth and
feedback suppression of brassinosteroid biosynthesis [J]. Dev.
Cell, 2002, 2(4): 505-513.
[34] NOLAN T, CHEN J, YIN Y. Cross-talk of brassinosteroid
signaling in controlling growth and stress responses [J].
Biochem. J., 2017, 474(16): 2641-2661.
[35] OH M H,WANG X F,CLOUSE S D,et al .. Deactivation of the
Arabidopsis BRASSINOSTEROID INSENSITIVE 1 (BRI1)
receptor kinase by autophosphorylation within the glycine-rich
loop [J]. Proc. Natl. Acad. Sci. USA, 2012, 109(1): 327-332.
[36] NOLAN T M,VUKASINOVIC N,LIU D,et al .. Brassinosteroids:
multidimensional regulators of plant growth, development, and
stress responses [J]. Plant Cell, 2020, 32(2): 295-318.
[37] ZHAO X,ZHONG Y,SHI J,et al .. 24-epibrassinolide confers
tolerance against deep-seeding stress in Zea mays L. coleoptile
development by phytohormones signaling transduction and
their interaction network [J/OL]. Plant Signal. Behav., 2021,
16(11): 1963583 [2022-09-28]. https://doi. org/10.1080/
15592324. 2021.1963583.
[38] YAMAMURO C,IHARA Y,WU X, et al .. Loss of function of a
rice brassinosteroid insensitive1 homolog prevents internode
elongation and bending of the lamina joint [J]. Plant Cell,
2000, 12(9): 1591-1606.
[39] LI D, WANG L, WANG M, et al .. Engineering OsBAK1 gene as
a molecular tool to improve rice architecture for high yield [J].
Plant Biotechnol. J., 2010, 7(8): 791-806.
[40] BAI M Y, ZHANG L Y, GAMPALA S S,et al.. Functions of
OsBZR1 and 14-3-3 proteins in brassinosteroid signaling in
rice [J]. Proc. Natl. Acad. Sci. USA, 2007, 104(34): 13839-13844.
[41] TONG H N, JIN Y, LIU W B,et al .. DWARF AND LOWTILLERING,
a new member of the GRAS family, plays positive
roles in brassinosteroid signaling in rice [J]. Plant J.,
2009, 58(5): 803-816.
[42] HU X M,QIAN Q,XU T,et al .. The U-Box E3 ubiquitin ligase
TUD1 functions with a heterotrimeric G α subunit to regulate
brassinosteroid-mediated growth in rice [J/OL]. PLoS Genet.,
2013, 9(3): 1003391 [2022-09-28]. https://doi.org/10.1371/
journal.pgen.1003391.
[43] WANG L,XU Y,ZHANG C,et al .. OsLIC, a novel CCCH-type
zinc finger protein with transcription activation, mediates rice
architecture via brassinosteroids signaling [J/OL]. PLoS One,
2008, 3(10): e0003521 [2022-09-28]. https://doi.org/10.1371/
journal.pone.0003521.
[44] GAO X Y, ZHANG J Q, ZHANG X J,et al .. Rice qGL3/
OsPPKL1 functions with the GSK3/SHAGGY-like kinase
OsGSK3 to modulate brassinosteroid signaling [J]. Plant cell,
2019, 31(5): 1077-1093.
[45] XIAO Y, ZHANG G, LIU D,et al .. GSK2 stabilizes OFP3 to
suppress brassinosteroid responses in rice [J]. Plant J., 2020,
102(6): 1187-1201.
[46] 沈愛华,罗红兵,邓志平,等. 油菜素内酯信号传递在水稻中
的研究进展[J]. 浙江农业学报 ,2014,26(5): 1399-1404.
SHEN A H,LUO H B,DENG Z P,et al .. Recent advances in
brassinosteriod signaling in rice [J]. Acta Agric. Zhejiangensis,
2014, 26(5):1399-1404.
[47] JI Y L, QU Y, JIANG Z Y, et al .. The mechanism for
brassinosteroids suppressing climacteric fruit ripening [J].
Plant Physiol., 2021, 185(4): 1875-1893.
[48] XIA X J,DONG H,YIN Y L,et al .. Brassinosteroid signaling
integrates multiple pathways to release apical dominance in
tomato [J/OL]. Proc. Natl. Acad. Sci. USA, 2021, 118(11):
384118 [2022-09-28]. https://doi.org/10.1073/pnas.2004384118.
[49] AN S M, LIU Y, SANG K Q,et al .. Brassinosteroid signaling
positively regulates abscisic acid biosynthesis in response to
chilling stress in tomato [J]. J. Integr. Plant Biol., 2023, 65(1):
10-24.
[50] WU Z Y, GU S C, GU H, et al .. Physiological and
transcriptomic analyses of brassinosteroid function in kiwifruit
root [J]. Environ. Exp. Bot., 2022, 194: 104685-104685.
[51] ZHENG T, DONG T, HAIDER M S,et al .. Brassinosteroid
regulates 3-hydroxy-3-methylglutaryl CoA reductase to promote
grape fruit development [J]. J. Agric. Food Chem., 2020,
68(43): 11987-11996.
[52] 胡文海,黃黎锋,毛伟华,等. 油菜素内酯对黄瓜苗期叶片光
合机构调节作用的研究[J]. 园艺学报 ,2006,33(4): 762-766.
HU W H, HUANG L F, MAO W H, et al .. Role of
brassinosteroids in the regulation of photosynthetic apparatus
in cucumber leaves [J]. Acta Hortic. Sin., 2006, 33(4):762-766.
[53] 王金平,张金池,岳健敏,等. 油菜素内酯对氯化钠胁迫下樟
树幼苗光合色素和叶绿素荧光参数的影响[J]. 浙江农林大
学学报 ,2017,34(1): 20-27.
WANG J P,ZHANG J C,YUE J M,et al .. BRs, photosynthetic
pigment, and chlorophyll fluorescence parameters in Cinnamomum
camphora seedlings with NaCl stress [J]. J. Zhejiang A & F Univ.,
2017, 34(1):20-27.
[54] GILL S S,TUTEJA N. Reactive oxygen species and antioxidant
machinery in abiotic stress tolerance in crop plants [J]. Plant
Physiol. Biochem., 2010, 48(12): 909-930.
[55] ?ZDEMIR F, BOR M, DEMIRAL T,et al .. Effects of 24-
epibrassinolide on seed germination, seedling growth, lipid
peroxidation, proline content and antioxidative system of rice
(Oryza sativa L.) under salinity stress [J]. Plant Growth Regul.,
2004, 42(3): 203-211.
[56] LIU J L, YANG R C, JIAN N,et al .. Putrescine metabolism
modulates the biphasic effects of brassinosteroids on canola
and Arabidopsis salt tolerance [J]. Plant Cell Environ., 2020, 43(6):
1348-1359.
[57] CHEN H, JIANG J G. Osmotic adjustment and plant
adaptation to environmental changes related to drought and
salinity [J]. Environ. Rev., 2010, 18: 309-319.
[58] 孙珊珊,安勐颍,韩烈保,等. 外源24-表油菜素内酯对多年生
黑麦草幼苗耐盐性的影响[J]. 草地学报, 2014, 22(5): 1045-
1050.
SUN S S, AN M Y, HAN L B, et al .. Effects of exogenously
applied 24-epibrassinolide on the seedlings perennial ryegrass
under NaCl stress [J]. Acta Agrestia Sin.,2014, 22(5): 1045-
1050.
[59] 郑春芳,范翠枝,郑青松,等. 外施2,4-表油菜素内酯对盐胁
迫下番茄幼苗生长及生理特性的影响[J]. 浙江农林科学 ,
2022,63(5): 991-995.
ZHENG C F, FAN C Z, ZHENG Q S, et al .. Effect of
exogenous 2, 4-epibrassinolide on the growth and physiological
characteristics of tomato seedlings under salt stress [J]. J.
Zhejiang Agric. Sci., 2022, 63(5):991-995.
[60] DEMIDCHIK V, MAATHUIS F. Physiological roles of
nonselective cation channels in plants: from salt stress to
signalling and development [J]. New Phytol., 2007, 175(3):
387-404.
[61] ZHANG M F, WANG D, KANG Y L,et al .. Structure of the
mechanosensitive OSCA channels [J]. Nat. Struct. Mol. Biol.,
2018, 25(9): 850-858.
[62] L?UCHLI A, GRATTAN S R. Plant Growth and Development
under Salinity Stress [M]// Advances in Molecular Breeding
Toward Drought and Salt Tolerant Crops. Springer Netherlands,
2007: 1-32.
[63] MILLER G, SUZUKI N, CIFTCI-YILMAZ S,et al .. Reactive
oxygen species homeostasis and signalling during drought and
salinity stresses [J]. Plant, Cell Environ., 2010, 33(4): 453-467.
[64] SUN J,DAI S X,WANG R G,et al .. Calcium mediates root K+/Na+
homeostasis in poplar species differing in salt tolerance [J]. Tree
Physiol., 2009, 29(9): 1175-1186.
[65] SHI H Z,ISHITANI M,KIM C,et al .. The Arabidopsis thaliana salt
tolerance gene SOS1 encodes a putative Na+/H+ antiporter [J].
Nat. Acad. Sci., 2000, 97(12): 6896-6901.
[66] MASER P, ECKELMAN B, VAIDYANATHAN R, et al ..
Altered shoot/root Na+ distribution and bifurcating salt
sensitivity in Arabidopsis by genetic disruption of the Na+
transporter AtHKTI1 [J]. FEBS Lett., 2002, 531(2): 157-161.
[67] HALFTER U,ISHITANI M,ZHU J K. The Arabidopsis SOS2
protein kinase physically interacts with and is activated by the
calcium-binding protein SOS3 [J]. Proc. Natl. Acad. Sci. USA,
2000, 97(7): 3735-3740.
[68] QUAN R, LIN H, MENDOZA I,et al .. SCABP8/CBL10, a
putative calcium sensor, interacts with the protein kinase SOS2
to protect Arabidopsis shoots from salt stress [J]. Plant Cell,
2007, 19(4): 1415-1431.
[69] KIM W Y,ALI Z,PARK H J,et al .. Release of SOS2 kinase
from sequestration with GIGANTEA determines salt tolerance
in Arabidopsis [J/OL]. Nat. Commun., 2013, 4:2357 [2022-09-
28]. https://doi.org/10.1038/ncomms2357.
[70] YANG Z J, WANG C W, XUE Y, et al .. Calcium-activated
14-3-3 proteins as a molecular switch in salt stress
tolerance [J/OL]. Nat. Commun., 2019, 10(1) :09181 [2022-09-
28]. https://doi.org/10.1038/s41467-019-09181-2.
[71] FUKUDA A, CHIBA K, MAEDA M,et al .. Effect of salt and
osmotic stresses on the expression of genes for the vacuolar H+-
pyrophosphatase, H+-ATPase subunit A, and Na+/H+ antiporter
from barley [J]. J. Exp. Bot., 2002, 55(397): 585-594.
[72] YANG Y Q, GUO Y. Unraveling salt stress signaling in
plants [J]. J. Integr. Plant Biol., 2018, 60(9): 796-804.
[73] PLANAS-RIVEROLA A,GUPTA A,BETEGON-PUTZE I,et al..
Brassinosteroid signaling in plant development and adaptation
to stress [J/OL]. Development, 2019, 146(5): 151894 [2022-09-
28]. https://doi.org/10.1242/dev.151894.
[74] LI J F,ZHOU H P,ZHANG Y,et al .. The GSK3-like kinase
BIN2 is a molecular switch between the salt stress response
and growth recovery in Arabidopsis thaliana [J]. Dev. Cell,
2020, 55(3): 367-380.
[75] ZHANG S S, CAI Z Y, WANG X L. The primary signaling
outputs of brassinosteroids are regulated by abscisic acid
signaling [J]. Proc. Natl. Acad. Sci. USA, 2009, 106(11): 4543-
4548.
[76] ZHAO X, DOU L R, GONG Z Z, et al .. BES1 hinders
ABSCISIC ACID INSENSITIVE5 and promotes seed
germination in Arabidopsis [J]. New Phytol., 2019, 221(2):
908-918.
[77] CHEN J,YU F,LIU Y,et al .. FERONIA interacts with ABI2-
type phosphatases to facilitate signaling cross-talk between
abscisic acid and RALF peptide in Arabidopsis [J]. Proc. Natl.
Acad. Sci. USA, 2016, 113(37): 5519-5527.
[78] KANCHAN V, NEHA U, NITIN K, et al .. Abscisic acid
signaling and abiotic stress tolerance in plants: a review on
current knowledge and future prospects [J/OL]. Front. Plant
Sci., 2017, 8: 161 [2022-09-28]. https://doi.org/10.3389/
fpls.2017.00161.
[79] XIA X J, GAO C J, SONG L X, et al .. Role of H2O2 dynamics
in brassinosteroid-induced stomatal closure and opening in
Solanum lycopersicum [J]. Plant Cell Environ., 2014, 37(9):
2036-2050.
[80] HAUBRICK L L, TORSETHAUGEN G, ASSMANN S M, et
al .. Effect of brassinolide, alone and in concert with abscisic
acid, on control of stomatal aperture and potassium currents of
Vicia faba guard cell protoplasts [J]. Physiol. Plantarum, 2006,
128(1): 134-143.
[81] LI J G,FAN M,HUA W,et al .. Brassinosteroid and hydrogen
peroxide interdependently induce stomatal opening by
promoting guard cell starch degradation [J]. Plant Cell, 2020,
32(4): 984-999.
[82] ?BRAH?M E,RIG? G,SZ?KELY G,et al .. Light-dependent
induction of proline biosynthesis by abscisic acid and salt
stress is inhibited by brassinosteroid in Arabidopsis [J]. Plant
Mol. Biol., 2003, 51(3): 363-372.
[83] HANSEN M, CHAE H S, KIEBER J J. Regulation of ACS
protein stability by cytokinin and brassinosteroid [J]. Plant J.,
2009, 57(4): 606-614.
[84] PENG J Y, LI Z H, WEN X, et al .. Salt-induced stabilization of
EIN3/EIL1 confers salinity tolerance by deterring ROS
accumulation in Arabidopsis [J/OL]. PLoS Genet., 2014,
10(10): 1004664 [2022-09-28]. https://doi.org/10.1371/journal.
pgen.1004664.
[85] CHEN Y,CAO C,GUO Z,et al .. Herbivore exposure alters ion
fluxes and improves salt tolerance in a desert shrub [J]. Plant
Cell Environ., 2020, 43(2): 400-419.
[86] BAO F,SHEN J,BRADY S R,et al .. Brassinosteroids interact with
auxin to promote lateral root development in Arabidopsis [J]. Plant
Physiol., 2004, 134(4): 1624-1631.
[87] MOUBAYIDIN L, PERILLI S, DELLO IOIO R, et al .. The rate
of cell differentiation controls the Arabidopsis root meristem
growth phase [J]. Curr. Biol., 2010, 20(12): 1138-1142.
[88] MOUCHEL C F, OSMONT K S, HARDTKE C S. BRX
mediates feedback between brassinosteroid levels and auxin
signalling in root growth [J]. Nature, 2006, 443(7110): 458-461.
[89] YOSHIMITSU Y, TANAKA K, FUKUDA W, et al ..
Transcription of DWARF4 plays a crucial role in auxinregulated
root elongation in addition to brassinosteroid
homeostasis in Arabidopsis thaliana [J/OL]. PLoS One, 2011,
6(8): e0023851 [2022-09-28]. https://doi.org/10.1371/journal.
pone.0023851.
[90] WASTERNACK C, HAUSE B. A bypass in jasmonate
biosynthesis-the OPR3-independent formation [J]. Trends
Plant Sci., 2018, 23(4): 276-279.
(責任编辑:胡立霞)

