妇科恶性肿瘤化疗患者营养状况降低的影响因素
刘志超,窦现凤,赵海灵
[新乡市中心医院(新乡医学院第四临床学院) a.临床营养科;b.妇科肿瘤,河南 新乡 453000]
妇科恶性肿瘤是威胁女性生命安全的主要因素,近年来随生活、学习、工作习惯发生变化,乳腺癌、卵巢癌等妇科相关恶性肿瘤发生率不断升高,化疗是术后辅助治疗及晚期姑息疗法中的重要治疗方式,被认为是癌症五大治疗手段之一[1]。但因化疗药物具有较强细胞毒性,会刺激机体消化系统,影响代谢与免疫,使得机体处于高度应激状态,增加营养不良风险[2]。临床证据已证实,患者营养状况与其生存期存在相关性,长期营养不良会对机体免疫及代谢产生不利影响,增加并发症风险,影响疗效,还会加重家庭经济负担[3]。但目前关于妇科恶性肿瘤化疗患者营养状况的研究较少。本研究开展横断面研究,调查247例妇科恶性肿瘤患者营养状况,并分析营养状况降低的危险因素,以期为临床诊疗提供参考。
1 对象与方法
1.1 研究对象
本研究选取2023年3月至2023年7月247例妇科恶性肿瘤患者开展横断面研究。纳入标准:经影像学、病理学检查确诊为妇科恶性肿瘤;年龄≥18岁;接受化疗;具备正常语言、认知能力;预计生存时间>6个月;患者及家属知晓研究目标及意义,承诺配合研究,自愿签署同意书。排除标准:存在精神类疾病诊断史者;伴有重要器官器质性损伤者;孕期、哺乳期女性;同期接受其他研究可能影响本次调查结果。本次选例253例,发放问卷253份,有效回收247份,有效回收率97.63%。
1.2 营养状况降低标准
研究人员一对一指导患者完成主观整体评估问卷(patient-generated subjective global assessment,PG-SGA)[4],问卷涉及4个方面:患者自评、疾病状态、代谢应激情况、体格检查,评分越高表示营养状况越差,依据评分分为4个等级,营养良好(0~1分)、可疑营养不良(2~3分)、中度营养不良(4~8分)、重度营养不良(≥9分)。
1.3 调查工具
(1)临床资料调查表,由本研究小组制定临床资料调查表,收集资料,包括①一般资料,年龄、受教育程度、保险情况、职业、居住状态、经济水平、居住地等;②诊疗资料,收集化疗前患者体质量指数(body mass index,BMI)、卡氏评分、TNM分期、疾病类型、糖尿病史、高血压史等,同时临床调查患者是否接受手术根治术、化疗周期、化疗方案、是否接受放疗等;③实验室资料,收集化疗前患者血清白蛋白、血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)、中性粒细胞与淋巴细胞比值(neutrophil-lymphocyte ratio,NLR)、淋巴细胞总数水平。(2)焦虑情绪:采用焦虑自评量表(self-rating anxiety scale,SAS)[5]评估,共20个条目,均应用1~4分评分法,总分换算为百分制评分,评分越高,表示情绪越焦虑,将评分≥50分患者定义为存在焦虑情绪,反之为不存在焦虑情绪。(3)抑郁情绪:采用抑郁自评量表(self-rating depression scale,SDS)[6]评估,量表涉及20个自评条目,包括4个维度,均按照1~4分评分法,总分换算为百分制评分,将评分≥53分,定义为存在抑郁情绪,反之为不存在抑郁情绪。(4)应对方式:采用简明应对方式问卷(simple coping style questionnaire,SCSQ)[7]评估,包括2个维度:消极应对、积极应对,评分范围分别为0~24分、0~36分,评分越高说明患者越倾向于选择对应维度的应对方式,各维度独立评分后计算均分,若积极维度总均分≥消极维度,表示患者选择积极应对方式,反之表示患者选择消极应对方式。(5)睡眠障碍:以匹兹堡睡眠质量量表(Pittsburgh sleep quality index,PSQI)[8]从7个维度评估,共18个条目,总分21分,>7分表示存在睡眠障碍,评分越高说明睡眠质量越差。(6)前1周饮食状况:参考“营养日”(nutrition day)模式营养状况调查表[9]制定饮食调查问卷,收集患者前1周饮食量,与化疗前日常饮食状态进行对比,饮食量增加,或减少量<10%,为正常;饮食量明显减少,减少量10%~50%,为减少;饮食量显著下降,减少量>50%,为较差。(7)化疗药物所致恶心呕吐(chemotherapy-induced nausea and vomiting,CINV)程度分级:根据患者恶心情况分为5个等级,未出现恶心、呕吐,为0级;仅出现恶心,未呕吐,为Ⅰ级;出现一过性恶心、呕吐,为Ⅱ级;呕吐明显,常规药物治疗后可控制,为Ⅲ级;呕吐难以控制,为Ⅳ级。(8)味觉改变:以化疗相关性味觉改变量表(chemotherapy induced taste alteration scale,CiTAS)[10]从4个方面评估,总分90分,各维度总和为最终得分,得分>18分说明味觉发生改变,且得分越高,味觉障碍越严重。
1.4 统计学分析

2 结果
2.1 营养状况降低现况
247例妇科恶性肿瘤化疗患者有75例出现营养状况降低,发生率为30.36%,其中16例(21.33%)为可疑营养不良,中度营养不良占比54.67%(41例),重度营养不良占比24.00%(18例)。
2.2 两组患者临床资料比较
两组在TNM分期、化疗周期、经济水平、焦虑、抑郁、应对方式、味觉改变、前1周饮食状况、CINV程度分级、血清白蛋白、PLR、NLR及淋巴细胞总数方面对比,差异有统计学意义(P<0.05)。见表1。
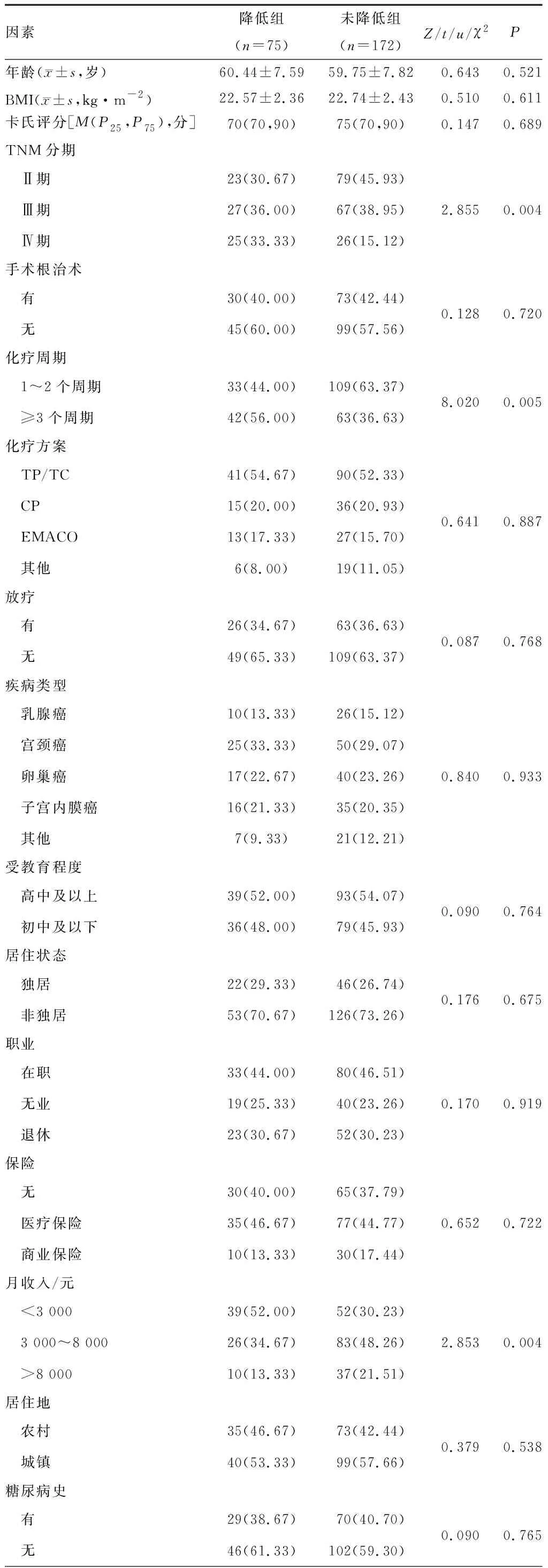
表1 两组临床资料比较
2.3 lasso筛选
以妇科恶性肿瘤化疗患者是否发生营养状况降低为因变量,将表1中差异有统计学意义的13个指标作为自变量,如表2赋值,采用R软件中glmnet进行lasso分析,最佳因素选择的效果图见图1,采用交叉验证法寻找最佳惩罚系数λ,见图2,当惩罚系数λ=0.11时模型性能优良且影响因素最少,此λ值对应6个预测因素:TNM分期、经济水平、抑郁、味觉改变、前1周饮食状况、血清白蛋白。
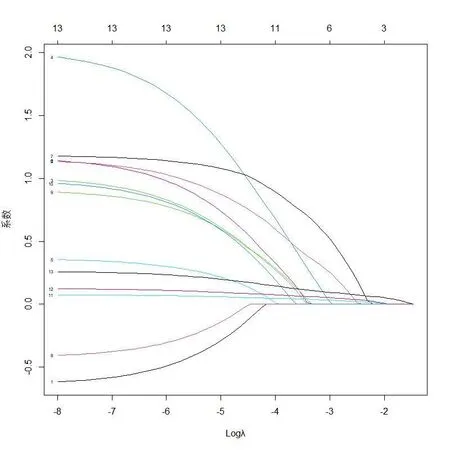
图1 lasso回归筛选变量动态过程图
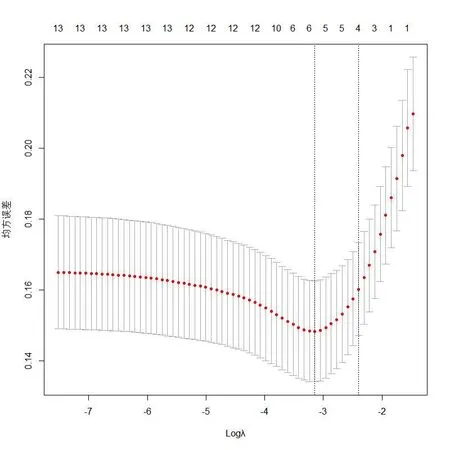
图2 交叉验证最佳参数λ选择过程图

表2 赋值方法
2.4 多因素分析
将lasso回归筛选出的6个变量带入logistic多因素回归分析,结果显示,TNM分期、抑郁、前1周饮食状况、味觉改变、血清白蛋白是妇科恶性肿瘤化疗患者营养状况降低的影响因素(P<0.05)。见表3。
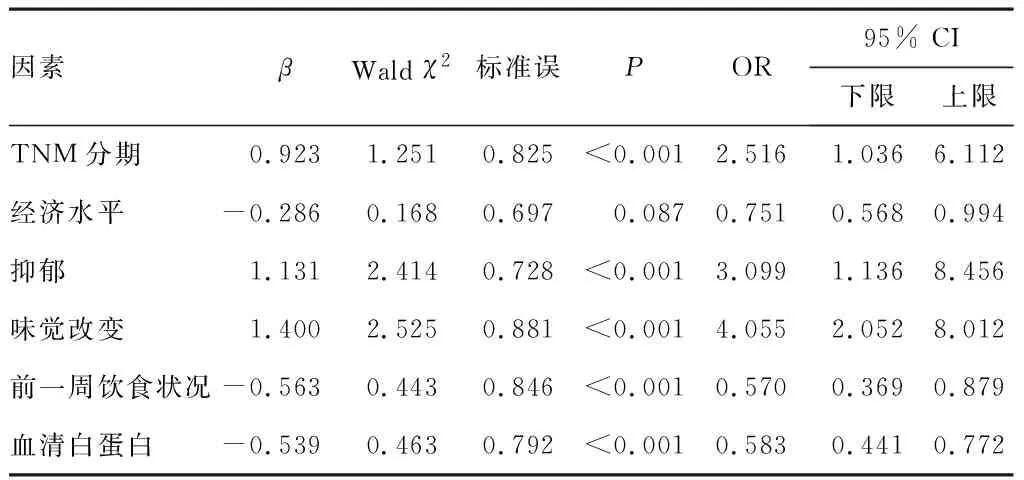
表3 多因素logistic回归分析结果
3 讨论
本研究结果显示,247例妇科恶性肿瘤化疗患者营养降低发生率30.36%,低于消化道恶性肿瘤化疗患者35.4%[11]。妇科恶性肿瘤患者病位在乳腺、生殖系统,化疗药物毒性对患者胃肠道消化、吸收能力的影响较小,营养不良风险较低。但化疗期间,机体对营养物质的消耗增加,摄入减少,双重作用下导致血浆蛋白降低、能量代谢异常,不利于患者预后恢复[12]。因此,积极探讨营养状况影响因素,对采用预见性护理措施具有重要意义。
本研究经lasso回归模型变量筛选及logistic多因素分析发现,TNM分期、抑郁、前1周饮食状况、味觉改变、血清白蛋白是妇科恶性肿瘤化疗患者营养状况降低的影响因素。(1)周欣等[13]研究表示,肿瘤分期与恶性肿瘤放疗患者营养不良存在相关性,与本研究观点相似。TNM分期越高患者接受药物干预等医源性刺激较多,机体长期处于高应激、高代谢状态,对营养物质的需求增多、消耗增多,加重营养不良风险。(2)味觉改变是妇科肿瘤化疗患者营养状况降低的独立危险因素。倪玉丹等[14]研究证实,老年消化道肿瘤味觉改变患者营养不良发生率为50.00%,高于未改变组21.21%。环磷酰胺、顺铂、紫杉醇等化疗药物会直接刺激患者味蕾系统,导致味觉相关细胞萎缩甚至凋亡,引起味觉异常丧失[15]。化疗患者因味蕾损伤,难以感受大多数食物滋味,导致食欲降低,还可能出现偏食甚至厌食等问题,增加营养状况降低风险。(3)味觉改变降低患者食欲,继而对患者饮食状况产生影响。合理营养摄入是维持机体正常生理代谢的基础,但化疗患者因胃肠道反应等毒副作用会表现出不同程度胃肠道反应,导致能量物质摄入减少,无法满足机体活动及抗肿瘤治疗对营养物质的需求,直接引起营养不良。(4)有抑郁情绪患者营养状况降低风险是无抑郁情绪患者的3.099倍。妇科恶性肿瘤患者因本身疾病及治疗会出现生理痛苦,继而催生不良情绪,即便在享受食物时也不能感受到幸福感,会影响食欲,降低营养状态。
本研究单因素分析中,化疗前降低组血清白蛋白低于未降低组,且多因素分析也发现,化疗前血清白蛋白与患者营养状况降低相关。妇科恶性肿瘤患者因个体化差异在接受化疗前身体状态处于不同水平,若本身体重较轻,脂肪储备较少,在接受化疗治疗后会加重机体损耗,导致营养状况下降。此外,临床对于营养不良的评估方式不一。杨宇等[16]研究对218例肿瘤患者营养状况进行调查,显示以PG-SGA量表为诊断依据患者营养不良阳性率为43.58%,而以血清白蛋白为诊断依据则显示有39.91%患者存在营养不良。PG-SGA量表包括患者自评及医护人员评估内容,被美国营养协会确定为恶性肿瘤患者营养筛查首选方式,其与血清白蛋白均在评估患者营养状况中具有良好灵敏度及特异度。但因选择评估工具不同可能造成最终结果分析存在差异,也提示临床下一步可尝试联合实验室指标、主观指标等综合测定患者营养情况,以获得更精确结论。
4 结论
妇科恶性肿瘤化疗患者营养状况降低与TNM分期、抑郁等因素相关,临床可依据本研究分析,提前开展有效干预措施以减少营养状况降低的风险。

