血清IL-2、sST2表达与特发性膜性肾病免疫抑制剂治疗反应性的相关性
王念华,吴玉彩
(濮阳市人民医院 肾内科,河南 濮阳 457000)
特发性膜性肾病为临床常见肾病综合征类型,患者若未得到及时有效治疗,随着疾病进展,可发展为终末期肾病,危及生命[1]。目前,临床针对特发性膜性肾病多在初期单用糖皮质激素治疗,但对于诱导疾病缓解及肾功能保护方面无明显效果,患者的治疗反应性欠佳。为提高特发性膜性肾病临床治疗有效率,免疫抑制剂逐渐应用于该病的治疗中,可有效延缓肾功能的持续下降[2]。但免疫抑制剂在治疗的同时易引起骨髓抑制,并对血液系统造成影响,导致部分特发性膜性肾病患者治疗反应性较差,疾病无法得到有效缓解,从而影响预后[3]。因此,寻找与特发性膜性肾病患者免疫抑制剂治疗反应性有关的指标,对早期判断患者预后并调整治疗方案具有重要意义。研究表明,免疫反应的异常及炎症介质的释放与特发性膜性肾病的发生与发展密切相关,其病理机制为免疫功能紊乱损伤肾组织后所产生的炎症导致[4]。血清白介素-2(interleukin-2,IL-2)为一种具有多种生物活性的细胞因子,可溶性生长刺激表达基因2蛋白(soluble growth stimulating expression gene 2 protein,sST2)为白介素-1(interleukin-1,IL-1)受体家族中的成员之一,二者均被证实在膜性肾病的发生与发展中起重要作用[5-6]。但对于二者是否与特发性膜性肾病患者免疫抑制剂治疗反应性有关尚无明确结论,基于此,本研究旨在分析血清IL-2、sST2与特发性膜性肾病患者免疫抑制剂治疗反应性的关系,为临床调整治疗方案、提高治疗效果提供参考。
1 资料与方法
1.1 一般资料
本研究经医院医学伦理委员会审批通过,前瞻性选取2020年1月至2022年10月于医院接受免疫抑制剂治疗的135例特发性膜性肾病患者。其中男71例,女64例;年龄44~64岁,平均(53.45±4.18)岁;体重指数16.0~30.3 kg·m-2,平均(23.10±2.45)kg·m-2。纳入标准:(1)符合第9版《内科学》[7]中特发性膜性肾病诊断标准,且经由肾穿刺活检明确诊断;(2)年龄>18岁;(3)认知功能及精神状态正常;(4)经过至少6个月降压及降蛋白尿治疗后,24 h尿蛋白仍持续超过4 g且维持在基线水平50%以上,无下降趋势;(5)患者及家属均知情同意。排除标准:(1)近3个月接受过免疫抑制剂治疗;(2)妊娠期或哺乳期女性;(3)伴有恶性肿瘤;(4)伴有血液系统或免疫系统疾病;(5)伴有心、肝等其他重要器官疾病;(6)参与其他研究。剔除及脱落标准:(1)未能完成规律治疗;(2)研究中患者或家属主动要求退出。
1.2 治疗方法
所有患者入院后均依据治疗指南[8]接受规范治疗,在限钠、降尿蛋白、调脂等对症治疗及糖皮质激素治疗的同时联合免疫抑制剂治疗。治疗第1个月,静脉滴注甲泼尼龙注射液(重庆华邦制药有限公司生产,国药准字H20143136)每次1 g,静滴3 d后改为口服甲泼尼龙片(天津金耀药业有限公司生产,国药准字H20020224)0.5 mg·kg-1·d-1,连续口服27 d;治疗第2个月,口服环磷酰胺片(吉林海通制药有限公司生产,国药准字H22024086)2 mg·kg-1·d-1,连续口服30 d;治疗第3、5个月重复第1个月治疗方案;治疗第4、6个月重复第2个月治疗方案。共治疗6个月。
1.3 观察指标
1.3.1一般资料
详细询问并记录患者一般资料,包括性别、年龄、体重指数、病程、入院时血压、入院时肾功能分级、疾病分期。
1.3.2实验室资料
于入院时检测患者血清IL-2、sST2。具体方法:抽取患者空腹状态下外周静脉血5 mL,采用3 000 r·min-1转速、15 cm离心半径离心处理10 min,取离心后血清,采用化学发光法检测血清IL-2水平,试剂盒购自英国西门子医学诊断产品有限公司,采用酶联免疫法检测血清sST2水平,试剂盒购自广州春康生物科技有限公司。
1.3.3治疗反应性判定方法
于治疗前及治疗完成后收集患者24 h全部尿液,采用比浊法测定24 h尿蛋白定量[9],试剂盒购自上海执诚生物科技有限公司。将治疗后24 h尿蛋白定量<3.5 g,且与治疗前对比减少超过50%,血清白蛋白浓度和肌酐改善明显或恢复正常判定为疾病缓解,将患者纳入缓解组;将24 h尿蛋白定量减少未达到50%或出现肾功能恶化判定为未缓解,患者纳入未缓解组。
1.4 统计学方法

2 结果
2.1 治疗反应性
135例特发性膜性肾病患者中有1例患者未完成规律治疗,2例患者主动要求退出研究,最终共有132例完成规律治疗,经免疫抑制剂治疗后共有101例疾病缓解,纳入缓解组,其余31例患者纳入未缓解组。
2.2 一般资料与实验室资料
未缓解组年龄、入院时肾功能分级、疾病分期、血清IL-2、sST2水平均高于缓解组(P<0.05);两组性别、病程等一般资料对比,差异无统计学意义(P>0.05)。见表1。
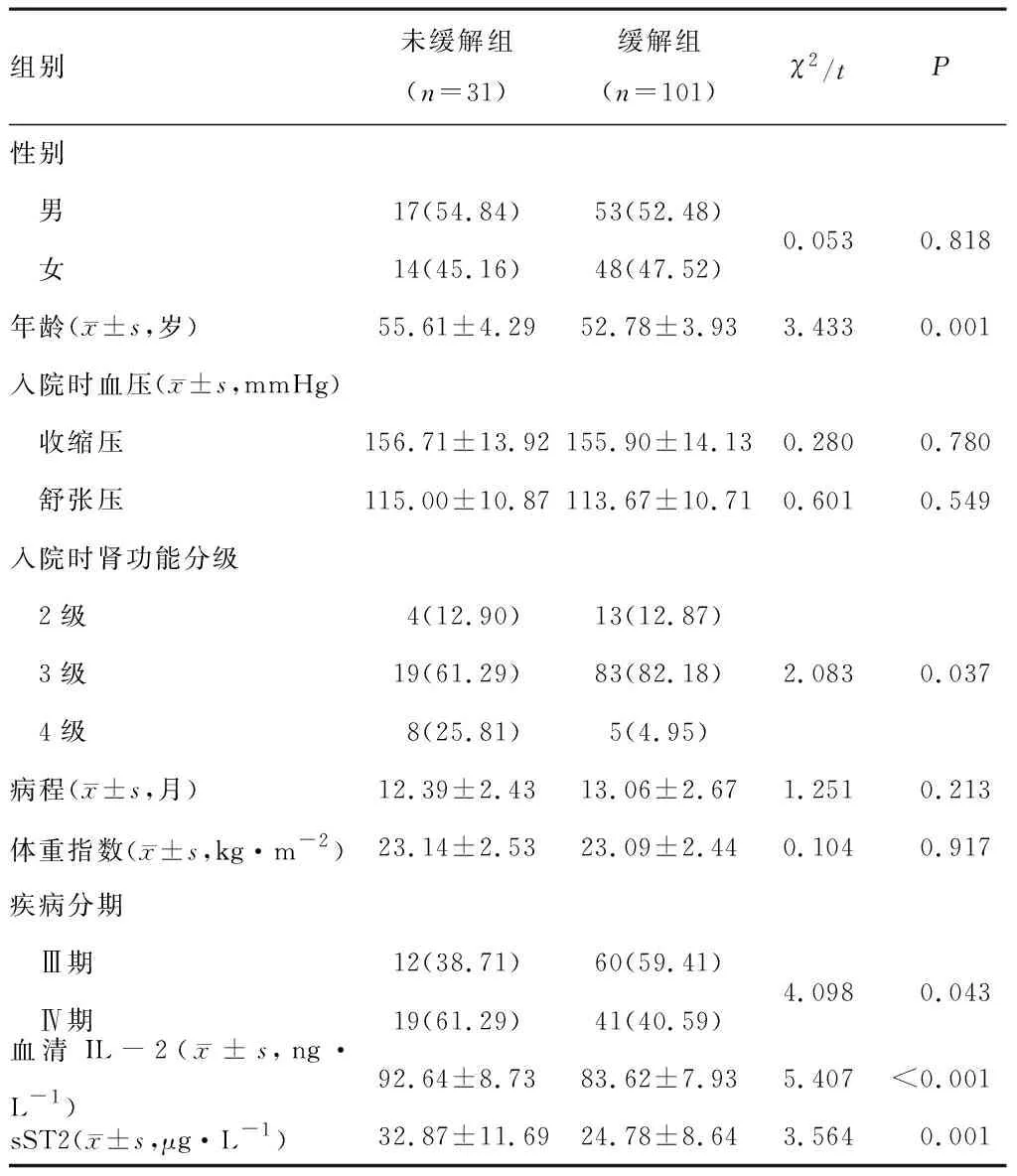
表1 两组一般资料与实验室资料对比
2.3 血清IL-2、sST2水平与特发性膜性肾病免疫抑制剂治疗反应性关系
点二列相关性分析显示,血清IL-2、sST2水平与特发性膜性肾病免疫抑制剂治疗反应性不良风险呈正相关(r1=0.428,P1<0.001;r2=0.344,P2<0.001)。
2.4 血清IL-2、sST2水平预测特发性膜性肾病免疫抑制剂治疗反应性分析
绘制ROC曲线,结果显示,血清IL-2、sST2预测特发性膜性肾病免疫抑制剂治疗反应性不良的AUC均>0.7,具有一定预测价值,且联合预测价值更高。见表3。
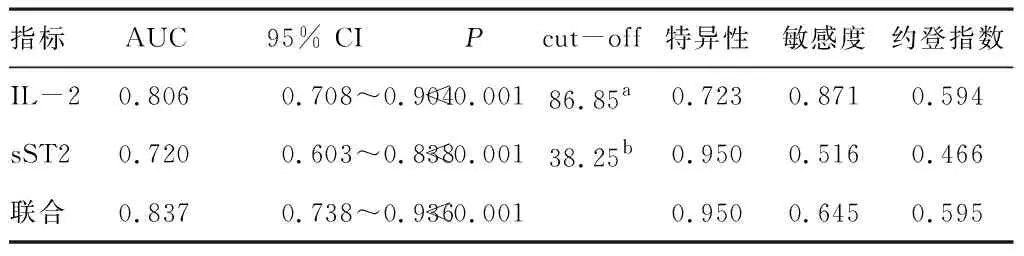
表3 血清IL-2、sST2水平预测特发性膜性肾病免疫抑制剂治疗反应性分析
3 讨论
免疫抑制剂治疗特发性膜性肾病可通过抑制与免疫反应相关细胞的增殖功能,降低机体免疫反应来达到缓解肾功能下降的目的[10]。谢新富等[11]将糖皮质激素与环磷酰胺联合应用于特发性膜性肾病的治疗中,发现二者联合应用可显著改善患者临床症状,疗效显著。但仍有部分患者经免疫抑制剂治疗后肾功能无法得到有效缓解,甚至出现复发,加重病情。本研究132例特发性膜性肾病患者中有31例患者经规范治疗后疾病仍未得到有效缓解,疾病缓解率为76.52%,高于徐丽梨等[12]研究中63.2%的疾病缓解率,考虑与本研究对象年龄较低有关。由此可见,特发性膜性肾病患者免疫抑制剂治疗反应性不佳,寻找与治疗反应性有关的指标对于指导临床治疗方案的调整具有重要意义。
血清IL-2为常见γ链细胞因子家族的成员之一,可通过与其受体结合产生信号复合物参与炎症、自身免疫性疾病、癌症等严重疾病的发生与发展[13]。sST2具有可溶性形式和跨膜形式,可诱导释放细胞因子及趋化因子,从而引起炎症瀑布反应[14]。而特发性膜性肾病的发生、发展与体内炎症反应及免疫功能紊乱密切相关,因此推测血清IL-2、sST2或与特发性膜性肾病患者治疗反应性有关。本研究中未缓解组入院时血清IL-2、sST2均高于缓解组,点二列相关性分析显示二者水平与特发性膜性肾病患者免疫抑制剂治疗反应性不佳呈正相关,且经由ROC曲线分析表明,二者均可作为预测特发性膜性肾病患者免疫抑制剂治疗反应性不佳的有效指标,且联合预测价值更高。分析其原因,血清IL-2为T细胞生长因子,可促进B细胞生长及免疫球蛋白的产生,从而加快免疫复合物的形成速度,参与机体的免疫应答与免疫反应。血清IL-2水平的升高表明机体内B淋巴细胞不断被活化形成浆细胞,并能够产生特异性抗体,与抗原发生免疫反应,从而激活补体产生免疫溶解作用,造成免疫病理损伤,进而降低肾脏的清除能力,引起肾小球滤过功能下降,加重患者病情,最终导致患者对免疫抑制剂治疗反应性不佳。sST2为白介素-33(interleukin-33,IL-33)的可溶性受体,可诱导肾CD4+T细胞的浸润,产生趋化因子并诱导大量的炎症细胞生成,进而引起肾小球、肾小管等出现继发性病变,最终导致肾脏损伤,影响特发性膜性肾病患者免疫抑制剂治疗的反应性[15]。因此,对二者联合检测可更为全面地了解特发性膜性肾病患者机体的免疫应答反应与炎症反应水平,从而更好地判断患者病情,较为准确地预测免疫抑制剂治疗反应性。
此外,本研究对比两组患者一般资料及临床资料发现,未缓解组年龄、肾功能分级及疾病分期均高于缓解组,提示上述指标或与特发性膜性肾病患者免疫抑制剂治疗反应性有关。但考虑本研究主要分析血清IL-2、sST2表达对治疗反应性的影响,未对上述指标与治疗反应性之间的关系进行进一步分析,为本研究局限性之一,未来仍需展开进一步研究加以明确。
4 结论
血清IL-2、sST2表达水平越高,特发性膜性肾病患者免疫抑制剂治疗反应性越差,且对二者进行联合检测可作为预测特发性膜性肾病患者免疫抑制剂治疗反应性的敏感指标。

