重症急性胰腺炎患者并发急性肾损伤的影响因素分析
林珊羽 王飞龙 朱建华

基金项目:浙江省医药卫生科技计划项目(2022KY1117,2023KY255)
作者单位:315000 宁波,宁波大学医学部(林珊羽);上海 200120,上海东方医院(王飞龙);315000 宁波,宁波大学附属第一医院重症医学科(朱建华)
通信作者:朱建华,E-mail: fyyzhujianhua@ndu.edu.cn
【摘要】目的 探討重症急性胰腺炎(SAP)患者并发急性肾损伤(AKI)的影响因素。方法 采用回顾性研究的方法,收集66例SAP患者的临床资料,根据是否并发AKI分为AKI组和非AKI组,分别采用Logistic回归和受试者操作特征(ROC)曲线分析SAP患者并发AKI的危险因素。结果 SAP合并AKI患者的总体年龄和急性生理学和慢性健康状况评价(APACHEⅡ)评分高于未合并者,但糖尿病多见于未合并者(P < 0.05)。与非AKI组相比,AKI组患者入院时的CRP、全身炎症反应指数(SIRI)、血清肌酐、CRP/白蛋白比值、D-二聚体升高,但三酰甘油-葡萄糖(TyG)指数、白蛋白、总胆固醇、HDL-C、血钙水平下降(P < 0.05)。逐步回归分析结果显示,APACHEⅡ评分升高、SIRI升高、血小板/淋巴细胞比值(PLR)升高、全身免疫炎症指数(SII)降低、血钙水平下降是SAP患者并发AKI的独立危险因素(P < 0.05)。ROC曲线结果显示,除血清肌酐外,APACHEⅡ评分、SIRI指数、血钙水平对SAP患者并发AKI有一定的诊断价值,其中APACHEⅡ评分的AUC为0.880(95% CI 0.787~0.974,截断值11.50分),SIRI指数的AUC为0.662(95% CI 0.521~0.804,截断值 10.89),血钙水平的AUC为0.754(95% CI 0.627~0.881,截断值2.07 mmol/L),P均< 0.05;当上述三种指标联合血清肌酐时可进一步提高对于SAP患者并发AKI 的诊断效能,其中血清肌酐+血钙的AUC最大,达0.969(95% CI 0.929~1.000,P < 0.05)。结论 APACHEⅡ评分、SIRI指数、PLR指数、SII指数、血钙水平是SAP并发AKI的影响因素,APACHEⅡ评分、SIRI指数和血钙水平对SAP患者并发AKI具有诊断价值,三者联合血清肌酐可提高对AKI的诊断效能,为临床识别SAP患者并发AKI提供新的手段。
【关键词】重症急性胰腺炎;急性肾损伤;炎症;血钙;血清肌酐;急性生理学和慢性健康状况评价;
全身炎症反应指数
Analysis of risk factors of acute kidney injury in patients with severe acute pancreatitis Lin Shanyu△, Wang Feilong, Zhu Jianhua.△Health Science Center, Ningbo University, Ningbo 315000, China
Corresponding author: Zhu Jianhua, E-mail: fyyzhujianhua@ndu.edu.cn
【Abstract】Objective To investigate the risk factors of acute kidney injury (AKI) in patients with severe acute pancreatitis (SAP). Methods Clinical data of 66 patients with SAP were collected in this retrospective study. All patients were divided into the AKI and non-AKI groups according to whether they were complicated with AKI. The risk factors of AKI in patients with SAP were identified by using Logistic regression analysis and receiver operating characteristic (ROC) curve. Results The overall age and Acute Physiology and Chronic Health Evaluation (APACHE) Ⅱscore of SAP patients complicated with AKI were higher than those without AKI, but diabetes mellitus was more common in non-AKI patients (all P < 0.05). Patients in the AKI group had higher levels of hypersensitive C-reactive protein (CRP), systemic inflammatory response index (SIRI), creatinine (Scr), CRP/Albumin (Alb) index and D-dimer (DDI) upon admission, whereas had lower fasting triglyceride and glucose simple index (TyG), Alb, total cholesterol, high density lipoprotein cholesterol (HDL-C) and blood calcium levels compared with their counterparts without AKI, and the differences were statistically significant (all P < 0.05). Stepwise regression analysis showed that increased APACHEⅡ score, increased SIRI index, increased PLR index, decreased SII index and decreased blood calcium were the independent risk factors for SAP patients complicated with AKI (all P < 0.05). ROC curve results showed that in addition to Scr, APACHEⅡ score, SIRI index and blood calcium had certain diagnostic value in SAP patients complicated with AKI, among which the area under the ROC curve (AUC) of APACHEⅡ score was 0.880 (95% CI 0.787-0.974, optimal cutoff value 11.50), 0.662 (95% CI 0.521-0.804, optimal cutoff value 10.89) for SIRI index, and 0.754 (95% CI 0.627-0.881, optimal cutoff value 2.07 mmol/L) for blood calcium level (all P < 0.05). The combination of the above three indexes with Scr could further improve the diagnostic value for AKI in SAP patients, among which the AUC of Scr + blood calcium was the largest, reaching 0.969 (95% CI 0.929-1.000, P < 0.05). Conclusions APACHEⅡ score, SIRI index, PLR index, SII index and blood calcium level are the independent risk factors of AKI in SAP patients. APACHEⅡ score, SIRI index and blood calcium have diagnostic value in SAP patients complicated with AKI. The combination of these three indexes with Scr can significantly improve the diagnostic efficiency for AKI, providing a novel diagnostic approach for AKI in SAP patients.
【Key words】Severe acute pancreatitis; Acute kidney injury; Inflammation; Blood calcium; Serum creatinine;
Acute physiology and chronic health evaluation; systemic inflammatory response index
急性胰腺炎是重症医学科常见的消化道疾病,主要临床表现为剧烈腹痛、恶心、呕吐和发热等。根据严重程度,急性胰腺炎可分为轻症急性胰腺炎、中重症和重症急性胰腺炎(SAP),其中轻症急性胰腺炎常具有自限性,SAP则可并发全身MODS而危及生命。据流行病学统计,SAP患者的比例在8%~20%之间[1]。急性肾损伤(AKI)是SAP的常见并发症之一,通常发生在病程晚期,多见于呼吸衰竭、心脏衰竭后。急性胰腺炎合并AKI的发病率为7.9%,一旦发生AKI,患者病死率可达25%~75%,即使抢救成功仍可能遗留慢性胰腺炎、慢性肾脏病等并发症[2]。因此,早期识别SAP患者并发AKI的影响因素,对评估病程发展及预后情况至关重要。已有研究表明,三酰甘油-葡萄糖(TyG)指数、全身炎症反应指数(SIRI)、全身免疫炎症指数(SII)、血小板/淋巴细胞比值(PLR)、中性粒细胞-淋巴细胞比值(NLR)、CRP/白蛋白比值等与急性胰腺炎或AKI病程有关,但这些指标能否有效预测SAP合并AKI目前尚不明确[3-5]。鉴于此,本研究将探讨SAP患者并发AKI的影响因素,以期为早期识别并进行治疗干预提供理论依据和指标。
对象与方法
一、研究对象
回顾性收集2021年6月至2023年7月宁波大学附属第一医院重症医学科收治的66例SAP患者临床资料。纳入标准:确诊SAP。排除标准:①妊娠期患者;②慢性肾脏病长期透析者;③肾移植者;④恶性肿瘤终末期出现恶病质表现者;⑤生存时间或入院时间小于72 h者。根据患者出院前是否诊断AKI分为AKI组和非AKI组,其中AKI组23例、非AKI组43例。本研究为回顾性研究,不干预患者治疗方案,患者免签知情同意书,已获得宁波大学附属第一医院医学伦理委员会批准(批件号:2023-130RS)。
二、诊断标准
根据2012年改善全球肾脏病预后组织(KDIGO)指南,符合以下其中一项可诊断为AKI:①48 h內血清肌酐上升0.3 mg/dL或25.6 μmol/L;
②7 d内血清肌酐上升至基础值的1.5倍;③持续6 h尿量<0.5 mL/(kg·h)[6]。SAP的诊断标准:①腹痛与胰腺炎相关疼痛性质一致,血清淀粉酶和(或)脂肪酶水平至少高于正常上限值3倍,影像学检查符合急性胰腺炎改变,上述3项中符合2项;②基于改良Marshall 评分,存在任一器官功能障碍;③根据修订版Atlanta分级(RAC)标准,存在超过48 h的单器官功能障碍或MODS[7-8]。
三、资料收集
从电子病历系统中获取患者治疗前/入院时(D0)以及病程期间第3日(D3)、第7日(D7)的临床资料和实验室检查指标,其中基本信息包括性别、年龄、BMI、个人史、基础疾病、生命体征、急性生理学和慢性健康状况评价(APACHEⅡ)评分等,实验室检查包括CRP、白细胞、血红蛋白、血小板、总胆红素、血清肌酐、甘油三酯、空腹血糖、总胆固醇、HDL-C、LDL-C、D-二聚体、血钙等指标。SII=中性粒细胞计数×血小板计数/淋巴细胞计数。SIRI=中性粒细胞计数×单核细胞计数/淋巴细胞计数。PLR=血小板计数/淋巴细胞计数。NLR=中性粒细胞计数/淋巴细胞计数。TyG指数= ln[空腹甘油三酯(mg/dL)×空腹血糖(mg/dL)/2][3-5]。
四、统计学处理
采用SPSS 25.0统计软件和GraphPad Prism 9.5绘图软件对数据进行分析处理。符合正态分布的计量资料以表示,组间比较采用t检验;偏态分布的计量资料以M(P25,P75)表示,两组间比较采用Mann-Whitney U检验;计数资料以n(%)表示,组间比较采用χ 2检验。根据治疗时间分为治疗前/入院时(D0)、治疗3 d后(D3)、治疗7 d后(D7)三组,采用Friedman检验评价相关指标是否随时间变化差异存在统计学意义,并用Bonferroni校正法进行组内比较;通过单因素和多因素Logistic回归分析AKI的影响因素。采用GraphPad Prism 9.5绘图软件绘制受试者操作特征(ROC)曲线并计算各AUC明确相关影响因素的诊断价值。P < 0.05为差异有统计学意义,Bonferroni校正法P < 0.017为差异有统计学意义。
结果
一、AKI组与非AKI组SAP患者的基本特征比较
本研究共纳入SAP患者66例,其中合并AKI的患者23例,未发生AKI患者43例。本研究人群基本为中青年患者,年龄中位数为35岁,男性占69.70%,BMI平均为26.99 kg/m?,高脂血症是最常见的基础疾病。AKI组患者的总体年龄和APACHEⅡ评分均高于非AKI组,但糖尿病多见于非AKI组(P < 0.05),其余个人史及入院时生命体征在AKI组与非AKI组SAP患者间比较差异均无统计学意义(P > 0.05)。见表1。
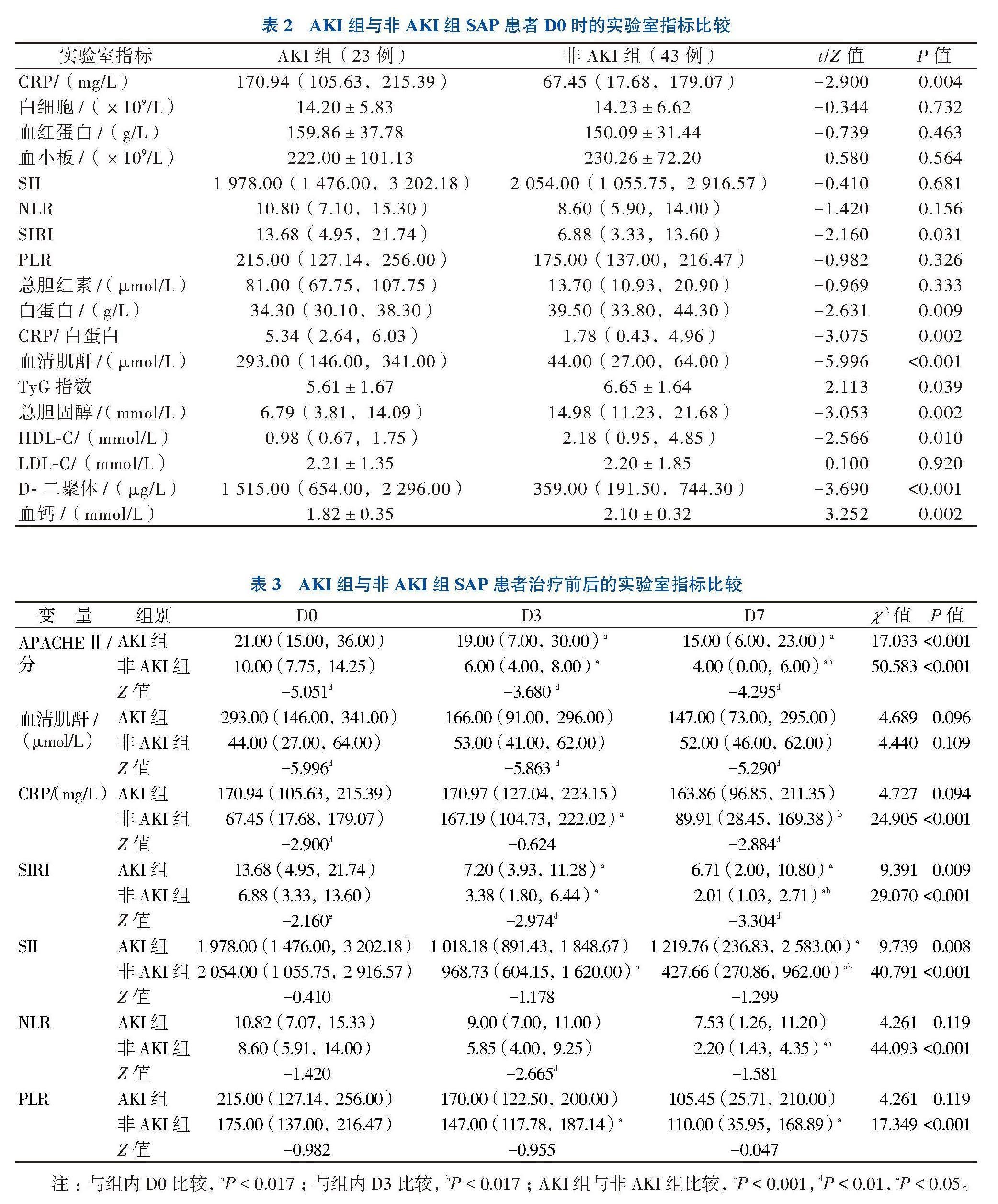
二、AKI组与非AKI组SAP患者的实验室指标比较
1. AKI组与非AKI组SAP患者D0时的实验室指标比较
与非AKI组相比,AKI组患者D0时的CRP、SIRI、血清肌酐、D-二聚体和CRP/白蛋白比值水平升高,但TyG指数、白蛋白、总胆固醇、HDL-C、血钙水平下降(P < 0.05)。其余实验室指标比较差异均无统计学意义(P均> 0.05)。见表2。
2. AKI组与非AKI组SAP患者治疗前后的实验室指标比较
Friedman检验显示,2组患者的APACHEⅡ评分、SIRI、SII随着时间呈现出变化趋势,比较差异均有统计学意义(P均< 0.05),而CRP水平、NLR、PLR的时间相关性仅在非AKI组比较差异有统计学意义(P均< 0.05),同时血清肌酐水平的变化比较差异无统计学意义(P > 0.05)。此外经Bonferroni法校正后发现,上述指标的组内差异多存在于D0~D3和D0~D7之间,而APACHEⅡ评分、CRP、SIRI、SII、NLR在非AKI组患者D3~D7比较差异有统计学意义(P均< 0.017)。2组患者在3个治疗时间点的APACHEⅡ评分、血清肌酐、CRP、SIRI比较均有统计学意义(P均< 0.05),且均以AKI组患者的数据较高。CRP水平在D0和D7时2组比较差异有统计学意义,NLR指数在D3时比较差异有统计学意义(P < 0.05),其余指标在2组间同一时间点比较差异无统计学意义(P均> 0.05)。见表3。
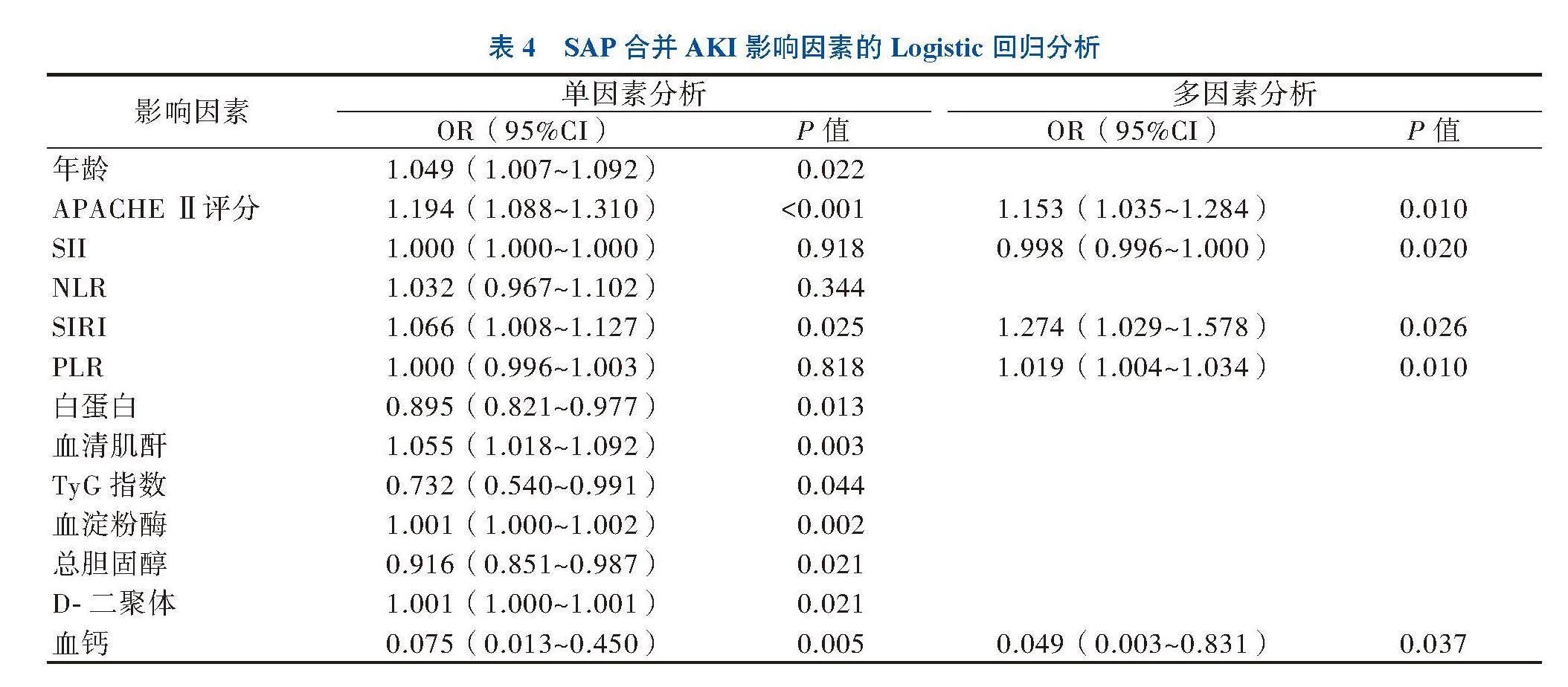
三、SAP并发AKI相关因素分析
将患者D0的基本资料及实验室指标进行逐步回归分析(进行共线性诊断并判断,去除导致共线性的非本研究主要关注的指标),最终纳入分析的指标有APACHEⅡ评分、SII、SIRI、PLR、血钙水平,结果显示APACHEⅡ评分升高、SIRI指数升高、PLR指数升高、SII指数下降、血钙水平下降是SAP患者并发AKI的危险因素(P < 0.05)。见表4、5。
四、相关因素对SAP并发AKI的诊断价值
构建ROC曲线进一步分析D0时APACHEⅡ评分、SIRI指数、SII指数、PLR指数、血钙水平对SAP患者并发AKI的诊断价值。结果显示,除血清肌酐外,APACHEⅡ评分、SIRI、血钙水平对SAP患者并发AKI有一定的诊断价值,其中APACHEⅡ评分的AUC为0.880(95% CI 0.787~0.974,截断值11.50分),SIRI指数的AUC为0.662(95% CI 0.521~0.804,截断值10.89),血钙的AUC为0.754(95% CI 0.627~0.881,截断值 2.07 mmol/L),P < 0.05;利用Logistic回归模型建立联合检测的预测公式Logit P,APACHEⅡ评分、SIRI、血钙联合血清肌酐可进一步提高这些指标对于SAP患者并发AKI的诊断价值,其中血清肌酐+血钙(Logit P = 0.061×血清肌酐-2.792×血鈣-0.240)的AUC最
大,达0.968(95% CI 0.927~1.009),P < 0.05。见图1、表6。
讨论
急性胰腺炎是一种病程长短和严重程度不一致的急腹症。AKI是SAP最常见的器官功能损伤之一,当患者肾损伤进展至需要肾脏替代治疗时,病死率高达75%[2]。然而SAP和AKI共存时的临床特征常无法精准识别,易导致治疗延误而增加病死率。血清肌酐是临床实践中诊断AKI的常见指标,其水平除了受肾功能影响外,还受患者年龄、性别、肌肉质量和水合状态的影响[9]。因此,研究者需要筛选出兼具灵敏度和特异度的生物标志物,进而对SAP患者是否会并发AKI进行及时、有效的识别,最终达到改善这些患者预后的目的。本研究分析了几种炎症相关指数和血清学标志物与SAP并发AKI间的关系,结果显示APACHEⅡ评分、SII、SIRI、PLR以及血钙水平等指标对于早期识别SAP患者并发AKI具有一定的价值,特别是与血清肌酐联合可以精确地诊断AKI,为临床诊治此类患者提供新的依据。
SAP的病理生理过程复杂,可大致归结为局部炎症、全身炎症反应和多器官功能障碍三个阶段。多种炎症介质导致肾小管上皮细胞内的线粒体出现结构、功能障碍并引起肾脏微循环损伤,进而影响呼吸链的功能和细胞内ATP产生,最终导致肾衰竭[10]。近期研究显示,SII、SIRI、NLR、PLR是预测全身炎症的生物标志物,可以通过公式计算评估相关疾病的发展和预后[11]。SII、SIRI 和PLR最初用于评估恶性肿瘤患者的预后,NLR指数与冠状动脉硬化风险增加有关[12]。有学者分别研究SII和PLR与AMI患者行PCI治疗后并发AKI的关系,结果显示这两种指数均为疾病发生的独立危险因素[9, 13]。另有研究者发现,PLR、SII、SIRI可用于早期诊断糖尿病肾病,并对急性胰腺炎严重程度有一定的预测价值[3, 14-15]。由此提示,上述炎症指标可能在SAP合并AKI的诊断中起重要作用,本研究则通过简单回顾SAP人群的临床特征,分析新型炎症指标对SAP并发AKI的预测价值。
本研究逐步回归分析结果显示,SII、SIRI、PLR是SAP患者并发AKI的影响因素,其中AKI组的SIRI、PLR高于非AKI组,而SII指数低于非AKI组。SIRI和SII均涉及中性粒细胞,PLR和SII均涉及血小板,但SIRI和PLR为SAP患者并发AKI的危险因素,SII指数为保护因素,这或许与中性粒细胞胞外诱捕网(NET)的功能和血小板作用状态有关。中性粒细胞是外周血中数量最多的白细胞,在宿主防御中起着重要的作用。其防御功能主要有两个途径:一是通过吞噬作用直接吞噬入侵的病原体;二是在中性粒细胞凋亡后形成NET达到杀伤效果[16]。2004年Brinkmann等[17]报道,NET能有效捕获病原体,降低脓毒症患者病死率。近年的研究表明,NET可引起急性胰腺炎患者血管内血栓形成和微循环障碍,最终导致AKI[18]。因此,NET的生成在SAP中是一把双刃剑,其无论功能失调还是过度释放均会导致组织损伤。此外,持续的血小板活化可放大炎症反应,促进内皮功能障碍和多器官功能衰竭的发展;而血小板减少则表明机体可能处于严重感染或骨髓抑制状态,与预后不良有关。中性粒细胞和血小板数量共同决定SII水平,最终导致出现不同于另外两个炎症指标的统计结果。ROC曲线分析结果显示,SIRI对SAP患者并发AKI具有诊断价值,联合血清肌酐后的诊断效能进一步提高。这或许与SIRI同时涉及中性粒细胞、单核细胞和淋巴细胞有关,相较于其他炎症指标更能体现免疫炎症反应。
APACHEⅡ评分包括急性生理学、慢性健康评价以及年龄评价,因其快速性和准确性被广泛应用于ICU。目前,APACHEⅡ评分在临床上用于预测ICU中SAP患者的预后,尚无相关研究计算该评分对SAP患者并发AKI的预测价值[19]。本研究显示,合并AKI的患者APACHEⅡ评分高于未合并者,且该指标为AKI发生的危险因素之一。
研究发现,低钙血症常见于急性出血坏死性胰腺炎。急性胰腺炎时脂肪酶被激活释放,分解脂肪并释放出大量的脂肪酸,后者和血清钙结合,导致低钙血症[20]。Chen等[21]进行的一项前瞻性观察性研究显示,低钙血症是急性胰腺炎并发 AKI的独立危险因素,且当血钙水平<1.94 mmol/L时可作为急性胰腺炎并发 AKI的预测指标。本研究发现,AKI组的血钙水平低于非AKI组,D-二聚体水平高于非AKI组,这可能与SAP并发AKI时凝血功能障碍有关。随着疾病进展,患者因微循环障碍导致全身血液呈现高凝状态,而钙离子作为凝血因子Ⅳ参与凝血被大量消耗,因此AKI组血钙水平低,而D-二聚体水平高。此外,本研究ROC曲线分析结果显示,低钙血症是SAP并发AKI的独立危险因素,且血钙对SAP患者并发AKI具有诊断价值,这与Chen等的研究结果一致。
已有研究表明,糖尿病会增加AKI的易感性,高血糖使肾脏内氧合减少、血管损伤加重、炎症反应增强[22]。然而本研究显示,非AKI组糖尿病患者比例高于AKI,与既往的研究结论相悖,这可能与糖尿病患者长期服用糖尿病治疗药物有一定的关联。以钠-葡萄糖协同转运蛋白2抑制剂为例,该药物降低肾近端小管的糖酵解率,引起NOD样受体热蛋白结构域蛋白3(NLRP3)等炎性小体的下调,抑制了氧化应激,减少肾小管细胞内活性氧的产生;同时哺乳动物雷帕霉素靶蛋白1(mTORC1)信号被抑制,腺苷酸活化蛋白激酶(AMPK) /沉默信息调节因子1(SIRT1)信号通路被激活,自噬得以恢复,并促进线粒体生物发生,从而降低患者发生AKI的风险[11]。
综上所述,SIRI、PLR、SII、APACHEⅡ评分、血钙水平是SAP并发AKI的影响因素,SIRI、APACHEⅡ评分和血钙水平对SAP患者并发AKI具有诊断价值,联合血清肌酐诊断效能可得到进一步提高,临床医师应动态监测相关指标进行病情评估,制定合理的诊疗计划,有效阻止急性胰腺炎患者向AKI发展。本研究有几个潜在的局限性:①小样本、单中心回顾性研究,不能完全排除残余混杂因素。因此,需要扩大样本量并进行前瞻性研究来改善当前结论。②本研究未分析SAP患者的病死率,因为当前无法获得患者出院后的生存情况。③部分患者入院时已并发AKI,所获得的数据缺乏有效性,需要从其他渠道获得最初就诊时的临床资料。今后还需扩大样本量,延长随访期,进一步验证研究结论。
参 考 文 献
[1] Garg P K, Singh V P. Organ failure due to systemic injury in acute pancreatitis[J]. Gastroenterology, 2019, 156(7): 2008-2023.
[2] Nassar T I, Qunibi W Y. AKI associated with acute pancreatitis[J]. Clin J Am Soc Nephrol, 2019, 14(7): 1106-1115.
[3] Liu X, Guan G, Cui X, et al. Systemic immune-inflammation index (SII) can be an early indicator for predicting the severity of acute pancreatitis: a retrospective study[J]. Int J Gen Med, 2021, 14: 9483-9489.
[4] Silva-Vaz P, Abrantes A M, Morgado-Nunes S, et al. Evaluation of prognostic factors of severity in acute biliary pancreatitis[J]. Int J Mol Sci, 2020, 21(12): 4300.
[5] Wei Y, Guo J. High triglyceride-glucose index is associated with poor prognosis in patients with acute pancreatitis[J]. Dig Dis Sci, 2023, 68(3): 978-987.
[6] Ronco C, Bellomo R, Kellum J A. Acute kidney injury[J]. Lancet, 2019, 394(10212): 1949-1964.
[7] 中華医学会外科学分会胰腺外科学组. 中国急性胰腺炎诊治指南(2021)[J]. 浙江实用医学, 2021, 26(6): 511-519, 535.
Chinese Pancreatic Surgery Association, Chinese Society of Surgery, Chinese Medical Association. Guidelines for diagnosis and treatment of acute pancreatitis in China (2021)[J]. Zhejiang Pract Med, 2021, 26(6): 511-519, 535.
[8] Abu Omar Y, Attar B M, Agrawal R, et al. Revised Marshall Score: a new approach to stratifying the severity of acute pancreatitis[J]. Dig Dis Sci, 2019, 64(12): 3610-3615.

