3例CHDFIDD患儿的分子遗传学分析及文献复习
赵静 宣小燕 李红英 陈政芳 范晓萱 赵晓科
基金項目:江苏省妇幼保健协会科研基金(FYX202013)
作者单位:210008 南京,南京医科大学附属儿童医院 南京儿童医院
通信作者:赵晓科,E-mail: xiaokezhao@vip.163.com
【摘要】目的 分析先天性心脏缺陷、面部畸形和智力发育障碍[CHDFIDD,细胞周期蛋白依赖性激酶13(CDK13)相关疾病)]患儿的临床表型及基因突变情况,探讨其遗传学病因。方法 采用芯片捕获高通量测序技术对3例CHDFIDD患儿及其父母的基因组DNA进行全外显子组测序,对疑似致病突变进行Sanger测序验证和生物信息分析。以“CDK13 基因”“CDK13相关疾病”为检索词,检索中国知网、万方数据库建库至2024年2月的文献;以“CDK13”“CDK13-related disorder ”“CHDFIDD”为检索词,检索PubMed数据库建库至2024年2月的文献,对相关文献进行复习。结果 全外显子组测序结果均提示3例患儿存在CDK13基因杂合突变,分别为c.2572C>T (p.Leu858Phe)、c.2579G>A(p.Arg860Gln)和c.2602C>T (p.Arg868Trp),Sanger测序也证实了3种突变,结合临床表型,3例患儿均被确诊为CHDFIDD。3例患儿在各自家系中表现为新发突变;但不排除患儿双亲之一为该突变的生殖系嵌合体。根据美国医学遗传学与基因组学学会的指南,3个突变位点均可能致病。文献复习检索到14篇相关文献共108例CHDFIDD病例,其中c.2572C>T突变未见文献报道。结论 CDK13基因突变可能是该3例患儿的遗传学病因。本研究丰富了CDK13基因突变谱,为CHDFIDD相关疾病的诊疗提供了参考。
【关键词】先天性心脏缺陷、面部畸形和智力发育障碍;CDK13基因;CDK13相关疾病;全面性发育迟缓;
智力障碍
Molecular genetic analysis of three children with CHDFIDD and literature review Zhao Jing, Xuan Xiaoyan, Li Hongying, Chen Zhengfang, Fan Xiaoxuan, Zhao Xiaoke. Childrens Hospital of Nanjing Medical University, Nanjing Childrens Hospital,Nanjing 210008, China
Corresponding author: Zhao Xiaoke, E-mail: xiaokezhao@vip.163.com
【Abstract】Objective To analyze the clinical and genetic characteristics of three children with congenital heart defects, dysmorphic facial features and intellectual developmental disorders(CHDFIDD). Methods Three children presenting with CHDFIDD were enrolled. Genomic DNA was extracted from peripheral venous blood of the children and their parents. Whole-exome sequencing(WES) was performed using chip-capture high-throughput sequencing technology. Suspected causative mutations were verified by Sanger sequencing and bioinformatic analysis. Using “CDK13 gene” and “CDK13-related diseases” as search terms, literatures of CNKI and Wanfang database were retrieved until February 2024. Using “CDK13”, “CDK13-related disorder” and “CHDFIDD” as search terms, literatures from the establishment of PubMed database untio February 2024 was retrieved, and the relevant literature was reviewed. Results WES revealed heterozygous variants of the CDK13 gene in three children, including c.2572 C>T (p.Leu858Phe), c.2579 G>A (p.Arg860Gln), and c.2602C>T (p.Arg868Trp), which were verified as de novo variants by Sanger sequencing.Combined with the clinical phenotype, all 3 children were diagnosed with CHDFIDD. However, the possibility that one of the affected childrens parents was a germline chimera for the mutation could not be excluded. According to the ACMG guidelines, all three mutation sites were classified as likely pathogenic. A total of 14 studies consisting of 108 cases were retrieved. Among them, c.2572C>T has not been reported. Conclusions The de novo variants of the CDK13 gene may be the genetic cause of developmental delay/intellectual disability in these three children. The findings in the present study expand the spectrum of CDK13 gene mutations, providing reference for the diagnosis of CHDFIDD.
【Key words】Congenital heart defects, dysmorphic facial features and intellectual developmental disorders; CDK13 gene;
CDK13-related disorder;Global developmental delay;Intellectual disability
先天性心脏缺陷、面部畸形和智力发育障碍(CHDFIDD)又被称为细胞周期蛋白依赖性激酶13(CDK13)相关疾病,是由CDK13 (OMIM:603309)基因突变所致的常染色体显性遗传性疾病,其临床特征主要包括发育迟缓或智力障碍、可识别的颅面特征、小头畸形、先天性心脏异常和大脑结构异常等[1]。目前国际报道100余例[2-14],国内仅报道1例[15]。本研究总结了新发现的3例CHDFIDD患儿的临床表型,并应用全外显子组测序进行基因突变分析,以明确其遗传学病因。
对象与方法
一、3例CHDFIDD患儿临床资料的收集
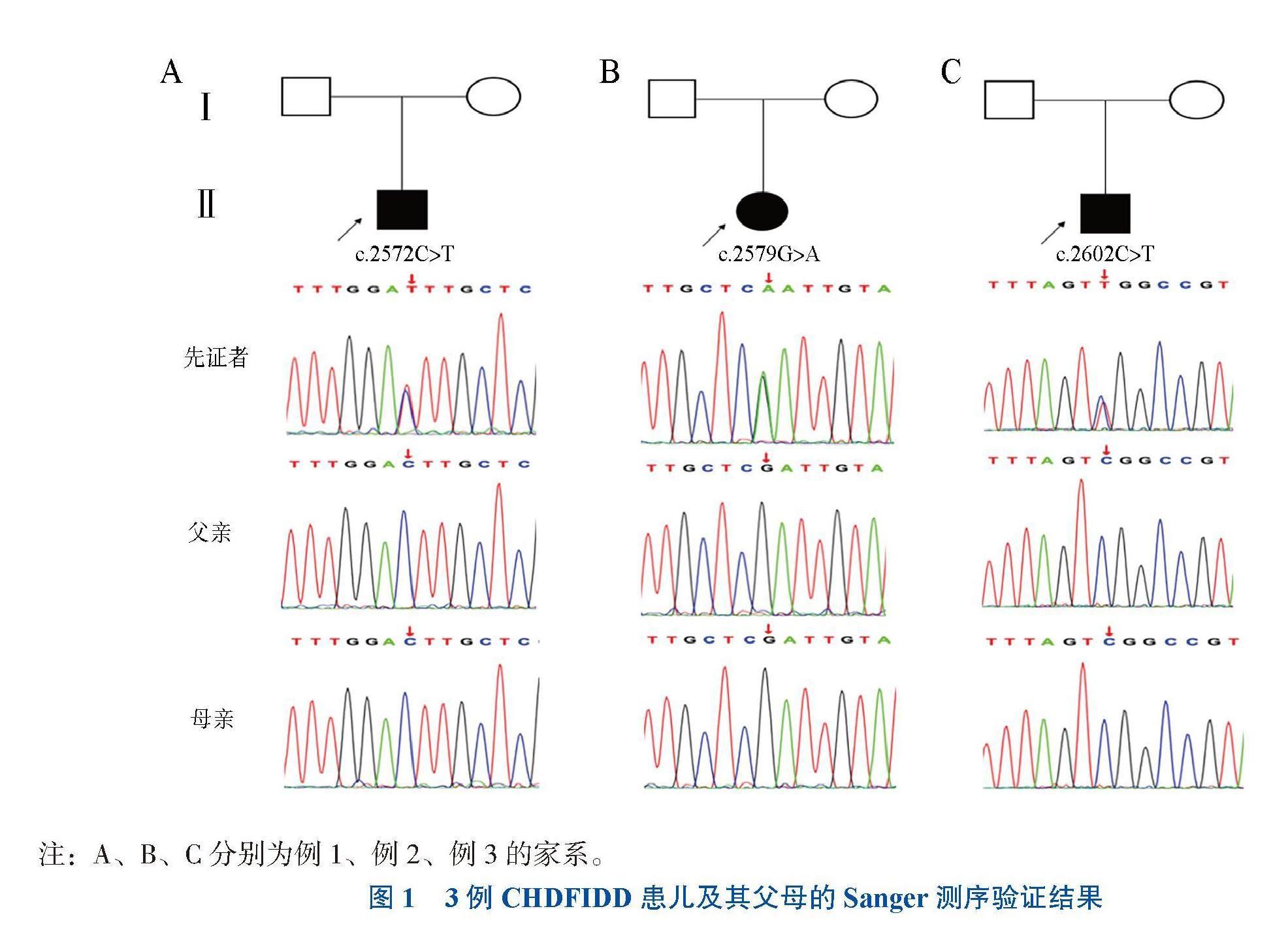
选取2018年9月至2023年4月在我院就诊的3例CHDFIDD患儿为研究对象,采集患儿及其父母外周血进行全外显子检测。本研究通过了南京医科大学附属儿童医院伦理委员会的审查(批件号:202401010-1),家属均知情同意。
1. 临床资料的收集
通过电子病历收集患儿的基本资料、生长发育史、临床表现、体格检查、实验室及辅助检查结果等。
2.全外显子组测序
采集患儿及其父母的外周静脉血2 mL,提取基因组DNA。全外显子组测序由北京全谱医学检验实验室完成,通过采用IDT The xGen Exome Research Panel v2.0全外显子捕獲芯片捕获并测序,检测人类近2万个有功能的基因的外显子编码区序列,经过基因数据分析筛选,对基因突变进行分级。
3. Sanger测序验证及序列对比
对筛查到的目标序列进行PCR后,经ABI3730
测序仪进行Sanger测序验证。同时对患儿父母的相同基因位点进行验证。
4. 生物信息学分析
应用ClinVar数据库、dbSNP数据库、正常人基因组数据库、基因组聚合数据库 (gnomAD)查询突变位点的收录情况,根据文献[16]分析突变位点的致病性。对筛查到的突变位点进行保守性分析,在Ensembl数据库中查找并下载CDK13在不同物种中相应直系同源基因的蛋白质序列,随后应用Clustal Omega数据库进行多序列对比,预测不同突变位点的保守性。对野生型和突变型蛋白进行三维结构可视化分析,在UniProt数据库中查找并下载CDK13的三维结构预测图,应用PyMol分子图形系统(V.1.7)进行野生型和突变型蛋白的计算机蛋白建模预测。
二、文献检索
以“CDK13 基因”“CDK13相关疾病”为检索词,检索中国知网、万方数据库建库至2024年
2月的文献;以“CDK13”“CDK13-related disorder”
“CHDFIDD”为检索词,检索PubMed数据库建库至2024年2月的文献,收集以发育迟缓/智力障碍(DD/ID)、特殊的颅面特征、心脏缺陷等为临床表现的CHDFIDD相关病例并进行文献分析。
结果
一、3例CHDFIDD患儿临床资料的收集
例1,患儿男,1岁4个月。因“运动发育落后”于2022年8月23日来我院就诊,患儿出生后表现出运动和语言发育落后。患儿为足月自然娩出,无缺氧窒息史。患儿母亲孕2产2,曾因羊水浑浊住院5 d。患儿父母身体健康,非近亲结婚,家族中无类似发育迟缓史,患儿的5岁胞兄身体健康。体格检查:反应可,无意识发“ba”“ma”音,鼻梁低平,低位耳,四肢肌张力偏低,可扶站,未见其他神经系统阳性体征。格塞尔发育量表提示:动作能发育商56,应物能发育商56,言语能发育商63,应人能发育商56,诊断为“全面性发育迟缓”。患儿头颅MRI未见异常,听觉诱发电位示右耳听力损害(>95 dHBL)。初次就诊后一直在我院及当地康复机构接受康复治疗。2023年12月20日最后一次随访时,患儿尚未完善心脏超声检查,其运动发育有改善,但仍存在轻度语言发育落后。
例2,患儿女,6岁10个月。3岁时因“语言发育落后”于2018年9月1日来我院就诊,患儿出生后表现出语言和运动发育落后。患儿为足月自然娩出,出生时无缺氧窒息史,出生后黄疸时间延长。患儿母亲孕2产2,孕早期有先兆流产保胎史。患儿父母身体健康,否认近亲结婚,患儿胞姐身体健康。体格检查:反应可,能简单对答,吐字不清,面容异常:眼距宽、鼻梁低平、斜视,四肢肌张力正常,能独站、独走,未见其他神经系统阳性体征。儿童智能发育筛查测验量表(DST)评估智龄27(月),韦氏智力量表为57分,提示轻度智力障碍。心脏超声示先天性心脏病、房间隔缺损(2.1 mm),头颅MRI示双侧终末带信号稍高。腰椎正侧位片示S1及以下椎板未闭合。患儿初次就诊后一直在我院门诊接受康复治疗。2022年6月27日最后一次随访时,患儿语言、运动能力有进步,但仍轻度落后于正常同龄儿。
例3,患儿男,1岁2个月。因“运动、语言落后”于2023年4月6日来我院就诊,患儿出生后表现出语言和运动发育落后。患儿为足月自然娩出,无缺氧窒息史。患儿母亲孕3产3。患儿父母身体健康,否认近亲结婚。患儿同父异母的一兄一姐均患有先天性心脏病,并且其兄运动发育落后;其同母异父的2名胞姐均身体健康。体格检查:反应可,无意识发“ba”“ma”音,患儿没有明显的面容异常,四肢肌张力基本正常,会独坐,可扶站、扶走,未见其他神经系统阳性体征。患儿心脏超声示先天性心脏病、动脉导管未闭(1.2 mm)。头颅CT提示左颞极脑外间隙增宽;双侧侧脑室稍饱满。心电图、脑电图、血液遗传代谢检查未见异常。患儿初次就诊后一直在我院接受康复治疗。至2024年2月18日最后一次随访时,患儿运动发育基本正常,但存在轻度语言发育迟缓。
二、全外显子测序及Sanger测序结果
全外显子组测序结果显示3例患儿的CDK13基因(NM_003718)存在杂合错义突变,其中例1患儿携带c.2572C>T(p.Leu858Phe)杂合突变,例2患儿携带c.2579G>A(p.Arg860Gln)杂合突变,例3患儿携带c.2602C>T(p.Arg868Trp)杂合突变。Sanger测序结果与全外显子组测序一致,并证实其父母均未在相同基因位点发生变异(图1),提示可能为新发突变,但不排除患儿双亲之一为该突变的生殖系嵌合体。结合3例患儿的临床表型及基因检测,可确诊为CHDFIDD。
三、生物信息学分析结果
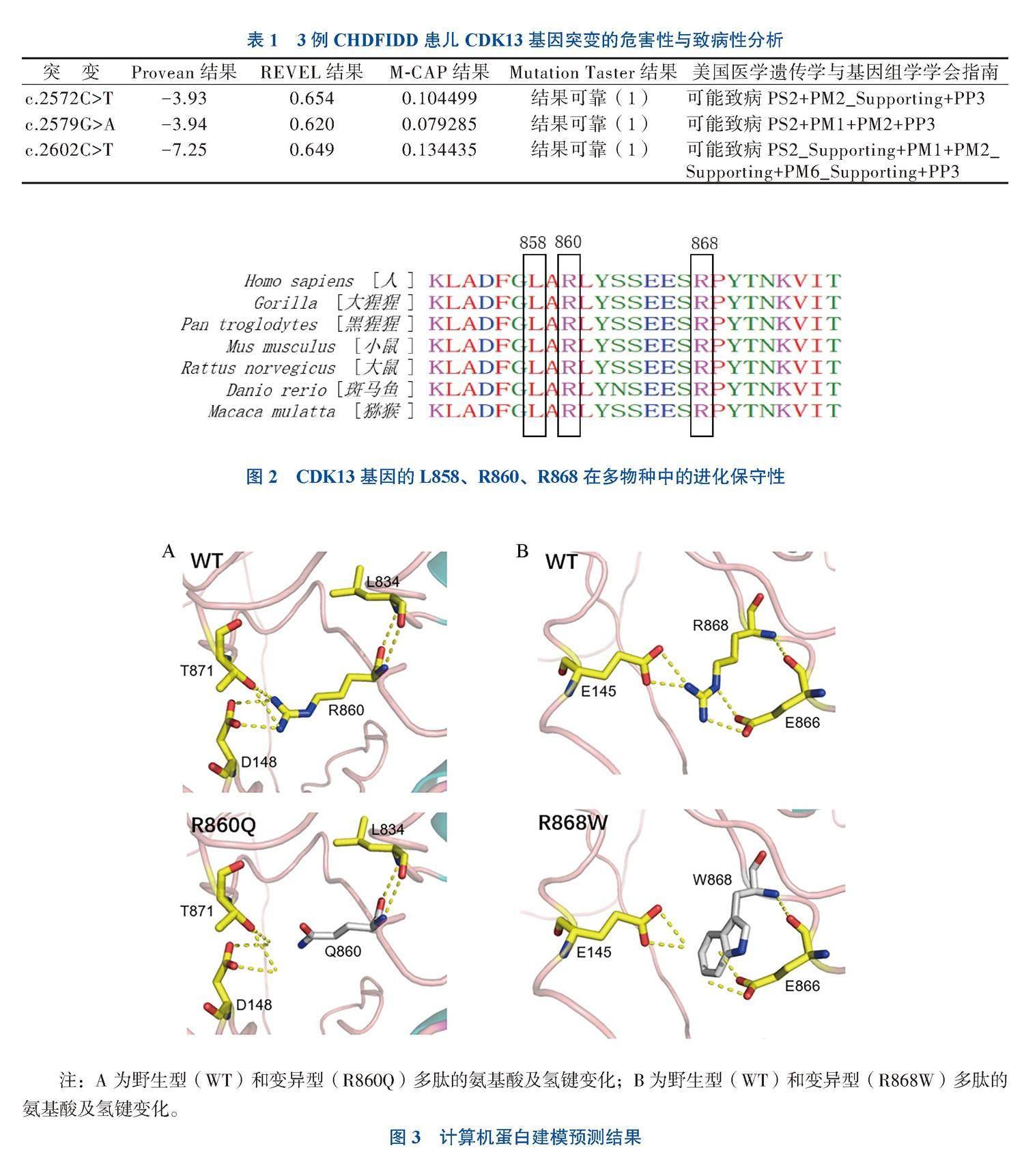
CDK13 c.2572C>T是既往未报道的新突变;c.2602C>T为ClinVar数据库收录突变,是罕见突变,最小等位基因频率为0.000 039 83;c.2579G>A为既往文献报道变异。生物信息计算方法预测3个突变对基因产物有害(表1)。
对突变位点的保守性进行分析的结果显示,3种突变影响的氨基酸L858、R860、R868均位于CDK13蛋白激酶结构域中,并且相应氨基酸序列在多物种进化中高度保守(图2)。计算机蛋白建模预测结果显示,与野生型多肽相比,R860Q和R868W突变型多肽周围的氢键和结构发生了改变,可能改变了激酶结构域的结构及蛋白稳定性(图3)。
四、文献检索结果
在PubMed数据库中共检索到相关文献13篇,共报道CHDFIDD病例107例;在中国知网、万方数据库中检索到相关文献1篇,共报道1例。
在突变位点方面,108例共涉及42个不同的CDK13突变位点,其中最常见的突变位点为p.Asn842Ser,共在42例患者中出现;其次为p.Gly717Arg,共在9例患者中出現。本研究中的c.2579G>A(p.Arg860Gln)突变位点既往已被报道,而c.2572C>T(p.Leu858Phe)和c.2602C>T(p.Arg868Trp)未见报道。
在临床表型方面,发育迟缓/智力障碍以及面容异常是常被报道的特征,面容异常常见的表现包括耳部形态异常(如低位耳和后旋耳)、鼻梁/
鼻翼宽、眼距宽和内眦赘皮,其次可见卷发、高拱眉、上睑下垂、人中短、薄上唇等。约40%患者存在先天性心脏病,常表现为室间隔缺损、房间隔缺损或肺动脉异常。在有具体数据的28例脑结构异常患者中,最常见的大脑影像学表现为胼胝体发育不全、缺失、变薄或异常(11/28)、脑室周围胶质细胞增生/白质软化或减少(6/28)、小脑扁桃体下垂/异常(4/28)。婴儿期患儿喂养困难较为常见,涉及胃食管反流、腭咽闭合不全等问题。 其他临床表型还包括肌张力减低、行为异常(如孤独症谱系障碍)、癫痫发作、泌尿/生殖系统异常、听力受损和骶骨异常等(表2)。
讨论
细胞周期蛋白依赖性激酶13(CDK13)属于丝氨酸苏氨酸蛋白激酶家族,作为磷酸化转录RNA聚合酶Ⅱ C末端结构域(CTD)的激酶, 主要参与基因转录调控、RNA剪接和生长信号通路等[17-18]。人类CDK13由CDK13基因编码,包含许多功能结构域,其中重要的蛋白激酶结构域在进化中高度保守。CDK13可在心脏、胚胎发育中的颅面区域和大脑被检测到[19],并在神经系统发育中发挥重要作用。
2016年,Sifrim等[2]利用2011年的解密发育
障碍研究对7例受综合征先天性心脏缺陷影响的发育迟缓患儿进行了外显子测序分析,发现了CDK13的新发突变高度富集,首次将CDK13基因突变与人类疾病联系起来。随后的报道表明CDK13基因的致病突变可导致CHDFIDD,其特征是发育迟缓/智力障碍、特征性面容异常、结构性心脏或大脑畸形等。约94%的已报道个体显示出轻至中度发育迟缓/智力障碍,其中言语和语言障碍是中心特征,伴随运动发育迟缓[20]。
目前人类基因突变数据库(HGMD)专业版共收录了68种CDK13基因突变(2024年2月20日检索),最常见的突变类型为错义突变/无义突变(54/68),其他突变类型包括移码突变、剪切突变和大片段缺失。其中引起特征性表型的大多为集中在蛋白激酶结构域中的新发错义突变。Bostwick等[3]发现错义突变聚集在蛋白激酶结构域中的ATP结合位点和镁结合位点,或会干扰CDK13的磷酸化活性。计算机蛋白建模表明,错义突变可能通过显性负性机制影响CDK13的功能[6]。目前认为影响CDK13蛋白激酶结构域的杂合突变会导致可识别的综合征形式的发育迟缓/智力障碍,然而激酶结构域末端的移码突变和无义突变则表现出温和的表型[4, 6],因此可能存在单倍剂量不足对CDK13表型的影响。但目前尚未发现可靠的CHDFIDD基因型-表型相关性,且缺乏突变相关的功能实验。
本研究在3例CHDFIDD患儿中分别检测到CDK13基因的3种错义突变。例1的c.2572C>T突变既往未见文献报道,该患儿除了具有全面性发育迟缓表型,同时合并面容异常和神经系统异常(肌张力降低和听力受损)。例2的c.2579G>A (p.R860Q)突变为既往报道的突变,表现出特征性的智力障碍伴面容异常,此外,该患儿还表现出先天性心脏病及少见的骶骨异常。而例3的c.2602C>T为已被ClinVar数据库收录的罕见突变,该患儿的心脏超声显示少见的动脉导管未闭。3例患儿的头颅影像学检查均没有既往报道的CHDFIDD阳性表现。3例患儿的3种突变均位于CDK13蛋白激酶结构域中,可能通过显性负效应影响结构域功能,进而干扰CDK13催化活性或与细胞周期蛋白的结合,影响蛋白生物功能,从而成为患儿发育迟缓/智力障碍表型的遗传病因。
综上所述,本研究对3例CHDFIDD患儿进行了表型分析、分子遗传分析及文献复习,为其分子诊断、疾病管理和遗传咨询提供了依据,扩展了已知的CDK13基因致病突变范围及表型谱,并为CHDFIDD的诊疗提供了参考。
參 考 文 献
[1] Hamilton M J, Suri M. CDK13-related disorder[J]. Adv Genet, 2019, 103: 163-182.
[2] Sifrim A, Hitz M P, Wilsdon A, et al. Distinct genetic architectures for syndromic and nonsyndromic congenital heart defects identified by exome sequencing[J]. Nat Genet, 2016, 48(9): 1060-1065.
[3] Bostwick B L, McLean S, Posey J E, et al. Phenotypic and molecular characterisation of CDK13-related congenital heart defects, dysmorphic facial features and intellectual developmental disorders[J]. Genome Med, 2017, 9(1): 73.
[4] van den Akker W M R, Brummelman I, Martis L M, et al. De novo variants in CDK13 associated with syndromic ID/DD: molecular and clinical delineation of 15 individuals and a further review[J]. Clin Genet, 2018, 93(5): 1000-1007.
[5] Uehara T, Takenouchi T, Kosaki R, et al. Redefining the phenotypic spectrum of de novo heterozygous CDK13 variants: three patients without cardiac defects[J]. Eur J Med Genet, 2018, 61(5): 243-247.
[6] Hamilton M J, Caswell R C, Canham N, et al. Heterozygous mutations affecting the protein kinase domain of CDK13 cause a syndromic form of developmental delay and intellectual disability[J]. J Med Genet, 2018, 55(1): 28-38.
[7] Carneiro T N, Krepischi A C, Costa S S, et al. Utility of trio-based exome sequencing in the elucidation of the genetic basis of isolated syndromic intellectual disability: illustrative cases[J]. Appl Clin Genet, 2018, 11: 93-98.
[8] Trinh J, Kandaswamy K K, Werber M, et al. Novel pathogenic variants and multiple molecular diagnoses in neurodevelopmental disorders[J]. J Neurodev Disord, 2019, 11(1): 11.
[9] Yakubov R, Ayman A, Kremer A K, et al. One-month-old girl presenting with pseudohypoaldosteronism leading to the diagnosis of CDK13-related disorder: a case report and review of the literature[J]. J Med Case Rep, 2019, 13(1): 386.
[10] Hildebrand M S, Jackson V E, Scerri T S, et al. Severe childhood speech disorder: gene discovery highlights transcriptional dysregulation[J]. Neurology, 2020, 94(20): e2148-e2167.
[11] Rouxel F, Relator R, Kerkhof J, et al. CDK13-related disorder: report of a series of 18 previously unpublished individuals and description of an epigenetic signature[J]. Genet Med, 2022, 24(5): 1096-1107.
[12] Morgan A, Morison L, Van Reyk O, et al. CDK13-related disorder: a deep characterization of speech and language abilities and addition of 33 novel cases[J]. Eur J Hun Genet, 2023,31(7):793-804.
[13] Cui X, Wu X, Wang H, et al. Genetic of preimplantation diagnosis of dysmorphic facial features and intellectual developmental disorder (CHDFIDD) without congenital heart defects[J]. Mol Genet Genomic Med, 2022, 10(2): e1863.
[14] Cui D, Wang S, Zhang A, et al. Case report: hemophagocytic lymphohistiocytosis prior to the onset of leukemia in a boy with CDK13-related disorder[J]. Front Genet, 2022, 13: 858668.
[15] 顏芳玲, 尹飞, 邓小鹿, 等. CDK13相关疾病1例病例报告[J]. 中国循证儿科杂志, 2021, 16(2): 162-164.
Yan F L, Yin F, Deng X L, et al. A case report of CDK13-related diseases[J]. Chin J Evid Based Pediatr, 2021, 16(2): 162-164.
[16] Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424.
[17] Greifenberg A K, H?nig D, Pilarova K, et al. Structural and functional analysis of the Cdk13/cyclin K complex[J]. Cell Rep, 2016, 14(2): 320-331.
[18] Cao L, Chen F, Yang X, et al. Phylogenetic analysis of CDK and cyclin proteins in premetazoan lineages[J]. BMC Evol Biol, 2014, 14: 10.
[19] Nováková M, Hampl M, Vrábel D, et al. Mouse model of congenital heart defects, dysmorphic facial features and intellectual developmental disorders as a result of non-functional CDK13[J]. Front Cell Dev Biol, 2019, 7: 155.
[20] Firth H V, Wright C F, Study F T D. The Deciphering Developmental Disorders (DDD) study[J]. Dev Med Child Neurol, 2011, 53(8): 702-703.
(收稿日期:2023-12-21)
(责任编辑:洪悦民)

