非小细胞肺癌组织中circBIRC6、APPBP2表达及临床预后意义
陈丽萍 籍强 陈艳红 史永兴 冯平 林卫佳 项保利 赵建清
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最常见的类型,占所有肺癌的85%以上,据国际癌症研究机构报道,2020年全球肺癌新发病例2206771例,死亡1796144例,我国肺癌新发病例815563例,死亡714699例,发病率和死亡率均居全球首位[1]。寻找相关标志物评估NSCLC患者临床预后非常重要。研究表明,环状核糖核酸(circular ribonucleic acid,circRNA)能通过调控多种靶基因在NSCLC进程中发挥重要作用[2]。杆状病毒IAP重复序列6(baculoviral IAP repeat containing 6,BIRC6)是新近发现的一种circRNA,研究报道circBIRC6与肝细胞癌患者预后有关[3]。同时有学者指出,在NSCLC中异常表达,并与肺癌细胞恶性进展密切相关[4]。β淀粉样蛋白前体蛋白结合蛋白2(amyloid beta precursor protein binding protein 2,APPBP2)是一种膜内在蛋白,能通过转运和/或加工淀粉样前体蛋白(amyloid precursor protein,APP)调控肿瘤细胞增殖、迁移和侵袭[5]。相关研究指出,APPBP2与结直肠癌患者预后有关[6]。本研究拟探讨NSCLC组织中circBIRC6、APPBP2表达及临床预后意义,为促进NSCLC患者预后提供参考依据。
资料与方法
一、研究对象
收集2018年6月~2020年1月90例在河北北方学院附属第一医院行手术切除的NSCLC组织及癌旁组织(距离癌组织≥3cm),女25例、男65例;年龄范围27~75岁,平均(60.47±8.36)岁;40例吸烟;病理类型:29例腺癌、53例鳞癌、8例腺鳞癌;表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变:阳性46例、阴性44例;肿瘤大小:≥5cm的患者为17例、<5cm的患者为73例;分化程度:31例低分化、59例中高分化;TNM分期[7]:14例Ⅰ期、29例Ⅱ期、47例Ⅲ期;45例淋巴结转移。纳入标准:(1)经病理检查确诊为NSCLC。(2)接受根治性或姑息性切除。(3)患者或家属签署同意书。排除标准:(1)非初诊或入院前已接受抗肿瘤治疗。(2)不可手术切除或术前接受化疗。(3)合并其他肺部疾病。(4)合并急慢性感染。(5)合并其他部位恶性肿瘤。(6)不能耐受手术。(7)临床或随访资料不完整。(8)合并自身免疫性疾病。(9)年龄<18岁。(10)合并精神疾病。本研究经医院伦理委员会批准(W2023041)。
二、方法
使用总核糖核酸(ribonucleic acid,RNA)提取试剂盒(试剂盒购自江西艾博因生物科技有限公司,货号:IBIO-C1764)从NSCLC组织及癌旁组织中提取总RNA,紫外分光光度计(仪器购自上海谱元仪器有限公司,型号:Alpha-1860Plus)验证RNA纯度和完整性合格后,使用逆转录酶试剂盒(试剂盒购自北京智杰方远科技有限公司,货号:RR036A)将其逆转录为单链RNA。使用实时荧光定量聚合酶链式反应系统(仪器购自赛默飞世尔科技公司,型号:7500 Fast)并按照聚合酶链式反应试剂盒(试剂盒购自北京百奥莱博科技有限公司,货号:RFT164-JMA)说明书进行扩增。反应体系:单链RNA反转录液1μL、2×聚合酶链式反应缓冲液10μL、上游引物1μL、下游引物1μL、去离子水7μL,总体积20 μL;热循环参数:先95℃预变性5min,然后循环40次94℃变性30s、58℃退火30s、72℃延伸30s。收集荧光信号,通过2-ΔΔCT法计算组织中circBIRC6、APPBP2相对表达量。引物序列由北京擎科生物科技股份有限公司设计和合成:circBIRC6上游引物:5′-CCACAGATACAAGTGACACTGC-3′、下游引物:5′-CTGGAGTTTGCAGAGCAGTG-3′;APPBP2上游引物:5′-CGCT-GTCGTGGACAACTACAT-3′、下游引物:5′-ATAAGCG-TCCCTGTTGGTAAAG-3′;内参甘油醛-3-磷酸脱氢酶上游引物:5′-GAAGGTGAAGGTCGGAGTC-3′、下游引物:5′-GAAGATGGTGATGGGATTTC-3′。
三、随访和分组
通过电话或门诊方式对NSCLC患者随访3年(3~6个月/次),随访终止事件为患者死亡或随访终点时间(2023年1月),统计3年总生存率。根据NSCLC组织中circBIRC6、APPBP2 mRNA表达均值分为高/低表达组。
四、统计学分析

结 果
一、NSCLC组织和癌旁组织中circBIRC6、APPBP2 mRNA表达比较
NSCLC组织中circBIRC6、APPBP2 mRNA表达高于癌旁组织(P<0.05)(见表1)。
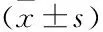
表1 NSCLC组织和癌旁组织中circBIRC6、APPBP2 mRNA表达比较
二、NSCLC组织中circBIRC6与APPBP2 mRNA表达的相关性
Pearson相关性分析显示,NSCLC组织中circBIRC6与APPBP2 mRNA表达呈正相关(r=0.817,P<0.001)(见图1)。

图1 NSCLC组织中circBIRC6与APPBP2 mRNA表达的相关性图
三、circBIRC6、APPBP2 mRNA表达与NSCLC患者临床病理特征的关系
NSCLC患者不同分化程度、TNM分期、淋巴结转移组织中circBIRC6、APPBP2 mRNA表达比较有差异(P<0.05),不同性别、年龄、吸烟、病理类型、EGFR基因突变、肿瘤大小组织中circBIRC6、APPBP2 mRNA表达比较无差异(P>0.05)(见表2)。
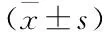
表2 circBIRC6、APPBP2 mRNA表达与NSCLC患者临床病理特征的关系
四、不同EGFR基因突变、TNM分期和circBIRC6、APPBP2 mRNA表达与NSCLC患者总生存率的关系
随访3年,90例NSCLC患者3年总生存率为55.56%(50/90)。Kaplan-Meier生存曲线分析显示,EGFR基因突变阳性(46例)总生存率为50.00%(23/46)与EGFR基因突变阴性(44例)的61.36%(27/44)比较无差异(Log-rank χ2=0.824,P=0.364,图2A)。TNM分期Ⅰ~Ⅱ期(43例)NSCLC患者总生存率为79.07%(34/43)高于Ⅲ期(47例)NSCLC患者的34.04%(16/47);(Log-rank χ2=15.005,P<0.001,图2B)。circBIRC6高表达组(≥10.97,46例)总生存率为45.65%(21/46)低于低表达组(<10.97,44例)的65.91%(29/44);APPBP2 mRNA高表达组(≥2.48,45例)总生存率为46.67%(21/45)低于低表达组(<2.48,45例)的64.44%(29/45)(Log-rank χ2=5.203、4.718,P=0.023、0.030,图2C-D)。

图2 NSCLC患者Kaplan-Meier生存曲线A:EGFR基因突变阳性/阴性NSCLC患者Kaplan-Meier生存曲线;B:不同分期NSCLC患者Kaplan-Meier生存曲线;C:circBIRC6高/低表达NSCLC患者Kaplan-Meier生存曲线;D:APPBP2 mRNA高/低表达NSCLC患者Kaplan-Meier生存曲线
五、NSCLC患者预后的单因素和多因素Cox回归分析
将失访患者排除,以随访时间为时间变量,性别(男/女=1/0)、年龄(≥60岁/<60岁=1/0)、吸烟(是/否=1/0)、病理类型(腺鳞癌/鳞癌/腺癌=3/2/1)、EGFR基因突变(阳性/阴性=1/0)、肿瘤大小(≥5cm/<5cm=1/0)、分化程度(低分化/中高分化=1/0)、TNM分期(Ⅲ期/Ⅰ~Ⅱ期=1/0)、淋巴结转移(是/否=1/0)、circBIRC6(≥10.97/<10.97=1/0)、APPBP2 mRNA(≥2.48/<2.48=1/0)为自变量,生存状态(死亡/存活=1/0)为因变量,选择“Enter”法建立单因素和多因素Cox回归模型。结果显示:低分化、TNM分期Ⅲ期、淋巴结转移和circBIRC6≥10.97、APPBP2 mRNA≥2.48为NSCLC患者死亡的独立危险因素(P<0.05)(见表3)。

表3 NSCLC患者预后的单因素和多因素Cox回归分析
讨 论
NSCLC是除小细胞肺癌以外所有起源于支气管粘膜上皮的恶性肿瘤的统称,以气短、咯血和反复咳嗽等为主要临床表现,目前认为其诱发原因包括吸烟、油烟、环境污染、慢性肺部疾病史、肺癌家族史、职业致癌物质暴露史等[8]。近年来随着居民健康意识的提高和低剂量螺旋计算机断层扫描的开展,早期NSCLC诊断率有所提高,但初诊晚期仍然占75%[8-9]。尽管近年来肿瘤分子生物学的进展使晚期NSCLC靶向和免疫治疗取得极大进展,NSCLC患者预后有所改善,但疗效随着治疗时间延长和患者数量增加逐渐降低,NSCLC患者总体预后依然很差[10-11]。寻找NSCLC预后影响因素,对指导患者个体化治疗和促进预后改善具有重要意义。
circRNA是一类新型的非编码RNA,最初被认为是RNA剪接错误而出现的副产物,近年研究发现circRNA具有高度稳定性和保守性,可以通过与线性微小RNA(microRNA,miRNA)相互竞争对mRNA进行螯合,或直接与RNA结合蛋白相互作用,或miRNA海绵竞争性干扰miRNA与mRNA结合等多种机制参与肿瘤过程[12]。circBIRC6是人染色体2p22.3上的一种circRNA,是凋亡抑制蛋白家族中相对分子量巨大的成员,能作为泛素连接酶促进凋亡蛋白的蛋白酶体降解,促进细胞存活[13]。基于circRNA的抗凋亡作用,近年来被多种研究报道参与恶性肿瘤过程。如circBIRC6能靶向下调miR-449b-5p促进胃癌细胞增殖、周期进展和抑制其凋亡[14];circBIRC6能靶向下调miR-495-3p上调X-盒结合蛋白1,促进膀胱癌细胞增殖、侵袭、迁移和上皮-间质转化[15];circBIRC6能靶向下调miR-367-3p促进卵巢癌顺铂耐药和抑制癌细胞凋亡[16]。研究提示,circBIRC6在多种恶性肿瘤中发挥抑癌作用。同时有实验显示,下调circBIRC6表达能抑制NSCLC细胞增殖、分化、迁移、侵袭和促进凋亡[17-18]。然而关于circBIRC6在临床NSCLC癌组织的表达意义尚不清楚。结果显示,NSCLC组织中circBIRC6高表达,提示circBIRC6高表达可能参与NSCLC发生,符合上述研究结果。结果还显示,NSCLC组织中circBIRC6表达与分化程度、TNM分期和淋巴结转移有关,circBIRC6高表达患者3年总生存率显著降低,是NSCLC患者死亡的独立危险因素,进一步说明circBIRC6高表达参与NSCLC发生发展。其机制可能是circBIRC6能靶向miR-944上调程序性细胞死亡配体1表达,抑制肿瘤微环境中T淋巴细胞对NSCLC细胞的杀伤作用,促进NSCLC细胞存活和持续恶性发展,进而导致患者预后降低[19]。
APP是一种跨膜糖蛋白,既往常被作为阿尔茨海默病的重要参与者,近年研究发现APP不仅在神经中大量表达,在各种非神经组织中也表达丰富,能影响细胞增殖、分化、迁移和存活,在结直肠癌、胰腺癌、肺癌、甲状旁腺癌、乳腺癌、甲状腺癌等恶性肿瘤中过表达,并影响着癌细胞进程[20]。APPBP2是一种与微管相互作用,并在功能与APP转运和加工相关有关的膜内在蛋白,基于APPBP2对APP的调控作用,且APPBP2自身也能影响微管活动和功能,因此有学者推测APPBP2在恶性肿瘤中扮演重要角色[5]。有学者通过基因组鉴定发现,APPBP2异常表达与乳腺癌、骨肉瘤等恶性肿瘤发生有关[21-22]。实验指出,下调APPBP2能增强NSCLC细胞对靶向药物的敏感性,抑制NSCLC细胞增殖、迁移和侵袭[23]。然而关于APPBP2在临床NSCLC癌组织的表达意义尚不清楚。本研究结果显示,NSCLC组织中APPBP2高表达,提示APPBP2高表达可能参与NSCLC发生。结果还显示,NSCLC组织中APPBP2表达与分化程度、TNM分期和淋巴结转移有关,APPBP2高表达患者3年总生存率显著降低,是NSCLC患者死亡的独立危险因素,进一步说明APPBP2高表达参与NSCLC发生发展。其机制可能是APPBP2高表达能促进APP大量合成,通过激活磷脂酰肌醇3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号通路,促进NSCLC恶性进展[24]。同时APPBP2高表达也会导致微管功能异常,改变细胞骨架结构,促进NSCLC细胞持续分裂、增殖和迁移[5]。
本研究通过相关性分析发现,NSCLC组织中circBIRC6与APPBP2 mRNA表达呈正相关,提示circBIRC6与APPBP2可能共同参与NSCLC进程而影响患者预后。最近Ni等[25]通过双荧光素酶报告基因检测也发现,NSCLC中circBIRC6能通过海绵miR-217促进APPBP2表达,敲低circBIRC6则会抑制APPBP2表达,进而抑制NSCLC细胞增殖、侵袭和存活。此外本研究结果还显示,EGFR基因突变阳性/阴性NSCLC患者总生存率并无差异,考虑原因是EGFR基因突变虽然对EGFR靶向治疗更敏感,但针对部分EGFR基因突变亚型作用较差,因此可能影响疗效,这与既往研究报道结果相符[26]。TNM分期Ⅰ~Ⅱ期NSCLC患者总生存率高于Ⅲ期患者,且TNM分期Ⅲ期为NSCLC患者死亡的独立危险因素,说明TNM分期能显著影响NSCLC患者预后。其原因可能是TNM分期越高反映肿瘤细胞的侵袭性更强,恶性程度更高,因此会降低总生存率,并增加死亡风险。
综上所述,NSCLC组织中circBIRC6、APPBP2 mRNA表达升高,与分化程度、TNM分期、淋巴结转移和预后有关。但本研究样本量较少和随访时间较短,其结果还需多中心研究进一步扩张样本量和延长随访时间进行验证。

