基于Nrf2/HO-1通路探讨捏脊改善孤独症大鼠行为障碍的机制研究
苏丽红 郭榕蕙 洪燕玲 林丽莉

本文引用: 苏丽红, 郭榕蕙, 洪燕玲, 林丽莉. 基于Nrf2/HO-1通路探讨捏脊改善孤独症大鼠行为障碍的机制研究[J]. 湖南中医药大学学报, 2024, 44(4): 592-599.
〔摘要〕 目的 从氧化应激及核因子NF-E2相关因子-2(nuclear factor erythroid 2-related factor 2, Nrf2)/血红素加氧酶-1(heme oxygenase-1, HO-1)通路探讨捏脊改善孤独症大鼠行为障碍的作用机制。方法 将孤独症模型大鼠随机分为模型组、捏脊组,每组9只;同时纳入9只正常大鼠为空白组。捏脊组进行捏脊,21次/d,持续28 d。干预结束,各组大鼠进行行为学检测后处死取材,灌注固定后Nissl染色检测海马CA1、CA2区神经元损伤情况,取海马以生化试剂盒检测还原型谷胱甘肽(glutathione, GSH)、丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)表达,Western blot检测Nrf2及其磷酸化指标p-Nrf2、HO-1、NAD(P)H:醌氧化还原酶1[NAD(P)H:quinone oxidoreductase 1, NQO1]表达。结果 与空白组比较,模型组社交指数、站立次数均显著降低(P<0.01),理毛次数显著增多(P<0.01);与模型组比较,捏脊组社交指数、站立次数均明显提升(P<0.01),理毛次数减少(P<0.05)。空白组神经元细胞排列紧密,形态规则,尼氏体数量丰富;模型组有大量神经元受损,细胞核固缩深染,细胞膜破裂、边界模糊,尼氏体偏移、溶解,尼氏体阳性细胞数量减少;捏脊组细胞排列基本整齐,核固缩形态有所改善,细胞形态可,尼氏体阳性细胞数量增加。与空白组比较,模型组GSH、SOD、CAT、p-Nrf2/Nrf2、HO-1、NQO1表达量均降低(P<0.05或P<0.01),MDA表达量明显升高(P<0.01);与模型组比较,捏脊组GSH、SOD、CAT、p-Nrf2/Nrf2、HO-1、NQO1表达量均升高(P<0.05或P<0.01),MDA表达量显著下降(P<0.01)。结论 捏脊能改善孤独症大鼠行为障碍,与其活化Nrf2/HO-1通路、引起抗氧化因子表达、改善氧化应激、减轻神经元损伤有关。
〔关键词〕 孤独症;捏脊;氧化应激;Nrf2/HO-1通路;社交行为;海马区
〔中图分类号〕R244.1 〔文献标志码〕A 〔文章编號〕doi:10.3969/j.issn.1674-070X.2024.04.010
Mechanism of spine pinching in behavioral improvement of autistic rats based on Nrf2/HO-1 pathway
SU Lihong1, Guo Ronghui1, Hong Yanling1, LIN Lili1,2*
1. Fujian University of Chinese Medicine, Fuzhou, Fujian 350122, China;
2. Fujian Academy of Chinese Medical Sciences, Fuzhou, Fujian 350003, China
〔Abstract〕 Objective To investigate the mechanism of action of spine pinching in behavioral improvement of autistic rats from the perspective of oxidative stress and the nuclear factor erythroid 2-related factor 2 (Nrf2)/heme oxygenase-1 (HO-1) pathway. Methods The autism model rats were randomized into model group and spine-pinching group, with nine rats in each group. Nine normal rats were included as the blank group. In the spine-pinching group, spine-pinching manipulation was performed 21 times/d for consecutive 28 d. After the intervention, the rats in each group were sacrificed for sampling after behavioral tests. After perfusion and fixation, Nissl staining was performed to determine the neuronal damage in the CA1 and CA2 regions of the hippocampus, biochemical kits were applied to measuring the expressions of reduced glutathione (GSH), malondialdehyde (MDA), superoxide dismutase (SOD), and catalase (CAT) in the hippocampus, and Western blot was used to examine expressions of Nrf2 and its phosphorylation indicators p-Nrf2, HO-1, and NAD(P)H: quinone oxidoreductase 1 (NQO1). Results Compared with the blank group, the model group exhibited significantly lower social index and standing frequency (P<0.01), as well as a significant increase in grooming frequency (P<0.01). Compared with the model group, the spine-pinching group showed a significant improvement in social index and standing frequency (P<0.01), with a reduction in grooming frequency (P<0.05). In the blank group, the neurons were closely arranged, morphologically regular, and abundant in Nissl bodies. However, in the model group, a large number of neurons were damaged, with pyknotic and deeply stained nuclei, ruptured cell membranes, blurred cell boundaries, displaced and dissolved Nissl bodies, and a decrease in the number of Nissl-positive cells. In the spine-pinching group, cells were basically arranged neatly, with relieved nuclear pyknosis, acceptable cellular morphology, and an increase in the number of Nissl-positive cells. Compared with the blank group, GSH, SOD, CAT, p-Nrf2/Nrf2, HO-1, and NQO1 expressions in the model group decreased (P<0.05 or P<0.01), and MDA expression significantly increased (P<0.01). Compared with the model group, GSH, SOD, CAT, p-Nrf2/Nrf2, HO-1, and NQO1 expressions were higher (P<0.05 or P<0.01) and MDA expression was significantly lower (P<0.01) in the spine-pinching group. Conclusion Spine pinching can improve the behaviors of rats with autism, the mechanism of which is related to activating the Nrf2/HO-1 pathway, inducing the expressions of antioxidant factors, relieving oxidative stress, and reducing of the neuronal damage.
〔Keywords〕 autism; spine pinching; oxidative stress; nuclear factor erythroid 2-related factor 2/heme oxygenase-1 pathway; social behavior; hippocampus
孤独症(autism),又称自闭症,以沟通能力障碍、社会交往能力异常、刻板行为和单一兴趣为特征。迄今为止,孤独症发病机制尚未阐明,并且仍然缺少针对孤独症核心症状的有效药物。抗癫痫药丙戊酸钠(sodium valproate, VPA)被认为是孤独症的环境危险因素,妊娠期间孕母的VPA治疗可导致新生儿孤独症[1]。VPA被认为是氧化应激的触发因素,能够引发活性氧(reactive oxygen species,ROS)的形成,ROS通过破坏脂质、蛋白质和DNA来干扰神经元细胞发育[2]。核因子NF-E2相关因子-2(nuclearfactor erythroid 2-related factor 2, Nrf2)/血红素加氧酶-1(heme oxygenase-1, HO-1)通路被认为是脑组织中重要的抗氧化应激通路,氧化应激促使游离状态下的Nrf2发生了磷酸化入核,激活抗氧化因子的表达,同时还可诱导内源性防御系统以保护细胞免受氧化应激反应的损伤[3]。
素有“病变在脑,首取督脉”的观点[4-5],而捏脊也成为小儿推拿在脑病研究中的常用手段之一。前期研究发现,捏脊可以改善自闭症大鼠的焦虑样行为,并进一步发现这种改善可能与捏脊抑制NF-κB通路的过度激活有关[6]。但氧化应激作为孤独症效应及机制研究领域新进的关注热点,尚且缺少研究探讨捏脊干预是否与氧化应激及其Nrf2/HO-1通路存在关联。因此,拟通过研究捏脊对孤独症大鼠氧化应激相关氧化/还原代表性指标还原型谷胱甘肽(glutathione, GSH)、丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT),和Nrf2/HO-1通路重要指标Nrf2及其磷酸化指标p-NRF2、HO-1、NAD(P)H:醌氧化还原酶1[NAD(P)H:quinone oxidoreductase 1,NQO1]表达,以及神经元损伤的影响,探索捏脊改善孤独症大鼠行为障碍的作用机制。
1 材料与方法
1.1 动物
成年健康Wistar大鼠26只,雌雄各半,雌性大鼠体质量为200~220 g,雄性大鼠体质量为220~250 g,购自上海斯莱克实验动物有限责任公司,实验动物许可证号:SYXK(闽)2019-0007,喂养于福建中医药大学实验动物中心。动物饲养条件:温度20~24 ℃、相对湿度40%~60%、明暗各12 h交替,自由进食及饮水,普通饲料喂养。实验已通过福建中医药大学动物实验伦理委员会批准(伦理审批号:2022-185)。
1.2 主要试剂与仪器
鼠单克隆抗体β-actin、鼠单克隆抗体HO-1、兔多克隆抗体Nrf2、Anti-Mouse二抗、Anti-Rabbit二抗(武汉三鹰生物技术有限公司,批号分别为66009-1-Ig、66743-1-Ig、16396-1-AP、SA00001-1、SA00001-2);兔多克隆抗体p-Nrf2(江苏亲科生物研究中心有限公司,批号:DF7519);兔单克隆抗体NQO1(美国Abcam公司,批号:Ab80588);尼氏染色液(索莱宝生物科技有限公司,批号:G1436); MDA试剂盒、SOD试剂盒、CAT试剂盒、GSH试剂盒、蛋白定量(TP)测定试剂盒(南京建成生物工程研究所,批号分别为A003-1-1、A001-3-2、A007-1-1、A006-2-1、A045-4-2);VPA(美國Sigma-Aldrich公司,批号:P4543)。
生物组织自动脱水机(亚光医用电子技术有限公司,型号:ZT-14V1);石蜡包埋机(亚光医用电子技术有限公司,型号:YB-7LF);电泳仪(美国Bio-Rad公司,型号:Mini-PROTEAN);凝胶成像仪(美国Bio-Rad公司,型号:ChemiDoc XRS+)。
1.3 模型制备与分组
孤独症模型大鼠制备参考SCHNEIDER等[7]采用的方法。育龄期雌、雄Wistar大鼠适应性喂养1周后,于18:00将雌、雄大鼠按1∶1合笼过夜,次日8:00检查鼠笼底部托盘,若发现脱落的淡黄色、半透明、凝胶状阴栓,则记录为该雌鼠妊娠0.5 d,并单独分笼饲养。随机选取9只孕鼠,在发现阴栓后12 d,即妊娠12.5 d,腹腔注射VPA,剂量为600 mg/kg,产下的仔鼠经发育行为学检测(体质量、睁眼时间、方向趋向性功能测试、足底热痛试验、游泳试验)确认造模成功,模型组大鼠体质量明显偏低,睁眼时间显著落后于空白组,在方向趋向性功能检测、游泳试验、足底热痛实验中模型组大鼠使用了较长的时间完成180°转向、游泳评分较低、对热痛刺激应答时间较长,显示出明显的运动神经和前庭发育状态低下、运动协调性不足、对伤害性刺激的敏感程度减退等特点,均反映了孤独症大鼠的发育行为学缺陷[8]。另外4只孕鼠注射等量的生理盐水,产下的仔鼠为空白组大鼠。每组随机选取9只大鼠纳入实验。
1.4 干预方法
捏脊组采取捏脊干预:一名实验员用食指和中指轻柔固定在大鼠颈部两侧,另一名实验员进行捏脊操作;在开始捏脊前至上而下轻抚大鼠背部1~3次,实验员双手配合交替从大鼠脊中线尾根部逐渐向上捏至大椎穴(大椎穴参照唐勇主编的《实验针灸学》确定[9]),拇、食二指相对捏起大鼠脊柱背部皮肤,边捏边往上推;捏起大鼠皮肤高度达0.2~0.3 cm,从大鼠脊柱中线尾根部捏至大椎穴为一遍捏脊操作;从第7次起,每捏3次将捏起处皮肤轻提起1次,直至完成所有捏脊次数操作。21次/d,连续捏脊28 d。在捏脊组大鼠捏脊期间,空白组和模型组仅模拟抓取动作。
1.5 取材
2%戊巴比妥鈉按0.25 mL/100 g腹腔注射麻醉大鼠,麻醉后快速打开胸腔,暴露心脏,以眼科剪在左心室处开一个小口,迅速将灌流针头从左心室插入主动脉,固定针头,随即剪开右心耳,灌注生理盐水约200 mL,直至观察到大鼠肝脏由深褐色变为浅褐色、足部变白,再向左心室注入4%多聚甲醛约100 mL,待大鼠头部及肢体僵硬后断头,从嗅球处向下取出全脑。每组随机选取3只大鼠进行灌注,取全脑置于4%多聚甲醛溶液固定,以待尼氏染色检测,海马CA1区、CA2区参照PAXINOS等[10]主编的The Rat Brain进行定位;另外6只大鼠不进行灌注,麻醉后断头,取出全脑后钝性分离海马,迅速将组织转存至-80 ℃冰箱。
1.6 行为学检测
1.6.1 旷场实验 旷场实验箱是规格为75 cm×75 cm×40 cm的正方体,四周及底部均为亚克力板。选择大鼠的非活动期(8:00—16:00)进行检测。将大鼠提前1 h放置于无背景噪声室内适应,实验前用75%乙醇清洁旷场实验箱。实验人员依次将大鼠放入旷场实验箱内,每次1只,并任其自由活动,每只大鼠活动时间为5 min,记录大鼠在旷场内站立、理毛等行为。
1.6.2 三箱社交实验 三箱测试工具为亚克力板做成的长方体箱子,用两个隔板在中间隔开,形成左侧、右侧、中间3个隔箱,每等份规格为30 cm×40 cm×30 cm的长方体,两个隔板开放有可供大鼠出入的小门,左右两侧小箱子中各有一个高18 cm、直径8 cm的铁笼,将陌生大鼠放入其中。陌生大鼠选择同龄、同性别、体质量差异不大且从未接触过的同类。先于无背景噪声房间内适应1 h,再将被试大鼠放进三箱内适应5 min,期间大鼠可以在三箱中自由出入;待5 min结束后先将大鼠取出,然后将陌生大鼠1号放进左侧铁笼(1号笼),右侧铁笼不放置大鼠,再将被试大鼠放进中间隔箱内,任其自由活动,监测10 min。大鼠探索1号笼的社交时间与探索空笼的时间比值即为社交指数[11]。
1.7 指标检测
1.7.1 Western blot检测 以Western blot检测大鼠左脑海马Nrf2、p-Nrf2、HO-1、NQO1蛋白的相对表达量。6只大鼠左脑海马加入含有蛋白酶抑制剂和磷酸酶抑制剂的裂解液,制备匀浆,提取上清,BCA 法测定蛋白浓度,加入足量的上样缓冲液使各蛋白浓度保持一致,根据待测蛋白的预测分子量制备凝胶,80 V电泳2 h,400 mA转膜0.5 h,封闭0.5 h,而后孵育一抗β-actin(1∶50 000)、Nrf2(1∶8 000)、p-Nrf2(1∶500)、HO-1(1∶2 000)、NQO1(1∶25 000),一抗4 ℃冷库孵育14 h后,TBST洗脱5次,1次5 min,二抗比例均为1∶10 000,室温孵育2 h,TBST洗脱5次,1次5 min,显影曝光,使用Image J分析条带灰度值。
1.7.2 生化试剂盒法检测 准确称取大鼠右脑海马组织质量,按质量(g)∶体积(mL)=1∶9的比例,加入9倍体积的生理盐水,冰水浴条件下,制备成10%的组织匀浆,以2 500 r/min半径8 cm离心10 min,随后取上清,再用生理盐水稀释成不同取样浓度,根据GSH、MDA、SOD、CAT试剂盒说明书逐一进行操作。
1.7.3 尼氏染色检测 组织脱水,浸蜡,包埋,切片(厚度4 μm),摊片,烤片。将切片依次经二甲苯Ⅰ(8 min)、二甲苯Ⅱ(8 min)、二甲苯Ⅲ(8 min)、100%乙醇Ⅰ(4 min)、100%乙醇Ⅱ(4 min)、95%乙醇(2 min)、80%乙醇(2 min)、70%乙醇(2 min)脱蜡水化,蒸馏水水洗2次,1次1 min,随后将切片浸没于装有尼氏染色液的染色缸中,避光,60 ℃条件下染色25 min。染色结束,取出切片,流水洗1 min。用95%乙醇快速分化60 s。将切片依次经95%乙醇Ⅰ(30 s)、95%乙醇Ⅱ(30 s)、100%乙醇Ⅰ(30 s)、100%乙醇Ⅱ(30 s)、二甲苯Ⅰ(10 s)、二甲苯Ⅱ(10 s)、二甲苯Ⅲ(10 s)脱水透明,显微镜下观察染色结果。
1.8 统计学方法
采用SPSS 23.0 统计软件进行分析。数据以“x±s”表示:若数据符合正态分布,采用单因素方差分析方法,方差齐者用LSD法,方差不齐则用Dunnett T3法;若数据不符合正态分布,则采用非参数检验的分析方法。以P<0.05 表示差异具有统计学意义。
2 结果
2.1 各组大鼠旷场实验检测指标比较
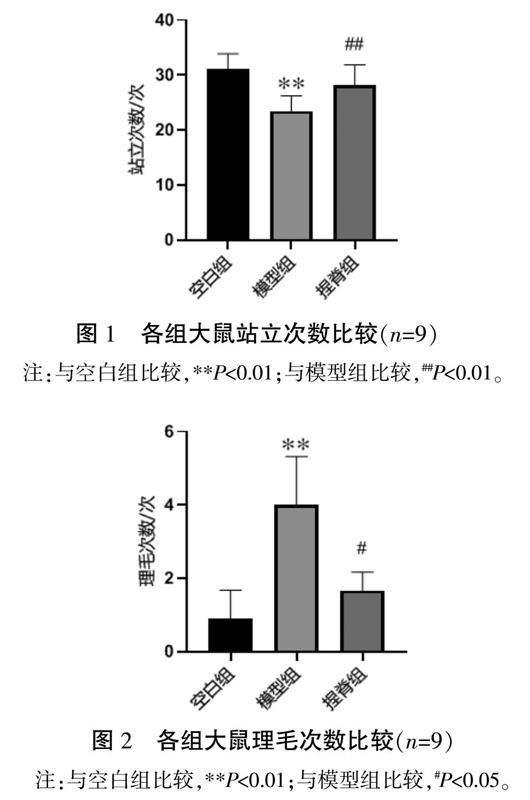
与空白组比较,模型组大鼠站立次数明显减少(P<0.01)、理毛次数明显增多(P<0.01);与模型组比较,捏脊组大鼠站立次数明显增加(P<0.01)、理毛次数降低(P<0.05)。详见图1—2。
2.2 各组大鼠社交指数比较
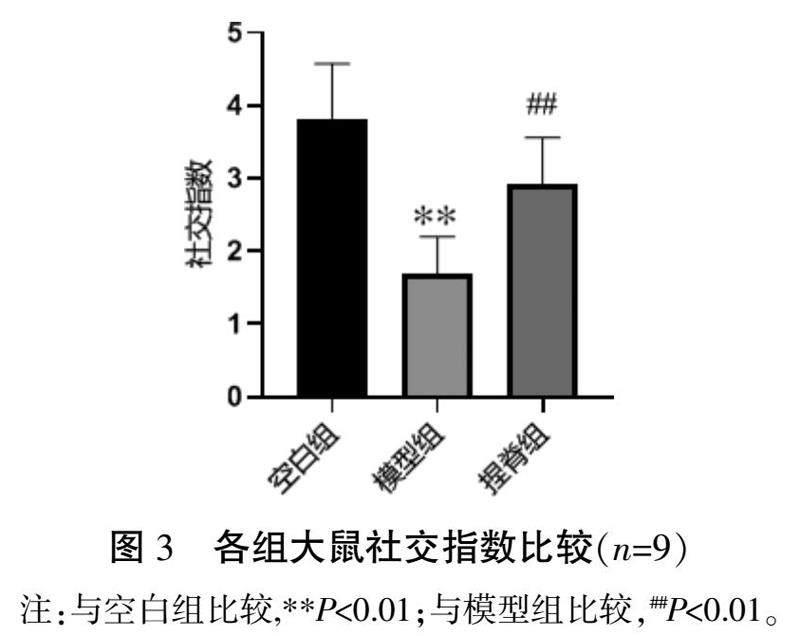
与空白组比较,模型组大鼠社交指数明显降低(P<0.01);与模型组比较,捏脊组大鼠社交指数明显升高(P<0.01)。详见图3。
2.3 各组大鼠海马CA1、CA2区尼氏染色结果
空白组海马CA1区、CA2区神经元细胞排列紧密,形态规则,核仁明显,尼氏体数量丰富,着色均匀,无明显的神经元丢失。模型组有大量神经元受损,出现细胞萎缩,呈空泡状改变;细胞膜破裂、边界模糊,细胞核深染、变小、固缩、呈不规则或破裂形态,尼氏体偏移、溶解,尼氏体阳性细胞数量减少。捏脊组神经元细胞排列基本整齐,核固缩形态有所改善,细胞形态可,少量神经元形态皱缩不完整,尼氏体阳性细胞数量增加。详见图4—5。
2.4 各組大鼠海马区氧化应激指标GSH、MDA、SOD、CAT表达水平比较
与空白组比较,模型组GSH、SOD、CAT表达水平均显著降低(P<0.01),MDA表达水平显著升高(P<0.01);与模型组比较,捏脊组GSH、SOD表达水平升高(P<0.05),CAT表达水平显著升高(P<0.01),MDA表达水平显著下降(P<0.01)。详见图6—9。
2.5 各组大鼠海马区p-Nrf2/Nrf2、HO-1、NQO1表达比较
与空白组比较,模型组p-Nrf2/Nrf2、HO-1表达均明显降低(P<0.01),NQO1表达降低(P<0.05);与模型组比较,捏脊组p-Nrf2/Nrf2、HO-1、NQO1表达升高(P<0.05)。详见表2、图10。
3 讨论
中医学认为孤独症属于“目无情”“视无情”“五迟”范畴,病机为神机紊乱(或不足)、脏腑功能失调,病位在脑,与心、肝、肾相关[12]。现代医学研究发现,孤独症成因复杂,普遍认为孤独症是遗传、环境、免疫、神经等多因素作用的结果,氧化应激作为结合这些危险因素的内在机制,是孤独症神经发育障碍的重要促成因素。氧化应激损害发育中的海马、前额皮质等重要脑区神经元并造成损伤,这种损伤通过炎症等破坏进一步加剧过氧化状态的恶化,形成负性循环,最终导致孤独症样异常的社会、认知和运动行为[13]。因此,团队基于前期研究发现,捏脊改善了精神发育迟滞患儿的社交行为,缓解孤独症模型大鼠的孤独症样行为障碍[6],进一步认为捏脊改善孤独症模型大鼠的行为障碍可能与其调节孤独症模型大鼠的氧化应激状态密切相关。
对啮齿类动物孕期腹腔注射VPA以从子代获取孤独症模型动物,是孤独症可靠和成熟的造模方法,具有良好的构建效度[14]。旷场实验中,模型组大鼠站立次数下降,理毛次数增加,说明孤独症模型大鼠对陌生环境缺乏探索兴趣以及重复刻板行为的增多[15]。经过捏脊干预,孤独症大鼠的新环境探索兴趣提高,重复刻板样行为发生次数减少。本实验中,经过捏脊干预,孤独症模型大鼠社交指数提高,表明捏脊有助于孤独症模型大鼠社交缺陷的恢复。社交行为包括了社交认知和社交记忆,海马作为记忆和认知的重要脑区[16],也参与了社交行为。海马CA1区和CA2区二者共同承担了社交信息的传递和整合任务[17-18],尤其CA2区被认为是海马社交功能的核心脑区,在三箱社交实验中,正常转基因小鼠对环境中新加入的陌生鼠表现出显著的探索偏好,而CA2区失活的转基因小鼠对陌生鼠和熟悉鼠之间的探索兴趣没有出现显著差异,提示海马CA2区对社交认知活动产生影响[19]。本实验中捏脊改善孤独症大鼠海马社交相关的重要脑区CA1、CA2区的神经元损伤,对海马神经元的结构和功能具有一定保护作用。
虽然普通成年人大脑只占体质量的2%,但是消耗了机体20%的氧气[20]。高耗氧过程会产生大量ROS,由于神经元缺乏产生抗氧化剂GSH的能力,大脑解毒ROS的能力有限,神经元是第一个受到ROS增加和抗氧化剂短缺影响的细胞[21-22],最易受氧化应激影响。脑组织内主要的抗氧化物质有GSH、SOD、CAT等,GSH是机体内最重要的非酶性抗氧化物,它通过提供一个电子以中和自由基,减少氧化应激反应的发生,是衡量机体抗氧化能力的重要因素。GSH缺乏是孤独症的重要病理改变,低GSH水平可能是许多与孤独症相关的系统性异常的基础,例如氧化应激和免疫功能失调等[23]。SOD是细胞内抗脂质过氧化作用的酶性保护系统的主要成分,SOD是机体对抗自由基的第一道屏障,能清除超氧阴离子自由基,将其转化为过氧化氢(hydrogen peroxide, H2O2)和氧气(oxygen, O2),低SOD水平可导致超氧化物介导的DNA损伤,从而影响神经元的生长和迁移[24]。CAT是过氧化物酶体H2O2的主要清除者,其可以有效地催化H2O2降解为无害的水和O2[25]。在自由基攻击膜脂蛋白和多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)的过程中,会产生许多含氧化合物,MDA作为硫代巴比妥酸(2-thiobarbituric acid, TBA)反应产物的原型,是反映机体内脂质过氧化水平的良好标记。本实验中,孤独症大鼠海马区存在明显的氧化应激状态,表现在GSH、SOD、CAT等抗氧化剂含量不足,而MDA含量明显升高。捏脊干预使得孤独症大鼠的MDA水平较模型组显著下降,GSH、SOD、CAT水平较模型组显著升高,提示捏脊具有改善海马区氧化/还原失衡状态的效应。
Nrf2是细胞内参与抗氧化反应的主要调节成分,在外源性应激条件下,Nrf2被激活后进入细胞核,Nrf2与Maf家族蛋白形成异源二聚体并与抗氧化反应元件ARE结合,转录调控下游抗氧化因子HO-1、NQO1、SOD、GSH、CAT等物质的表达[26]。一方面,Nrf2是调节细胞内抗氧化应激反应的重要转录因子;另一方面,Nrf2基因也与自闭症异常行为表现相关。研究发现,与服用VPA的野生型小鼠相比,Nrf2基因敲除小鼠对早期发育期间施用VPA引起的神经损伤更敏感,表现出更明显的探索性行为减少及学习记忆障碍[27]。ZHAO等[28]研究表明,孤独症大鼠前额皮质区Nrf2在核内低表达。氧化应激状态下,HO-1可以裂解产生胆绿素甚至是抗氧化作用更强的胆红素以减轻氧化应激损伤[29]。NQO1能通过双电子还原反应使醌类化合物变成低毒性的氢醌类物质,抑制醌类化合物转化为半醌类自由基和ROS[30]。本实验中,捏脊组大鼠的p-Nrf2/Nrf2比值、HO-1和NQO1蛋白表达较模型组升高,提示捏脊活化孤独症模型大鼠海马区Nrf2/HO-1通路,提高下游抗氧化酶HO-1、NQO1的表达。
综上所述,捏脊干预使得孤独症大鼠的社交障碍发生改善,刻板理毛行为减少,对陌生环境探索兴趣提升,其机制可能与捏脊活化Nrf2/HO-1通路、引起抗氧化因子表达、提高抗氧化酶含量、加速清除氧自由基、缓解神经元氧化应激损伤有关。
參考文献
[1] CHRISTENSEN J, GR?NBORG T K, S?RENSEN M J, et al. Prenatal valproate exposure and risk of autism spectrum disorders and childhood autism[J]. JAMA, 2013, 309(16): 1696-1703.
[2] SANDHYA T, SOWJANYA J, VEERESH B. Bacopa monniera (L.) Wettst ameliorates behavioral alterations and oxidative markers in sodium valproate induced autism in rats[J]. Neurochemical Research, 2012, 37(5): 1121-1131.
[3] STENVINKEL P, MEYER C J, BLOCK G A, et al. Understanding the role of the cytoprotective transcription factor nuclear factor erythroid 2-related factor 2-lessons from evolution, the animal Kingdom and rare progeroid syndromes[J]. Nephrology, Dialysis, Transplantation, 2020, 35(12): 2036-2045.
[4] 李 璟, 刘艳艳, 赵海音, 等. 秦亮甫“督脉为要”之临证经验[J]. 江苏中医药, 2014, 46(7): 14-16.
[5] 张学君. 自闭症从“督脉论治”的探讨[J]. 上海针灸杂志, 2013, 32(11): 968-970.
[6] 龚梦华, 吴倩雯, 李一纯, 等. 捏脊疗法对自闭症模型大鼠焦虑样行为及NF-κB通路的影响[J]. 云南中医中药杂志, 2023, 44(4): 81-85.
[7] SCHNEIDER T, PRZEW?OCKI R. Behavioral alterations in rats prenatally exposed to valproic acid: Animal model of autism[J]. Neuropsychopharmacology, 2005, 30(1): 80-89.
[8] 林 燊, 林 栋, 齐诗仪, 等. 电针不同刺激时长对自闭症大鼠BDNF-CREB信号通路的影响[J]. 中华中医药杂志, 2022, 37(7): 4063-4069.
[9] 唐 勇. 实验针灸学[M]. 3版. 上海: 上海科学技术出版社, 2021: 149.
[10] PAXINOS G, WATSON C. The Rat Brain[M]. sixth ed. London: Elsevier, 2007: 98-115.
[11] JIAN J, LI L G, ZHAO P J, et al. TCHis mitigate oxidative stress and improve abnormal behavior in a prenatal valproic acid-exposed rat model of autism[J]. Physiological Genomics, 2022, 54(9): 325-336.
[12] 党伟利, 马丙祥. 基于玄府理论及变蒸学说对小儿自闭症的认识[J]. 中华中医药杂志, 2020, 35(10): 4914-4916.
[13] BJ?RKLUND G, MEGUID N A, EL-BANA M A, et al. Oxidative stress in autism spectrum disorder[J]. Molecular Neurobiology, 2020, 57(5): 2314-2332.
[14] ROULLET F I, WOLLASTON L, DECATANZARO D, et al. Behavioral and molecular changes in the mouse in response to prenatal exposure to the anti-epileptic drug valproic acid[J]. Neuroscience, 2010, 170(2): 514-522.
[15] NADEEM A, AHMAD S F, AL-HARBI N O, et al. Increased oxidative stress in the cerebellum and peripheral immune cells leads to exaggerated autism-like repetitive behavior due to deficiency of antioxidant response in BTBR T+tf/J mice[J]. Progress in Neuro-Psychopharmacology&Biological Psychiatry, 2019, 89: 245-253.
[16] LANG M, COLBY S, ASHBY-PADIAL C, et al. An imaging review of the hippocampus and its common pathologies[J]. Journal of Neuroimaging, 2024, 34(1): 5-25.
[17] DIETHORN E J, GOULD E. Development of the hippocampal CA2 region and the emergence of social recognition[J]. Developmental Neurobiology, 2023, 83(5/6): 143-156.
[18] TZAKIS N, HOLAHAN M R. Social memory and the role of the hippocampal CA2 region[J]. Frontiers in Behavioral Neuroscience, 2019, 13: 233.
[19] HITTI F L, SIEGELBAUM S A. The hippocampal CA2 region is essential for social memory[J]. Nature, 2014, 508: 88-92.
[20] MARE[ˇ][C]KOV? K, MARE[ˇ][C]EK R, BENCUROVA P, et al. Perinatal stress and human hippocampal volume: Findings from typically developing young adults[J]. Scientific Reports, 2018, 8: 4696.
[21] WU P, JIANG L, CHEN H S. Sodium valproate at the therapeutic concentration inhibits the induction but not the maintenance phase of long-term potentiation in rat hippocampal CA1 area[J]. Biochemical and Biophysical Research Communications, 2010, 391(1): 582-586.
[22] 高立偉, 李 萌, 许 静, 等. 核转录相关因子2和自噬在血管性痴呆中的作用机制研究[J]. 国际神经病学神经外科学杂志, 2018, 45(6): 633-636.
[23] REID M, JAHOOR F. Glutathione in disease[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2001, 4(1): 65-71.
[24] MEGUID N A, DARDIR A A, ABDEL-RAOUF E R, et al. Evaluation of oxidative stress in autism: Defective antioxidant enzymes and increased lipid peroxidation[J]. Biological Trace Element Research, 2011, 143(1): 58-65.
[25] YU W C, KONG G H, YA H J, et al. Comprehensive analysis of the catalase (CAT) gene family and expression patterns in rubber tree (Hevea brasiliensis) under various abiotic stresses and multiple hormone treatments[J]. International Journal of Molecular Sciences, 2023, 25(1): 70.
[26] STENVINKEL P, MEYER C J, BLOCK G A, et al. Understanding the role of the cytoprotective transcription factor nuclear factor erythroid 2-related factor 2-lessons from evolution, the animal Kingdom and rare progeroid syndromes[J]. Nephrology, Dialysis, Transplantation, 2020, 35(12): 2036-2045.
[27] FURNARI M A, SAW C L, KONG A N, et al. Altered behavioral development in Nrf2 knockout mice following early postnatal exposure to valproic acid[J]. Brain Research Bulletin, 2014, 109: 132-142.
[28] ZHAO Y H, FU H G, CHENG H, et al. Electroacupuncture at Zusanli ameliorates the autistic-like behaviors of rats through activating the Nrf2-mediated antioxidant responses[J]. Gene, 2022, 828: 146440.
[29] OTTERBEIN L E, SOARES M P, YAMASHITA K, et al. Heme oxygenase-1: Unleashing the protective properties of heme[J]. Trends in Immunology, 2003, 24(8): 449-455.
[30] YANG Y J, DAI M C, REO Y J, et al. NAD(P)H quinone oxidoreductase-1 in organ and tumor tissues: Distinct activity levels observed with a benzo-rosol-based dual-excitation and dual-emission probe[J]. Analytical Chemistry, 2021, 93(20): 7523-7531.
〔基金项目〕国家自然科学基金项目(81704194);福建省自然科学基金项目(2022J01366);福建省属公益类科研院所基本科研专项项目(2023R1003006)。
〔通信作者〕*林丽莉,女,博士,教授,博士研究生导师,E-mail:438488409@qq.com。

