固本平喘方对慢性阻塞性肺疾病模型大鼠气道MUC5AC水平的影响
吴阳洋 欧阳桂兰 陈新海 游柏稳


本文引用: 吴阳洋, 欧阳桂兰, 陈新海, 游柏稳. 固本平喘方对慢性阻塞性肺疾病模型大鼠气道MUC5AC水平的影响[J]. 湖南中医药大学学报, 2024, 44(4): 565-571.
〔摘要〕 目的 使用固本平喘方对香烟烟雾暴露联合气管滴注脂多糖(lipopolysaccharide,LPS)、猪胰弹性蛋白酶(porcine pancreatic elastase,PPE)造模大鼠进行干预,以主要分泌性黏蛋白5AC(mucin5AC,MUC5AC)作为评价指标,测定肺组织MUC5AC含量、蛋白表达、mRNA表达,评价各组气道黏液分泌强度。方法 将64只SPF级SD大鼠适应性饲养1周后,随机取52只进行造模,造模成功后取50只随机分为模型组(蒸馏水)、地塞米松组(0.15 mg·kg-1)及固本平喘方高(28 g·kg-1)、中(14 g·kg-1)、低(7 g·kg-1)剂量组,每组10只,另取10只大鼠为对照组(蒸馏水)。15 d后处死大鼠并收集标本。HE染色观察大鼠肺组织病理学变化;ELISA法检测肺组织MUC5AC水平;RT-PCR检测肺组织MUC5AC mRNA表达水平;Western blot检测肺组织MUC5AC蛋白表达;免疫荧光检测肺组织MUC5AC表达分布态势。结果 模型组大鼠肺组织结构显著破坏,肺泡腔内及肺间质见大量炎性浸润;地塞米松组及固本平喘方各剂量组可见肺泡腔受损程度及组织炎性浸润程度减轻。与对照组比较,其余各组MUC5AC含量均升高(P<0.05);与模型组比较,地塞米松组及固本平喘方各剂量组MUC5AC含量及MUC5AC mRNA表达均下降(P<0.05),地塞米松组及固本平喘方高、中剂量组MUC5AC蛋白表达降低(P<0.05)。肺组织免疫荧光可见,MUC5AC在模型组中呈现强表达,在地塞米松组中呈现较弱表达,在固本平喘方低、中、高剂量组中,表达强度依次减弱。结论 固本平喘方可改善慢性阻塞性肺疾病模型大鼠的肺组织病理损伤,有效减少MUC5AC含量、下调MUC5AC mRNA表達、降低MUC5AC蛋白表达,改善大鼠气道黏液高分泌状态。
〔关键词〕 慢性阻塞性肺疾病;固本平喘方;黏蛋白5AC;气道黏液状态
〔中图分类号〕R256.1 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.04.006
Effects of Guben Pingchuan Formula on MUC5AC level in the airway of chronic obstructive pulmonary disease model rats
WU Yangyang, OUYANG Guilan, CHEN Xinhai, YOU Bowen*
The Second Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410000, China
〔Abstract〕 Objective Using Guben Pingchuan Formula (GBPCF) to intervene the rat model established by cigarette smoke exposure combined with tracheal instillation of lipopolysaccharide (LPS) and porcine pancreatic elastase (PPE), taking mucin 5AC (MUC5AC) as the evaluation indicator, so as to measure its content, protein expression, and mRNA expression in the rat lung tissue and evaluate the airway mucus secretion intensity in each group. Methods After one week of adaptive feeding of 64 SPF-level SD rats, 52 of them were randomly taken for modeling. After successful modeling, 50 model rats were randomized into model group (distilled water), dexamethasone group (0.15 mg·kg-1), and GBPCF high- (28 g·kg-1), medium- (14 g·kg-1), and low-dose groups (7 g·kg-1), with ten rats in each group. Another ten rats were selected as control group (distilled water). After 15 days, the rats were euthanized and specimens were collected. HE staining was used to observe the pathological changes in the lung tissue of rats, ELISA to determine the level of MUC5AC in the lung tissue, RT-PCR to measure MUC5AC mRNA expression level, Western blot to examine MUC5AC protein expression, and immunofluorescence to check the distribution pattern of MUC5AC expression. Results The pulmonary tissue structure of the model group was notably damaged, with a large amount of inflammatory infiltration in the alveolar cavity and pulmonary interstitium. The degree of alveolar damage and tissue inflammatory infiltration was reduced in the dexamethasone group and GBPCF groups of various doses. Compared with the control group, the content of MUC5AC in all other groups increased (P<0.05). Compared with the model group, the content and mRNA expression of MUC5AC in the dexamethasone group and GBPCF groups of various doses decreased (P<0.05), and the MUC5AC protein expression in the dexamethasone group, the high-and medium-dose groups of GBPCF decreased (P<0.05). Immunofluorescence of the lung tissue revealed strong MUC5AC expression in the model group, weaker expression in the dexamethasone group, and successively decreased expressions in the low-, medium-, and high-dose groups of GBPCF. Conclusion GBPCF can alleviate the pathological damage of lung tissue in model rats of chronic obstructive pulmonary disease (COPD), effectively reduce MUC5AC content, downregulate MUC5AC mRNA expression, decrease MUC5AC protein expression, and improve the high secretion state of airway mucus in rats.
〔Keywords〕 chronic obstructive pulmonary disease; Guben Pingchuan Formula; mucin 5AC; airway mucus
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一组慢性支气管炎和(或)肺气肿合并气流受限,并可进一步发展为呼吸衰竭和肺心病的慢性疾病,常与烟雾及其他毒性颗粒的长期刺激密切相关[1]。目前,因COPD死亡的人群已占据全球死亡原因的第三位[2],已成为全球范围内的严重公众安全问题。目前认为,气道黏液高分泌是COPD的重要病理特点[3],最新的COPD全球倡议指南亦将慢性黏液高分泌作为COPD急性加重的一项重要依据[4]。黏蛋白5AC(mucin5AC,MUC5AC)作为主要的分泌性气道黏蛋白,在肺组织中的含量及蛋白、mRNA表达量可作为判断气道黏液高分泌的重要评估手段[5]。本实验选择固本平喘方作为干预措施,以研究其对COPD模型大鼠气道MUC5AC水平的影响。
1 材料
1.1 实验动物
选取健康7周龄SPF级SD大鼠64只(皆为雄性),体质量(200±20) g。大鼠由湖南斯莱克景达实验动物有限公司提供,实验动物生产许可证号为SCXK(湘)2019-0004。饲养设施由湖南中医药大学第一附属医院医学创新实验中心提供,使用许可证号为SYXK(湘)2020-0010。饲养环境温度为(22±2) ℃,适应性饲养7 d后进行实验。本实验所涉及的动物实验操作经湖南中医药大学第一附属医院医学创新实验中心实验动物伦理委员会批准,伦理编号为ZYFY20211220。
1.2 药物
(1)固本平喘方组成:党参10 g,黄芪30 g,白术10 g,茯苓15 g,法夏10 g,陈皮6 g,补骨脂10 g,菟丝子10 g,苦杏仁10 g,紫苏子10 g,红景天10 g,炙甘草6 g。购于湖南中医药大学第二附属医院中药房。中药煎煮2次,分别加入10、8倍量水,各煎煮1 h,合并2次药液,过滤去沉淀,合并滤液,蒸发浓缩至每毫升药液含生药1 g,冷却后置于4 ℃冰箱备用,临用前用蒸馏水配成所需浓度。
(2)地塞米松片:生产厂商为浙江仙琚制药,国药准字为H33020822,生产批号为210330,规格为0.75 mg/片。
1.3 主要试剂
2%戊巴比妥钠(山东西亚化学工业有限公司,批号:57-33-0);4%多聚甲醛溶液(中国Biosharp公司,批号:30525-89-4);MUC5AC ELISA试剂盒(江苏菲亚生物科技有限公司,批号:2206M09);逆转录试剂盒(北京康为世纪生物科技有限公司,批号:CW2569);核酸染料(北京普利莱基因科技有限公司,批号:PB11141);蛋白上样缓冲液、Tris-HCl缓冲液、山羊抗兔免疫球蛋白IgG(中国Abiowell公司,批号:AWB0055、AWB0073、AWS0002);MUC5AC兔抗(美国ThermoFisher公司,批号:PA5-79705);HRP-山羊抗兔、CY3山羊抗兔IgG(湖南艾方生物科技有限公司,批号:AFIHC003、AFSA006);猪胰弹性蛋白酶(porcine pancreatic elastase,PPE)(上海Acmec公司,批号:39445-21-1);脂多糖(lipopolysaccharide,LPS)(美国Sigma-Aldrich公司,批號:L2880-100MG);白沙牌香烟(湖南中烟工业有限责任公司,焦油量:10 mg,烟气烟碱量:0.8 mg,烟气一氧化碳量:12 mg,序列号:6901028191135)。
1.4 主要仪器
自制烟熏箱;移液器(德国艾本德股份公司,型号:Finnpipette-4641080N);离心机(长沙湘智离心机仪器有限公司,型号:TG16W);台式冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R);荧光定量RCP仪、荧光PCR板(美国Thermo公司,型号:PIKOREAL96、SPL0960);电泳仪、水平琼脂糖电泳槽(北京六一生物科技有限公司,型号:DYY-6C、DYCZ-24DN);旋涡混合器(江苏其林贝尔仪器制造有限公司,型号:GL-88B);磁力搅拌器(上海仪电科学仪器股份有限公司,型号:81-2);生物样品均质仪(杭州奥盛仪器有限公司,型号:BioPrep-24);化学发光成像系统(上海勤翔科学仪器有限公司,型号:ChemiScope6100)。
2 方法
2.1 动物模型的制备
将64只SPF级SD大鼠适应性饲养1周后,采用随机数字表法选取其中52只,采用香烟烟雾暴露联合气管滴注LPS、PPE的方法[6-7]制备COPD大鼠模型。大鼠每日两次被动吸烟,每次时长60 min,每次被动吸烟间隔时间≥5 h,共烟熏4周。除此之外,日常饲养保证与对照组一致,并在烟熏首日及第14日行气管内滴注LPS、PPE。
气管内滴注LPS、PPE操作方法:首先使用1%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,固定大鼠,剃去颈部毛发,消毒后纵形切开并向下剥离组织,暴露气管后使用1 mL注射器先抽取0.3 mL空气,再分别抽取LPS(0.1 mg/0.1 mL)及PPE(10 U/0.1 mL)快速注入气管,旋转固定大鼠,使LPS、PPE均匀分布双肺,随后消毒伤口并缝合,放入笼盒待苏醒。术后7 d每日用青霉素冲洗伤口预防感染;对照组于第1日及第14日气管内滴注等量生理盐水。
造模完成后,立即从对照组和COPD造模组中分别随机抽取2只进行检测。分别称重记录,麻醉后处死,取肺组织,立即用组织溶液固定后,送湖南中医药大学第二附属医院病理科进行病理检验,行HE染色,观察肺组织情况。大鼠肺组织出现支气管管壁增厚、炎性细胞浸润、肺泡间隔增宽、肺泡腔扩张融合,形成肺大疱即提示造模成功[8]。
2.2 分组及给药
从64只雄性大鼠中随机抽取12只作为对照组,52只作为COPD造模组。待造模完成后,从两个组中随机抽取2只大鼠取肺组织送病检,观察造模情况。对照组剩余10只大鼠,将造模完成后的50只大鼠按随机数字表法分为5组:模型组、地塞米松组及固本平喘方高、中、低剂量组,每组10只,总计6组。
将制备好的固本平喘方参照《药理实验方法学》[9],根据人和大鼠剂量换算系数进行换算,结合固本平喘方临床成人每日给药量为137 g生药/60 kg,计算可得人每日所需药量为2.28 g/kg,按照高、中、低剂量以临床剂量的2倍、1倍、1/2倍计算,得出固本平喘方高、中、低剂量组剂量分别为28、14、7 g/kg。将固本平喘方用蒸馏水溶解至相应浓度进行灌胃处理;对照组和模型组大鼠用同等剂量蒸馏水灌胃,连续灌胃14 d。地塞米松组按人与大鼠体表面积折算,以0.15 mg/kg兑温水灌胃,持续14 d。第15日处死所有大鼠。
2.3 标本收集
将处死大鼠的左肺叶取下,冲洗完成后,以3 000 r/min离心10 min(离心半径8 cm),将上清液分装于EP管中,置于-80 ℃冰箱中以备MUC5AC定量检测。将各组大鼠右肺前叶、中叶用4%多聚甲醛溶液浸泡固定,用作病理切片操作。将各组大鼠的右肺后叶、副叶放入EP管中,经过液氮冷冻处理,然后将其放入-80 ℃冰箱中冷冻保存,以进行RT-PCR、Western blot和免疫荧光检测。
2.4 观察指标
2.4.1 HE染色观察大鼠肺组织病理学变化 将固定后的大鼠右肺前叶组织流水冲洗30 min,梯度乙醇脱水,二甲苯替换出乙醇透明,浸蜡包埋后切片并染色封片,使用光镜观察肺组织病理变化。
2.4.2 ELISA法检测肺组织MUC5AC水平 采用ELISA试剂盒检测肺组织MUC5AC水平,严格按试剂盒说明书进行操作。
2.4.3 Western blot检测肺组织MUC5AC蛋白表达
取冷冻肺组织25 mg,用冰预冷PBS洗组织,加入300 μL RIPA裂解液裂解10 min;4 ℃、12 000 r/min离心15 min(离心半径9 cm)。制胶后取200 μL蛋白上清液电泳,电泳结束后转膜。转膜完毕后将膜取出,放入1×PBST中洗1次。并用1×PBST配制5%脫脂奶粉,浸膜,室温放置90 min;一抗(稀释比例为1∶1 000)孵育,4 ℃过夜,次日室温放置30 min;孵育结束,1×PBST洗3次,每次15 min。二抗(稀释比例为1∶5 000)孵育90 min,孵育结束,1×PBST洗3次,每次10 min。最后ECL显色曝光,凝胶成像系统成像。
2.4.4 免疫荧光检测肺组织MUC5AC表达分布态势 冰冻切片室温晾干15 min后用组化笔将待染组织画圈,将切片放入PBS溶液晃动洗涤3次,每次5 min;甩干PBS,滴加10%驴血清封闭30 min。甩掉封闭液,滴加一抗(即用型),湿盒4 ℃孵育过夜。吸去抗体后室温下PBS洗涤3次,每次5 min。切片稍甩干后在圈内滴加与一抗相应种属的 HRP 标记的二抗(稀释比例为1∶200),室温孵育50 min。PBS洗涤3次,每次5 min。加入4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)(1∶400)室温孵育10 min,PBS清洗3次,每次5 min。切片甩干后在圈内滴加自发荧光淬灭剂,孵育5 min,最后流水冲洗10 min后封片、荧光显微镜观察并拍照。
2.4.5 RT-PCR检测肺组织MUC5AC mRNA表达
取肺组织20 mg,加入1 mL Trizol于匀浆器中充分研磨匀浆,混匀后室温裂解5 min,提取总RNA后以组织总mRNA为模板,逆转录cDNA,最后进行荧光定量PCR反应。反应条件:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火30 s,共计40个循环。用2-Ct法计算表达水平,MUC5AC引物序列如下:正向CAACTT?CAGCCACATCGTCT;反向CTGCCATCTATCCAAT?CAGTCC。
2.5 统计方法
采用SPSS 23.0软件进行数据处理,所有数据以“x±s”表示,多组计量资料组间比较用单因素方差分析,两两比较用LSD法,以P<0.05为差异有统计学意义。
3 结果
3.1 各组大鼠肺组织病理改变比较
对照组大鼠镜下肺组织黏膜上皮和肺泡结构未见明显异常,支气管管壁无增厚,管腔内纤毛排列整齐,肺间质内未见炎性细胞浸润,肺泡未见扩张;模型组大鼠肺组织可见肺泡腔明显扩张,伴大量肺泡壁变薄甚至断裂,部分融合成肺大泡,支气管管腔纤毛倒伏,排列紊乱,肺泡腔内及肺间质可见大量炎性浸润;与模型组比较,固本平喘方各剂量组可见肺泡腔扩张程度显著减轻,支气管管腔变形较少,管腔纤毛排列相对整齐,组织炎性浸润程度较轻。详见图1。
3.2 各组大鼠肺组织MUC5AC含量比较
与对照组比较,模型组、地塞米松组及固本平喘方各剂量组中MUC5AC含量均升高(P<0.05);与模型组比较,地塞米松组、固本平喘方各剂量组中MUC5AC含量均降低(P<0.05);与地塞米松组比较,固本平喘方低剂量组MUC5AC含量升高(P<0.05),固本平喘方高剂量组MUC5AC含量降低(P<0.05);与固本平喘方低、中剂量组比较,固本平喘方高剂量组MUC5AC含量降低(P<0.05)。详见表1。
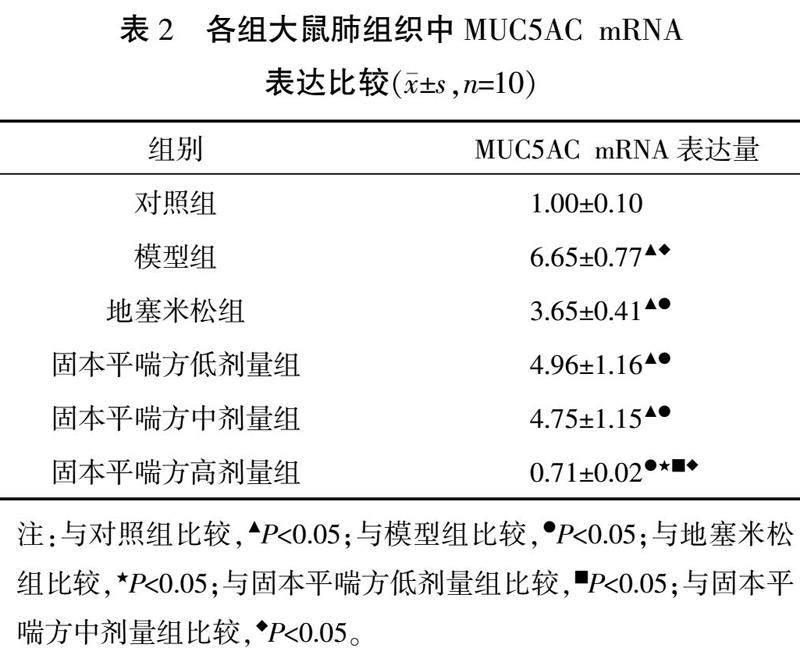
3.3 各组大鼠肺组织MUC5AC mRNA表达比较
与对照组比较,模型组、地塞米松组及固本平喘方低、中剂量组MUC5AC mRNA表达升高(P<0.05);与模型组比较,地塞米松组及固本平喘方各剂量组MUC5AC mRNA表达降低(P<0.05);与地塞米松组及固本平喘方低、中剂量组比较,固本平喘方高剂量组MUC5AC mRNA表达降低(P<0.05)。详见表2。
3.4 各组大鼠气道MUC5AC蛋白表达比较
与对照组比较,模型组、地塞米松组及固本平喘方各剂量组MUC5AC蛋白表达均升高(P<0.05);与模型组比较,地塞米松组及固本平喘方中、高剂量组MUC5AC蛋白表达降低(P<0.05);与地塞米松组比较,固本平喘方低剂量组MUC5AC蛋白表达升高(P<0.05),固本平喘方高剂量组MUC5AC蛋白表达降低(P<0.05);与固本平喘方低剂量组比较,固本平喘方中、高剂量组MUC5AC蛋白表达降低(P<0.05);与固本平喘方中剂量组比较,固本平喘方高剂量组中MUC5AC蛋白表达降低(P<0.05)。详见表3、图2。
3.5 各组大鼠肺组织免疫荧光结果比较
MUC5AC在对照组大鼠肺组织内呈弱表达,表现为细胞胞浆和细胞间隙中的暗淡荧光;在模型组大鼠肺组织中呈现强表达,为明亮荧光;在地塞米松组中,表现为较暗的荧光;在固本平喘方低、中、高剂量组中,荧光强度依次减弱。详见图3。
4 讨论
由于烟雾等毒性气体的长期刺激,COPD患者的气道炎性反应十分活跃,镜下可见细支气管以浆细胞、淋巴细胞为主的各类炎性浸润,基底部肉芽组织和机化纤维组织增生导致管腔狭窄,管壁黏液腺及杯状细胞增生、肥大,分泌亢进,腔内分泌物潴留[10]。气道黏液高分泌是COPD患者的重要病理特征,这种情况同样存在于无咳嗽和咯痰症状的COPD患者中[11]。长期的黏液潴留可导致气道纤毛功能障碍,引发局部防御功能下降,进一步加重气道阻塞。反复的黏液潴留促使细菌定植,使感染反复加重,又刺激气道进一步分泌黏液[10]。感染和黏液高分泌是COPD的独立危险因素[12-13]。而MUC5AC则是气道的主要分泌性黏蛋白,位于气道表面的上皮细胞层,其蛋白表达量及mRNA转录水平是衡量气道黏液分泌程度的重要指标[14]。
气道黏液高分泌的调节机制较为复杂,而黏液高分泌通常是指黏蛋白基因调节、生物合成、分泌释放全过程。其中,表皮生长因子受体(epidermal growthfactor receptor,EGFR)信号通路是诸多刺激因子[包括中性粒细胞弹性蛋白酶(neutrophil elastase,NE)、香煙烟雾、细菌感染、细胞因子及炎症介质等]诱导MUC5AC基因表达的共同通路,是黏液高分泌的最普遍途径。多种刺激物可通过MAPK信号途径,上调MUC5AC基因转录和黏蛋白生成[15-16]。既往已有多项研究表明,多种细胞因子和炎性介质对黏液分泌有促进作用,且不同因子和介质之间存在协同效应[17-19]。另外,NE是目前已知的最强有力的促黏液分泌因子[20],可通过释放转化生长因子-α活化EGFR,延长MUC5AC mRNA半衰期[21];同时,NE还能通过杯状细胞脱颗粒促进黏液高分泌[22]。此外,吸烟、感染均可活化EGFR而增加MUC5AC mRNA表达,促进黏液高分泌[23]。
COPD属于中医学“肺胀”“喘证”范畴,肺体用俱损,呼吸机能紊乱,气机滞留于肺,痰瘀阻于气道而致肺体胀满。在疾病的发展过程中,本虚逐渐加重,而痰浊、血瘀贯穿始终[24]。疾病晚期,本虚、标实相合为患,肺痿废不用。故治当补肺益气、健脾化痰、活血化瘀,标本兼顾,祛邪补正。固本平喘方中党参、黄芪为君,白术、茯苓为臣。党参味甘,性平,可健脾补肺益气;黄芪味甘,性微温,可大补肺脾之气。白术苦、甘而温,与黄芪相配更得补气健脾之功;茯苓甘淡,性平,与白术共用健脾渗湿,更助化痰。法半夏、陈皮、补骨脂、菟丝子共为佐药。法半夏、陈皮共伍,健脾化湿、止咳化痰之效益甚;补骨脂、菟丝子温脾补肾、纳气平喘。紫苏子、苦杏仁、红景天为使。其中,紫苏子、杏仁可降气消痰、止咳平喘;红景天可益气活血、通脉平喘。全方共奏补肺、健脾、固肾、化痰、活血、平喘之功效。
本研究使用固本平喘方对香烟烟雾暴露联合气管滴注LPS、PPE造模大鼠进行干预,造模成功后,模型组大鼠可见肺组织结构明显破坏,符合COPD病理改变。固本平喘方干预后,大鼠肺泡腔扩张程度较对照组显著减轻,支气管管腔变形较少,管腔纤毛排列相对整齐,组织炎性浸润程度较轻,提示固本平喘方对改善COPD模型大鼠的肺组织病理损害具有良好的效果。同时,以MUC5AC作为评价指标,测定肺组织MUC5AC含量、mRNA表达、蛋白表达及蛋白荧光强度,评价各组气道黏液分泌强度。结果显示,模型组肺组织中MUC5AC含量及MUC5AC mRNA表达、蛋白表达、蛋白荧光强度相较于对照组均显著升高,而地塞米松及固本平喘方能显著降低肺组织中MUC5AC含量、下调MUC5AC mRNA表达、减少MUC5AC蛋白表达、减弱MUC5AC蛋白荧光强度。
综上所述,固本平喘方可改善COPD模型大鼠的肺组织病理损伤,有效减少MUC5AC含量、下调MUC5AC mRNA表达、降低MUC5AC蛋白表达,改善大鼠气道黏液高分泌状态。固本平喘方有望成为COPD新的治疗药物,但其具体作用机制有待进一步研究。
参考文献
[1] 迟宝荣, 周胜华. 内科学[M]. 北京: 高等教育出版社, 2017: 42-46.
[2] HALPIN D M G, CRINER G J, PAPI A, et al. Global initiative for the diagnosis, management, and prevention of chronic obstructive lung disease. The 2020 GOLD science committee report on COVID-19 and chronic obstructive pulmonary disease[J]. American Journal of Respiratory and Critical Care Medicine, 2021, 203(1): 24-36.
[3] ATANASOVA K R, REZNIKOV L R. Strategies for measuring airway mucus and mucins[J]. Respiratory Research, 2019, 20(1): 261.
[4] ANNESI I, KAUFFMANN F. Is respiratory mucus hypersecretion really an innocent disorder? A 22-year mortality survey of 1, 061 working men[J]. The American Review of Respiratory Disease, 1986, 134(4): 688-693.
[5] LIN H L, QIAN Z M, GUO Y F, et al. The attributable risk of chronic obstructive pulmonary disease due to ambient fine particulate pollution among older adults[J]. Environment International, 2018, 113: 143-148.
[6] 黄文锋, 陈斯宁, 吴嘉冬, 等. 慢性阻塞性肺疾病大鼠模型的构建[J]. 现代医药卫生, 2019, 35(6): 801-803.
[7] 刘 迪, 张洪春. 慢性阻塞性肺疾病动物模型的造模方法[J]. 中国比较医学杂志, 2020, 30(3): 108-114.
[8] 欧阳桂兰, 游柏稳. 慢性阻塞性肺疾病大鼠模型的建立与比较[J]. 中西医结合研究, 2023, 15(2): 86-90.
[9] 徐叔云, 卞如濂, 陈 修. 药理实验方法学[M]. 3版. 北京: 人民卫生出版社, 2002: 202-204.
[10] 彭 鑫, 刘 健, 栾哲宇, 等. 慢性阻塞性肺疾病气道黏液高分泌的发病机制及中医药干预的研究进展[J]. 中国实验方剂学杂志, 2024, 30(4): 228-239.
[11] 窦丽红, 张传涛. 中医药治疗COPD气道黏液高分泌的研究新进展[J]. 四川中医, 2021, 39(1): 216-218.
[12] ROGERS D F. Physiology of airway mucus secretion and pathophysiology of hypersecretion[J]. Respiratory Care, 2007, 52(9): 1134-1149.
[13] ROJAS D A, PONCE C A, BUSTOS A, et al. Pneumocystis exacerbates inflammation and mucus hypersecretion in a murine, elastase-induced-COPD model[J]. Journal of Fungi, 2023, 9(4): 452.
[14] VAN BUREN E, RADICIONI G, LESTER S, et al. Genetic regulators of sputum mucin concentration and their associations with COPD phenotypes[J]. PLoS Genetics, 2023, 19(6): e1010445.
[15] 李天浩, 韩晨旭, 王惠琴, 等. 基于EGFR-MUC5AC信号通路探讨参鱼化痰口服液干预慢性阻塞性肺疾病大鼠气道黏液高分泌的机制[J]. 陕西中医, 2019, 40(8): 995-997, 1017.
[16] 陈锦标, 王慧贤, 卢杰伦, 等. 清金化痰汤通过P38 MAPK信号通路对COPD痰热证大鼠气道炎症反应及黏液高分泌的影响[J]. 中药材, 2021, 44(4): 970-974.
[17] KUBYSHEVA N I, POSTNIKOVA L B, SOODAEVA S K, et al. Comparative study of the levels of IL-1β, IL-4, IL-8, TNF-α, and IFN-γ in stable course and exacerbation of chronic obstructive pulmonary disease of varying severity[J]. Bulletin of Experimental Biology and Medicine, 2022, 173(6): 745-748.
[18] LOUAHED J, TODA M, JEN J, et al. Interleukin-9 upregulates mucus expression in the airways[J]. American Journal of Respiratory Cell and Molecular Biology, 2000, 22(6): 649-656.
[19] 白林林, 王志华, 宁学聪, 等. IL-17A对慢性阻塞性肺疾病的干预作用及其机制[J]. 中国应用生理学杂志, 2021, 37(6): 584-588.
[20] ZHENG S, KUMMARAPURUGU A B, BULUT G B, et al. Neutrophil elastase activates the release of extracellular traps from COPD blood monocyte-derived macrophages[J]. Clinical and Translational Science, 2023, 16(12): 2765-2778.
[21] KOHRI K, UEKI I F, NADEL J A. Neutrophil elastase induces mucin production by ligand-dependent epidermal growth factor receptor activation[J]. American Journal of Physiology Lung Cellular and Molecular Physiology, 2002, 283(3): L531-L540.
[22] STOCKLEY R A. Neutrophils and the pathogenesis of COPD[J]. Chest, 2002, 121(5 Suppl): 151S-155S.
[23] SUN Y P, SHI Z W, LIN Y H, et al. Benzo(a)pyrene induces MUC5AC expression through the AhR/mitochondrial ROS/ERK pathway in airway epithelial cells[J]. Ecotoxicology and Environmental Safety, 2021, 210: 111857.
[24] 崔英海, 胡鏡清, 李丁蕾, 等. 基于“痰瘀互结”理论论治慢性阻塞性肺疾病[J]. 世界中医药, 2021, 16(21): 3111-3115, 3121.
〔基金项目〕湖南省中医药管理局重点项目(2021003)。
〔通信作者〕*游柏稳,男,博士,教授,硕士研究生导师,E-mail:13974955546@163.com。

