胃癌病人术前贫血危险因素及术后并发症情况分析
马兴好,王家家,江晓阳,张 姁,王婷婷,张 丽,阮一凡
(安徽医科大学附属六安医院 临床营养科,安徽 六安 237005)
胃癌(gastric cancer,GC)在我国的发病率和死亡率均较高[1],是癌症相关死亡的第三大原因[2]。贫血在GC病人中的发病率高,增加了术后并发症,影响预后[3]。近年来,有胃癌术前贫血情况的相关研究报道[4],但存在纳入研究的病例样本量偏少或未将病人术前营养状况相关指标纳入分析,对胃癌术前贫血危险因素的分析研究有一定的局限性。本研究对500例GC病人术前营养状况、血液学指标及术后病理资料进行回顾性分析,探讨GC病人术前贫血状况、危险因素及对术后并发症的影响,现作报道。
1 资料与方法
1.1 研究对象
对皖西地区某三级医院2019-2022年500例初诊GC病人的临床资料进行收集、分析。纳入标准:(1)确诊为原发性GC;(2)行择期GC根治术;(3)无远处转移;(4)围手术期资料齐全。排除标准:(1)入院前6个月内接受过抗肿瘤治疗;(2)术前合并感染;(3)合并其他恶性肿瘤。本研究为回顾性调查研究,经医院伦理委员会批准。
1.2 方法
1.2.1 贫血诊断 参照我国贫血诊断标准[5],男性血红蛋白(Hb)值<120 g/L,女性Hb值<110 g/L定义为贫血;轻度:90 g/L≤Hb值<正常值;中度:60 g/L≤Hb值<90 g/L;重度:Hb值<60 g/L。
1.2.2 营养风险筛查 采用营养风险筛查2002(NRS2002)量表[6]。≥3分判定存在营养风险,可能会影响临床结局。
1.2.3 营养不良评估 采用主观整体评估(SGA)量表[7]。该量表是以疾病史和体格检查为基础提出的,由美国肠外肠内营养学会(ASPEN)推荐用于营养状况评价工具。
1.2.4 实验室检测 术前12 h采集清晨空腹静脉血5 mL。采用希森美康XN-2100型全自动血细胞分析仪进行血细胞分析;采用贝克曼全自动生化分析仪AU5821检测血清蛋白。参照美国癌症联合委员会第八版GC TNM分期标准进行肿瘤分期[8]。所有操作均严格按照第四版《全国临床检验操作规程》进行[9]。
1.3 统计学方法
采用t检验、χ2检验和logistic回归分析。
2 结果
2.1 术前血检指标情况
500例病人中,贫血212例(42.4%),非贫血288例(57.6%);贫血组与非贫血组在年龄、体质量指数(BMI)、红细胞计数(RBC)、Hb、红细胞分布宽度(RDW-CV)、血清总蛋白(TP)、白蛋白(Alb)、三酰甘油(TG)及总胆固醇(TCH)差异均具有统计学意义(P<0.01)(见表1)。
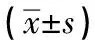
表1 术前血检指标比较
2.2 GC病人术前贫血危险因素的单因素分析
分析显示,年龄≥65岁、合并慢性阻塞性肺疾病、腹部手术史、BMI<18.5 kg/m2、NRS2002≥3分、营养不良、TNM分期(Ⅲ+Ⅳ期)、肿瘤直径>4 cm、分化程度、淋巴结转移、癌胚抗原(CEA)、糖链抗原125(CA125)、糖类抗原199(CA199)水平与GC病人术前发生贫血有关(P<0.05~P<0.01)(见表2)。
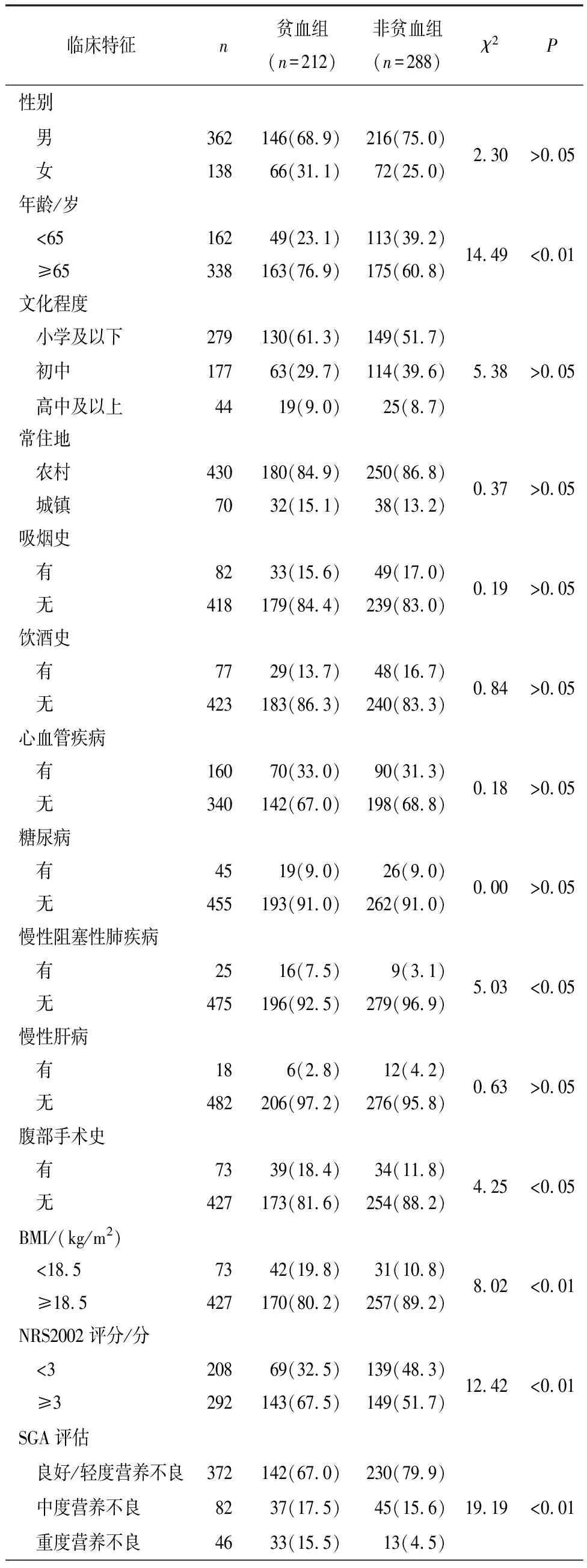
表2 GC病人术前贫血危险因素的单因素分析[n;百分率(%)]
2.3 GC病人术前贫血影响因素的多因素分析
logistic回归分析显示:年龄≥65岁、营养不良和肿瘤直径>4 cm是GC病人术前贫血的独立危险因素(P<0.05~P<0.01)(见表3)。

表3 GC病人术前贫血危险因素的logistic回归分析
2.4 贫血组与非贫血组术后并发症情况
与非贫血组相比,贫血组病人术后总并发症、肺部感染、发热和营养不良并发症增加(P<0.05~P<0.01)(见表4)。
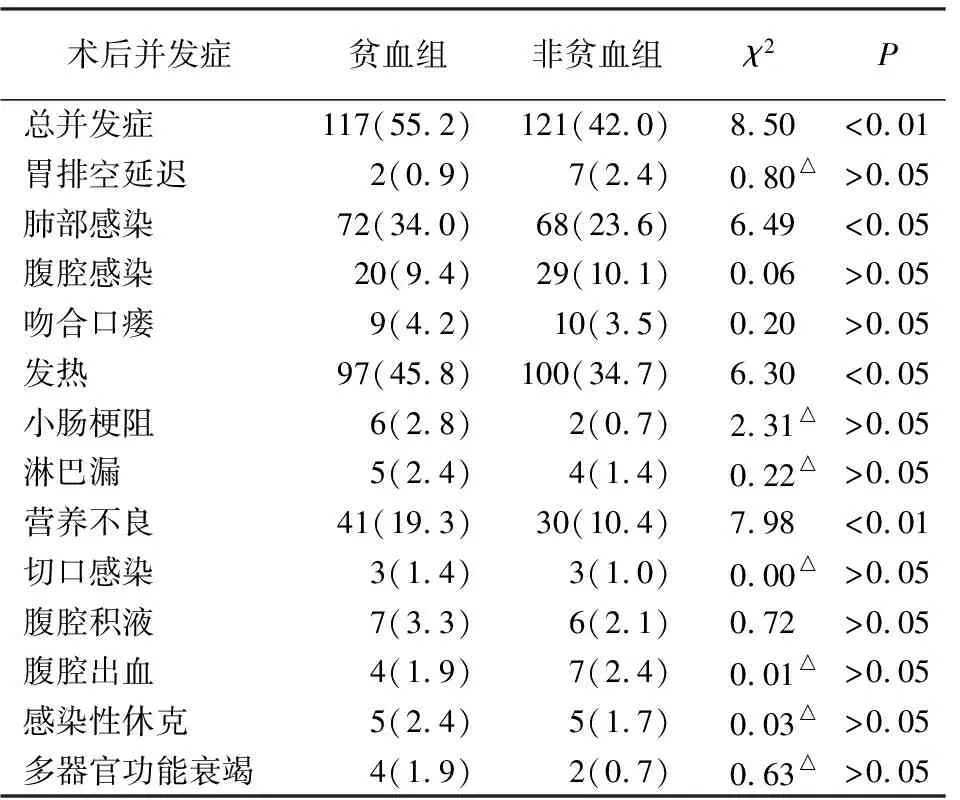
表4 术后并发症情况比较[n;百分率(%)]
3 讨论
GC病人因纳差、癌组织出血等因素,在初次诊断时已伴有不同程度的贫血情况[3]。贫血是影响GC病人预后的危险因素[10]。有两项调查显示,GC病人术前贫血检出率分别为36.0%和35.6%[11-12],本研究显示GC病人术前贫血检出率为42.4%。贫血组与非贫血组病人年龄、BMI值差异均有统计学意义,与相关研究[4,12]结果基本一致。同时,间接反映病人营养状况的血清TP、Alb、TG、TCH组间差异也具有统计学意义,与刘林辉等[13]报道的结果完全不同,可能是因为样本量差异较大而得出的结果不同,需进一步论证。
GC发病虽有年轻化趋势,但多数年龄较大。老年GC病人常合并其他慢性疾病,胃肠功能较差,伴有食欲下降和进食障碍,往往在初诊时就存在营养问题。癌症病人身体处于过度分解代谢和负氮平衡状态,低蛋白血症在癌症病人中普遍存在,增加了术后相关并发症的发生率[14]。术前营养风险与胃癌围手术期营养状况、术后并发症有关[15]。NRS2002是欧洲营养学会推荐的营养风险筛查工具[6]。而SGA是一种营养评估工具[7],在筛查和评估恶性肿瘤病人营养状况方面具有一致性[16]。本研究显示,NRS2002≥3分和SGA评估营养不良与GC术前贫血有关,且营养不良是术前贫血的独立危险因素。肿瘤TNM分期反映了肿瘤病灶大小、浸润程度、组织及区域淋巴结受累情况,是公认的评估GC病人预后的重要指标[17],本研究显示,TNM分期、分化程度和淋巴结转移是GC病人贫血发生的危险因素,也说明贫血多发生于肿瘤中晚期,受侵犯的组织越多,其发生营养不良的概率越高,与相关研究[18-19]结果相似。另外,GC晚期病人营养缺乏,其体内生成的红细胞数量减少;分期越晚,血管浸润越重,其出血概率相对越大[20]。本研究还发现癌灶直径>4 cm是GC病人术前贫血的独立危险因素,一方面说明随着肿瘤增大所需的营养物质增加,以及消化功能的降低,导致营养物质吸收障碍,贫血发生[21];另一方面肿瘤越大,更易侵犯血管,更易发生急慢性出血[22]。CEA、CA125和CA199在多种肿瘤病人血清中表达水平上升[23],其与肿瘤组织分化程度、TNM分期、转移相关,影响病人的生存时间,可作为GC预后的评估指标[24,25]。本研究显示血清CEA、CA199和CA125水平与GC贫血有关,对于血清CEA、CA199和CA125水平偏高的病人,应警惕贫血的发生[26]。胃癌根治术病人围手术期并发症,影响术后的生活质量及长期预后,且术前贫血会明显增加GC术后并发症发生率[27]。本研究结果显示,贫血组病人术后发热、肺部感染和营养不良的发生率明显增高。术后发热的发生率显著增高,可能是由于贫血病人体内抗原及免疫复合物等的清除减少所致[4];GC贫血病人在术前往往已有营养风险[12],加上根治手术的创伤会影响术后营养状态的快速恢复,更易出现营养不良,增加了术后感染的风险[28]。
综上,GC病人术前贫血危险因素复杂,年龄≥65岁、营养不良和肿瘤直径>4 cm是GC病人术前发生贫血的独立危险因素;术前贫血会增加术后发热、肺部感染等并发症的发生率。本研究为单中心回顾性分析,存在一定的局限性。另外,未对术前贫血的类型和GC预后的长期影响做探究,需在今后的研究中进一步探讨。

